TOSSICITA DEI METALLI PESANTI Essenziali e non tossici












- Slides: 51

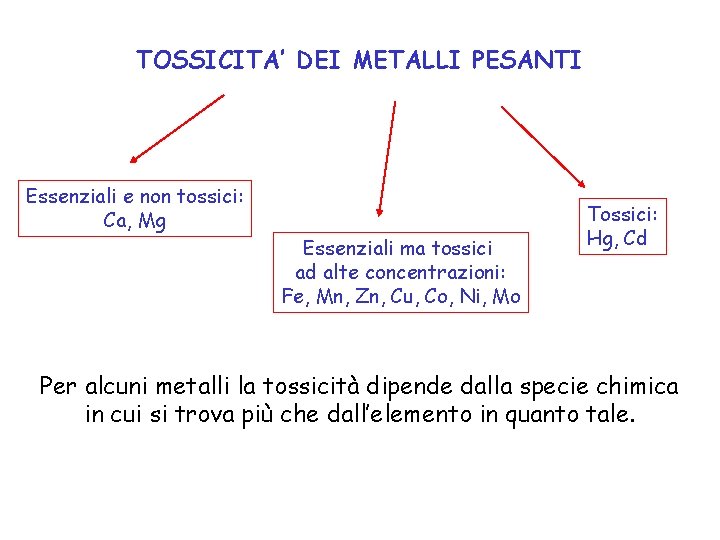
TOSSICITA’ DEI METALLI PESANTI Essenziali e non tossici: Ca, Mg Essenziali ma tossici ad alte concentrazioni: Fe, Mn, Zn, Cu, Co, Ni, Mo Tossici: Hg, Cd Per alcuni metalli la tossicità dipende dalla specie chimica in cui si trova più che dall’elemento in quanto tale.

La tossicità dei metalli pesanti M 2+ + H-S-H R-S-H + M 2+ + H-S-R MS + 2 H+ R-S-M-S-R + 2 H+ M = Hg, Pb, Cd Gruppi R-S-H di proteine possono produrre specie stabili come R-S-M-S-R Hg, Pb, Cd possono spostare i metalli fisiologici (p. es. Zn) dal loro sito di legame Trattamento medico: utilizzo di chelanti EDTA etilendiaminotetracetato di sodio BAL British Anti-Lewis 2, 3 dimercaptopropanolo

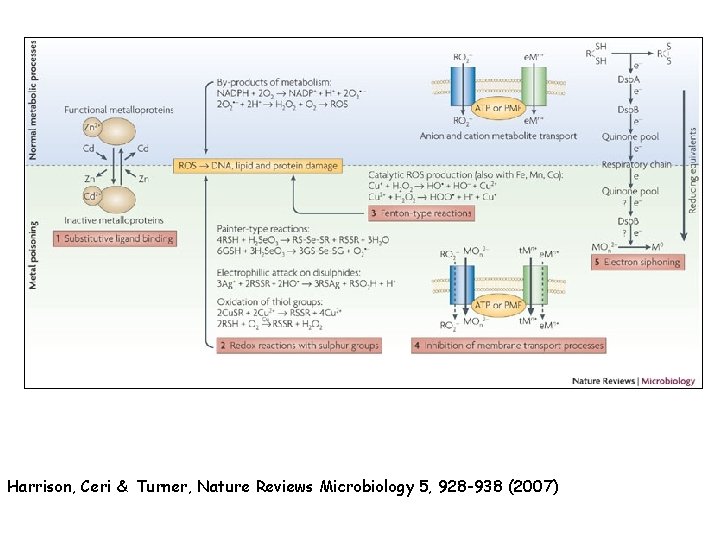
Harrison, Ceri & Turner, Nature Reviews Microbiology 5, 928 -938 (2007)

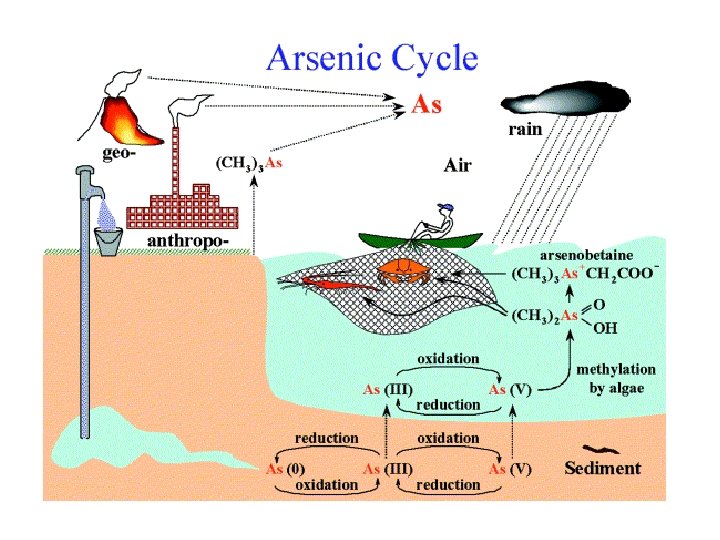
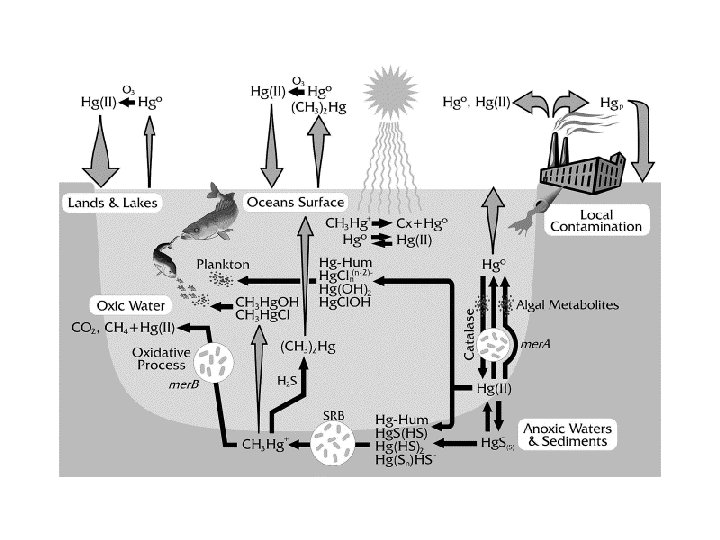
La tossicità dei metalli pesanti Natura dell’elemento Concentrazione Speciazione Disponibilità Un caso: CH 3 -Hg+ > Hg(II) e Cl-composti > Hg(0)g (volatile) Ø(CH 3) 2 Hg (vol. non reattivo) > Hg. S Metil(o alchil)-mercurio traversa più facilmente la barriera emato-encefalica (causa disturbi al sistema nervoso centrale, p. e. s malattia di Minamata, 1950) Speciazione è la distribuzione di un metallo nelle sue varie specie chimiche

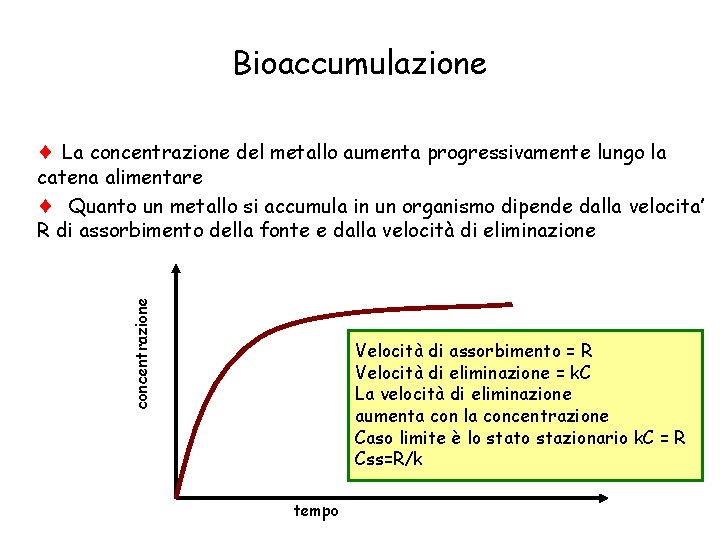
Bioaccumulazione La concentrazione del metallo aumenta progressivamente lungo la concentrazione catena alimentare Quanto un metallo si accumula in un organismo dipende dalla velocita’ R di assorbimento della fonte e dalla velocità di eliminazione Velocità di assorbimento = R Velocità di eliminazione = k. C La velocità di eliminazione aumenta con la concentrazione Caso limite è lo stato stazionario k. C = R Css=R/k tempo

Stato stazionario Velocità di eliminazione = Velocità di assorbimento k. Css = R Se ne parla in termini di tempo di vita media t 0. 5 Dall’analisi matematica delle cinetiche del primo ordine è noto che k = 0. 69/t 0. 5 Css = Rt 0. 5/0. 69 = 1. 45 Rt 0. 5 Più alto è il tempo di vita media di un metallo in un organismo maggiore è il suo accumulo in condizioni stazionarie Hg 2+ nel corpo umano ha t 0. 5 = 6 d Ostriche e molluschi possono contenere Hg 2+ a concentrazioni mille volte maggiori di quelle delle acque di mare

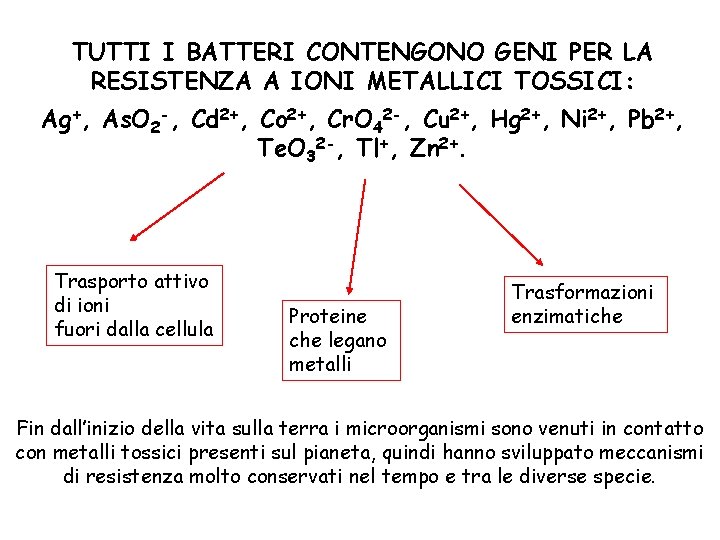
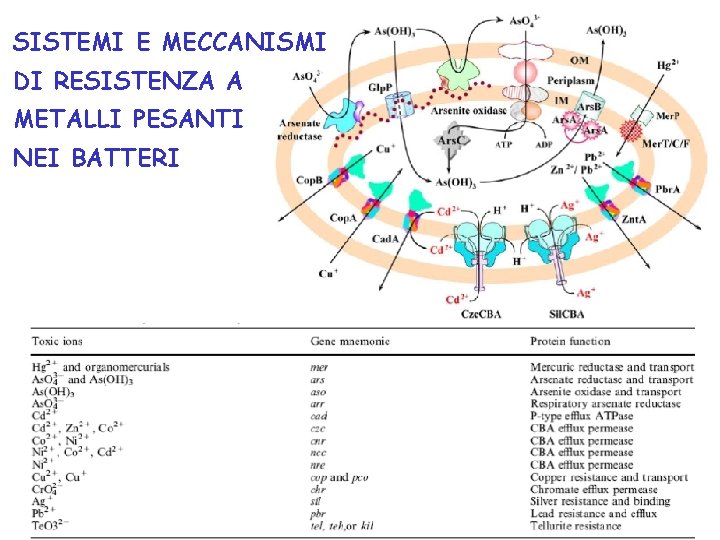
TUTTI I BATTERI CONTENGONO GENI PER LA RESISTENZA A IONI METALLICI TOSSICI: Ag+, As. O 2 -, Cd 2+, Co 2+, Cr. O 42 -, Cu 2+, Hg 2+, Ni 2+, Pb 2+, Te. O 32 -, Tl+, Zn 2+. Trasporto attivo di ioni fuori dalla cellula Proteine che legano metalli Trasformazioni enzimatiche Fin dall’inizio della vita sulla terra i microorganismi sono venuti in contatto con metalli tossici presenti sul pianeta, quindi hanno sviluppato meccanismi di resistenza molto conservati nel tempo e tra le diverse specie.

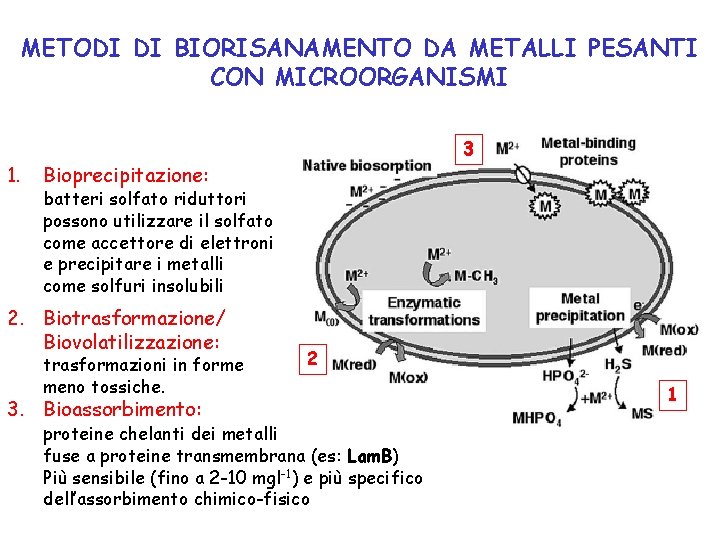
METODI DI BIORISANAMENTO DA METALLI PESANTI CON MICROORGANISMI 1. 3 Bioprecipitazione: batteri solfato riduttori possono utilizzare il solfato come accettore di elettroni e precipitare i metalli come solfuri insolubili 2. Biotrasformazione/ Biovolatilizzazione: trasformazioni in forme meno tossiche. 3. Bioassorbimento: 2 proteine chelanti dei metalli fuse a proteine transmembrana (es: Lam. B) Più sensibile (fino a 2 -10 mgl-1) e più specifico dell’assorbimento chimico-fisico 1

SISTEMI E MECCANISMI DI RESISTENZA A METALLI PESANTI NEI BATTERI


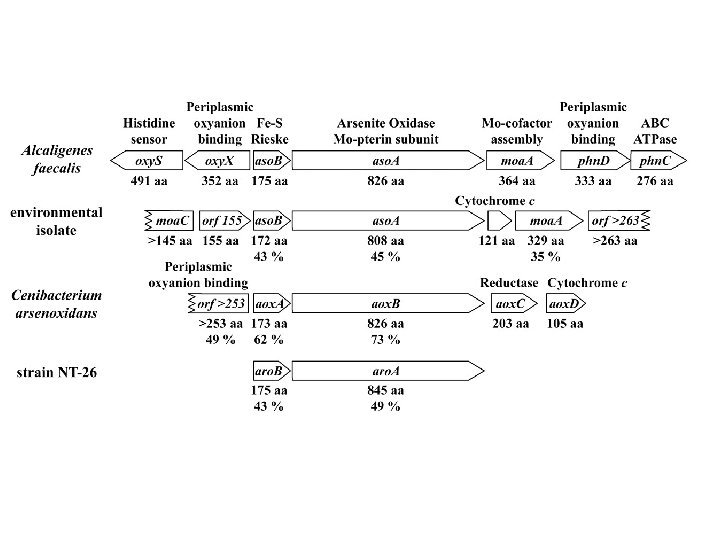
RESISTENZA BATTERICA ALL’ARSENICO: In circa tutti i batteri Gram positivi e Gram negativi OPERONE ars. R repressore ars. B pompa di membrana chemiosmotica ars. C arsenato riduttasi Locus opzionali (co-occorrono): ars. A ATPasi intracellulare ars. AB pompa ATPasica ars. D corepressore Altri enzimi coinvolti nel metabolismo dell’arsenico ed accoppiati alla catena respiratoria: Arsenito ossidasi periplasmatica (aso. AB) Arsenato riduttasi (arr. AB) Arsenico Metilasi

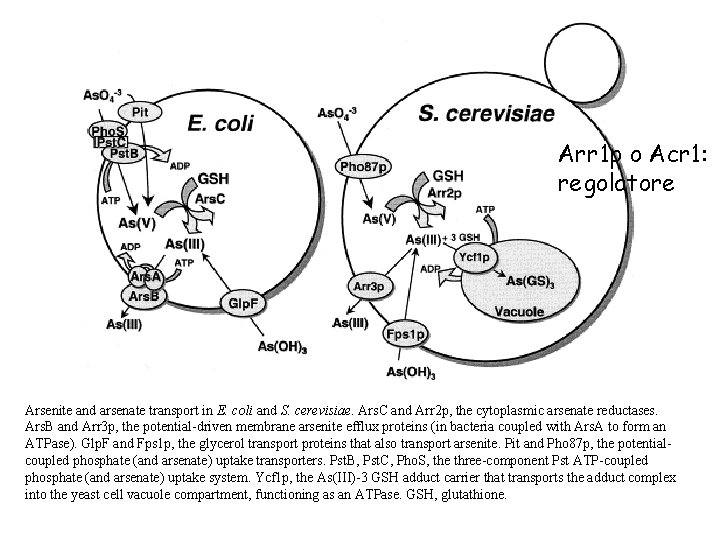
Arr 1 p o Acr 1: regolatore Arsenite and arsenate transport in E. coli and S. cerevisiae. Ars. C and Arr 2 p, the cytoplasmic arsenate reductases. Ars. B and Arr 3 p, the potential-driven membrane arsenite efflux proteins (in bacteria coupled with Ars. A to form an ATPase). Glp. F and Fps 1 p, the glycerol transport proteins that also transport arsenite. Pit and Pho 87 p, the potentialcoupled phosphate (and arsenate) uptake transporters. Pst. B, Pst. C, Pho. S, the three-component Pst ATP-coupled phosphate (and arsenate) uptake system. Ycf 1 p, the As(III)-3 GSH adduct carrier that transports the adduct complex into the yeast cell vacuole compartment, functioning as an ATPase. GSH, glutathione.

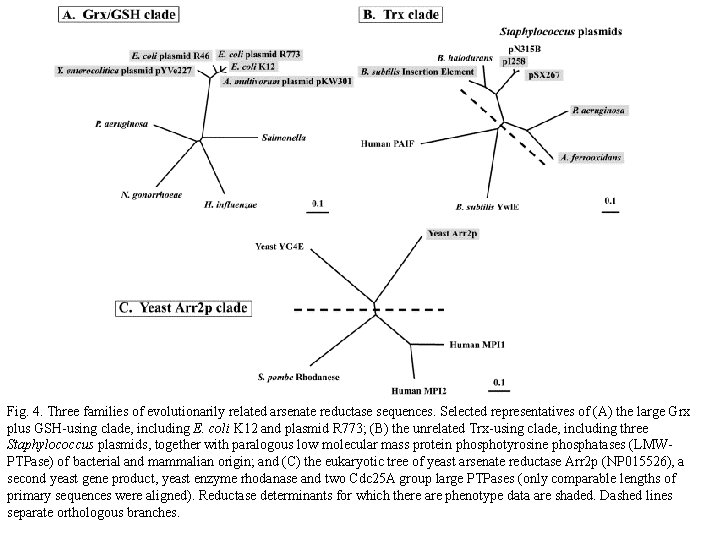
Fig. 4. Three families of evolutionarily related arsenate reductase sequences. Selected representatives of (A) the large Grx plus GSH-using clade, including E. coli K 12 and plasmid R 773; (B) the unrelated Trx-using clade, including three Staphylococcus plasmids, together with paralogous low molecular mass protein phosphotyrosine phosphatases (LMWPTPase) of bacterial and mammalian origin; and (C) the eukaryotic tree of yeast arsenate reductase Arr 2 p (NP 015526), a second yeast gene product, yeast enzyme rhodanase and two Cdc 25 A group large PTPases (only comparable lengths of primary sequences were aligned). Reductase determinants for which there are phenotype data are shaded. Dashed lines separate orthologous branches.


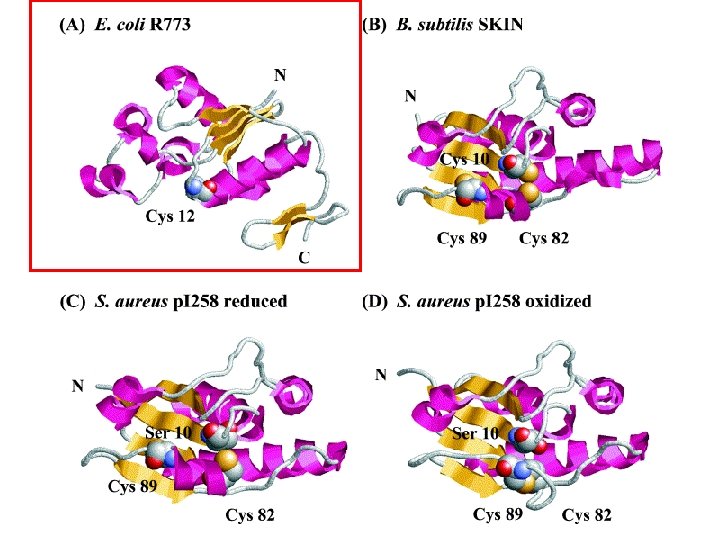
The proposed reaction mechanism pathways of Ars. C arsenate reductases from (A) plasmid R 773 and (B) plasmid p. I 258. The figure highlights the differences in proposed intermediates. Messens, Silver, J. Mol. Biol. 2006

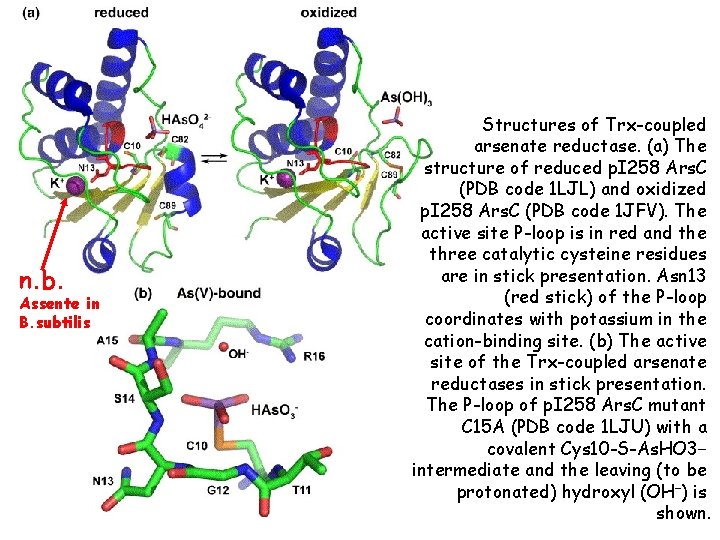
n. b. Assente in B. subtilis Structures of Trx-coupled arsenate reductase. (a) The structure of reduced p. I 258 Ars. C (PDB code 1 LJL) and oxidized p. I 258 Ars. C (PDB code 1 JFV). The active site P-loop is in red and the three catalytic cysteine residues are in stick presentation. Asn 13 (red stick) of the P-loop coordinates with potassium in the cation-binding site. (b) The active site of the Trx-coupled arsenate reductases in stick presentation. The P-loop of p. I 258 Ars. C mutant C 15 A (PDB code 1 LJU) with a covalent Cys 10 -S-As. HO 3− intermediate and the leaving (to be protonated) hydroxyl (OH−) is shown.

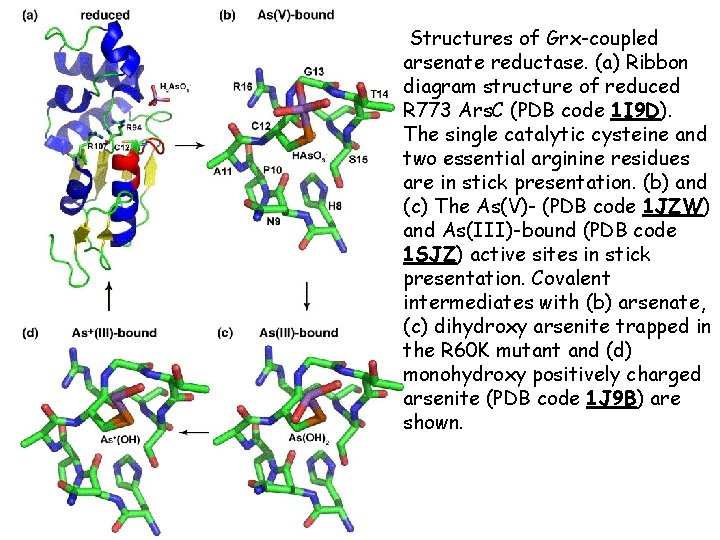
Structures of Grx-coupled arsenate reductase. (a) Ribbon diagram structure of reduced R 773 Ars. C (PDB code 1 I 9 D). The single catalytic cysteine and two essential arginine residues are in stick presentation. (b) and (c) The As(V)- (PDB code 1 JZW) and As(III)-bound (PDB code 1 SJZ) active sites in stick presentation. Covalent intermediates with (b) arsenate, (c) dihydroxy arsenite trapped in the R 60 K mutant and (d) monohydroxy positively charged arsenite (PDB code 1 J 9 B) are shown.

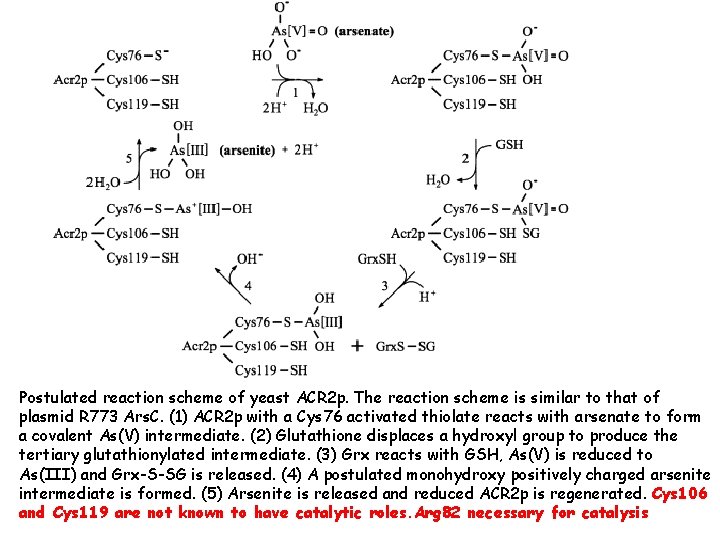
Postulated reaction scheme of yeast ACR 2 p. The reaction scheme is similar to that of plasmid R 773 Ars. C. (1) ACR 2 p with a Cys 76 activated thiolate reacts with arsenate to form a covalent As(V) intermediate. (2) Glutathione displaces a hydroxyl group to produce the tertiary glutathionylated intermediate. (3) Grx reacts with GSH, As(V) is reduced to As(III) and Grx-S-SG is released. (4) A postulated monohydroxy positively charged arsenite intermediate is formed. (5) Arsenite is released and reduced ACR 2 p is regenerated. Cys 106 and Cys 119 are not known to have catalytic roles. Arg 82 necessary for catalysis

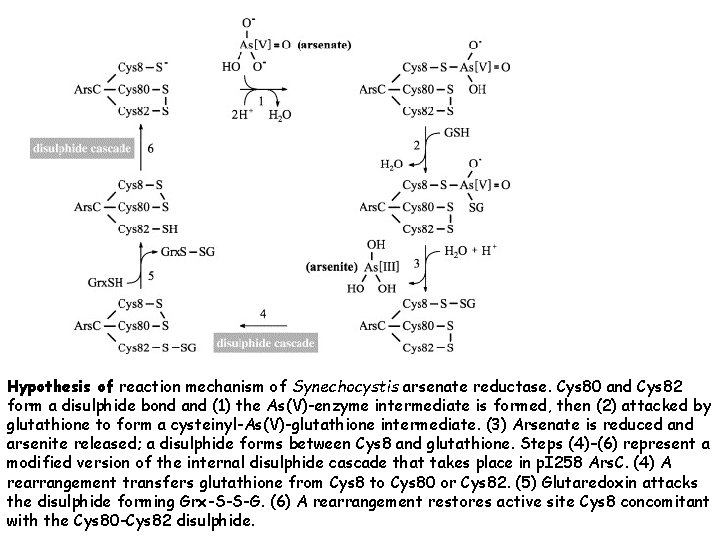
Hypothesis of reaction mechanism of Synechocystis arsenate reductase. Cys 80 and Cys 82 form a disulphide bond and (1) the As(V)-enzyme intermediate is formed, then (2) attacked by glutathione to form a cysteinyl-As(V)-glutathione intermediate. (3) Arsenate is reduced and arsenite released; a disulphide forms between Cys 8 and glutathione. Steps (4)–(6) represent a modified version of the internal disulphide cascade that takes place in p. I 258 Ars. C. (4) A rearrangement transfers glutathione from Cys 8 to Cys 80 or Cys 82. (5) Glutaredoxin attacks the disulphide forming Grx-S-S-G. (6) A rearrangement restores active site Cys 8 concomitant with the Cys 80 -Cys 82 disulphide.

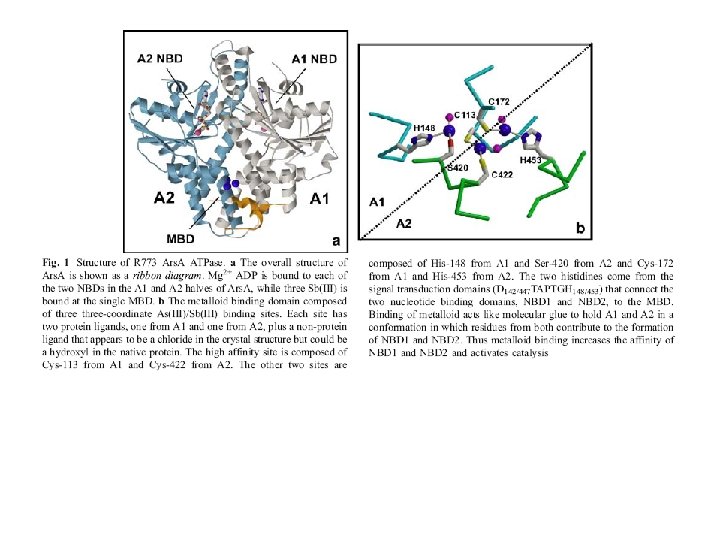
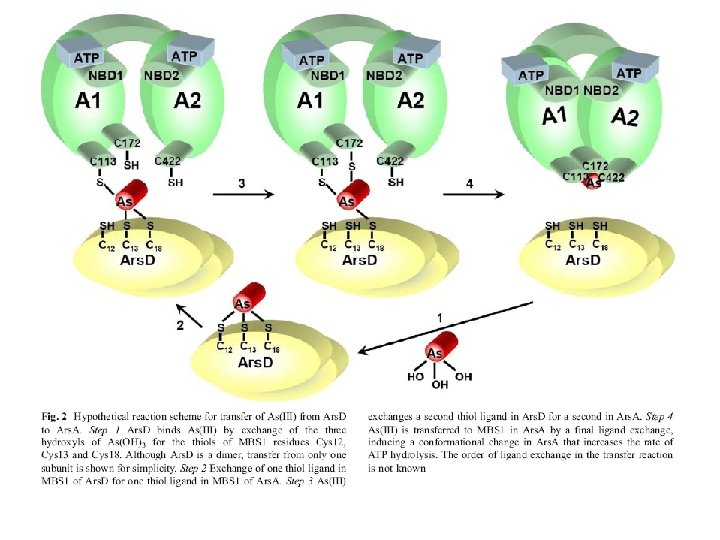
ars. A e ars. D sono presenti nella cellula come omodimeri ars. D e ars. A interagiscono fisicamente: Debolmente in assenza di As(III)/Sb(III) Fortemente in presenza di As(III)/Sb(III) Le cisteine di ars. D e ars. A sono necessarie per l’interazione. E’ ars. A legata ad ATP che interagisce L’interazione con ars. D aumenta l’efficienza della pompa ars. AB (dimostrato mettendo E. coli trasformato con ars. DAB e E. coli trasformato con ars. AB nella medesima coltura contenente As(III); dopo una settimana sopravvive solo il primo) Lin, Yang, Rosen Journal of Bioenergetics and Biomembranes 2007

ars. D è un “metallochaperone” ars. D trasferisce Sb(III)/As(III) ad ars. A, con efficienza Mg. ATP > Mg. ADP ars. D ha maggiore affinità per il metallo di ars. A, ma l’equilibrio è spostato dall’estrusione del metallo da parte di ars. AB



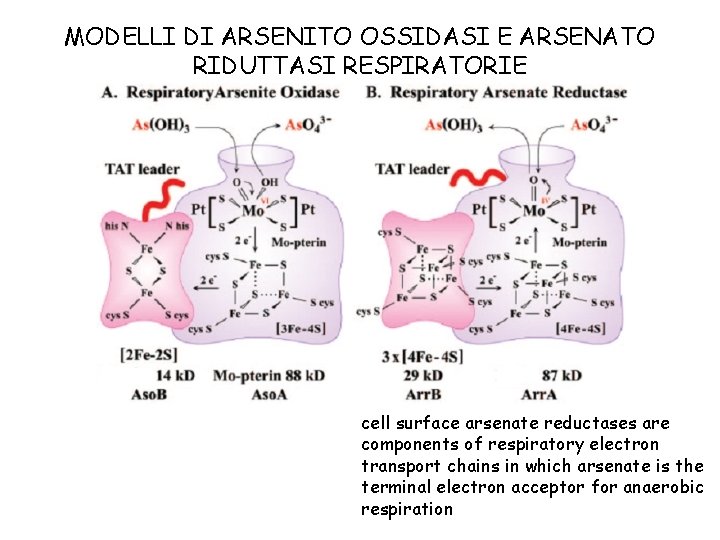
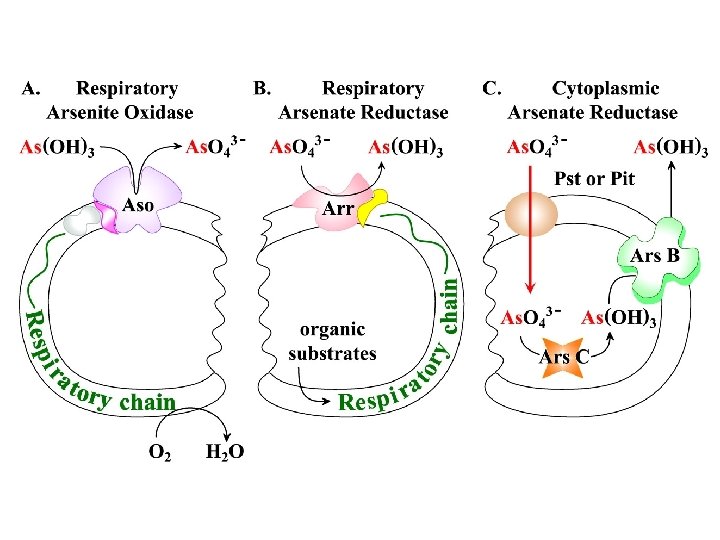
MODELLI DI ARSENITO OSSIDASI E ARSENATO RIDUTTASI RESPIRATORIE cell surface arsenate reductases are components of respiratory electron transport chains in which arsenate is the terminal electron acceptor for anaerobic respiration




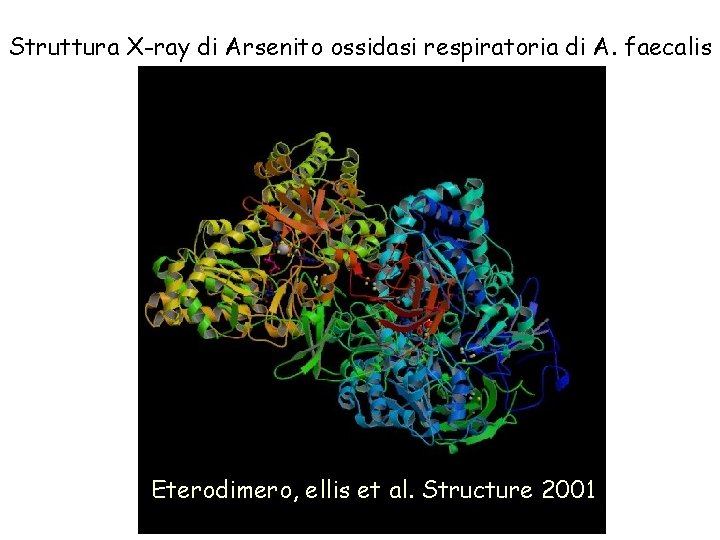
Struttura X-ray di Arsenito ossidasi respiratoria di A. faecalis Eterodimero, ellis et al. Structure 2001

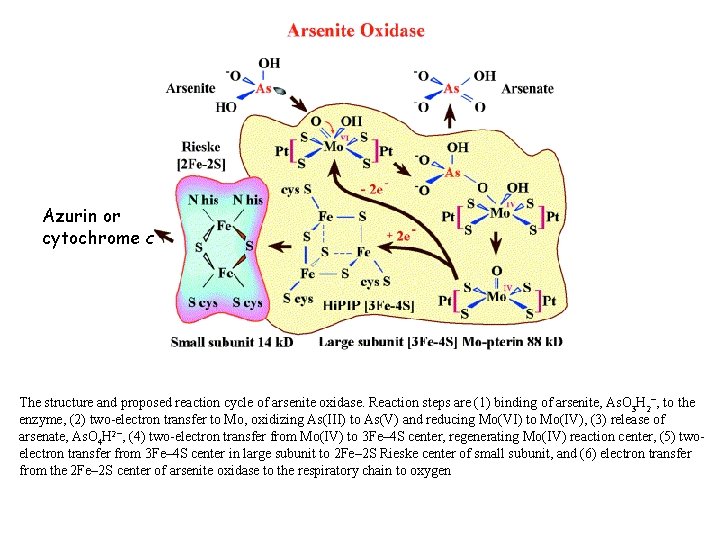
Azurin or cytochrome c The structure and proposed reaction cycle of arsenite oxidase. Reaction steps are (1) binding of arsenite, As. O 3 H 2−, to the enzyme, (2) two-electron transfer to Mo, oxidizing As(III) to As(V) and reducing Mo(VI) to Mo(IV), (3) release of arsenate, As. O 4 H 2−, (4) two-electron transfer from Mo(IV) to 3 Fe– 4 S center, regenerating Mo(IV) reaction center, (5) twoelectron transfer from 3 Fe– 4 S center in large subunit to 2 Fe– 2 S Rieske center of small subunit, and (6) electron transfer from the 2 Fe– 2 S center of arsenite oxidase to the respiratory chain to oxygen

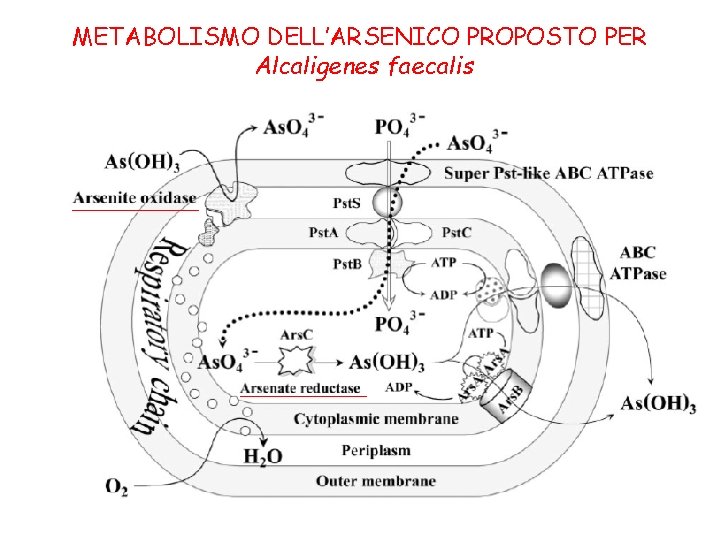
METABOLISMO DELL’ARSENICO PROPOSTO PER Alcaligenes faecalis

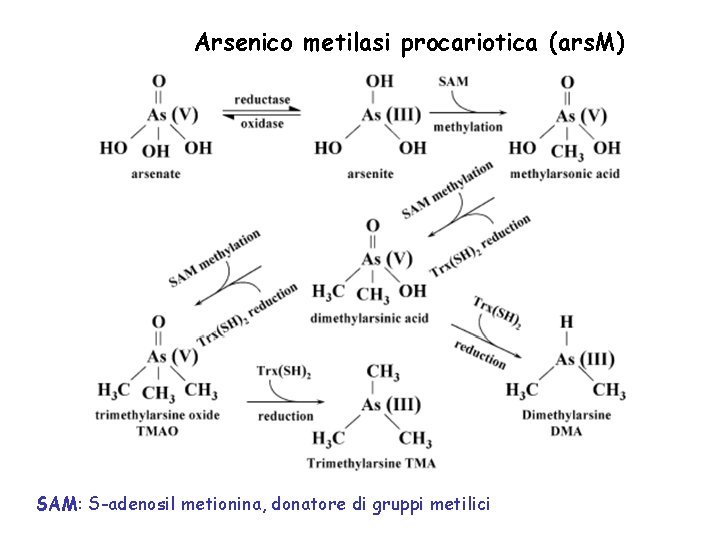
Arsenico metilasi procariotica (ars. M) SAM: S-adenosil metionina, donatore di gruppi metilici

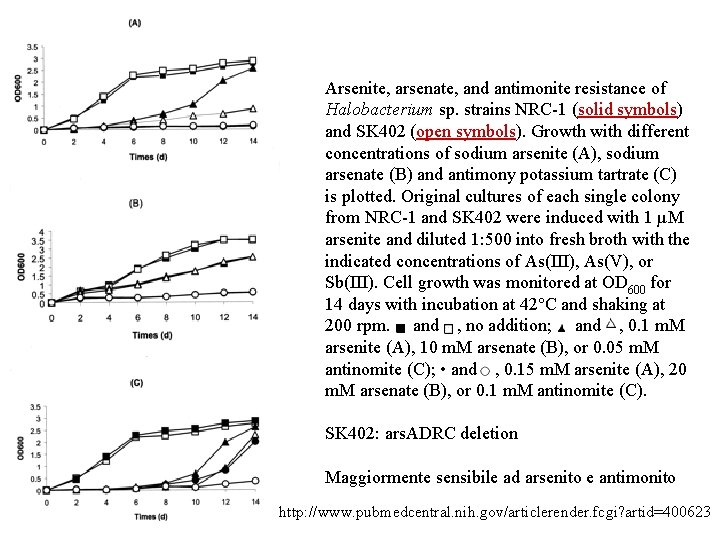
Arsenite, arsenate, and antimonite resistance of Halobacterium sp. strains NRC-1 (solid symbols) and SK 402 (open symbols). Growth with different concentrations of sodium arsenite (A), sodium arsenate (B) and antimony potassium tartrate (C) is plotted. Original cultures of each single colony from NRC-1 and SK 402 were induced with 1 µM arsenite and diluted 1: 500 into fresh broth with the indicated concentrations of As(III), As(V), or Sb(III). Cell growth was monitored at OD 600 for 14 days with incubation at 42°C and shaking at 200 rpm. and , no addition; and , 0. 1 m. M arsenite (A), 10 m. M arsenate (B), or 0. 05 m. M antinomite (C); • and , 0. 15 m. M arsenite (A), 20 m. M arsenate (B), or 0. 1 m. M antinomite (C). SK 402: ars. ADRC deletion Maggiormente sensibile ad arsenito e antimonito http: //www. pubmedcentral. nih. gov/articlerender. fcgi? artid=400623

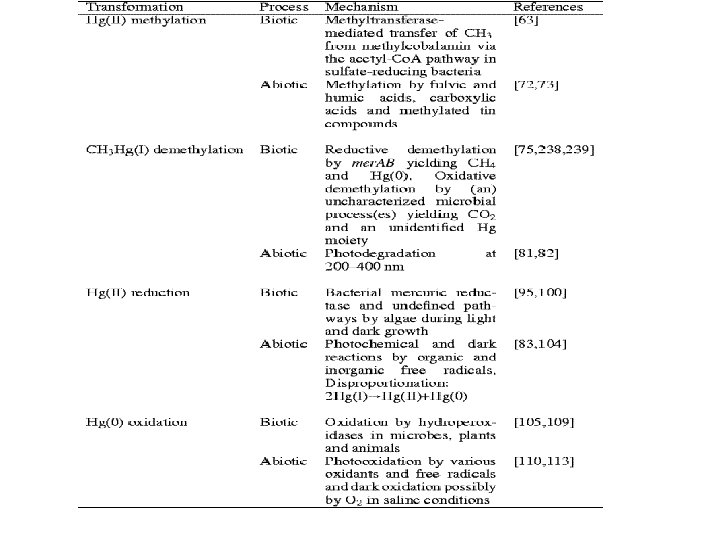
2. RESISTENZA BATTERICA AL MERCURIO E’ il meccanismo studiato per primo e meglio caratterizzato, è il meccanismo di resistenza a ioni tossici più diffuso. I geni coinvolti nella resistenza al Mercurio possono essere: • Plasmidici: presenti in plasmidi coniugativi o trasposoni, spesso associati a geni per la resistenza ad antibiotici [es: Un operone mer si trova nel trasposone Tn 21 (8 kb), all’interno del plasmide R 100 (94 kb), il primo multidrug resistence plasmid isolato]. • Cromosomici: geni per la resistenza a composti organici contenenti mercurio sono stati isolati in ceppi di Bacillus.



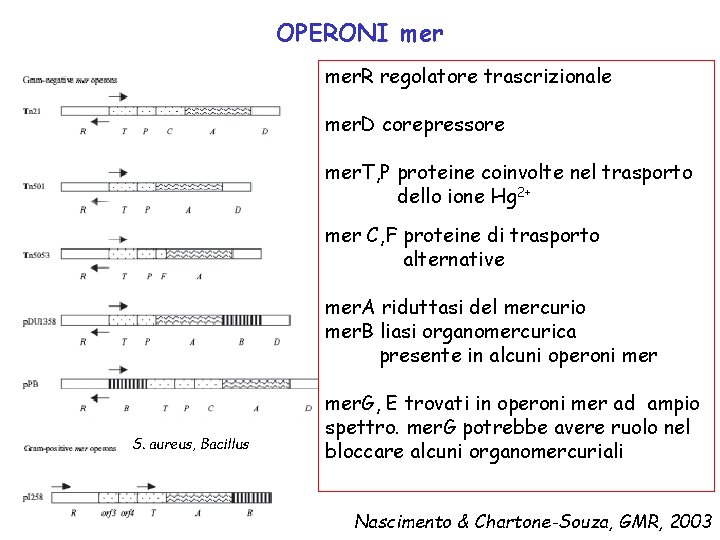
OPERONI mer. R regolatore trascrizionale mer. D corepressore mer. T, P proteine coinvolte nel trasporto dello ione Hg 2+ mer C, F proteine di trasporto alternative mer. A riduttasi del mercurio mer. B liasi organomercurica presente in alcuni operoni mer S. aureus, Bacillus mer. G, E trovati in operoni mer ad ampio spettro. mer. G potrebbe avere ruolo nel bloccare alcuni organomercuriali Nascimento & Chartone-Souza, GMR, 2003

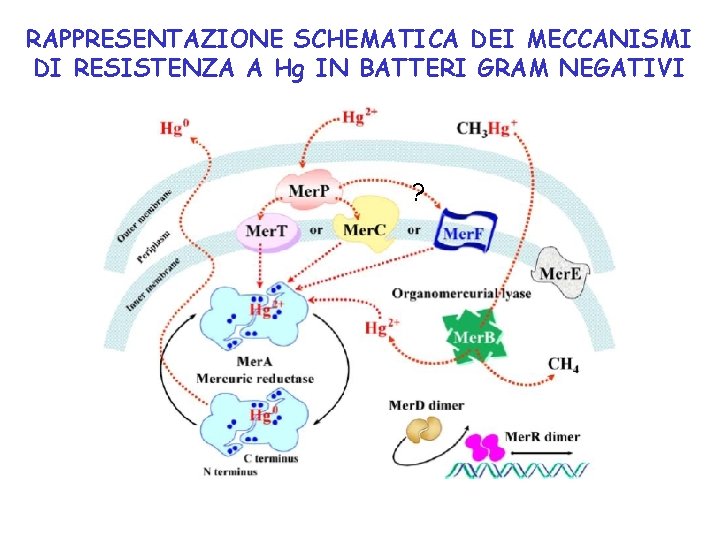
RAPPRESENTAZIONE SCHEMATICA DEI MECCANISMI DI RESISTENZA A Hg IN BATTERI GRAM NEGATIVI ?

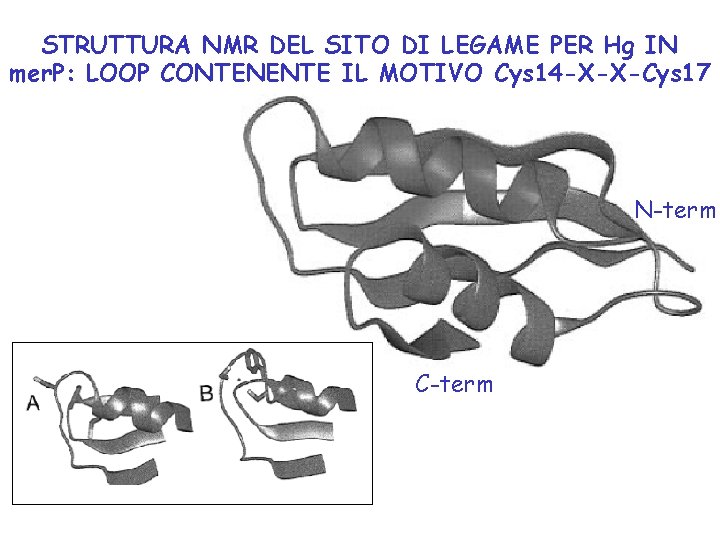
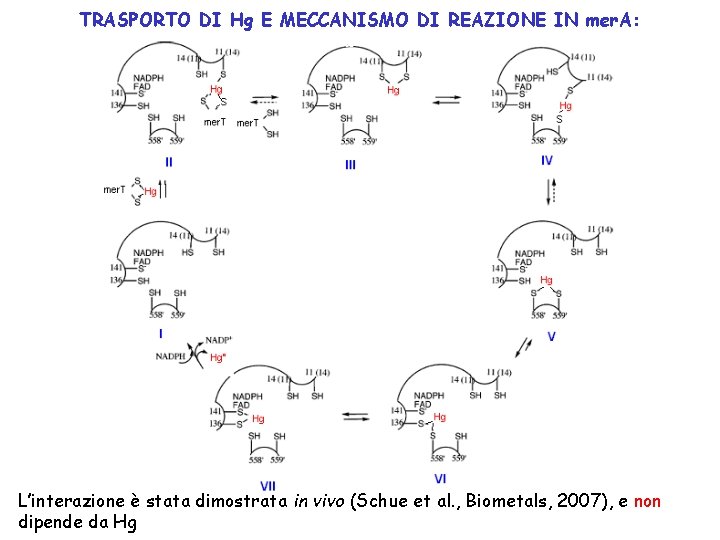
TRASPORTO DI Hg ALL’INTERNO DEL BATTERIO • Non sono state identificate proteine per il trasporto di Hg attraverso la membrana esterna. • mer. P nel periplasma lega Hg col motivo Cys 14 -X-X-Cys 17 presente in un loop all’interno della struttura . • mer. P trasferisce rapidamente Hg a 2 Cys di mer. T nella membrana interna • mer. T è una proteina con 3 eliche transmembrana che trasporta Hg nel citoplasma senza consumo di energia, probabilmente attraverso una coppia di Cys sulla prima elica TM e una citoplasmatica. • Hg viene trasferito alla coppia C 14 -C 11 nel dominio di legame N-terminale di mer. A, poi alla coppia C 557 -C 558 e poi alla coppia C 135 -C 140 nel sito attivo Il trasporto di Hg è mediato dal trasferimento di Hg tra coppie di Cys.

STRUTTURA NMR DEL SITO DI LEGAME PER Hg IN mer. P: LOOP CONTENENTE IL MOTIVO Cys 14 -X-X-Cys 17 N-term C-term

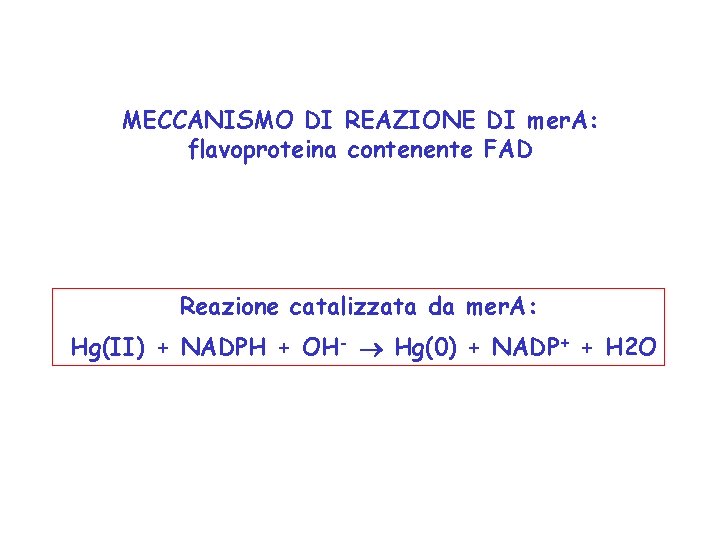
MECCANISMO DI REAZIONE DI mer. A: flavoproteina contenente FAD Reazione catalizzata da mer. A: Hg(II) + NADPH + OH- Hg(0) + NADP+ + H 2 O

TRASPORTO DI Hg E MECCANISMO DI REAZIONE IN mer. A: L’interazione è stata dimostrata in vivo (Schue et al. , Biometals, 2007), e non dipende da Hg

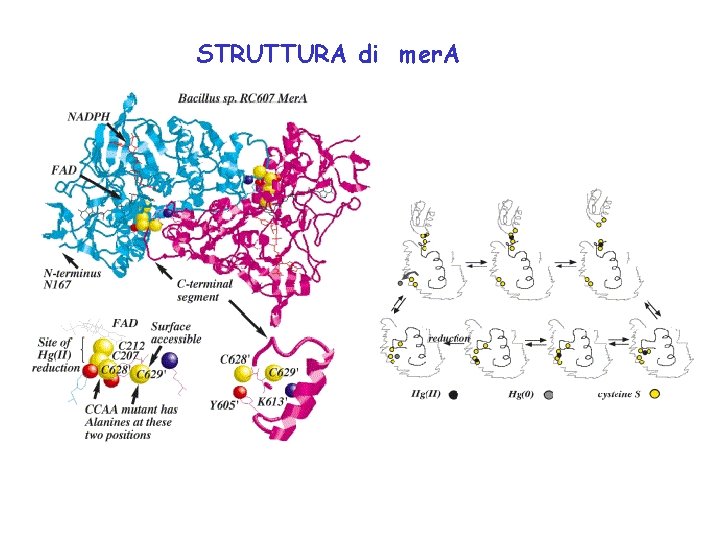
STRUTTURA di mer. A

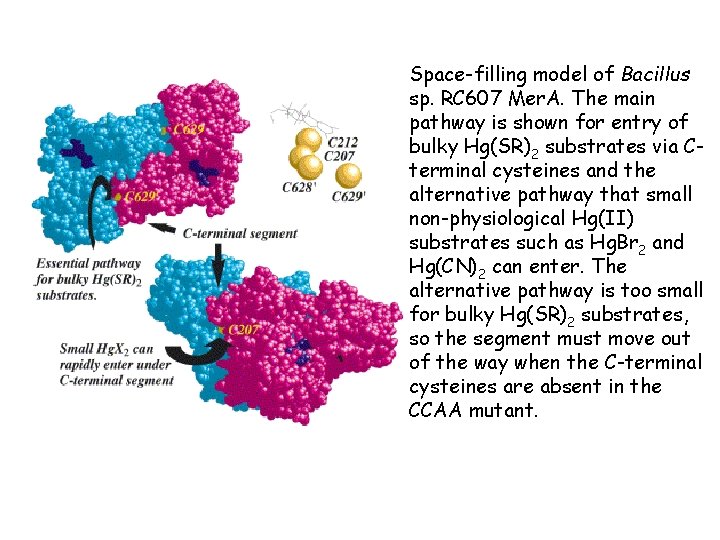
Space-filling model of Bacillus sp. RC 607 Mer. A. The main pathway is shown for entry of bulky Hg(SR)2 substrates via Cterminal cysteines and the alternative pathway that small non-physiological Hg(II) substrates such as Hg. Br 2 and Hg(CN)2 can enter. The alternative pathway is too small for bulky Hg(SR)2 substrates, so the segment must move out of the way when the C-terminal cysteines are absent in the CCAA mutant.

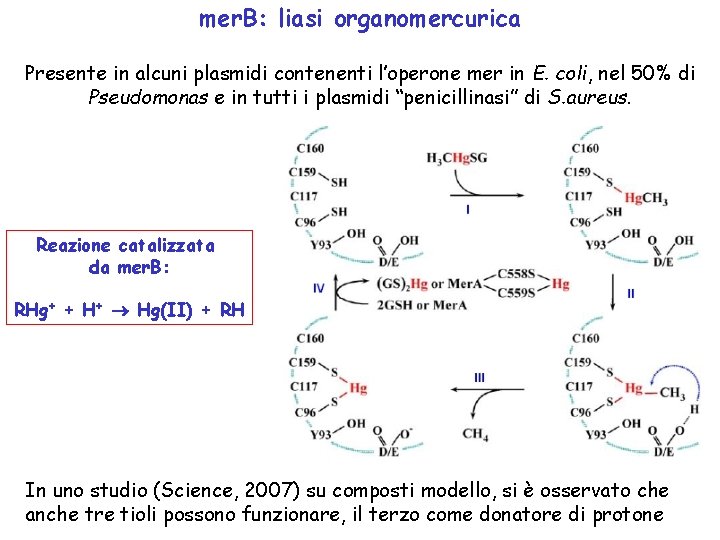
mer. B: liasi organomercurica Presente in alcuni plasmidi contenenti l’operone mer in E. coli, nel 50% di Pseudomonas e in tutti i plasmidi “penicillinasi” di S. aureus. Reazione catalizzata da mer. B: RHg+ + H+ Hg(II) + RH In uno studio (Science, 2007) su composti modello, si è osservato che anche tre tioli possono funzionare, il terzo come donatore di protone

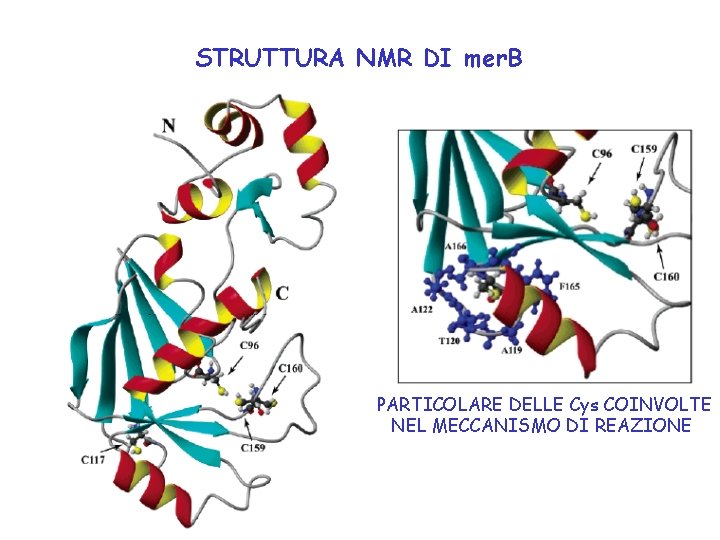
STRUTTURA NMR DI mer. B PARTICOLARE DELLE Cys COINVOLTE NEL MECCANISMO DI REAZIONE

Una pianta di pioppo nero americano transgenica che produce Mer. B (destra) mette radici in terreni contaminati con livelli di fenlimercurio (fenilmercurio acetato, PMA, è stato usato come disinfettante) che ne inibiscono la crescita nella pianta wildtype (sinistra). S. Lyyra et al. , Plant Biotechnol. J. 5, 254 (2007).

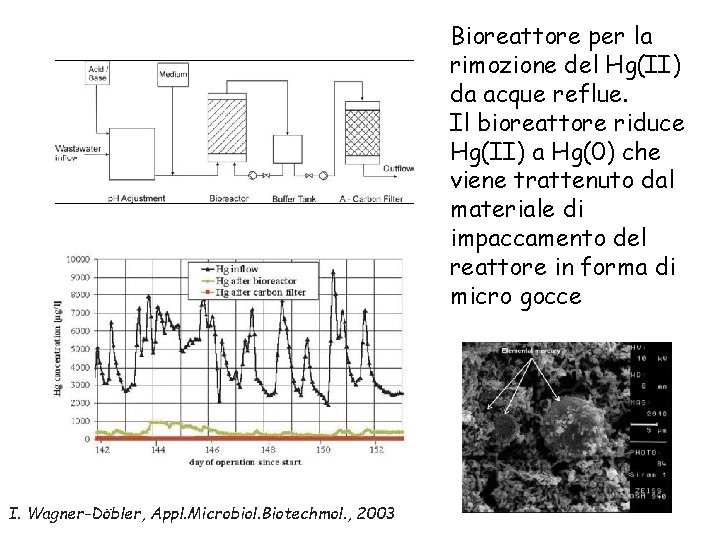
Bioreattore per la rimozione del Hg(II) da acque reflue. Il bioreattore riduce Hg(II) a Hg(0) che viene trattenuto dal materiale di impaccamento del reattore in forma di micro gocce I. Wagner-Döbler, Appl. Microbiol. Biotechmol. , 2003

I rimanenti meccanismi di resistenza a ioni inorganici tossici sfruttano sistemi di efflusso. POMPE DI MEMBRANA ATPasiche: 1. P-type ATPase: intermedio covalentemente fosforilato (ATP) 2. ABC ATPase: contengono un dominio legante ATP, generalmente appartenente ad una subunità ATPasica citoplasmatica associata alla membrana, non si formano intermedi fosforilati. POMPE DI MEMBRANA CHEMIOSMOTICHE: 1. Major Facilitator Superfamily (MFS): polipeptide con 12 -14 eliche TM 2. Cation Diffusion Facilitator family (CDF): i più rappresentativi sono Czc. D per Cd, Zn, Co 3. CBA family: complessi di antiporto chemiosmotico costituiti da un etrotrimero formato da una subunità TM nella membrana interna, una nella membrana esterna ed una periplasmatica che connette le due subunità TM (es: Czc. CBA) 4. Chr. A: sistema di efflusso del cromato 5. Ars. B: sistema di efflusso di arsenito [As(III)] e antimonito [Sb(III)]

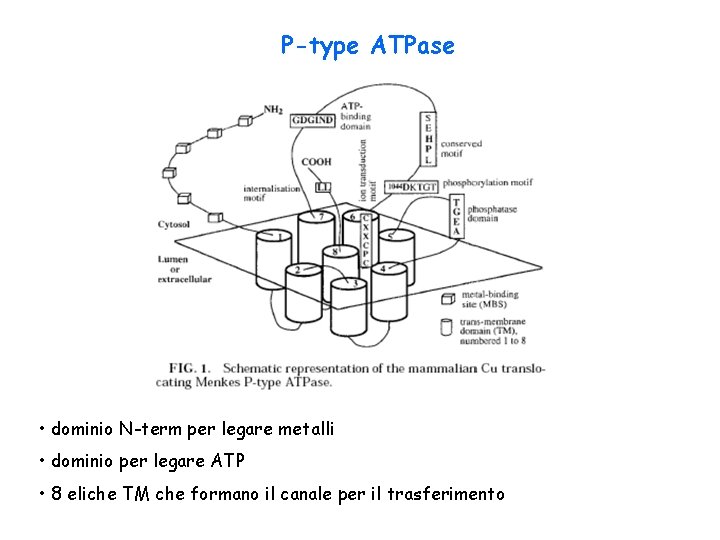
P-type ATPase • dominio N-term per legare metalli • dominio per legare ATP • 8 eliche TM che formano il canale per il trasferimento

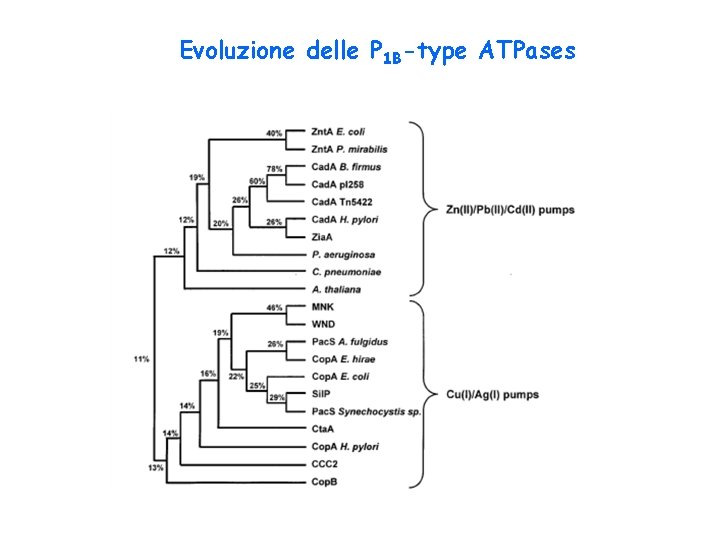
Evoluzione delle P 1 B-type ATPases

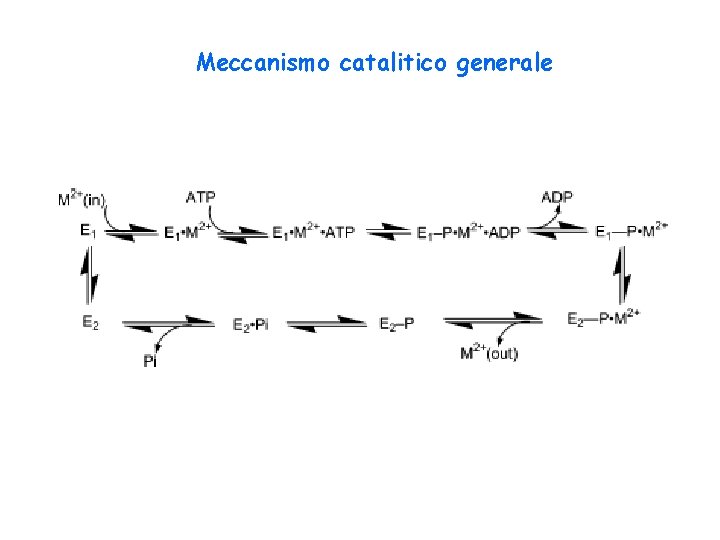
Meccanismo catalitico generale