Tit 15 Mt s mui quan trng Kim
















- Slides: 19

Tiết 15: Một số muối quan trọng

Kiểm tra bài cũ Đáp án: 1, Phản ứng trao đổi là PƯHH, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần 1, Thế nào là ứngchúng, trao đổi ? Điều kiện xảy phản cấuphản tạo của để tạo ra những hợp ra chất mới. ứng trao đổi? Viết PTPƯ Điều minhkiện họa? phản ứng trao đổi xảy ra : Đáp án: 2, Điền công thứcứng hóa học hệ số thích hợp vào chỗ Phản trao đổivà trong dung dịchcủa củachất các chất chỉ trống 2. tronga. các Fesơ + đồ Cu. Cl Cu xảy ra nếu phẩm thành không tan hoặc chất 2 sản 2 +có chất phản ứng sau: tạo Fe. Cl khí. + Cu. Cl > ……. . 2 b. a. …… Ca. CO + 2 HCl Ca. Cl 2 + +Cu. CO 2 + H 2 O 3 b. Ca. CO 3 + …… > Ca. Cl 2 +. . …+ H 2 O c. c. KOH + + HNO ++ H 3 3 2 O KOH …… 3 > KNO …… Na. SO SO 4 ++Ba. Cl …… > Ba. SO 4 + 2 Na. Cl + …… d. d. Na 22 4 e. KCl. O 3 t 0 > KCl + …… e. 2 KCl. O 3 2 KCl + O 2

Tiết 15: I. Muèi natri clorua (Na. Cl) Em 1. Tr¹ng th¸i nhiªn Quatù quan sáthãy Trong 1 m 3 nước biển có hòa tan cho biếtcó: tranh vẽnatri em clorua chừng 27 kg muối natri clorua, 5 Trong tù nhiªn muèi Vậy theo cách kg muối magie clorua, 1 kg muối hãy cho biết + Hßa tan trong n ícbiÓn. Em hảy cho biết canxi sunfat và một khối lượng + KÕt tinh trong muèi. khai thác muối khai cáchmá khai trong tự nhiênnhỏ muối khác. thác muối ăn muối natri clorua có natri clorua ta làm Hà Tĩnh chúng 2. C¸ch khai th¸c muối ăn như thế nào? từ nước biển? ở đâu? v Khai th¸c tõ n ícbiÓn: ta có vùng quê từ mỏ Cho n ícbiÓn bay h¬i tõ tõ thu ® îc muối? nào làm muối muèi kÕt tinh. v Khai th¸c tõ má muèi: hay §µo hÇm hoÆc giÕng s©u qua líp ®Êt ®¸ ®Õn má muèi. Muèi má ® îc nghiÒn nhá vµ tinh chÕ ®Ó cã muèi s¹ch. 3. øng dông không?

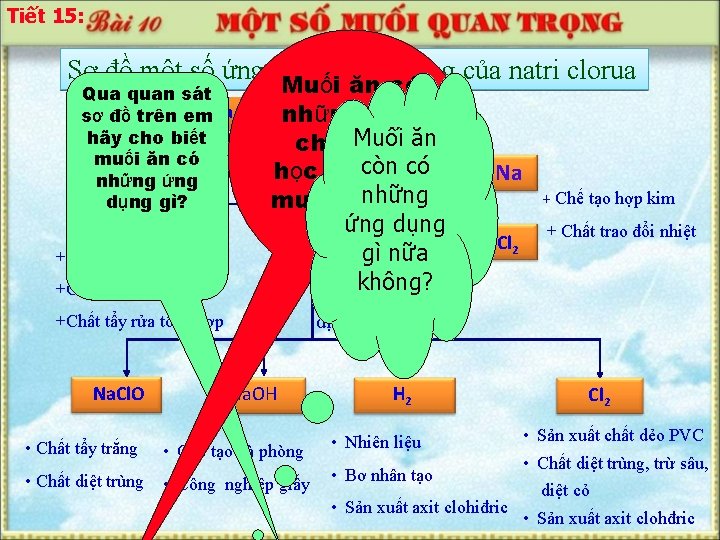
Tiết 15: Sơ đồ một số ứng dụng quan trọng của natri clorua Muối ăn có Qua quan sát quản thựctính phẩm sơ đồ trên em. Gia vị bảonhững hãy cho biết chất Muối hoá ăn muối ăn có còn có học nào của Na. HCO 3ứng những Điện phân những muối ? dụng gì? Na. Cl không Na 2 CO 3 nóng chảy ứng dụng Na + Chế tạo hợp kim Na. Cl Điện gì nữa phân không? dung dịch +Sản xuất thủy tinh +Chế tạo xà phòng +Chất tẩy rửa tổng hợp Na. Cl. O Na. OH • Chất tẩy trắng • Chế tạo xà phòng • Chất diệt trùng • Công nghiệp giấy H 2 Cl 2 + Chất trao đổi nhiệt Cl 2 • Sản xuất chất dẻo PVC • Chất diệt trùng, trừ sâu, • Bơ nhân tạo diệt cỏ • Sản xuất axit clohiđric • Sản xuất axit clohđric • Nhiên liệu

Tiết 15: I. Muèi natri clorua (Na. Cl) 1. Tr¹ng th¸i tù nhiªn 2. C¸ch khai th¸c 3. øng dông - Làm gia vị và bảo quản thực phẩm. - Dùng để sản xuất : Na; H 2 ; Cl 2 ; Na. OH ; Na 2 CO 3 ; Na. HCO 3 ………………. II. Muèi kali nitrat (KNO 3) 1. TÝnh chÊt Lµ chÊt r¾n mµu tr¾ng, tan nhiÒu trong n íc. BÞ ph©n hñy ë nhiÖt ®é cao t¹o thµnh muèi kali nitrit (KNO 2) vµ khÝ oxi. => KNO 3 cã tÝnh oxi hãa m¹nh. PTHH t 0 2 KNO + O 2 KNO 3 2 2 (r) (k) Kali nitrat Kali nitrit Muối kali nitrat có những tính Qua quan hoá học Thíchất nghiệm Nhóm: nào củasát muốithí 1. Quan sát mẫu chất kali nitrat. hay không? nghiệm (Trạng thái, màu sắc) em vào cốc nước. 2. Hòa tantrên kali nitrat hãytan cho (Tính trong nước) biết kali nitrat có tính chất vật lí như thế nào?

Tiết 15: I. Muèi natri clorua (Na. Cl) 1. Tr¹ng. Qua th¸iquan tù nhiªn tranh 2. C¸chsát khai th¸c vẽ , em 3. øng dông hãy cho biết muối II. Muèi kali (KNO 3) kalinitrat có những 1. TÝnh chÊt Lµ chÊtứng r¾ndụng mµu tr¾ng, tan nhiÒu trong n íc. gì? BÞ ph©n hñy ë nhiÖt ®é cao t¹o thµnh muèi kali nitrit (KNO 2). => KNO 2 cã tÝnh oxi hãa m¹nh. PTHH 0 t 2 KNO 3 2 KNO 2 + O 2 (r) (k) Kali nitrat Kali nitrit 2. øng dông - Chế tạo thuốc nổ đen. - Làm phân bón (cung cấp nguyên tố nitơ và kali cho cây trồng ). - Bảo quản thực phẩm trong công nghiệp.

Tiết 15: ØTác dụng tốt của muối ăn : Một gia vị không thể thiếu trong bữa ăn hằng ngày, bảo quản thực phẩm, làm nguyên liệu sản xuất Na. OH, Cl 2, HCl, . . . ØẢnh hưởng xấu của muối ăn : Đất nông nghiệp bị nhiễm mặn làm cây trồng bị chết. Con người không thể sử dụng nước mặn trong sinh họat. . . . Tóm lại : Một chất bất kỳ có thể có ảnh hưởng tốt hoặc xấu hoàn toàn là do cách sử dụng của con người.

Ngòai ra muối Na. Cl còn có nhiều ứng dụng trong cuộc sống, có thể dùng làm mộtvặt: số vị Tẩy thuốc chữa một Mẹo vếtđểkhó chùi rửasốở bệnh: xoong rắc muối chỗ dơ, đểmuối một hoà giờ sau đó Làm tanchảo: phù mắt: dùnglên một muỗng tan trong 600 ml nước chùi bông rửa lại, xoong chảo sẽ sạch. nóng, dùng thấm nước muối, đắp lên mắt, giúp chống sưng phù mắt. - Bảo quản đồ thủy tinh: khi mua về, bạn cho vào nồi nước có pha muối, nấu sôi lên. Sau đó thậttiếng: nguộitrước rồi vớt và rửa lại bằng nước Khô cổ, để khàn khiradiễn thuyết, ca hát, hớp một ngụm nước lã, đồ thủy tinh sẽ có thể chịu nhiệt tốt. muối nhạt. - Tẩy quần áo dơ: vắt chanh tươi lên quần áo bị gỉ saugừng đó lấy muối để một Cảm mạo dosắt, lạnh: tươi sau bột khi rắc giã lên, nhuyễn, rang nóng với muối, đêmtúi vàvải, giặtđắp lại bằng xà phòng và nước lạnh. chứa trong lên trán. - Làm sạch thảm: rắc đều muối lên chỗ dơ, để trong vài giờ, sau đó dùng bàn chải mềm chải Điều trị táo bón: người bệnh táo bón mỗi ngày uống 1 ly nước muối lúc thật kỹ, thảm sẽ sạch. bụng đói, giúp tăng cường tiêu hoá, giảm nhẹ táo bón. Điều trị bệnh trĩ, nứt hậu môn: dùng ít muối pha với nước nóng, ngồi ngâm.

Tiết 15: I. Muèi natri clorua (Na. Cl) 1. Tr¹ng th¸i tù nhiªn 2. C¸ch khai th¸c 3. øng dông - Làm gia vị và bảo quản thực phẩm. - Dùng để sản xuất : Na; H 2 ; Cl 2 ; Na. OH ; Na 2 CO 3 ; Na. HCO 3 ………………. II. Muèi kali nitrat (KNO 3) 1. TÝnh chÊt Lµ chÊt r¾n, tan nhiÒu trong n íc. BÞ ph©n hñy ë nhiÖt ®é cao t¹o thµnh muèi kali nitrit (KNO 2). => KNO 2 cã tÝnh oxi hãa m¹nh. t 0 2 KNO + O 2 KNO 3 PTHH 2 2 (r) (k) Kali nitrat Kali nitrit 2. øng dông - Chế tạo thuốc nổ đen. - Làm phân bón (cung cấp nguyên tố nitơ và kali cho cây trồng ). - Bảo quản thực phẩm trong công nghiệp.

Thảo luận nhóm (1 phút) 1 - Bài tập 1 trang 36 SGK : Có những muối sau : Ca. CO 3 ; Ca. SO 4 ; Pb(NO 3)2 ; Na. Cl Muối nào nói trên : a) Không được phép có trong nước ăn vì tính độc hại của nó Pb(NO 3)2 ? . . b) Không độc nhưng cũng không được có trong nước ăn vì vị Na. Cl mặn của nó ? . . . c) Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao Ca. CO 3 ? . . d) Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao ? . . Ca. SO 4

Chúc Phần mùng em. thưởng Phần của em là thưởng một tràng của em là vỗ tay. điểm 10 1 2 3 4 Phần thưởng của em là một chiếc một quyển bút vở 3 4 1 2 3 4

Câu 1 Khi điện phân dung dịch Na. Cl có màng ngăn, sản phẩm thu được là : A- Na. OH ; H 2 ; Cl 2. B- Na. Cl ; Na. Cl. O ; H 2 ; Cl 2. C- Na. Cl ; Na. Cl. O ; Cl 2. D- Na. Cl. O ; H 2 ; Cl 2.

Câu 2 Một trong những thuốc thử nào sau đây có thể dùng phân biệt dung dịch Na. Cl và KNO 3: A- Dung dịch Ba. Cl 2 B- Dung dịch Na. OH C- Dung dịch Ag. NO 3 D- Dung dịch HCl

Câu 3 Muối làm nguyên liệu sản xuất vôi, xi măng …. là: A- Na. Cl. B- KNO 3 C- Ca. CO 3 D- KNO 3

Câu 4 Phương pháp nào sau đây có thể điều chế được muối KNO 3 A- Cho dung dịch Na. Cl vào dung dịch KOH B- Cho dung dịch HNO 3 vào dung dịch KOH C- Cho dung dịch KCl vào dung dịch Cu(NO 3)2 D- Cho dung dịch Na. Cl vào dung dịch Ba(NO 3)2

Bài tập 2: Trộn 200 ml dung dịch K 2 SO 41 M với 150 ml dung dịch Ba(NO 3)2 2 M a) Tính lượng kết tủa thu được. b) Tính nồng độ mol dung dịch thu được sau phản ứng (Giả sử thể tích dung dịch trước và sau phản ứng không đổi) Phương hướng giải bài: - Tính số mol của 2 chất tham gia. - Viết phương trình hóa học. - Xác định chất tham gia phản ứng hết và chất dư (nếu có). - Sử dụng số mol của các chất phản ứng hết để tính toán theo phương trình.

Bài tập 2: Trộn 200 ml dung dịch K 2 SO 41 M với 200 ml dung dịch Ba(NO 3)2 1, 5 M a) Tính lượng kết tủa thu được. b) Tính nồng độ mol dung dịch thu được sau phản ứng (Giả sử thể tích dung dịch trước và sau phản ứng không đổi) Theo pư: Giải n. Ba(NO ) 3 2 = 0, 2 x 1, 5=0, 3(mol) PTHH: K 2 SO 4 + Ba(NO 3)2 Ba. SO 4 + 2 KNO 3 Trước pư 0, 2 mol 0. 3 mol 0 mol Phản ứng 0, 2 mol 0, 2 0, 4 Sau pư 0 mol 0, 1 mol 0, 2 mol 0, 4 mol a) Tính khối lượng kết tủa thu được: n. KNO =0, 4(mol) Vdd sau pư = 0, 2 + 0, 2 = 0, 4 (lit) CMKNO = 0, 4 : 0, 4 = 1(M) 3 CMBa(NO ) 3 2 (M) b) Dung dịch thu được sau phản ứng là KNO 3 và Ba(NO 3)2 dư 3 (dư) = 0, 1 : 0, 4 = 0, 25

HƯỚNG DẪN VỀ NHÀ • Học bài và làm bài tập : 2, 3, 4, 5 trang 36 SGK. • Đọc phần : “Em có biết ? “ trang 36 SGK • Chuẩn bị bài “ Phân bón hóa học” : Tìm hiểu xem về vai trò của các nguyên tố hóa học đối với cây trồng? Những lọai phân bón hóa học nào thường dùng và tác dụng của chúng?
