Tiivistelm 7 Hapot ja emkset Useimpien epmetallioksidien vesiliuokset



- Slides: 5

Tiivistelmä 7. Hapot ja emäkset • Useimpien epämetallioksidien vesiliuokset ovat happamia ja metallioksidien vesiliuokset ovat emäksisiä. • Vetyionit aiheuttavat liuoksen happamuuden. • Hydroksidi-ionit aiheuttavat liuoksen emäksisyyden. • Teollisuudessa tärkeitä happoja ovat rikkihappo, typpihappo ja suolahappo. • Teollisuuden tärkeitä emäksiä ovat natriumhydroksidi, ammoniakki ja erilaiset karbonaatit. _ Avain Kemia 2 | Luku 7 +

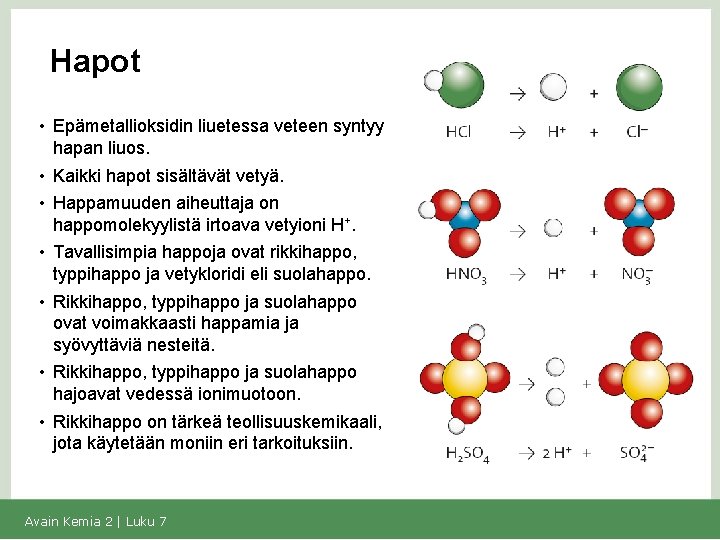
Hapot • Epämetallioksidin liuetessa veteen syntyy hapan liuos. • Kaikki hapot sisältävät vetyä. • Happamuuden aiheuttaja on happomolekyylistä irtoava vetyioni H+. • Tavallisimpia happoja ovat rikkihappo, typpihappo ja vetykloridi eli suolahappo. • Rikkihappo, typpihappo ja suolahappo ovat voimakkaasti happamia ja syövyttäviä nesteitä. • Rikkihappo, typpihappo ja suolahappo hajoavat vedessä ionimuotoon. • Rikkihappo on tärkeä teollisuuskemikaali, jota käytetään moniin eri tarkoituksiin. Avain Kemia 2 | Luku 7

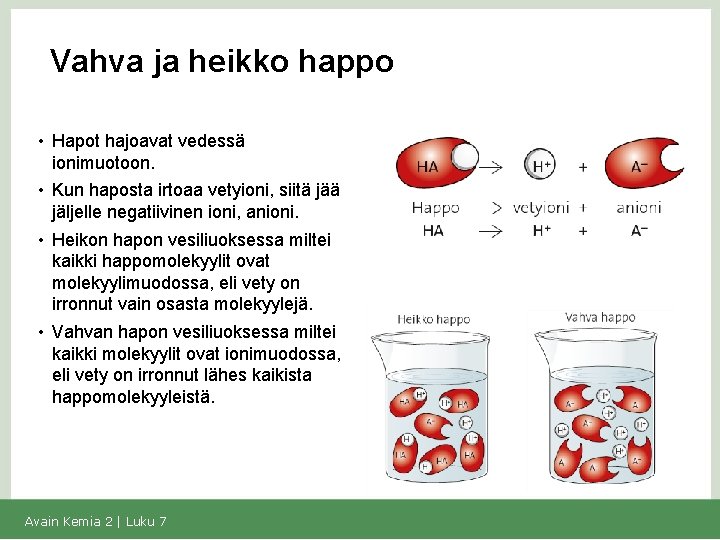
Vahva ja heikko happo • Hapot hajoavat vedessä ionimuotoon. • Kun haposta irtoaa vetyioni, siitä jäljelle negatiivinen ioni, anioni. • Heikon hapon vesiliuoksessa miltei kaikki happomolekyylit ovat molekyylimuodossa, eli vety on irronnut vain osasta molekyylejä. • Vahvan hapon vesiliuoksessa miltei kaikki molekyylit ovat ionimuodossa, eli vety on irronnut lähes kaikista happomolekyyleistä. Avain Kemia 2 | Luku 7

Emäkset • Metallioksidin liuetessa veteen syntyy emäksinen liuos. • Emäksisyyden aiheuttaa hydroksidi-ioni OH–. • Tavallisimpia emäksisiä aineita ovat lipeä eli natriumhydroksidi Na. OH, ammoniakki NH 3 ja sooda eli natriumkarbonaatti Na 2 CO 3. • Natriumhydroksidi on vahva emäs, joka hajoaa vedessä natriumioniksi ja hydroksidiioniksi: Na. OH Na+ + OH– • Ammoniakki on tärkeä kemikaali kemianteollisuudessa. Avain Kemia 2 | Luku 7

Happamuusaste ja p. H • Happamuusaste kuvaa liuoksen happamuuden tai emäksisyyden voimakkuutta. • Liuoksen happamuusaste ilmaistaan p. H-arvolla. • Liuoksen p. H-arvo vaihtelee välillä 0– 14. • Happaman liuoksen p. H on alle 7, emäksisen liuoksen p. H yli 7 ja neutraalin liuoksen noin 7. • Liuoksen happamuus ja emäksisyys voidaan todeta indikaattorilla. • Liuoksen p. H määritetään yleisindikaattoripaperilla tai p. H-mittarilla. Avain Kemia 2 | Luku 7



