The Applicacation of Mole Consept in Defining Chemical







- Slides: 10

The Applicacation of Mole Consept in Defining Chemical Calculation Penggunaan Konsep Mol dalam Hitungan Kimia

a. Konsentrasi Molar (Molaritas) Molaritas adalah jumlah mol zat terlarut dalam tiap literlarutan yang dinyatakan dengan notasi M. M= n V Dimana: M=Molaritas n=mol zat terlarut V=Volume larutan (liter) Contoh: Berapa molaritas larutan jika 4 gram Na. OH dilarutkan dalam 250 ml larutan ? . 4 4 = Dikatahui : massa Na. OH 4 gram Mr Na. OH 40 Volume larutan 250 ml =0, 25 liter = 0, 1 mol = 0, 4 M Maka Molaritas larutan= 0, 25 liter

b. Penentuan Rumus Empiris dan Rumus Molekul *Menentukan rumus empiris: -Tentukan perbandingan masa unsur-unsur atau perbandingan persentase unsur-unsur penyusun senyawa. -Tentukan perbandingan mol dengan membagi Ar masing-masing, tentukan perbandingan terkecil dan bulat. *Menentukan rumus molekul: -Sudah diketahui Mr. - RE = Mr

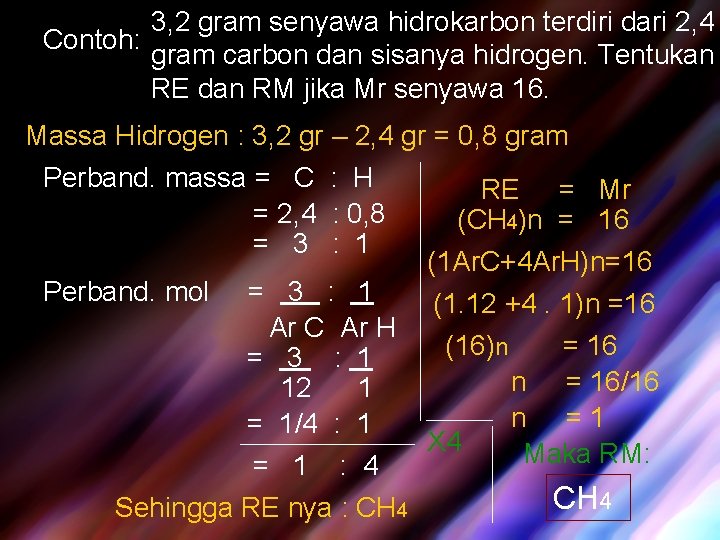
3, 2 gram senyawa hidrokarbon terdiri dari 2, 4 Contoh: gram carbon dan sisanya hidrogen. Tentukan RE dan RM jika Mr senyawa 16. Massa Hidrogen : 3, 2 gr – 2, 4 gr = 0, 8 gram Perband. massa = C : H = 2, 4 : 0, 8 = 3 : 1 Perband. mol RE = Mr (CH 4)n = 16 (1 Ar. C+4 Ar. H)n=16 = 3 : 1 (1. 12 +4. 1)n =16 Ar C Ar H (16)n = 16 = 3 : 1 n = 16/16 12 1 n =1 = 1/4 : 1 X 4 Maka RM: = 1 : 4 CH 4 Sehingga RE nya : CH 4

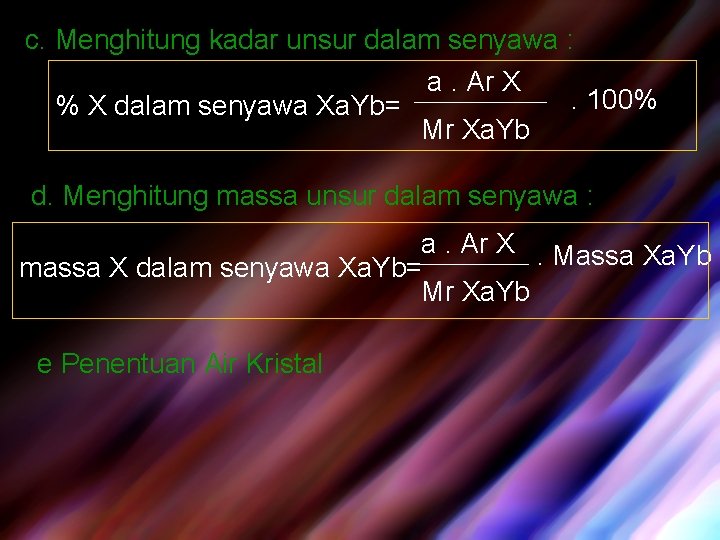
c. Menghitung kadar unsur dalam senyawa : a. Ar X. 100% % X dalam senyawa Xa. Yb= Mr Xa. Yb d. Menghitung massa unsur dalam senyawa : a. Ar X. Massa Xa. Yb massa X dalam senyawa Xa. Yb= Mr Xa. Yb e Penentuan Air Kristal

f. Hitungan Kimia dalam Persamaan Reaksi Langkah-langkah yang harus dilakukan : Tulis Persaman Raksi dan setarakan Ubah mol dari zat-zat yang diketahui Zat yg terlibat dalam bentuk gas, tentukan mol/volume dari zat yang diketahui Masukkan mol dalam Persamaan reaksi Masukkan mol/volume ke Persamaan reaksi Setarakan mol yang diketahui dengan yang ditanyakan Ubah mol yang ditanyakan Sesuai yang dikehendaki

Logam Mg sebanyak 4, 8 gram direaksikan Contoh 1: dengan larutan asam klorida berlebihan menghasilkan magnesium klorida dan gas hidrogen. Berapa volume gas hidrogen yang dihasilkan bila diukur pada tekanan standar ? Diketahui : 4, 8 gr Mg Langkah 1 Mg(g) + 2 HCl(aq) Mg. Cl 2(aq) + H 2(g) 4, 8 mol 4, 8 gr Mg = 0. 2 mol Ar Mg Langkah 3 Langkah 4 4, 8 mol = Volume H 2 (STP)=0. 2 X 22, 4 liter 24 =4, 48 liter = 0. 2 mol Langkah 5 Langkah 2

Gas C 3 H 8 sebanyak 2, 5 liter dibakar sempurna Contoh 2: dengan oksigen menghasilkan gas CO 2 dan uap air. Tentukan : - persamaan reaksinya dan setarakan! - volume gas oksigen yang diperlukan! - volume gas CO 2 yang terbentuk C 3 H 8(g) + 5 O 2(g) 2, 5 liter 12, 5 liter 3 CO 2(g) + 4 H 2 O(g) 7, 5 liter 10 liter

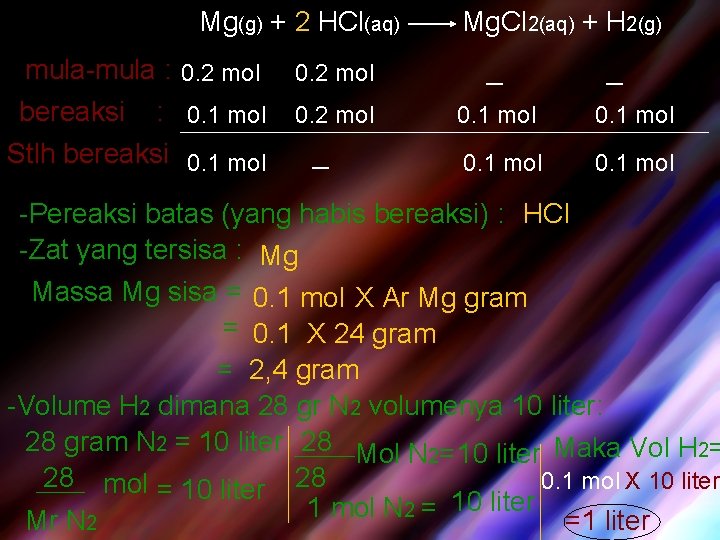
g. Pereaksi Batas Contoh 3: Logam Mg sebanyak 4, 8 gram direaksikan dengan 0, 2 mol HCl menghasilkan larutan magnesium clorida dan gas hidrogen. Tentukan : -Pereaksi batas, -Zat yang tersisa, berapa massanya, -Volume gas H 2 yang dihasilkan pada saat dimana 28 gram N 2 volumenya 10 liter. Diketahui : 4, 8 gram Mg= 0, 2 mol HCl 4, 8 Ar Mg mol = 0. 2 mol

Mg(g) + 2 HCl(aq) mula-mula : 0. 2 mol bereaksi : 0. 1 mol Stlh bereaksi 0. 1 mol Mg. Cl 2(aq) + H 2(g) 0. 2 mol _ 0. 2 mol 0. 1 mol _ _ -Pereaksi batas (yang habis bereaksi) : HCl -Zat yang tersisa : Mg Massa Mg sisa = 0. 1 mol X Ar Mg gram = 0. 1 X 24 gram = 2, 4 gram -Volume H 2 dimana 28 gr N 2 volumenya 10 liter: 28 gram N 2 = 10 liter 28 Mol N 2=10 liter Maka Vol H 2= 28 mol = 10 liter 28 0. 1 mol X 10 liter 1 mol N 2 = 10 liter Mr N 2 =1 liter