Termologia Quando dois corpos com temperaturas diferentes entram
































- Slides: 40

Termologia Quando dois corpos com temperaturas diferentes entram em contato um com o outro eles trocam temperatura ou calor?

Ø Definindo calor e temperatura - calor é, portanto, energia térmica em trânsito; calor trânsito - a energia térmica transita da região de maior temperatura (maior agitação) para a região de menor temperatura (menor agitação) naturalmente ; - quando dois ou mais corpos estão à mesma temperatura, o temperatura somatório do trânsito local de calor é zero. Isso é ententido, macroscopicamente, como equilíbrio térmico. - temperatura mede o nível de agitação térmica e indica temperatura térmica o sentido do fluxo natural de calor.

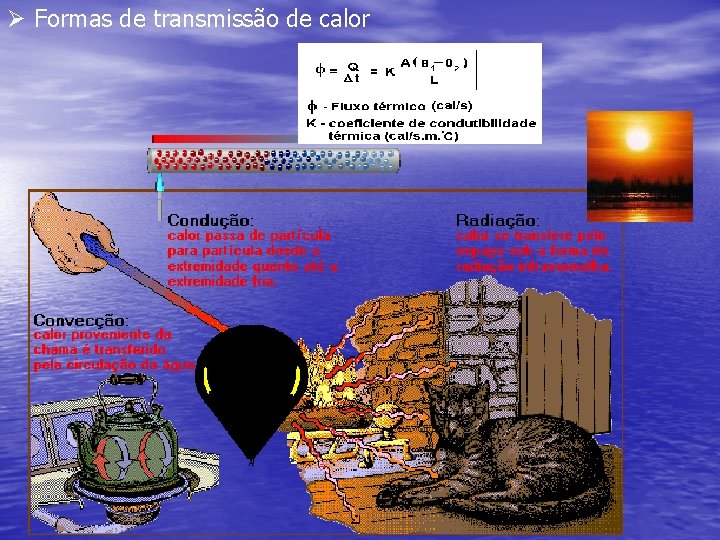
Ø Formas de transmissão de calor

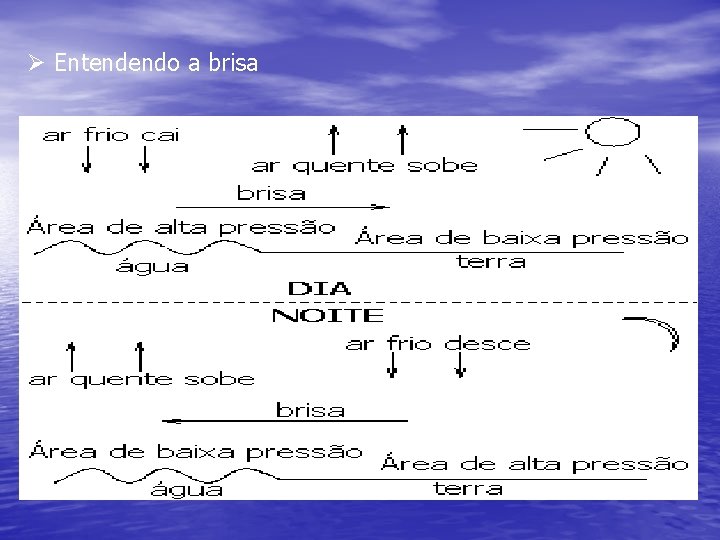
Ø Entendendo a brisa

Ø Resumindo ü Calor: Energia térmica que transita da região de maior temperatura para região de menor temperatura naturalmente. ü Temperatura: Determina o grau de agitação de um sistema e indica o sentido do fluxo de calor. ü Formas de transmissão de calor: convecção: gases e líquidos condução: sólidos radiação ou irradiação: espaço (ondas eletromagnéticas)

Vamos medir a temperatura dos corpos ü De forma qualitativa, podemos descrever a temperatura de um objeto como aquela que determina a sensação de quanto ele está quente ou frio quando entramos em contato com ele. ü No entanto, em alguns casos, é preciso quantificar a temperatura, para isso foram criados os termoscópios ou termômetros.

Termômetros ü Um termômetro é um instrumento que mede quantitativamente a temperatura de um sistema. A maneira mais fácil de se fazer isso é achar uma substância que possua uma propriedade que se modifica de modo regular com a modifica temperatura.

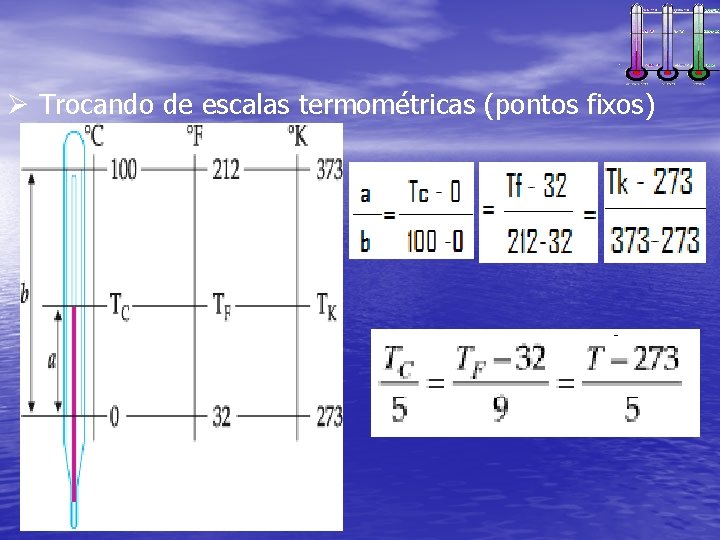
ü Escalas termométricas Escala Celsius No século XVIII, o físico e astrônomo sueco Anders Celsius(1701 -1744) sugeriu que a temperatura de fusão do gelo, ao nível do mar, recebesse o valor arbitrário de 0 grau (hoje 0 o C), e que a temperatura de ebulição da água, também ao nível do mar, fosse fixada em 100 graus (100 o C, valor igualmente arbitrário).

ü Escalas termométricas Escala Fahrenheit Em 1713 Gabriel Fahrenheit (1686 -1736), um um operário de uma fábrica de vidro, constrói um termômetro a álcool, que logo depois é substituido por um de mercúrio; ele usa como pontos fixos as temperaturas de uma mistura de cloreto de amônia com neve e do corpo humano, dividindo o espaço entre elas em 96 partes. Em 1724, passa a trabalhar com o ponto de ebulição da água, a 212°F, como ponto fixo superior, e com o ponto de fusão do gelo a 32°F; a escolha destes pontos define a escala conhecida hoje como Fahrenheit.

ü Escalas termométricas Escala Kelvin Sabe-se que não há, teoricamente, um limite superior para a temperatura que um corpo pode alcançar. Observa-se, entretanto, que existe um limite inferior. Os cientistas verificaram que é impossível reduzir a temperatura de qualquer substância a um valor inferior a -273º C (o zero absoluto). O físico inglês lorde Kelvin( 1824 -1907) propôs uma escala termométrica, que leva o seu nome. Tal escala tem origem no zero absoluto, usando como unidade de variação o grau Celsius. Na escala Kelvin, a temperatura de fusão do gelo corresponde a 273 K e a de ebulição da água, a 373 K.

Ø Trocando de escalas termométricas (pontos fixos)

Ø Trocando de escalas termométricas (variações)

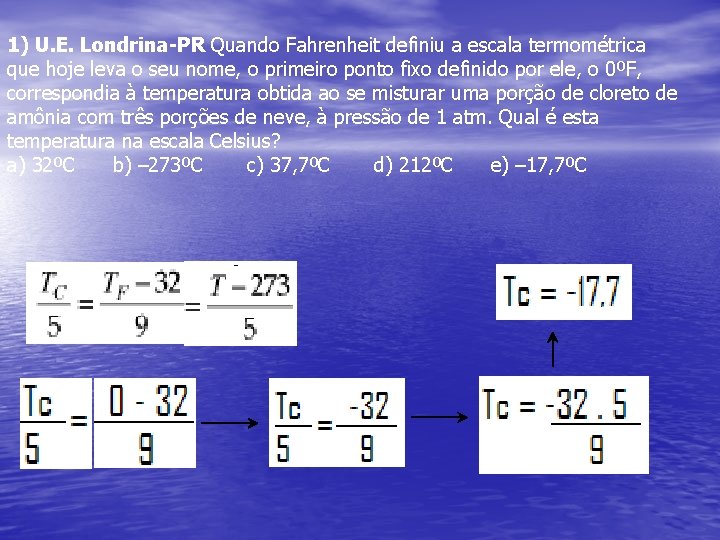
1) U. E. Londrina-PR Quando Fahrenheit definiu a escala termométrica que hoje leva o seu nome, o primeiro ponto fixo definido por ele, o 0ºF, correspondia à temperatura obtida ao se misturar uma porção de cloreto de amônia com três porções de neve, à pressão de 1 atm. Qual é esta temperatura na escala Celsius? a) 32ºC b) – 273ºC c) 37, 7ºC d) 212ºC e) – 17, 7ºC

2) UFR-RJ Um corpo de massa m temperatura t 0. Este corpo é aquecido até atingir uma temperatura t. Verifica-se, então, que a variação de temperatura Dt = t – t 0 = 15ºC. Neste caso, determine quanto corresponde esta variação de temperatura, nas escalas: a) Kelvin b) Farrenheit a) b)

3)(UNIMEP-SP) Mergulharam-se dois termômetros na água no estado liquido a 1 atm: um graduado na escala Celsius e o outro na escala Fahrenheit. Espera-se o equilíbrio térmico e nota-se que a diferença entre as leituras nos dois termômetros é igual a 92. A partir dessas informações, determine a temperatura da água em Celsius Tf – Tc = 92 1, 8 Tc = Tf – 32 1, 8 Tc = 92 + Tc – 32 0, 8 Tc = 60 Tc = 75 °C

4) O gráfico a seguir apresenta a relação entre a temperatura na escala Celsius e a temperatura numa escala termométrica arbitrária X. Calcule a temperatura de ebulição da água (100° C – 1 atm) na escala X. X = a. C + b (função do primeiro grau) 30 = ((80 -30)/(70 -20)). 20 + b 30 = (50/50). 20 + b 30 – 20 = b b = 10 °X X = 1. C + 10 X = 1. 100 + 10 X = 110 °X

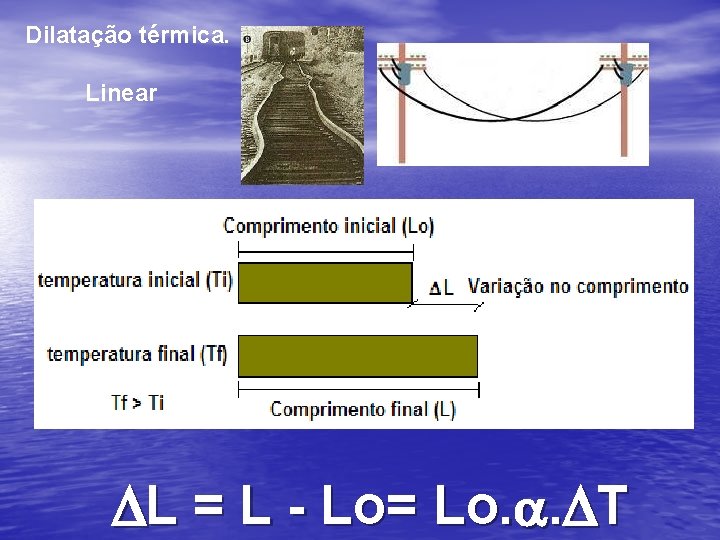
Dilatação térmica. Linear DL = L - Lo= Lo. a. DT

Dilatação térmica. Superficial DA=A-Ao=Ao. b. DT b = 2 a

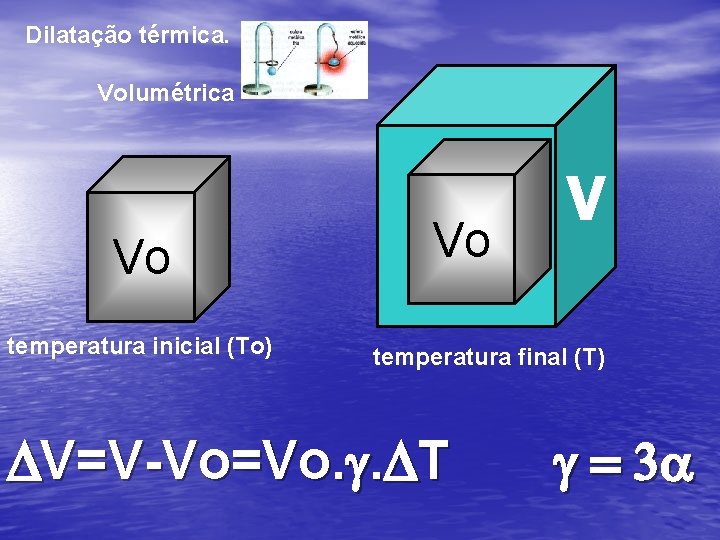
Dilatação térmica. Volumétrica Vo temperatura inicial (To) Vo V temperatura final (T) DV=V-Vo=Vo. g. DT g = 3 a

Calorimetria Calor sensível Calor latente Capacidade térmica Trocas de calor

CALOR SENSÍVEL Em 1747 o físico russo George Wilhelm Richmann (1711 -1753) Já havia observado que quantidades distintas de uma mesma substância, num mesmo estado físico, precisam de quantidades de calor diferentes para uma mesma elevação de temperatura. Em 1772, o físico alemão Johann Carl Wilcke (1732 -1796) observou que quantidades iguais de substâncias distintas necessitavam de quantidades de calor diferentes para uma mesma elevação de temperatura, levando assim ao conceito que o químico sueco Johan Gadolin, em 1784, denominou de calor específico.

ü Quantidade de Calor sensível A quantidade de calor recebida ou cedida por um corpo, ao sofrer variação de temperatura sem que haja mudança de estado físico, é denominada calor sensível. Q = m. c. Dq Q = quantidade de calor (cal) m = massa (g) c = calor específico (cal/g°C) Dq= variação da temperatura (°C ou K) Dq = t. F – t. I

Em 1754 o meteorologista suiço Jean Andre Deluc (1727 -1817) descobriu que a temperatura do gelo durante a fusão não muda. Pegando carona na descoberta de Deluc, o cientista britânico Joseph Black (1728 -1799), em 1761 estabelece o conceito de calor latente, como sendo a quantidade de calor necessária a um corpo para provocar uma mudança no seu estado de agregação, neste caso, fundir o gelo.

ü Quantidade de Calor latente Quando uma substância está mudando de estado, ela absorve ou perde calor sem que sua temperatura varie. A quantidade de calor absorvida ou perdida é chamada calor latente e serve para rearranjar as partículas da substância. Q = m. L Q = quantidade de calor m = massa L = calor latente da substância


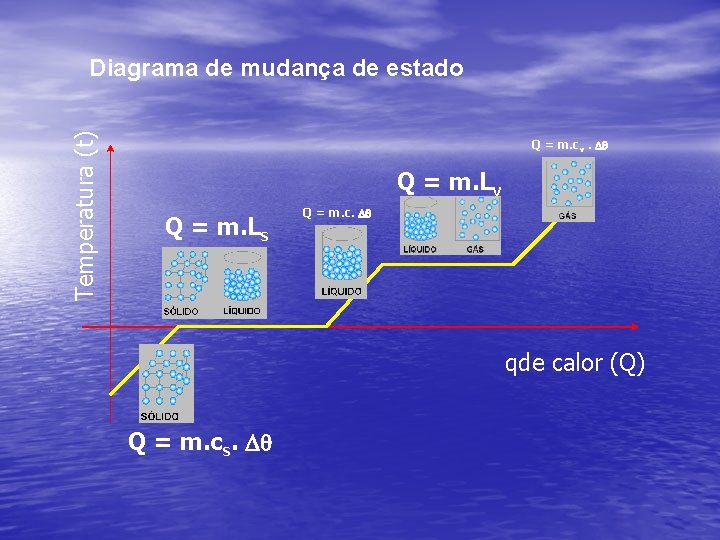
Temperatura (t) Diagrama de mudança de estado Q = m. cv. Dq Q = m. Lv Q = m. Ls Q = m. c. Dq qde calor (Q) Q = m. cs. Dq

Ø Resumindo ü Quantidade de calor sensível A quantidade de calor recebida ou cedida por um corpo, ao sofrer variação de temperatura sem que haja mudança de estado físico, é denominada calor sensível. Q = m. c. Dq ü Quantidade de Calor latente Quando uma substância está mudando de estado, ela absorve ou perde calor sem que sua temperatura varie. A quantidade de calor absorvida ou perdida é chamada calor latente e serve para rearranjar as partículas da substância. Q = m. L

Ø Entendendo a unidade de medida de calor Inicialmente pensava-se que o calor fosse uma espécie de fluído (Teoria do Calórico) contido nos corpos, tal que um corpo quente teria maior quantidade de calor que outro frio. Esta teoria está totalmente errada, só sobrevivendo o termo caloria. Foi o Conde de Rumford (1753 - 1814), físico norte americano/inglês um dos primeiros a contestar esta teoria pela observação do intenso calor gerado na perfuração dos blocos de ferro fundido para a fabricação de canhões: se o calor fosse um fluído de onde viria aquele calor tão intenso se inicialmente a broca e o bloco de ferro estavam à mesma temperatura?

Mais tarde, foi J. P. Joule (1818 - 1889) quem estabeleceu que o calor é definitivamente uma forma de energia (equivalente mecânico do calor => 1 cal = 4, 18 J). Assim, o que existe e é medido são as quantidades de calor trocados entre os corpos, sendo errado falar em conteúdo de calor ou dizer que um corpo tem mais calor que outro

ü O experimento de Joule Unidades de quantidade calor (Q): CALORIA (cal): É a quantidade de calor que deve ser retirada de um corpo ou fornecida a ele para que 1 g de sua massa varie sua temperatura em 1 o. C, na pressão de 1 atm e sem ocorrer transformação de estado. Nota: 1 cal ≈ 4, 2 J

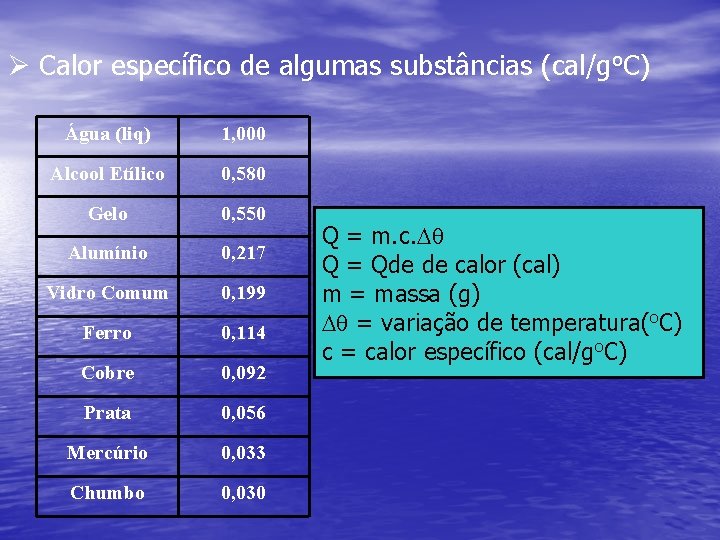
Ø Calor específico de algumas substâncias (cal/go. C) Água (liq) 1, 000 Alcool Etílico 0, 580 Gelo 0, 550 Alumínio 0, 217 Vidro Comum 0, 199 Ferro 0, 114 Cobre 0, 092 Prata 0, 056 Mercúrio 0, 033 Chumbo 0, 030 Q = m. c. Dq Q = Qde de calor (cal) m = massa (g) Dq = variação de temperatura(o. C) c = calor específico (cal/go. C)

Ø Calor latente de algumas substâncias (cal/g) Substância TFUSÃO(o. C) LF(cal/g) TV(o. C) LV(cal/g) Mercúrio -39 2, 8 357 65 Alcool -115 25 78 205 Chumbo 327 5, 8 1750 208 Alumínio 657 95 1750 208 Prata 961 22 2058 - Enxôfre 119 13, 2 420 62 Oxigênio -219 3, 30 -183 51 Nitrogênio 210 6, 09 -196 48 Água 0 79, 7 100 539, 6 Cobre 1083 32 1187 1211 Etílico Q = m. L Q = Qde de calor (cal) m = massa (g) L = calor latente (cal/g)

Ø Nota 1 ü Capacidade Térmica ( C ) A capacidade térmica é uma característica do corpo e não depende só da substância ou material, mas também de seu formato, tamanho, cor, massa, tensões internas. Praticamente representa a capacidade do corpo em absorver ou ceder calor para dada variação de temperatura sem considerar a sua massa. C = m. c = Q / DT (cal /o. C)

Ø Nota 2 ü Num sistema isolado, com dois ou mais corpos, a quantidade total de calor trocada entre os corpos é igual a zero, ou seja, o calor que um corpo perde (qde negativa) o outro recebe (qde positiva). T (OC) A T. eq. B 2 B 3 Q (cal) B 1 Qa + Qb 1 + Qb 2 + Qb 3 = 0

1) Um corpo de massa 50 gramas recebe 300 calorias e sua temperatura sobe de 10 o C até 30 o C. Determine o calor específico da substância que o constitui. Dq = 30 – 10 = 200 C c = Q / m. Dq m = 50 g c = 300 / 50. 20 Q = 300 cal c = 0, 3 cal / g 0 C c = ? Q = m. c. Dq

2) Qual a quantidade de calor que deve ser retirado de 100 g de Prata que está a 961 o. C (T. Fusão) para que ela solidifique completamente? Dados: LS = -22 cal/g m = 100 g L = -22 cal/g Q = m. L Q = 100. (-22) Q = -2200 cal = -2, 2 kcal

3) Qual a quantidade de calor que se deve fornecer a um bloco de 200 g de gelo que está a – 20 o. C para derretê-lo completamente? Dados: ca = 1 cal/go. C. . . . cg = 0, 5 cal/go. C LF = 80 cal/go C m = 200 g qinicial = -20 o. C qfinal = 00 C Q = m. c. Dq Q = m. L Q total = ? QT = QS + QL Q = m. c. Dq + m. L Q =200. 0, 5. ((0 -(-20)) + 200. 80 Q =2000 + 16000 Q = 18000 cal

4) Um bloco de chumbo (Pb) a 200 graus C foi colocado no interior de um vaso adiabático que continha 400 g de água a 20 graus C. Após algum tempo a temperatura de equilíbrio do conjunto foi de 25 graus C. Qual a massa do chumbo? Dados: c(Pb) = 0, 03 cal/g 0 C c(água) = 1 cal/g 0 C Qpb + Qa = 0 mpb. cpb. Dq + ma. ca. Dq = 0 mpb. 0, 03. (25 -200) + 400. 1. (25 -20) = 0 mpb. (-5, 25) +2000 = 0 5, 25. mpb = 2000 / 5, 25 = 381 g

5) Considerando o calor de combustão da lenha igual a 3500 kcal/kg, qual a massa de lenha necessária para fornecer a mesma energia que 40 litros de gasolina? Considere o valor da densidade da gasolina igual a 0, 7 kg/l, ou seja, cada litro de gasolina corresponde a 0, 7 kg. Dado: calor de combustão da gasolina 11000 kcal/kg. Lenha: 3500 kcal_____1 kg Gasolina: 11000 kcal_______1 kg 1 L_______0, 7 kg Massa de lenha que libere a mesma quantidade de energia de 40 litros de gasolina? G: 1 L_______0, 7 kg 40 L ______x G: 1 kg______11000 kcal 28 kg______x L: 1 kg_______3500 kcal X_____308000 kcal X=40. 0, 7 X = 28 kg X=28. 11000 X=308000 kcal X= 308000 / 3500 X=88 kg de Lenha

Calor: Energia que se transfere por diferença de temperatura
 Dậy thổi cơm mua thịt cá
Dậy thổi cơm mua thịt cá Cơm
Cơm O'que sao corpos luminosos
O'que sao corpos luminosos Um bastão atritado com lã atrai dois corpos leves m e n
Um bastão atritado com lã atrai dois corpos leves m e n Assinale a alternativa correta
Assinale a alternativa correta Dois corpos pontuais em repouso
Dois corpos pontuais em repouso Cristina planeja ir a praia
Cristina planeja ir a praia O sol beijava o alto das montanhas
O sol beijava o alto das montanhas Cantigas de amor
Cantigas de amor Um colar se rompeu quando brincavam dois namorados
Um colar se rompeu quando brincavam dois namorados Norma para trabajos en altas temperaturas
Norma para trabajos en altas temperaturas Temperaturas contrastadas
Temperaturas contrastadas Exposición a temperaturas extremas
Exposición a temperaturas extremas Equazione fondamentale della termologia
Equazione fondamentale della termologia Conceitos de calor e temperatura
Conceitos de calor e temperatura Termologia 2 ano ensino medio
Termologia 2 ano ensino medio Termologia fisica
Termologia fisica Legge fondamentale della termologia
Legge fondamentale della termologia Que estudia la termologia
Que estudia la termologia Termologia
Termologia Mapa conceptual de la termologia
Mapa conceptual de la termologia Estudo da termologia
Estudo da termologia Coefficiente dilatazione volumica rame
Coefficiente dilatazione volumica rame Capacità termica
Capacità termica Corpos subtis
Corpos subtis Aed 27
Aed 27 Face vertice e aresta
Face vertice e aresta Identificar fonte
Identificar fonte Medidas de temperatura
Medidas de temperatura Corpo ressurreto
Corpo ressurreto No arranjo experimental da figura os corpos a e b
No arranjo experimental da figura os corpos a e b Corpos redondos e poliedros
Corpos redondos e poliedros Corpos esbeltos
Corpos esbeltos Lançamento vertical para cima
Lançamento vertical para cima Um corpo eletrizado com carga
Um corpo eletrizado com carga Movimentos de corpos sujeitos a ligações
Movimentos de corpos sujeitos a ligações Galileu e a queda dos corpos
Galileu e a queda dos corpos Corpos redondos
Corpos redondos Clases de restas
Clases de restas Pan objetivo
Pan objetivo Habla directivo ejemplos
Habla directivo ejemplos