Termodynamika studuje fyzikln a chemick dje v systmech




![P, T Izobarický a izotermický děj konstantní tlak, nebo teplota t [s] 6 P, T Izobarický a izotermický děj konstantní tlak, nebo teplota t [s] 6](https://slidetodoc.com/presentation_image_h/cb573be1e6d685762bf7b664902545c1/image-6.jpg)








- Slides: 17

Termodynamika studuje fyzikální a chemické děje v systémech (soustavách) z hlediska energie Proč některé reakce produkují teplo (Na. OH + H 2 O) a jiným musíme teplo dodávat? 1

Soustavy Otevřená soustava 2

Uzavřená soustava 3

Izolovaná soustava (nereálná) 4

K popisu stavu, v jakém se soustava nachází používáme STAVOVÉ veličiny - závislé jen na počátečním a konečném stavu soustavy a ne na cestě, kterou soustava prošla Tlak – P; Hmotnost – m; Teplota – T; Objem – V Dělení: 1) Extenzivní stavové veličiny - závisí na velikosti soustavy m, V 2) Intenzivní stav. vel. - nezávisí na velikosti soustavy T, P Snaha o udržení alespoň jedné intenzivní veličiny konstantní většina reakcí se provádí za konstantního tlaku (izobarické) 5
![P T Izobarický a izotermický děj konstantní tlak nebo teplota t s 6 P, T Izobarický a izotermický děj konstantní tlak, nebo teplota t [s] 6](https://slidetodoc.com/presentation_image_h/cb573be1e6d685762bf7b664902545c1/image-6.jpg)
P, T Izobarický a izotermický děj konstantní tlak, nebo teplota t [s] 6

Termochemie Studuje tepelné zabarvení reakcí Entalpie – H Popisuje výměnu tepla s okolím při reakci prováděné za stálého tlaku (izobarický děj) -nelze změřit její absolutní hodnotu, jenom její změnu vzhledem ke standardnímu stavu -je extenzivní nebo intenzivní stavová veličina? Standardní stav 298, 15 K, 101, 325 k. Pa H=0 7

Reakční teplo – ∆H množství tepla, které soustava vymění s okolím při reakci v jednotkovém rozsahu (to, že zreaguje taková látková množství jednotlivých látek, jak udávají koeficienty v rovnici) reakčních přeměn za konstantního tlaku. Jednotka - [J] (jouly) N 2(g) + 3 H 2 (g) 2 NH 3 (g) ∆H = -92 k. J (při reakci 1 molu dusíku a 3 molů vodíku se uvolní teplo 92 k. J) 1/3 N 2(g) + H 2 (g) 2/3 NH 3 (g) ∆H = -30, 66 k. J (-92/3) (při reakci 1/3 molu dusíku a 1 mol vodíku se uvolní teplo 30, 66 k. J) 8

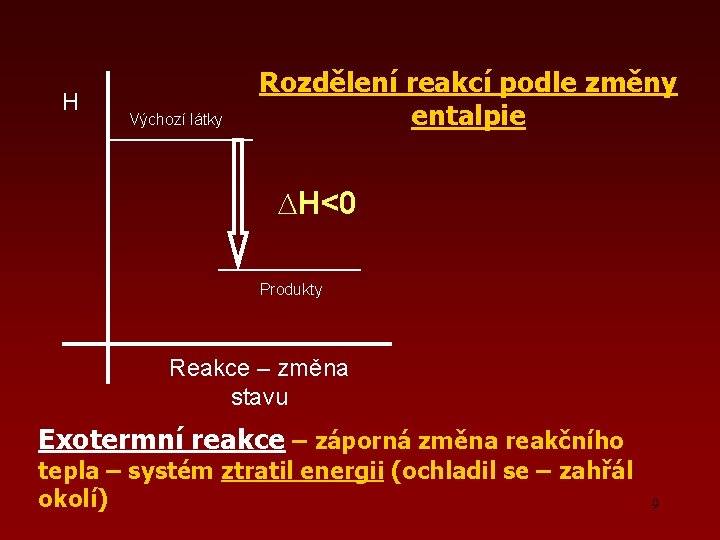
H Výchozí látky Rozdělení reakcí podle změny entalpie ∆H<0 Produkty Reakce – změna stavu Exotermní reakce – záporná změna reakčního tepla – systém ztratil energii (ochladil se – zahřál okolí) 9

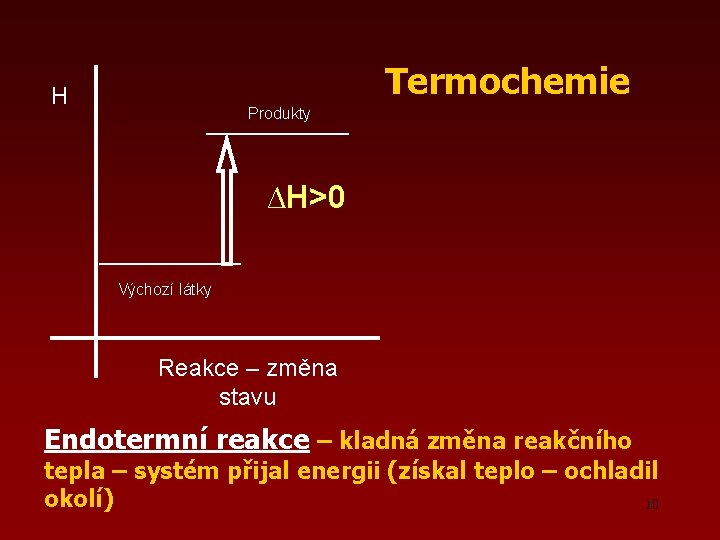
Termochemie H Produkty ∆H>0 Výchozí látky Reakce – změna stavu Endotermní reakce – kladná změna reakčního tepla – systém přijal energii (získal teplo – ochladil okolí) 10

Termochemické zákony I. Reakční teplo přímé a protisměrné reakce je stejné až na znaménko (Laplace−Lavoisier) 2 H 2 + -483 k. J O 2 +483 k. J 2 H 2 O 11

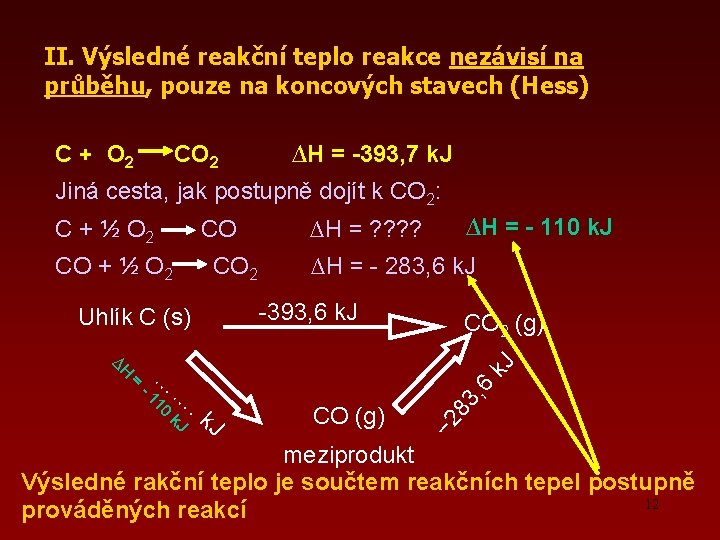
II. Výsledné reakční teplo reakce nezávisí na průběhu, pouze na koncových stavech (Hess) C + O 2 CO 2 ∆H = -393, 7 k. J Jiná cesta, jak postupně dojít k CO 2: C + ½ O 2 CO CO + ½ O 2 CO 2 ∆H = - 110 k. J ∆H = ? ? ∆H = - 283, 6 k. J -393, 6 k. J Uhlík C (s) k. J , 6 10 -1 k. J J CO (g) 83 = . k − 2 ∆H … … CO 2 (g) meziprodukt Výsledné rakční teplo je součtem reakčních tepel postupně 12 prováděných reakcí

Z čeho se dá vypočítat reakční teplo? 1) Ze standardního slučovacího tepla – reakční teplo rakce, při níž vzniká 1 mol sloučeniny přímo z prvků -pro prvky je nulové (s ničím se nesloučily) PŘ: Kolik je slučovací teplo amoniaku, když v této reakci vznikly 2 moly amoniaku? ∆H sluč = - 46 k. J/mol (-92/2) N 2(g) + 3 H 2 (g) 2 NH 3 (g) ∆H = -92 k. J (reakční teplo) 13

Kolik je slučovací teplo pro oxid uhličitý a uhelnatý, znáte-li reakční tepla těchto reakcí: C + O 2 C + ½ O 2 CO ∆H = -393, 7 k. J ∆H = -110 k. J Hodnota slučovacího tepla se shoduje s hodnotou reakčího tepla, protože v obou reakcích vzniká 1 mol oxidů přímo z prvků 14

PŘ: viz učebnice st. 93 (máte v sešitě) Standardní slučovací tepla vynásobit stechiometrickými koeficienty reakce! ∆H 0 = ∑ ∆H 0 sluč (produkty) - ∑ ∆H 0 sluč (reaktanty) 15

2) Ze standardního spalného tepla – reakční teplo reakce, při níž je spálen 1 mol látky v nadbytku kyslíku -pro prvky nejsou již nulové ∆H 0 = ∑ ∆H 0 spal (raktanty) - ∑ ∆H 0 spal (produkty) Opačně oproti předchozímu případu 16

PŘ: učebnice str. 95/3, 4 Standardní spalná tepla opět vynásobit stechiometrickými koeficienty reakce! 17