Teora del campo cristalino Compuestos de coordinacin Teora











- Slides: 25

Teoría del campo cristalino Compuestos de coordinación

Teoría del campo cristalino Postulados • Los ligantes están representados por cargas puntuales. • Las interacciones M-L son netamente electrostáticas. • Existe repulsión entre los electrones del metal y los ligantes. • Esta interacción es diferencial depende de la disposición espacial de los ligantes alrededor del metal (geometría de coordinación). • Como consecuencia se produce desdoblamiento de los orbitales d

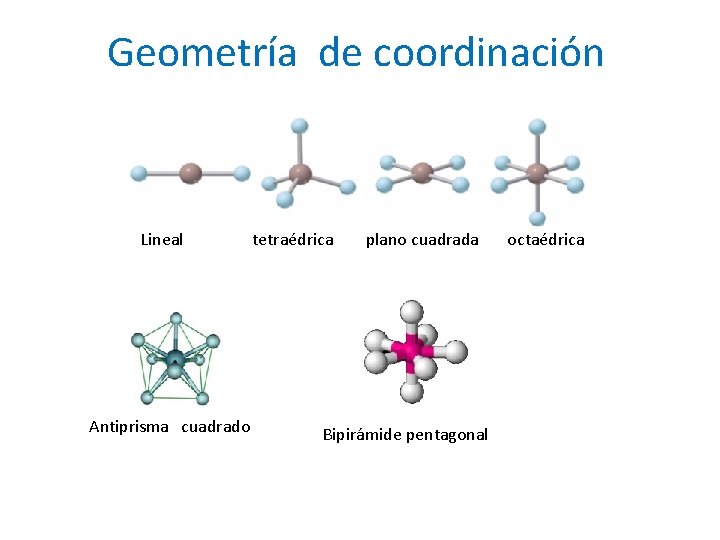
Geometría de coordinación Lineal Antiprisma cuadrado tetraédrica plano cuadrada Bipirámide pentagonal octaédrica

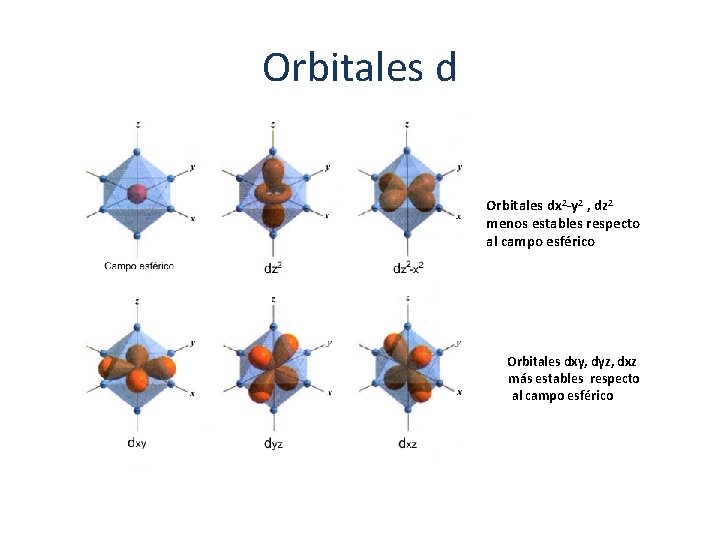
Orbitales dx 2 -y 2 , dz 2 menos estables respecto al campo esférico Orbitales dxy, dyz, dxz más estables respecto al campo esférico

Teoría de campo cristalino • -Orbitales d, combinación lineal de seis funciones matemáticas • -Modelo muy sencillo desarrollado por físicos (Bethe y Van Vlecke). Interacciones electrostáticas: • -Ion aislado los orbitales son degenerados • -Campo esféricamente simétrico de cargas negativas alrededor del ion central los orbitales aumentan de energía pero son degenerados.

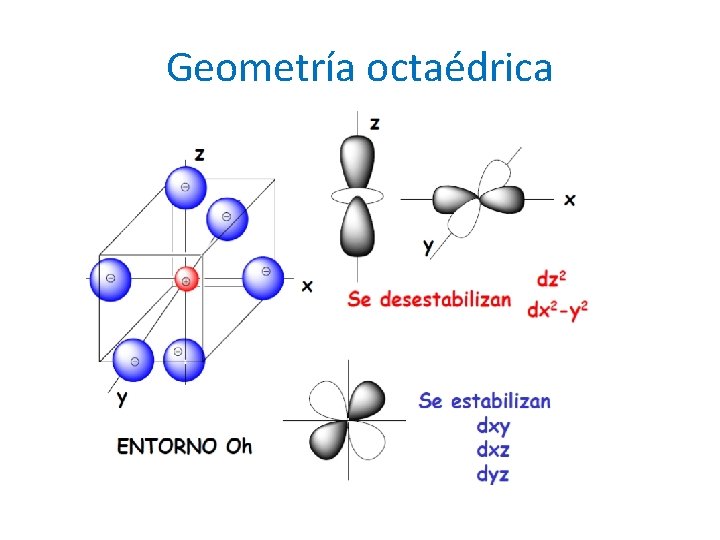
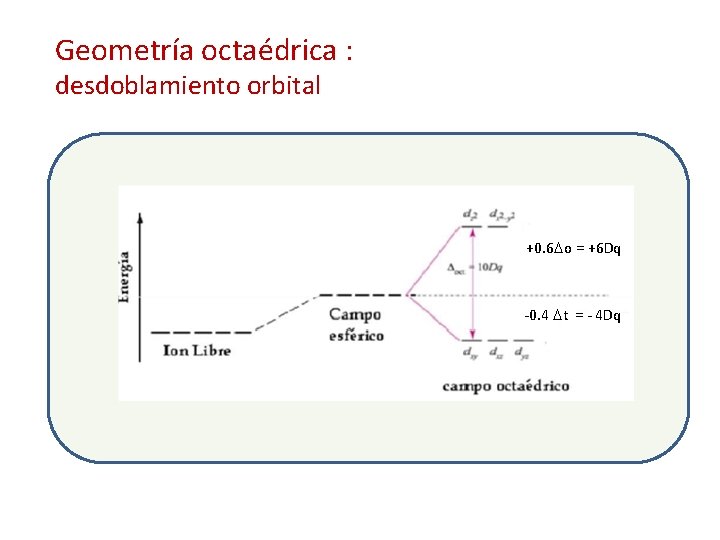
Geometría octaédrica

Geometría octaédrica : desdoblamiento orbital +0. 6 o = +6 Dq -0. 4 t = - 4 Dq

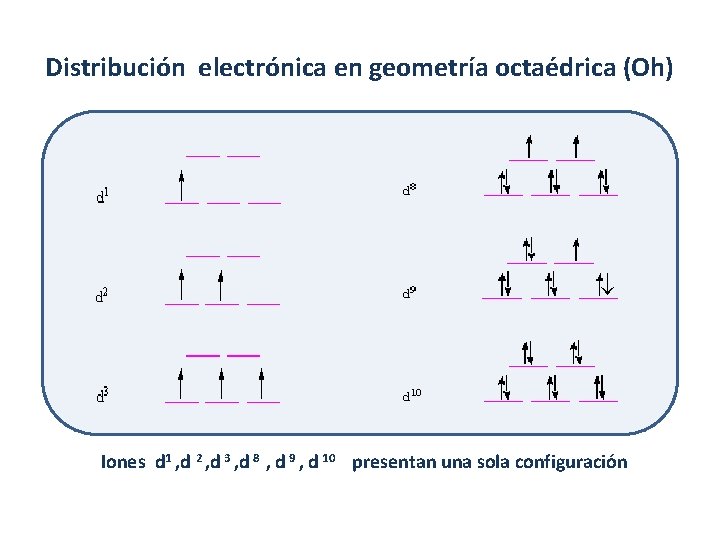
Distribución electrónica en geometría octaédrica (Oh) Iones d 1 , d 2 , d 3 , d 8 , d 9 , d 10 presentan una sola configuración

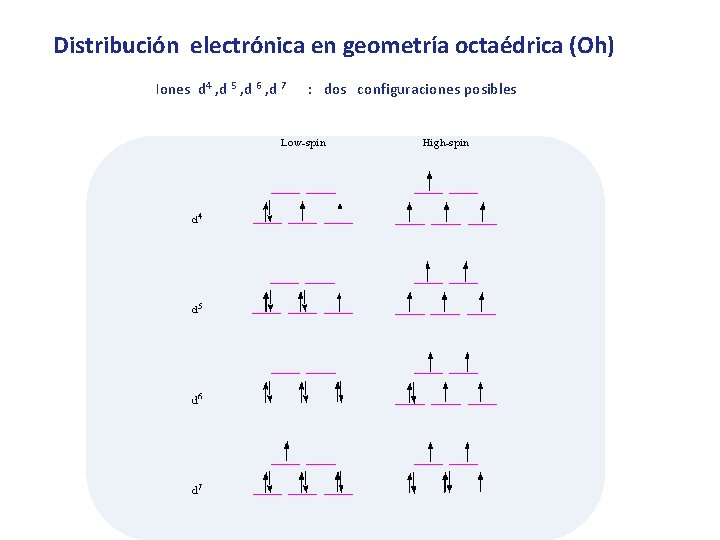
Distribución electrónica en geometría octaédrica (Oh) Iones d 4 , d 5 , d 6 , d 7 : dos configuraciones posibles

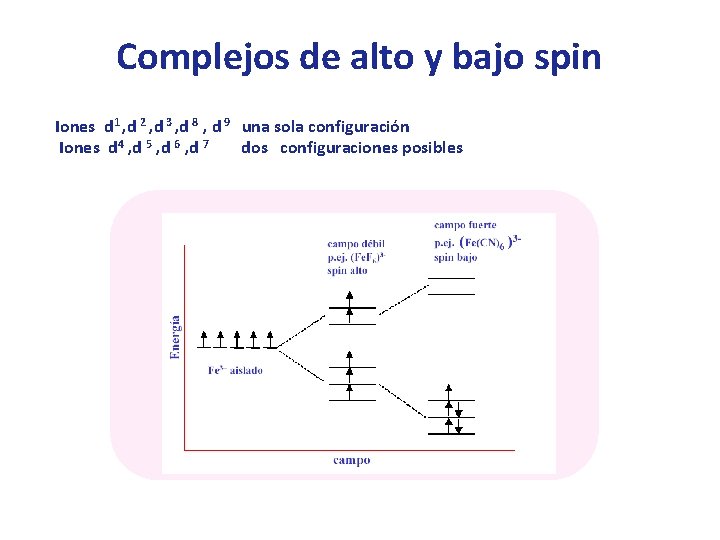
Complejos de alto y bajo spin Iones d 1 , d 2 , d 3 , d 8 , d 9 una sola configuración Iones d 4 , d 5 , d 6 , d 7 dos configuraciones posibles

Energía de estabilización producida por el campo cristalino Estados de spin y fuerza de campo ligante


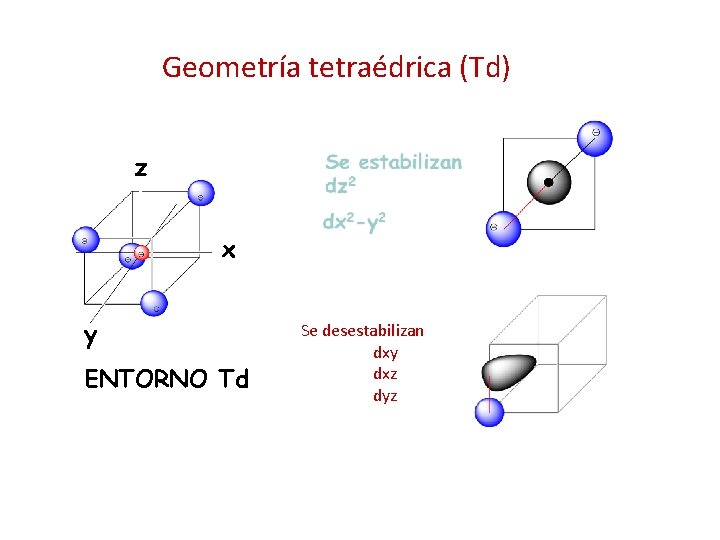
Geometría tetraédrica (Td) z x y ENTORNO Td Se desestabilizan dxy dxz dyz

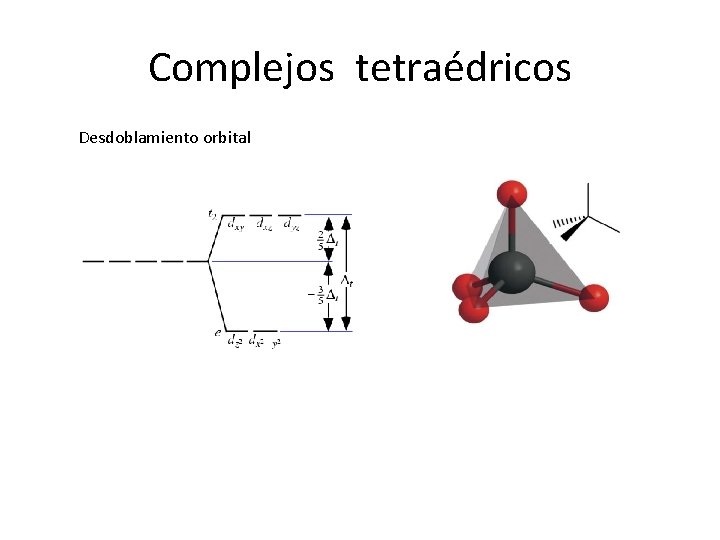
Complejos tetraédricos Desdoblamiento orbital

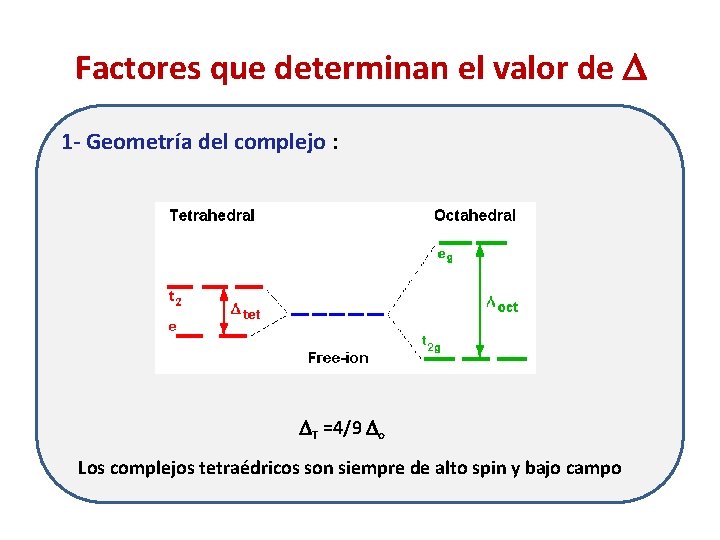
Factores que determinan el valor de 1 - Geometría del complejo : T =4/9 o Los complejos tetraédricos son siempre de alto spin y bajo campo

Factores que determinan el valor de 2. Estado de oxidación del ión metálico: aumenta con el aumento del estado de oxidación del ión metálico [Fe(H 2 O)6] 2+ = 10. 000 cm-1 [Fe(H 2 O)6] 3+ = 14. 000 cm -1 [Co(H 2 O)6] 2+ = 9. 700 cm-1 [Co(H 2 O)6] 2+ = 18. 000 cm -1

Factores que determinan el valor de 3. - Naturaleza del ión metálico : ubicación en la tabla periódica aumenta a medida que se baja en un grupo [ Co(NH 3) 6]3+ o = 22. 900 cm -1 [ Rh(NH 3) 6]3+ o = 34. 100 cm -1 [ Ir(NH 3) 6]3+ o = 41. 000 cm -1 Los complejos de la 2 y 3 ra serie son siempre de bajo spin

Factores que determinan el valor de 4. Los ligantes ( serie espectroquímica ) I- < Br- < S 2 - < SCN- < Cl- < NO 3 - < F- < OH- < C 2 O 42 - < H 2 O < NCS< CH 3 CN < NH 3 < en < bpy < phen < NO 2 - < PPh 3 < CN- < CO

Jørgensen sugiere que el valor de Δo se puede estimar considerando que está gobernado por dos factores independientes, uno procedente del metal ( g ) y otro del ligante ( f ), de esta manera: Δo = f x g f describe la fuerza del campo de un ligante relativa al agua, a la que se le ha asignado el valor de 1. 00, el intervalo de valores de este parámetro va de 0. 7 para el Br- (campo débil) hasta 1. 7 para el CN- (campo fuerte). g este factor es característico del ion metálico y varía de 8000 a 36000 cm-1. La ecuación anterior es útil para aproximar el valor de Δo y al combinarla con las energías de apareamiento, es factible predecir si un complejo será de alto espín o bajo espín

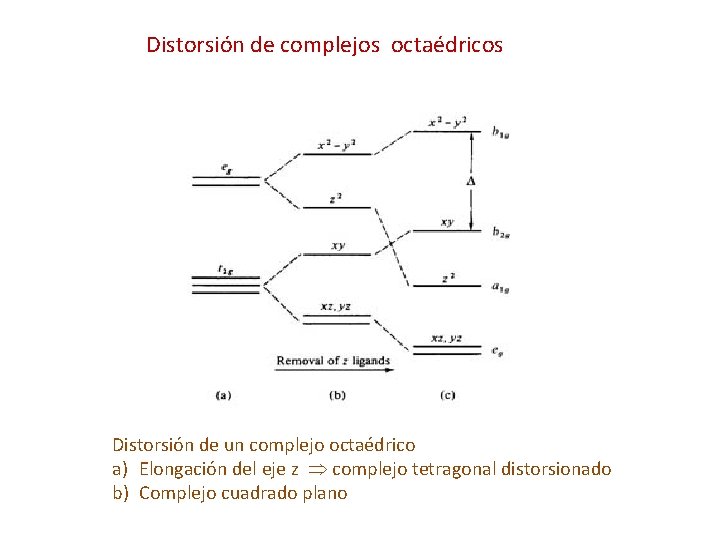
Distorsión de complejos octaédricos Distorsión de un complejo octaédrico a) Elongación del eje z complejo tetragonal distorsionado b) Complejo cuadrado plano

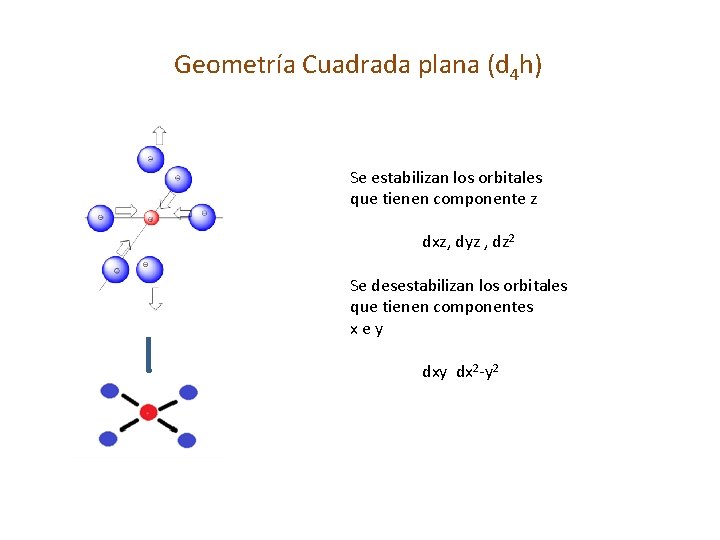
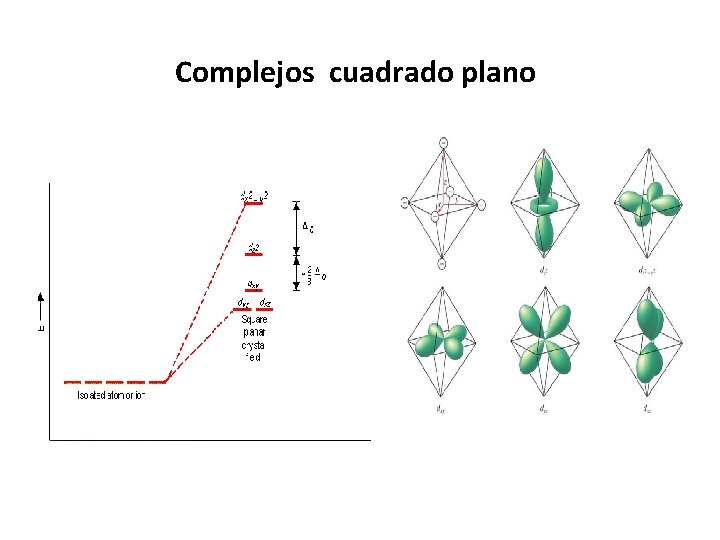
Geometría Cuadrada plana (d 4 h) Se estabilizan los orbitales que tienen componente z dxz, dyz , dz 2 Se desestabilizan los orbitales que tienen componentes xey dx 2 -y 2

Complejos cuadrado plano

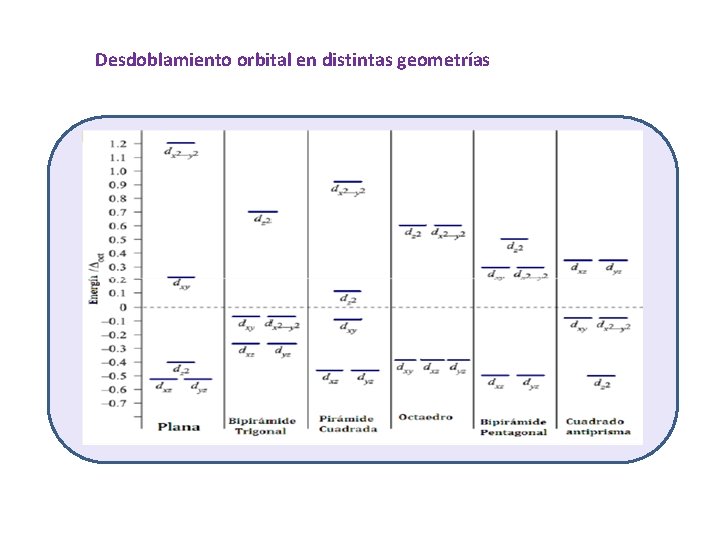
Desdoblamiento orbital en distintas geometrías


 Geometria octaedrica
Geometria octaedrica Coordinacin
Coordinacin Coordinacin
Coordinacin Coordinacin
Coordinacin Acomodacion del cristalino
Acomodacion del cristalino Calice optico
Calice optico La teora
La teora Quadrilátero ferrífero escudo cristalino
Quadrilátero ferrífero escudo cristalino Tenho ouvido de uma terra linda encantada
Tenho ouvido de uma terra linda encantada Direes
Direes Solido cristalino covalente
Solido cristalino covalente Te quieres casar conmigo poema
Te quieres casar conmigo poema Compuestos del tomate
Compuestos del tomate Semen conjunto de espermatozoides
Semen conjunto de espermatozoides Potenziale elettrico
Potenziale elettrico Ley de gauss magnetica
Ley de gauss magnetica Levin kurt
Levin kurt Emperador carlos medina del campo
Emperador carlos medina del campo Teorema di gauss campo elettrico
Teorema di gauss campo elettrico Contenidos de conocimiento del medio segundo grado
Contenidos de conocimiento del medio segundo grado Circuitazione campo elettrico formula
Circuitazione campo elettrico formula Teoria de campo de kurt lewin
Teoria de campo de kurt lewin Massacro del campo di marte
Massacro del campo di marte Teoria del campo dei leganti
Teoria del campo dei leganti Roberto del campo
Roberto del campo Campo
Campo