Temperatura y ley cero de la termodinmica Fsica

























- Slides: 34

Temperatura y ley cero de la termodinámica Física II

Contenido • • • • Equilibrio térmico Ley cero de la termodinámica Termómetros Termómetro de volumen constante Definición de temperatura Gases ideales Otras escalas de temperatura Expansión térmica de sólidos y líquidos Coeficiente Promedio De Expansión Lineal El Coeficiente Promedio De Expansión Volumétrica Variables termodinámicas y la ecuación de estado Ecuación de estado La ecuación de Van der Waals

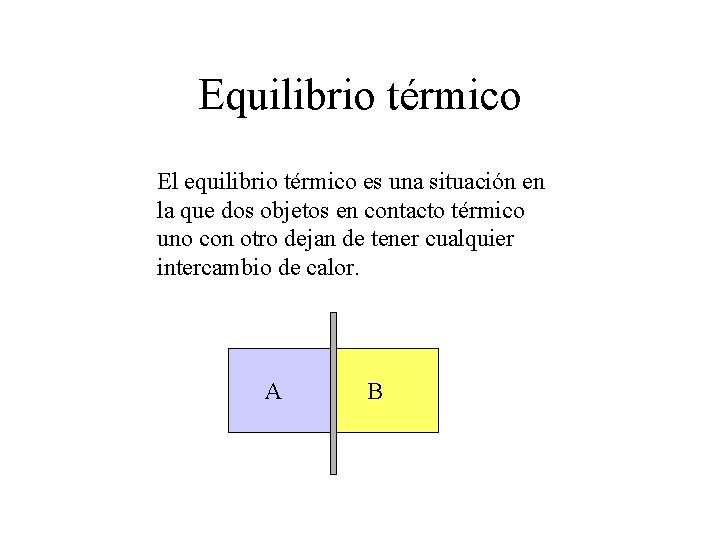
Equilibrio térmico El equilibrio térmico es una situación en la que dos objetos en contacto térmico uno con otro dejan de tener cualquier intercambio de calor. A B

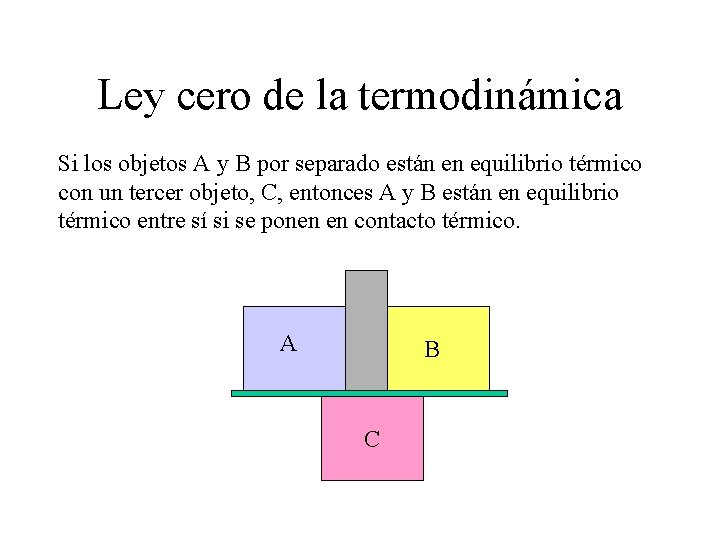
Ley cero de la termodinámica Si los objetos A y B por separado están en equilibrio térmico con un tercer objeto, C, entonces A y B están en equilibrio térmico entre sí si se ponen en contacto térmico. A B C

Termómetros Un termómetro es un dispositivo que mide la temperatura de un sistema térmico, en forma cuantitativa Termómetro Propiedad física que se mide Gas ideal Presión y volumen del gas Bulbo de Hg Expansión y contracción del fluido Bueno, cuando el fluido no cambia de fase Banda bimetálica Diferencia de expansión en dos sólidos Comentarios Se usa con termostatos Resistencia eléctrica Termopar Voltaje entre dos metales Es el termómetro más usado en la Propiedades magnéticas de la Útil a temperaturas ultra materia finas. industria Paramagnético Pirómetro óptico Color de la luz emitida Útil a altas temperaturas.

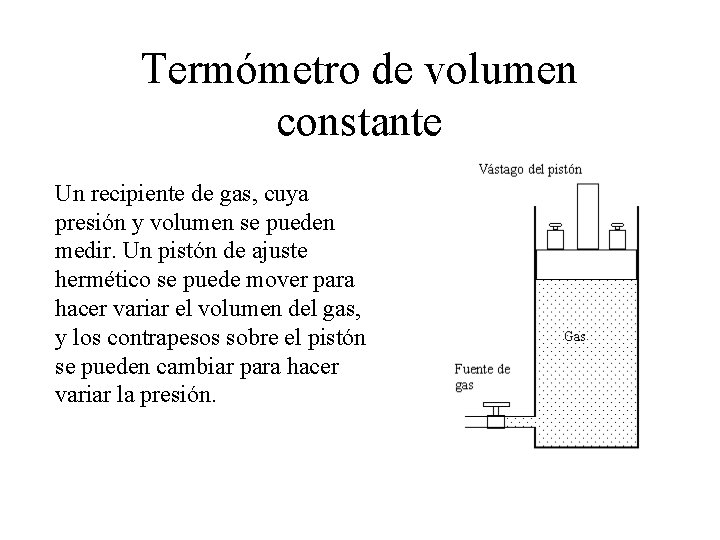
Termómetro de volumen constante Un recipiente de gas, cuya presión y volumen se pueden medir. Un pistón de ajuste hermético se puede mover para hacer variar el volumen del gas, y los contrapesos sobre el pistón se pueden cambiar para hacer variar la presión.

Definición de temperatura El producto de la presión por el volumen, dividido entre la masa de gas en el recipiente, aumenta o disminuye, según si el recipiente térmico en contacto con el primer recipiente está más caliente o más frío, respectivamente. Usaremos esta propiedad para definir la temperatura como una constante de proporcionalidad multiplicada por el producto de presión y volumen, dividido entre la masa.

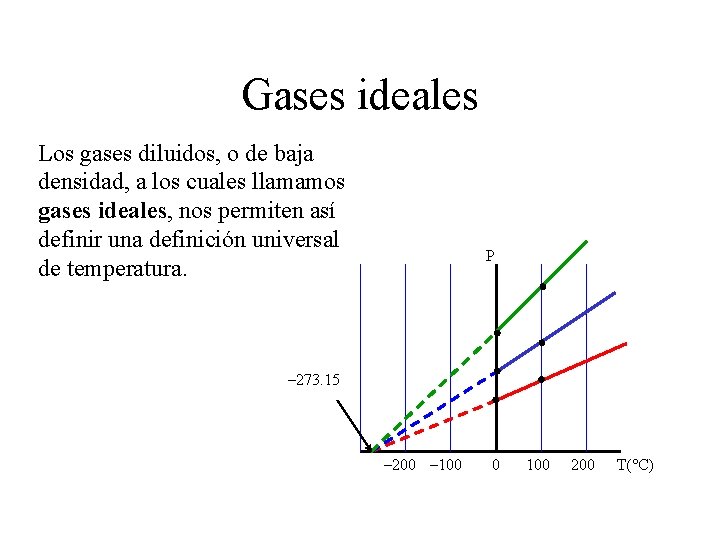
Gases ideales Los gases diluidos, o de baja densidad, a los cuales llamamos gases ideales, nos permiten así definir una definición universal de temperatura. P – 273. 15 – 200 – 100 0 100 200 T(°C)

Otras escalas de temperatura La fórmula de conversión entre la escala Celsius y la Kelvin: 100°C 373. 15 K 212°F tc = t. K – 273. 15 La fórmula de conversión entre Kelvin y Fahrenheit: 50°C 323. 15 K 273. 15 K 122°F 32°F

Tarea ¿Es posible que dos objetos estén en equilibrio térmico si no están en contacto mutuo? Explique. ¿A que temperatura la escala celsius la Farenheit coinciden?

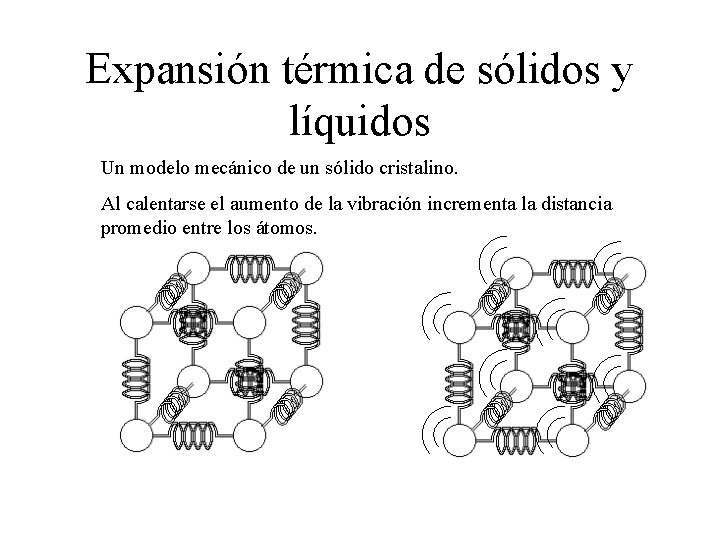
Expansión térmica de sólidos y líquidos Un modelo mecánico de un sólido cristalino. Al calentarse el aumento de la vibración incrementa la distancia promedio entre los átomos.

Coeficiente Promedio De Expansión Lineal La longitud aumenta en una cantidad DL por el cambio en la temperatura DT DL = a. L 0 DT o L – L 0 = a. L 0 ( T – T 0) a se denomina coeficiente promedio de expansión lineal L 0 T 0 L = L 0 + DL T = T 0 + DT DL

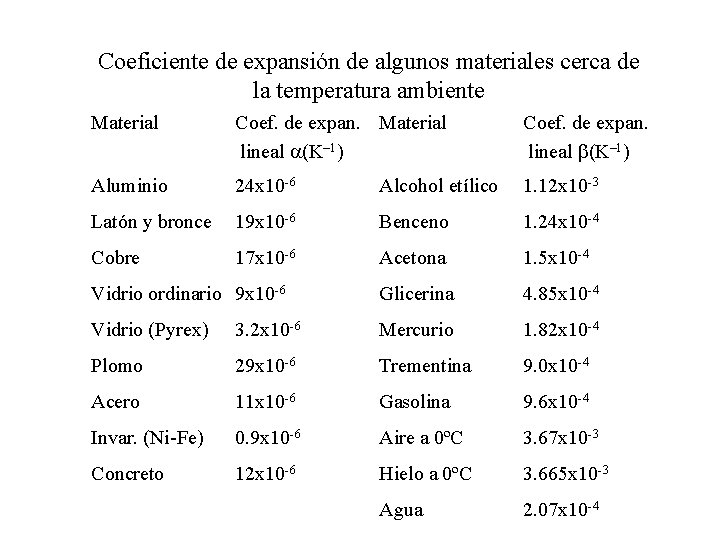
Coeficiente de expansión de algunos materiales cerca de la temperatura ambiente Material Coef. de expan. Material lineal a(K– 1) Coef. de expan. lineal b(K– 1) Aluminio 24 x 10 -6 Alcohol etílico 1. 12 x 10 -3 Latón y bronce 19 x 10 -6 Benceno 1. 24 x 10 -4 Cobre 17 x 10 -6 Acetona 1. 5 x 10 -4 Vidrio ordinario 9 x 10 -6 Glicerina 4. 85 x 10 -4 Vidrio (Pyrex) 3. 2 x 10 -6 Mercurio 1. 82 x 10 -4 Plomo 29 x 10 -6 Trementina 9. 0 x 10 -4 Acero 11 x 10 -6 Gasolina 9. 6 x 10 -4 Invar. (Ni-Fe) 0. 9 x 10 -6 Aire a 0ºC 3. 67 x 10 -3 Concreto 12 x 10 -6 Hielo a 0ºC 3. 665 x 10 -3 Agua 2. 07 x 10 -4

Ejemplo Un puente de acero de 600 m de longitud. ¿Cuánto margen se debe incluir para tomar la expansión térmica entre -40°C y 40°C?

El Coeficiente Promedio De Expansión Volumétrica Para un sólido, el coeficiente de expansión volumétrica es aproximadamente tres veces el coeficiente de expansión lineal, o b = 3 a DV = b. V 0 DT = 3 a. V 0 DT V 0 T 0 V = V 0 + DV T = T 0 + DT

Ejemplo Una pieza esférica hueca se expande igual como si fuera una pieza de material sólido. Un vaso de aluminio con una capacidad de 1000 cm 3 a 0°C, ¿Cuánto se expandirá su capacidad a 100°C?

Discusión El agua es una sustancia que se hace menos densa al congelarse, la densidad máxima del agua se da a los 4°C. Con base en este hecho discuta lo siguiente: Meter un refresco cerrado en el congelador. La vida en el planeta. Tuberías de agua en el invierno.

Tarea Una torre de acero tiene de 200 m de alto. ¿Cuánto aumenta su altura para una variación de la temperatura de 0°C y 40°C? El coeficiente del acero es 11 x 10 -6

Ecuación de estado de un gas Las propiedades de un gas se describen mediante las variables V (volumen), T (Temperatura) y P (presión). La ecuación que describe que interrelaciona estas cantidades se llama ecuación de estado.

Definición de mol Un mol de un gas se define como la cantidad de gas cuya masa, en gramos, es igual al peso atómico, o molecular, del gas. Una mol siempre contiene el número de Avogadro de partículas, NA 6. 022 x 1023. Ejemplo: El Oxígeno tiene una masa atómica de 16. 00, se presenta como una molécula con dos átomos, por tanto su masa molecular es 32. 00. 32 g de oxígeno es un mol de oxígeno y contiene NA moléculas.

Masa y moles El número de moles de una masa de gas m, se puede calcular por n = m/M Donde M es la masa molar de la sustancia (g/mol) Ejemplo: 400 g de oxígeno contienen: n = 400/32 = 12. 5 moles El número total de moléculas en un recipiente, N, se puede expresar en término del número de moles, n, en la siguiente forma: N = n. NA Ejemplo: 12. 5 moles de oxígeno contienen: N = n. NA = 12. 5 x 6. 022 x 1023. = 7. 5275 x 1024 moléculas

Variables termodinámicas Las variables P – presión T – temperatura V – volumen n – número de moles que se usan para describir sistemas térmicos, se llaman variables termodinámicas.

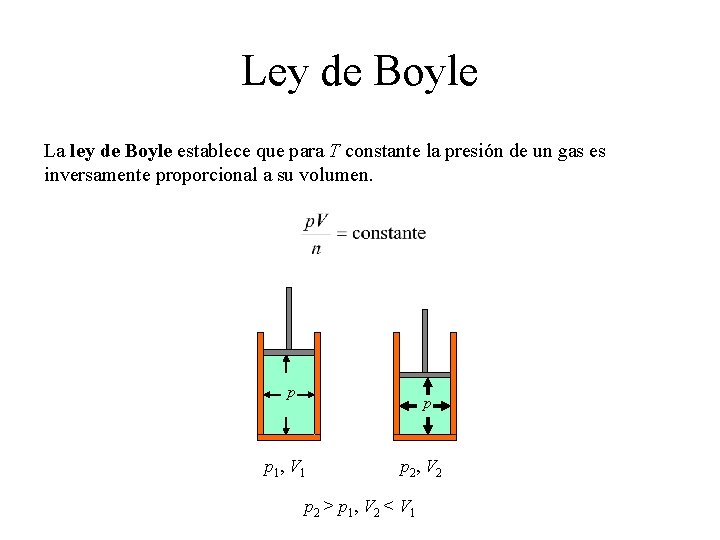
Ley de Boyle La ley de Boyle establece que para T constante la presión de un gas es inversamente proporcional a su volumen. p p p 1, V 1 p 2, V 2 p 2 > p 1, V 2 < V 1

Ejemplo En el cilindro de un automóvil la mezcla de aire y combustible se comprime de 0. 23 L a 0. 05 L, si la presión inicial es la presión atmosférica ¿cuál es la presión final?

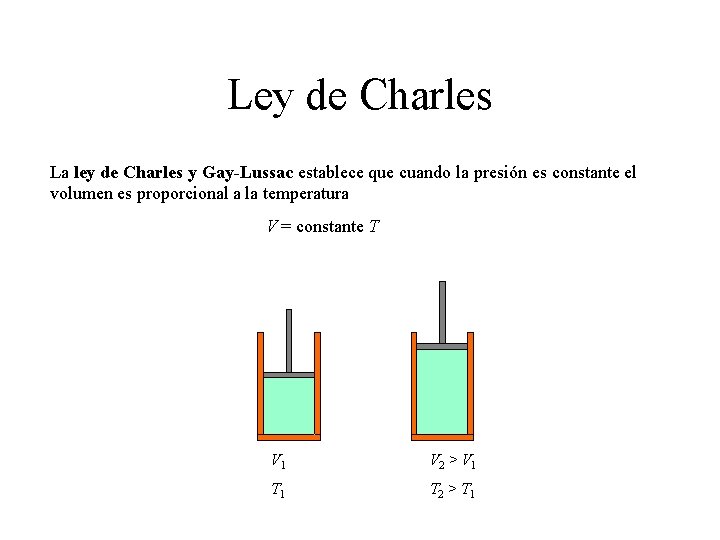
Ley de Charles La ley de Charles y Gay-Lussac establece que cuando la presión es constante el volumen es proporcional a la temperatura V = constante T V 1 V 2 > V 1 T 2 > T 1

Ley del gas ideal Podemos combinar la ley de Charles y Gay-Lussac con la ley de Boyle, y obtenemos la ley del gas ideal: p. V = n. RT p. V = NRT/NA = Nk. BT Constante de los gases R 8. 314 N m/mol K = 8. 314 J/mol K Constante de Boltzman k. B = 1. 38 x 10– 25 J/K

ejemplo Un gas ideal de 100 cm 3 a 20°C y 100 Pa. Determine el número de moles de gas en el recipiente y el número de moléculas. El volumen en m 3 es: V = (100 cm 3)(1 x 10– 6 m 3/cm 3) = 1 x 10– 4 m 3 El número de moles es: n = PV/RT = (100)(0. 0001)/((8. 315)(293)) = 4 x 10– 6 mol N = n. NA = 2. 4 x 1018 moléculas

ejemplo Un tanque de buzo de 10 L (0. 35 pies 3) a 22°C se llena con 66 pies 3 de aire a 3000 lb/pulg 2, ¿cuál es su temperatura cuando se llena completamente? P 1 = 1 atm = 14. 7 lb/pulg 2, V 1 = 0. 35 pies 3, T 1 = 22°C = 295 K, P 2 = 3000 lb/pulg 2, V 2 = V 1. Sustituyendo T 2 = 319 K = 45. 9 °C = 115 °F

Tarea Un tanque tiene un volumen de 0. 100 m 3 contiene gas helio a 150 atm. ¿Cuántos globos puede inflar el tanque si cada globo lleno es una esfera de 0. 300 m de diámetro a una presión de absoluta de 1. 20 atm?

ejemplo La llanta de un automóvil se infla usando aire originalmente a 10°C y presión atmosférica normal. Durante el proceso el aire se comprime hasta 28% de su volumen original y su temperatura aumenta a 40°C. a) ¿cuál es la presión de la llanta? B) Después de que carro se maneja a alta rapidez, la temperatura del aire dentro de la llanta se eleva a 85°C y su volumen interior aumenta 2%. ¿Cuál es la nueva presión (absoluta) de la llanta en pascales?

Tarea En sistemas de vació con la tecnología más avanzada se logran presiones tan bajas como 10– 9 Pa. Calcule el número de moléculas en un recipiente de 1. 00 m 3 a esta presión si la temperatura es de 27°C.

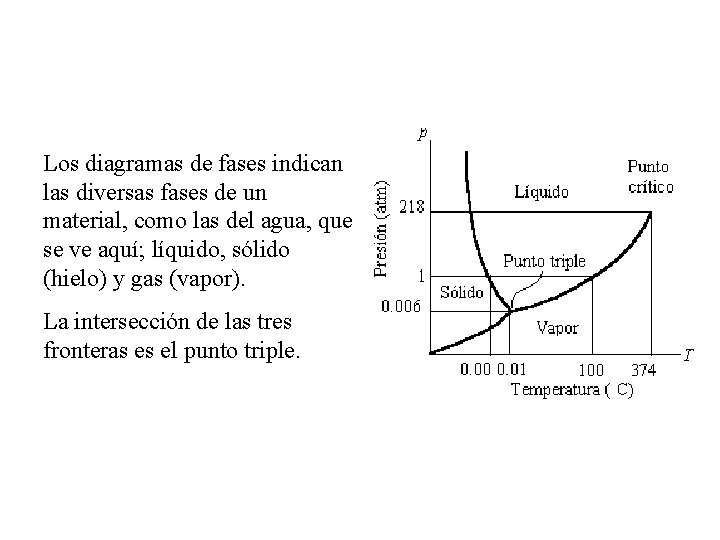
Los diagramas de fases indican las diversas fases de un material, como las del agua, que se ve aquí; líquido, sólido (hielo) y gas (vapor). La intersección de las tres fronteras es el punto triple.

La ecuación de Van der Waals, es: Las constantes a y b son ambas positivas.

Discusión ¿por qué se recomienda medir la presión de los neumáticos cuando el vehículo ha estado detenido durante algún tiempo? ¿qué es un gas ideal? ¿Por qué se derrite el hielo bajo un hilo cuando se coloca como se muestra? Hielo
 Ley 0 de la termodinamica
Ley 0 de la termodinamica Keq
Keq Keq
Keq Termodinmica
Termodinmica Termodinâmica
Termodinâmica Termodinmica
Termodinmica Calor y trabajo
Calor y trabajo Cv=du/dt
Cv=du/dt Termodinmica
Termodinmica Termodinmica
Termodinmica Termodinmica
Termodinmica Para que sirve la energía potencial
Para que sirve la energía potencial Que masa de vapor inicialmente a 130
Que masa de vapor inicialmente a 130 Trabalho adiabático
Trabalho adiabático Termodinmica
Termodinmica Mruv
Mruv Fsica
Fsica Que estudia la electrostatica
Que estudia la electrostatica Vaviao
Vaviao Fsica
Fsica Apoyo fijo movil y empotrado
Apoyo fijo movil y empotrado Coordenadas cartesianas
Coordenadas cartesianas Movimento uniforme
Movimento uniforme Fsica
Fsica Fsica
Fsica Vectores fisica
Vectores fisica Aceleracion relativa
Aceleracion relativa Lógica
Lógica Fsica
Fsica Ed
Ed Fsica
Fsica 2 lei de nwton
2 lei de nwton Fsica
Fsica Se define como
Se define como Formula centripeta
Formula centripeta