Tema 7 Enzimas DEFINICIN n LAS ENZIMAS son





![n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1 n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-13.jpg)





![Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-25.jpg)



![Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-30.jpg)











- Slides: 53

Tema 7 Enzimas

DEFINICIÓN n LAS ENZIMAS son proteínas que se comportan como catalizadores muy potentes y eficaces de las reacciones químicas de los sistemas biológicos. n La CATÁLISIS ENZIMÁTICA es esencial para los sistemas vivos. n La mayoría de las R. Q. ocurrirían muy lento en condiciones biológicamente significativas. n Hace posible que en condiciones fisiológicas tengan lugar reacciones que sin catalizador requerirían condiciones extremas de presión, temperatura o p. H. n Las biomoléculas son muy estables a p. H neutro, temperatura suave y ambiente acuoso

Características n Como catalizadores, los enzimas actúan en pequeña cantidad y se recuperan indefinidamente. n No llevan a cabo reacciones que sean energéticamente desfavorables, sino que solamente aceleran las que espontáneamente podrían producirse. n Los enzimas son catalizadores específicos: cada enzima cataliza un solo tipo de reacción, y casi siempre actúa sobre un único sustrato o sobre un grupo muy reducido de ellos.

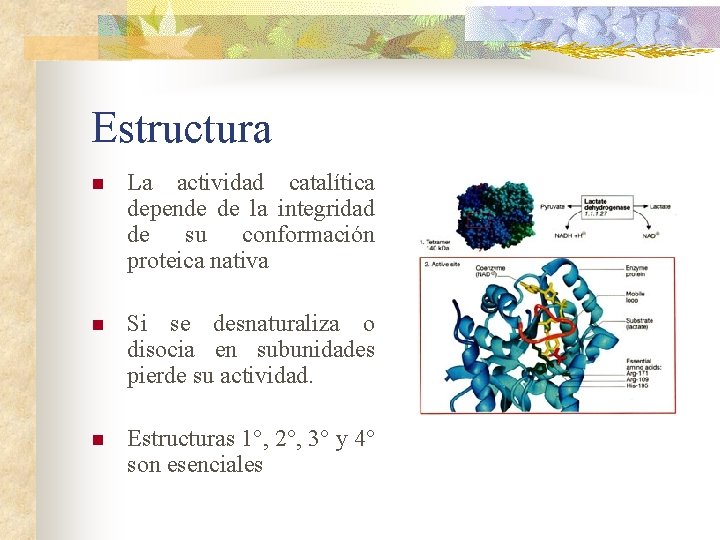
Estructura n La actividad catalítica depende de la integridad de su conformación proteica nativa n Si se desnaturaliza o disocia en subunidades pierde su actividad. n Estructuras 1°, 2°, 3° y 4° son esenciales

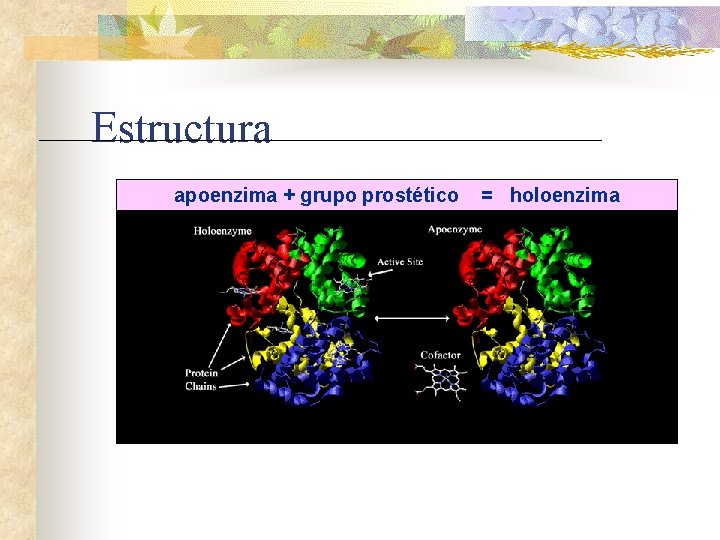
Estructura apoenzima + grupo prostético = holoenzima

Estructura

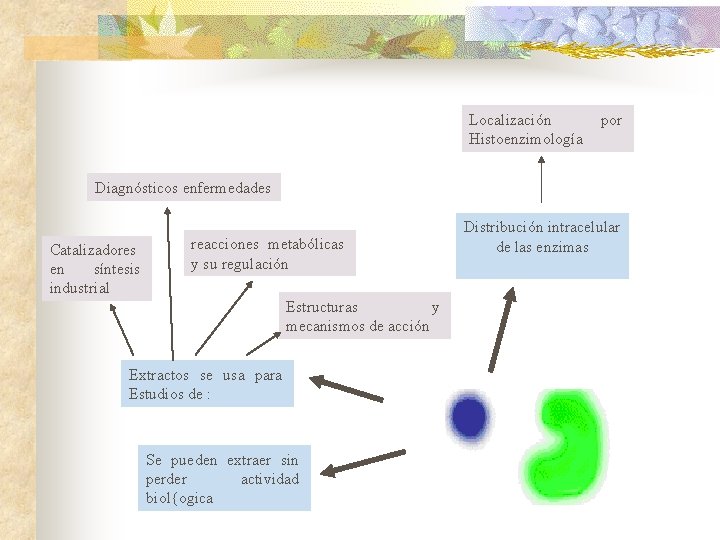
Localización Histoenzimología por Diagnósticos enfermedades Catalizadores en síntesis industrial reacciones metabólicas y su regulación Estructuras y mecanismos de acción Extractos se usa para Estudios de : Se pueden extraer sin perder actividad biol{ogica Distribución intracelular de las enzimas

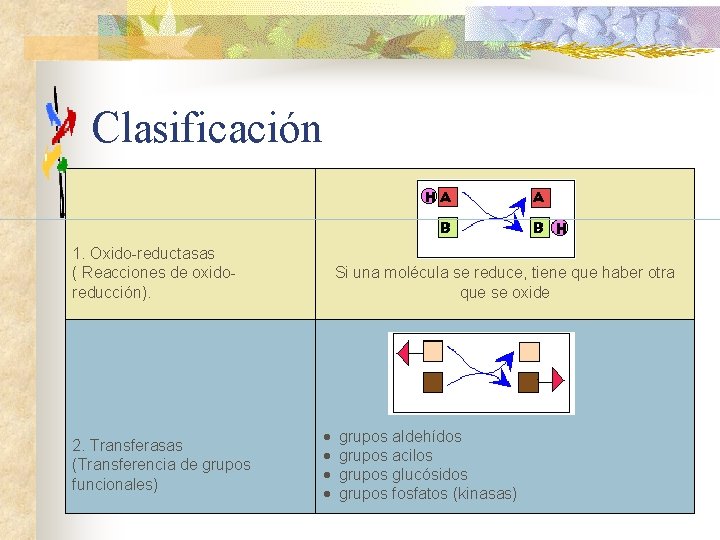
Clasificación 1. Oxido-reductasas ( Reacciones de oxidoreducción). 2. Transferasas (Transferencia de grupos funcionales) Si una molécula se reduce, tiene que haber otra que se oxide · · grupos aldehídos grupos acilos grupos glucósidos grupos fosfatos (kinasas)

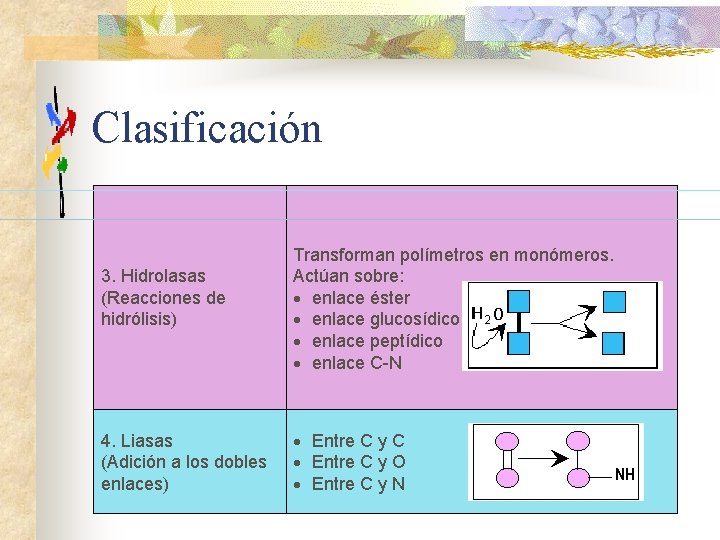
Clasificación 3. Hidrolasas (Reacciones de hidrólisis) 4. Liasas (Adición a los dobles enlaces) Transforman polímetros en monómeros. Actúan sobre: · enlace éster · enlace glucosídico · enlace peptídico · enlace C-N · Entre C y C · Entre C y O · Entre C y N

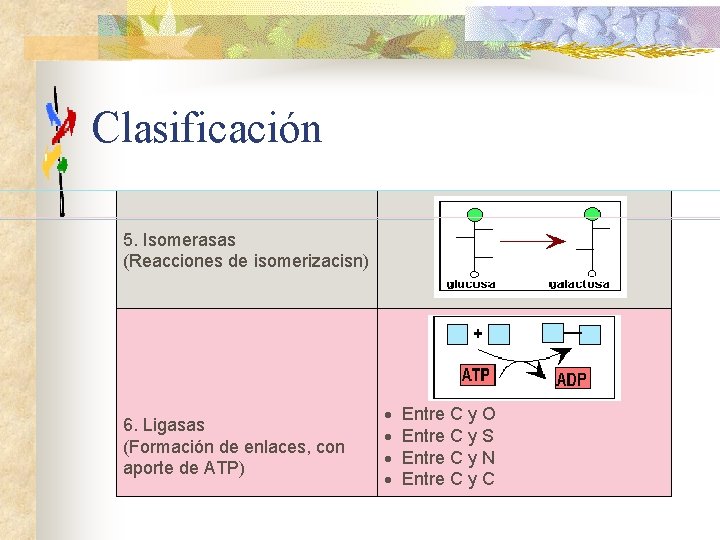
Clasificación 5. Isomerasas (Reacciones de isomerizacisn) 6. Ligasas (Formación de enlaces, con aporte de ATP) · · Entre C y O Entre C y S Entre C y N Entre C y C

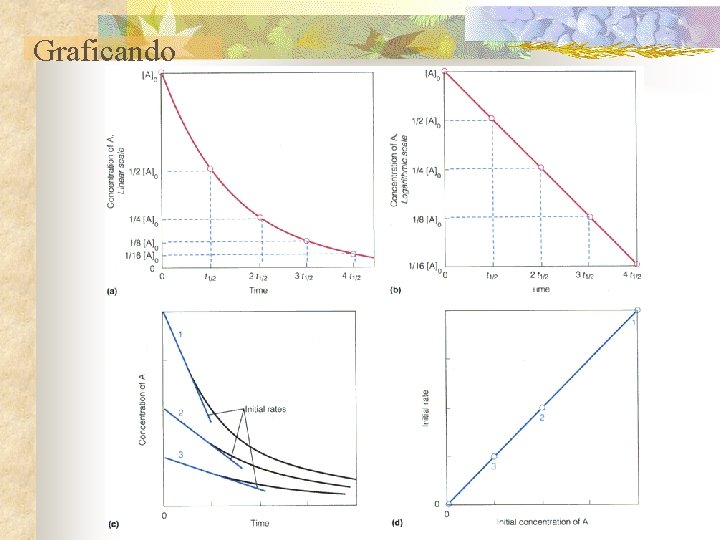
Velocidades de las reacciones químicas efecto de los catalizadores n Velocidades de reacción y orden de reacción Reacciones de 1º Orden n Para la reacción irreversible: n A B Integrando [A]/[A] 0 = e -(k-1 t) k 1 [s-1] donde [A]0 = concentración inicial de A cuando t = 0.

Graficando
![n Los procesos bioquímicos son reversibles A k 1 k1 B Donde k 1 n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-13.jpg)
n Los procesos bioquímicos son reversibles [A] k 1 k--1 [B] Donde k 1 y k-1 son ctts de v de 1° directa e inversa En equilibrio

Velocidades de las reacciones químicas efecto de los catalizadores n Reacciones de 2° Orden 2 A k 2 B Donde k 2 es ctt de v de 2° orden [(mol/L)-1 s-1] Los esquemas de reacciones complejas se simplifican con un paso limitante de la velocidad

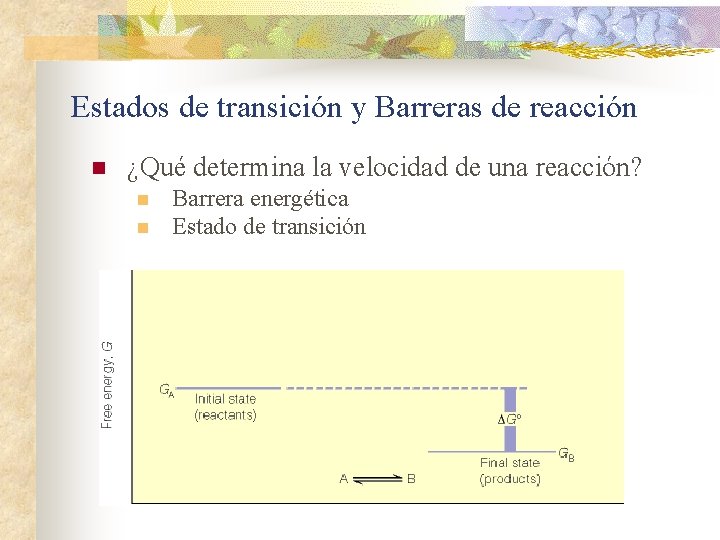
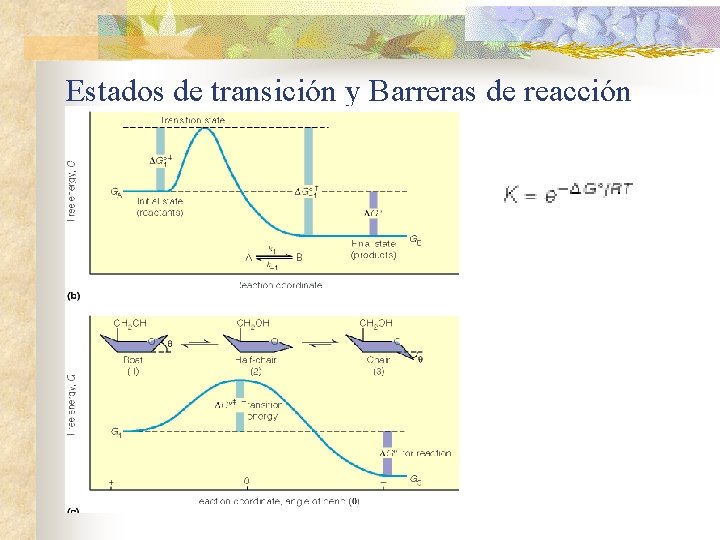
Estados de transición y Barreras de reacción n ¿Qué determina la velocidad de una reacción? n n Barrera energética Estado de transición

Estados de transición y Barreras de reacción

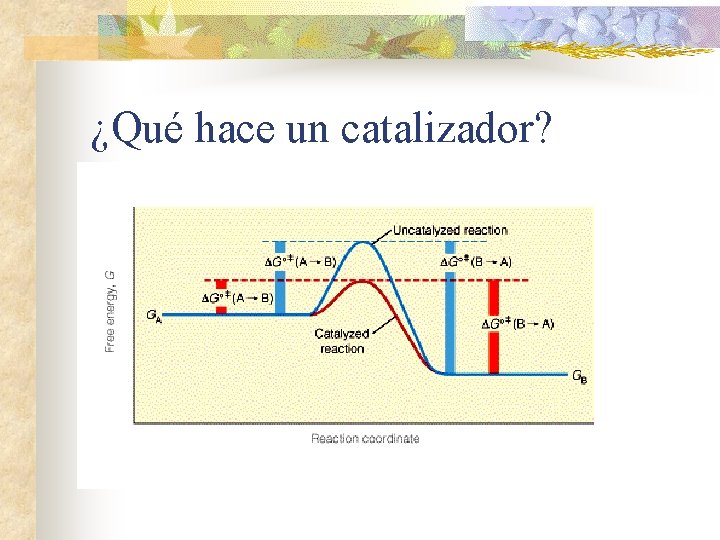
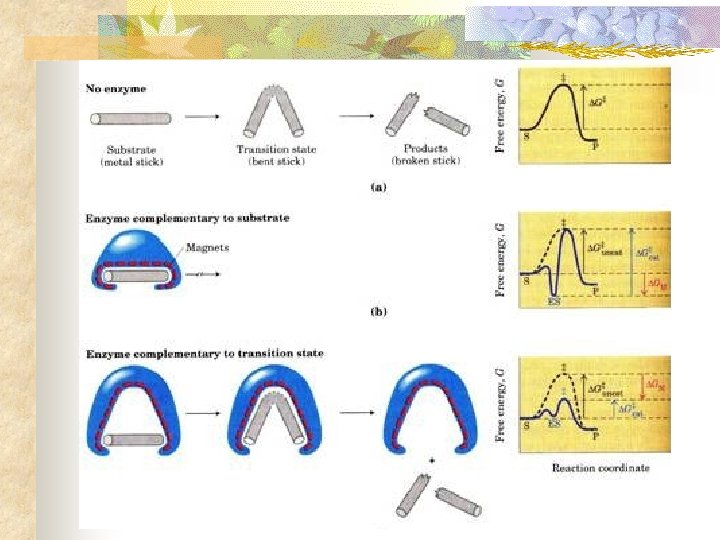
¿Qué hace un catalizador?

Cómo funcionan n Los enzimas disminuyen la energía de activación de las reacciones Reacción a) Energía de activación (Kcal*mol-1) el peróxido de hidrógeno se descompone en: H 2 O 2 H 2 O + O 2 18 b) el hierro catalítico (Fe) realiza la reacción 13 H 2 O 2 H 2 O + O 2 c) el platino catalítico (Pt) realiza la reacción : H 2 O 2 H 2 O + O 2 d) la catalasa una enzima hepática la realiza H 2 O 2 12 H 2 O + O 2 5

¿Qué hace un catalizador? n ¿Cómo reduce el catalizador la barrera energética? n n Reducción de entropía Desolvatación Se compensa tensión o distorsión del sustrato Consigue alineamiento entre grupos funcionales cataliticos del E y el S

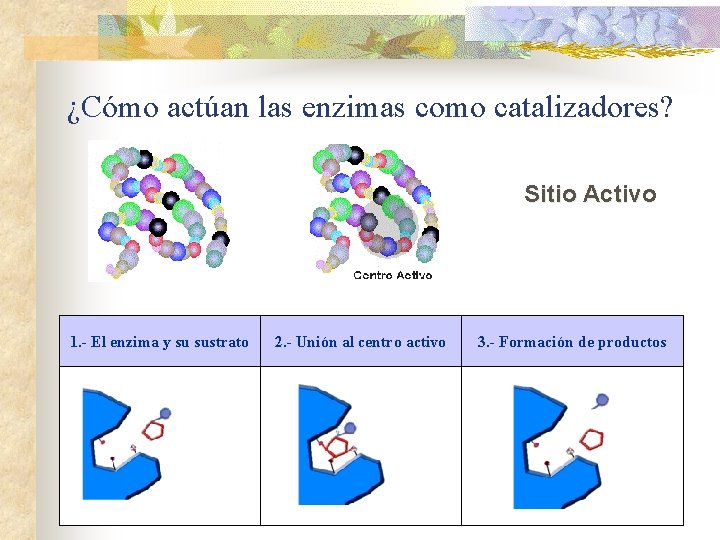
¿Cómo actúan las enzimas como catalizadores? Sitio Activo 1. - El enzima y su sustrato 2. - Unión al centro activo 3. - Formación de productos

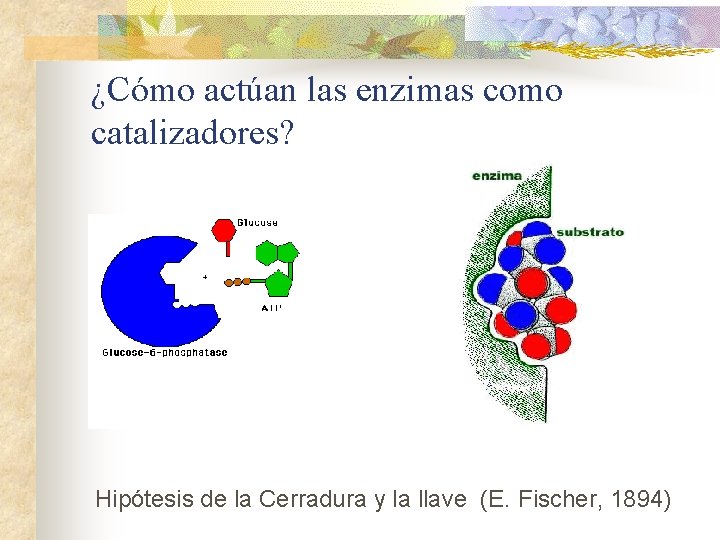
¿Cómo actúan las enzimas como catalizadores? Hipótesis de la Cerradura y la llave (E. Fischer, 1894)


¿Cómo actúan las enzimas como catalizadores? n Hipótesis del Ajuste Inducido (Daniel Koshland, 1958) n 1. 2. 3. 4. 5. E Induce al S a configuración aproximada al Edo. Transición UNE S REDUCE Ea IMPULSA Catalisis LIBERA P SE REGENERA

Cinética de la Catálisis Enzimática n Cinética de Michaelis-Menten n 1º etapa se forma el complejo enzima-sustrato. n 2º etapa, el complejo enzima-sustrato da lugar a la formación del producto, liberando el enzima libre: V 1 = k 1 [E] [S] V-1 = k-1 [ES] k 1 K -1 k 2 Paso lento V 2 = k 2 [ES]
![Cinética de la Catálisis Enzimática V 2 k 2 ES Podría Expresarse V Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-25.jpg)
Cinética de la Catálisis Enzimática V 2 = k 2 [ES] Podría Expresarse V como función de [E]t y [S] Asumiendo que E y S estan en equilibrio cuando k 2<< k-1 Ks ctte de disociación

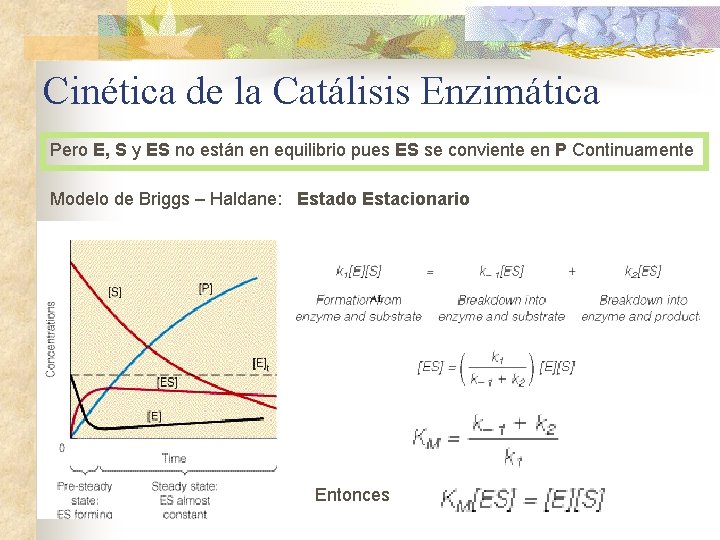
Cinética de la Catálisis Enzimática Pero E, S y ES no están en equilibrio pues ES se conviente en P Continuamente Modelo de Briggs – Haldane: Estado Estacionario Entonces

Cinética de la Catálisis Enzimática Ecuación de Michaelis - Menten n KM es característica de cada reacción Tiene unidades de concentración Cuando KM >> [S] se alcanza Vmax

Cinética de la Catálisis Enzimática n Para reacciones de pasos múltiples: K 2 es un caso particular la Kcat

Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Cuando k 2 << k-1 Entonces KM k-1/k 1 = K n Afinidad n de la enzima por el sustrato KM = [S] cuando V = ½ Vmax n Es una medida de la [S] necesaria para catálisis eficaz
![Cinética de la Catálisis Enzimática Significado de KM KcatKM n Kcat segundos1 n Medida Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida](https://slidetodoc.com/presentation_image_h/1352e027277329a5cb418d8af1ee1c25/image-30.jpg)
Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat [segundos-1] n Medida directa de la producción catalítica en condiciones {optimas (enzima saturada) n Tiempo necesario para cambiar S en P n Número de recambio (N° moléc de S recamb por seg)

Cinética de la Catálisis Enzimática Significado de KM, Kcat/KM n Kcat/ KM n Cuando [S] << KM Entonces [E]t << [E] n Medida directa de eficiencia y especifidad de la enzima n Permite comparar eficiencia de una enzima con diferentes sustratos n Valor máximo entre 108 y 109 (mol/L)-1 s-1

Cinética de la Catálisis Enzimática

Cinética de la Catálisis Enzimática

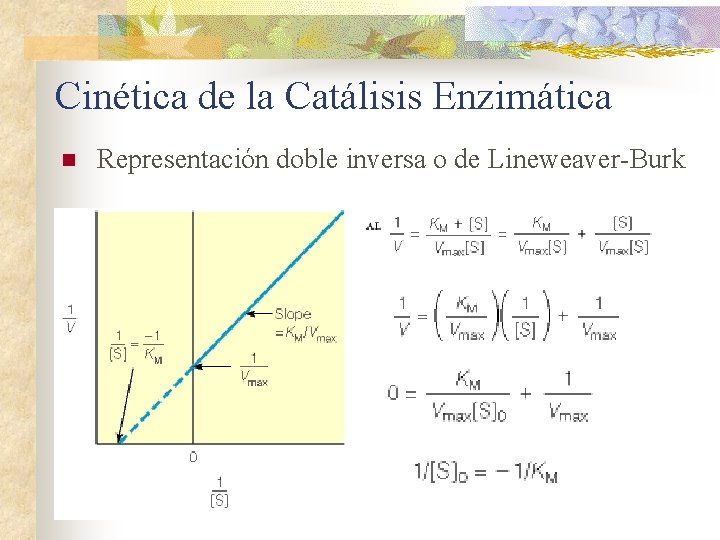
Cinética de la Catálisis Enzimática n Representación doble inversa o de Lineweaver-Burk

Cinética de la Catálisis Enzimática n Representación de Eadie- Hofstee

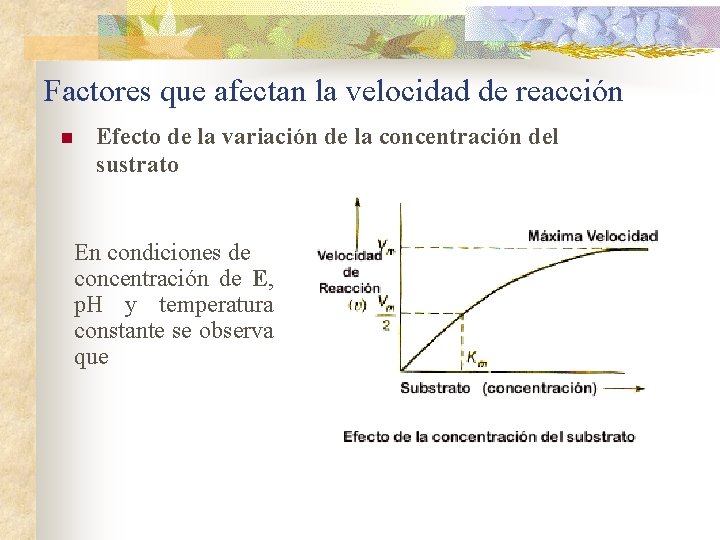
Factores que afectan la velocidad de reacción n Efecto de la variación de la concentración del sustrato En condiciones de concentración de E, p. H y temperatura constante se observa que

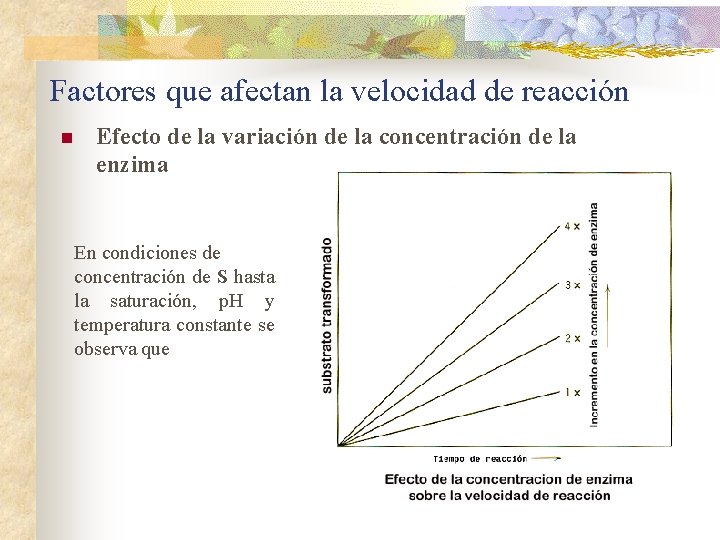
Factores que afectan la velocidad de reacción n Efecto de la variación de la concentración de la enzima En condiciones de concentración de S hasta la saturación, p. H y temperatura constante se observa que

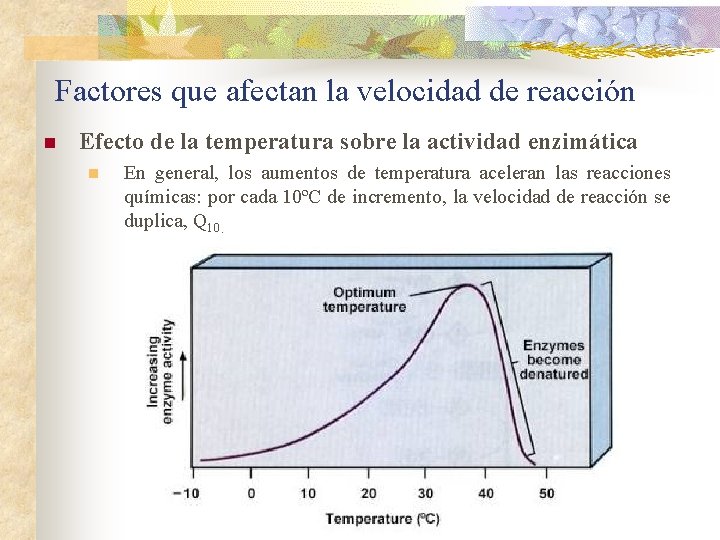
Factores que afectan la velocidad de reacción n Efecto de la temperatura sobre la actividad enzimática n En general, los aumentos de temperatura aceleran las reacciones químicas: por cada 10ºC de incremento, la velocidad de reacción se duplica, Q 10.

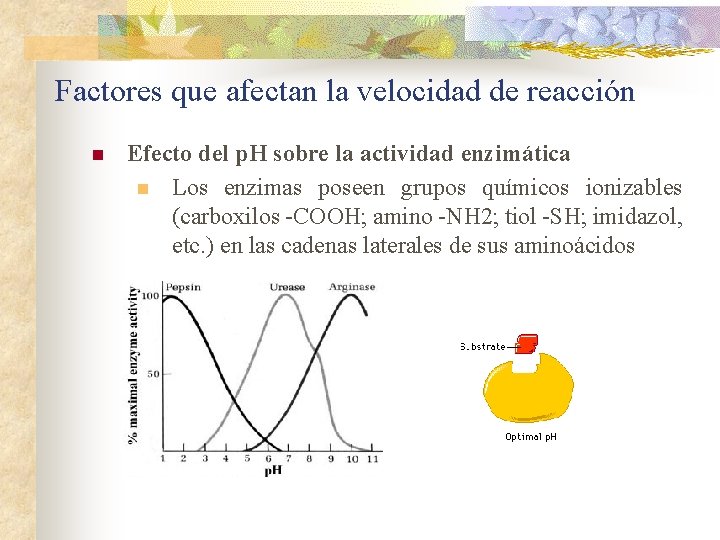
Factores que afectan la velocidad de reacción n Efecto del p. H sobre la actividad enzimática n Los enzimas poseen grupos químicos ionizables (carboxilos -COOH; amino -NH 2; tiol -SH; imidazol, etc. ) en las cadenas laterales de sus aminoácidos

Cinética Enzimática n Reacciones en que intervienen dos o más sustratos n Unión aleatória de los sustratos La fosforilación de la glucosa con ATP, catalizada con hexokinase, con tendencia a unirse a la glucosa en primer lugar.

Cinética Enzimática n Reacciones en que intervienen dos o más sustratos n Unión ordenada de los sustratos Se observa en oxidaciones de sustratos con la coenzima nicotinamide adenine dinucleotide (NAD+).

Cinética Enzimática n Reacciones en que intervienen dos o más sustratos n Mecanismo “ping-pong” La ruptura de una cadena polipetídica con una serina proteasa, tal como la trypsina o chymotrypsina.

Cinética Enzimática Análisis cinético en el estado estacionario de las reacciones bisustrato

Cinética Enzimática n Mecanismos de Inhibición

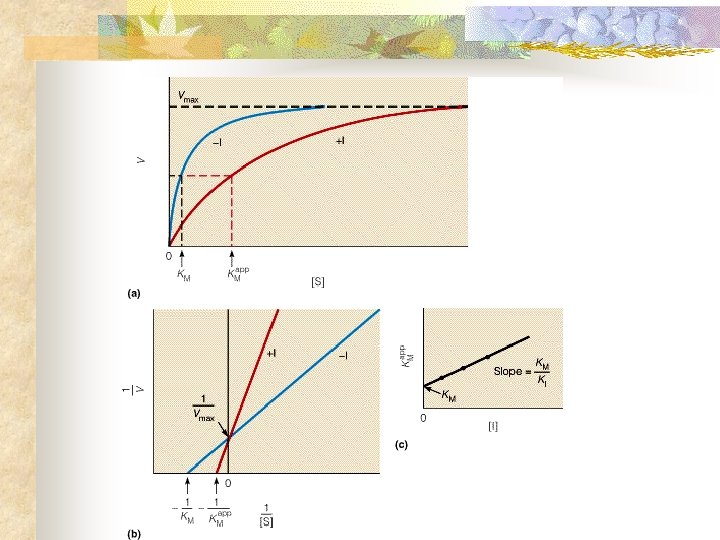
Cinética Enzimática n Mecanismos de Inhibición Inhibidor competitivo Inhibidor no competitivo

Cinética Enzimática n Mecanismos de Inhibición Reversibles n Inhibición competitiva


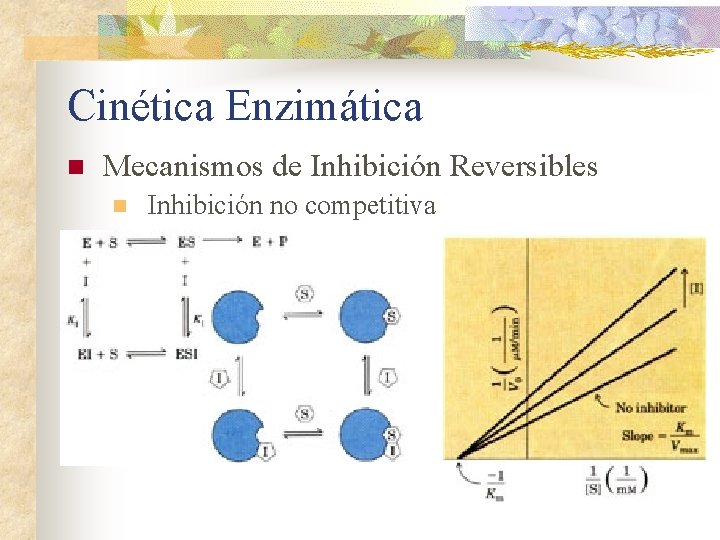
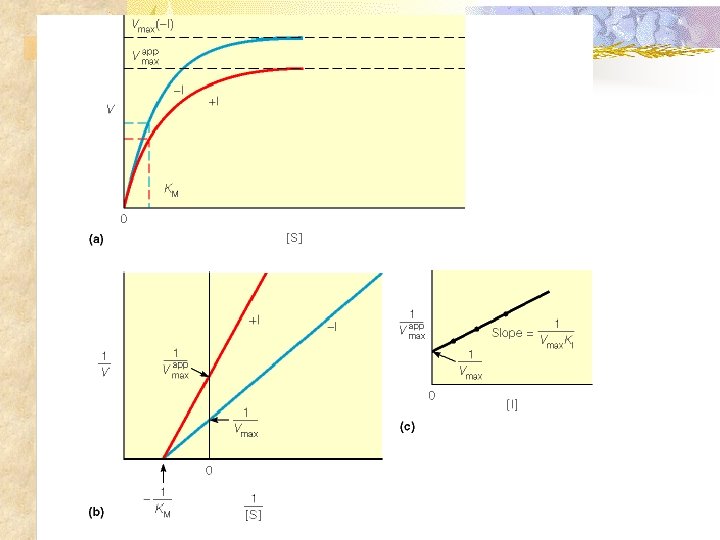
Cinética Enzimática n Mecanismos de Inhibición Reversibles n Inhibición no competitiva


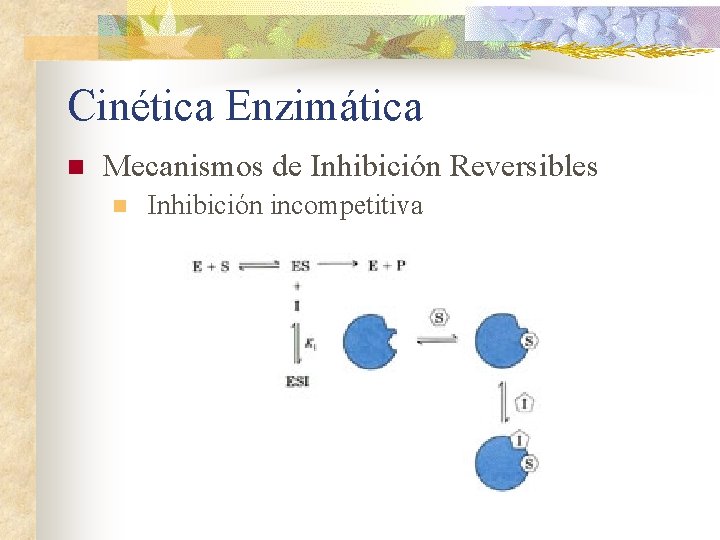
Cinética Enzimática n Mecanismos de Inhibición Reversibles n Inhibición incompetitiva

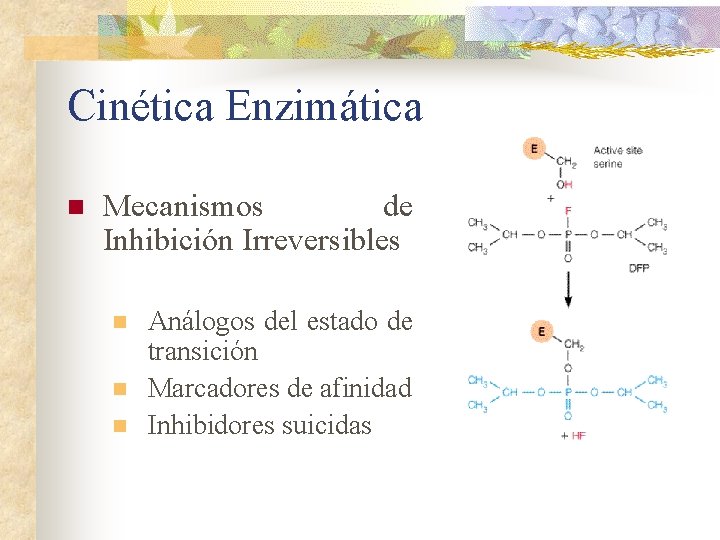
Cinética Enzimática n Mecanismos de Inhibición Irreversibles n n n Análogos del estado de transición Marcadores de afinidad Inhibidores suicidas

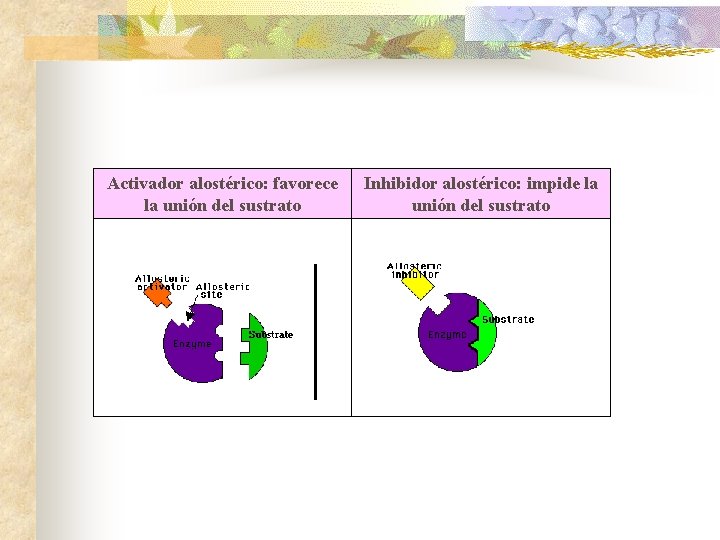
Activador alostérico: favorece la unión del sustrato Inhibidor alostérico: impide la unión del sustrato

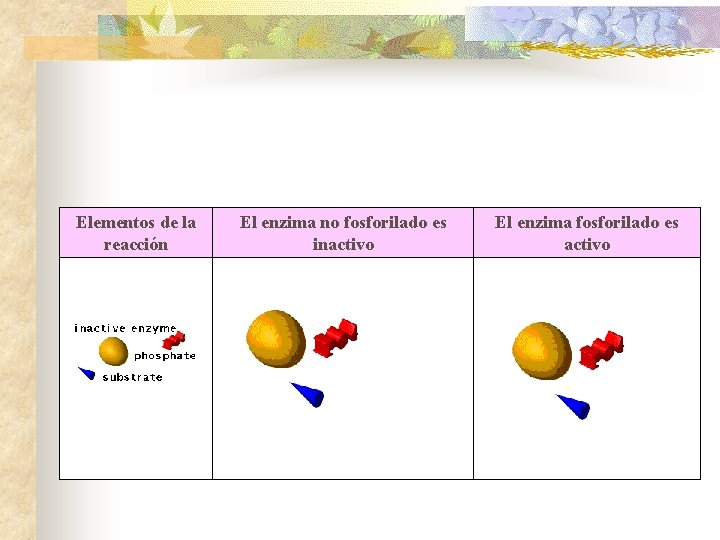
Elementos de la reacción El enzima no fosforilado es inactivo El enzima fosforilado es activo