Tema 5 GASES GASES Disposicin y distancia entre















- Slides: 28

Tema 5 GASES

GASES

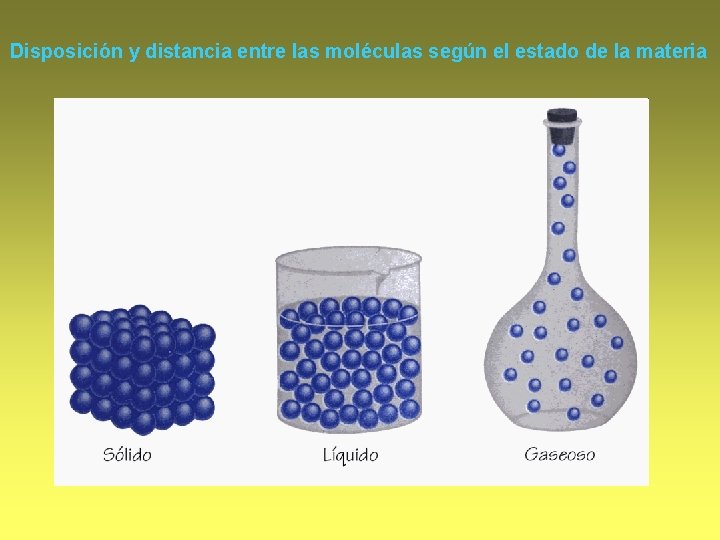
Disposición y distancia entre las moléculas según el estado de la materia

Características de los Gases • Los gases adoptan la forma del recipiente que los contiene. • Pueden ser comprimidos a menores volúmenes. • Cuando en un recipiente hay 2 o mas gases, difunden mezclándose homogéneamente y uniformemente. • Sus densidades son mucho menores que la de los líquidos y sólidos. • Ejercen presión sobre su entorno. Por lo tanto hay que ejercer presión para contenerlos.

Presión Se define como fuerza por unidad de área. Unidad en SI: PASCAL (Pa) Pa = Fuerza x área = N/m 2 = kg/m seg 2 N = kg m/seg 2

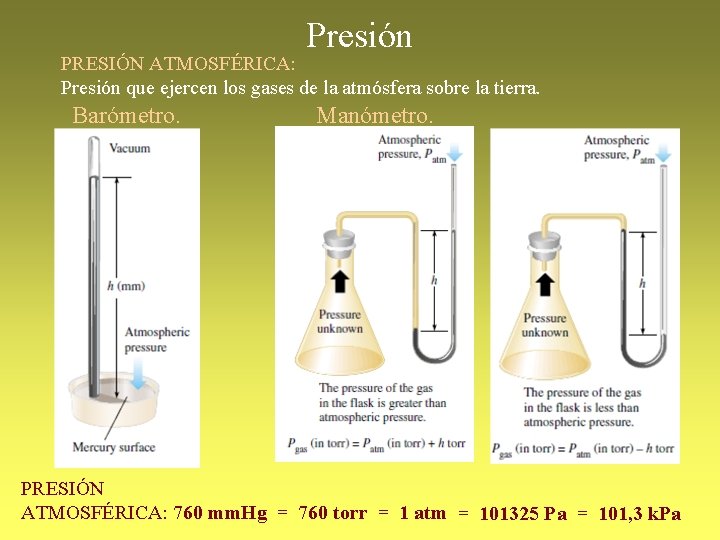
Presión PRESIÓN ATMOSFÉRICA: Presión que ejercen los gases de la atmósfera sobre la tierra. Barómetro. Manómetro. PRESIÓN ATMOSFÉRICA: 760 mm. Hg = 760 torr = 1 atm = 101325 Pa = 101, 3 k. Pa

Teoría Cinética de los Gases • Los gases están constituidos por partículas que se mueven en línea recta y al azar. • Las colisiones entre si y con las paredes del recipiente son perfectamente elásticas: transferencia de energía completa y esta permanece constante en el sistema. • La Presión es fruto de estos choques y depende de la frecuencia y de la fuerza. • Distancia de separación entre moléculas es mucho mayor que sus propias dimensiones: tamaño y volumen despreciable. • No hay fuerzas de atracción entre las moléculas que conforman el gas. • Energía cinética promedio es proporcional a la temperatura del sistema: Dos gases diferentes a la misma temperatura tendrán la misma Energía Cinética promedio. Gases Ideales

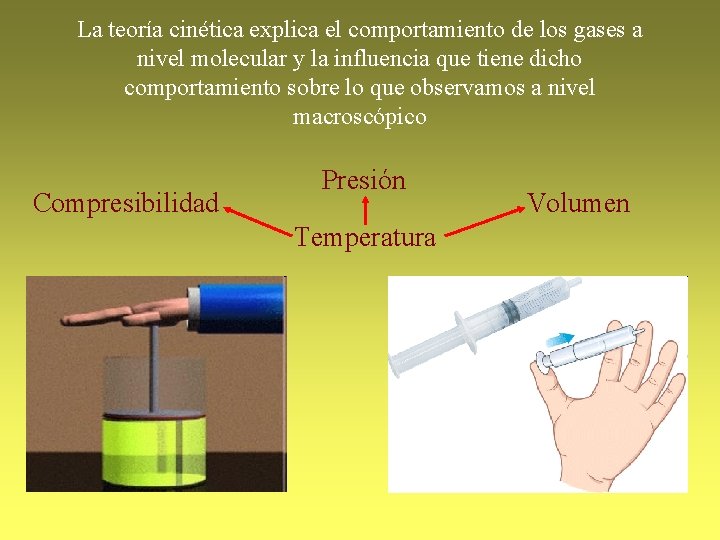
La teoría cinética explica el comportamiento de los gases a nivel molecular y la influencia que tiene dicho comportamiento sobre lo que observamos a nivel macroscópico Compresibilidad Presión Temperatura Volumen

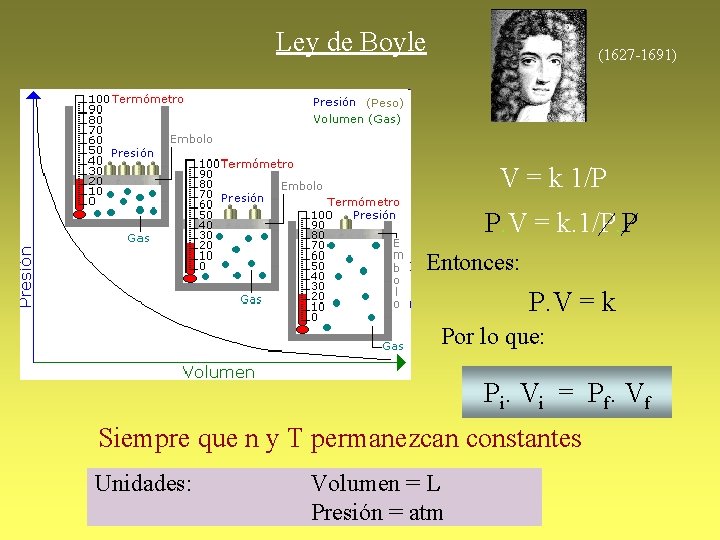
Ley de Boyle (1627 -1691) V = k 1/P P. V = k. 1/P. P Entonces: P. V = k Por lo que: P i. V i = P f. V f Siempre que n y T permanezcan constantes Unidades: Volumen = L Presión = atm

Veamos un ejemplo Una muestra de He ocupa 500 cm 3 a 2, 00 atm. Suponiendo que la Temperatura permanece constante: ¿Qué Volumen ocupará dicho gas a 4 atm? Datos: Vi = 0, 5 L Pi = 2 atm Pf = 4 atm Vf = ? Utilizando la Ley de Boyle P i. V i = P f. V f » Vf = (Pi. Vi) / Pf Reemplazando: Vf = (2 atm. 0, 5 L) / 4 atm Vf = 0, 25 L Rta: Vf = 0, 25 L

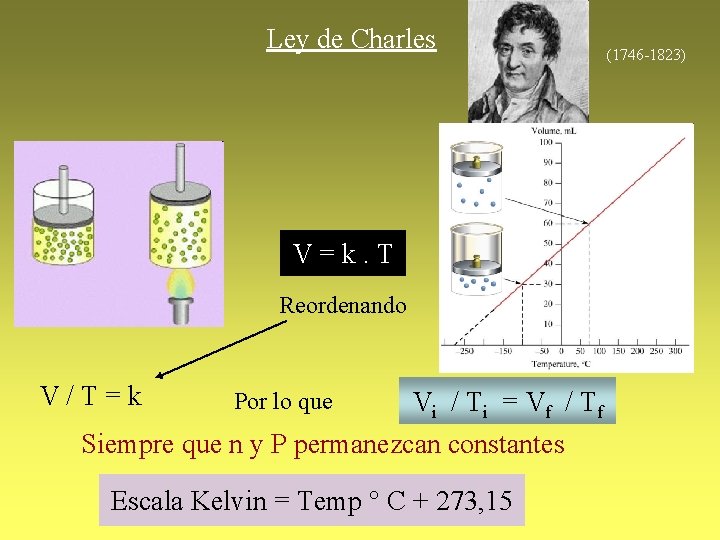
Ley de Charles V=k. T Reordenando V/T=k Por lo que Vi / T i = V f / T f Siempre que n y P permanezcan constantes Escala Kelvin = Temp ° C + 273, 15 (1746 -1823)

Veamos un ejemplo 250 m. L de Cl 2 medidos a 273 K son calentados a presión constante hasta alcanzar una temperatura de 373 K. ¿Cuál es el Volumen final que ocupa el gas? Datos: Vi = 0, 25 L Ti = 273 K Tf = 373 K Vf = ? Aplicando la Ley de Charles Vi / T i = V f / T f Reordenando y Reemplazando Vf = (0, 25 L. 373 °K) / 273 °K Vf = 0, 341 L Rta: Vf = 0, 341 L

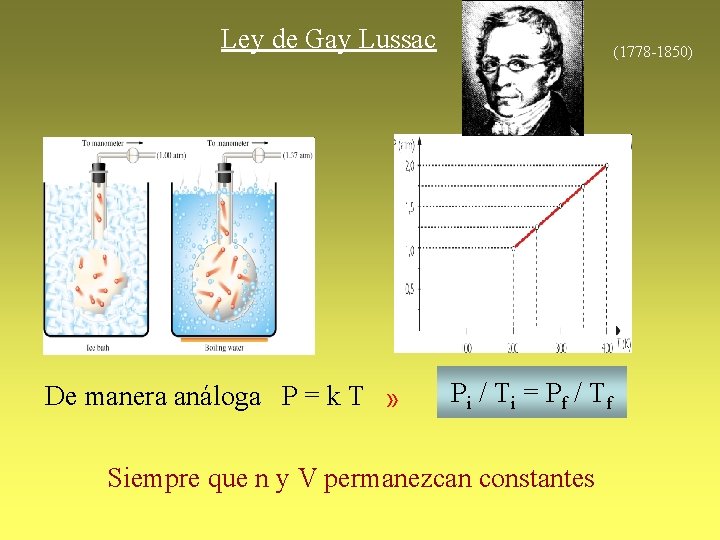
Ley de Gay Lussac De manera análoga P = k T » (1778 -1850) Pi / T i = P f / T f Siempre que n y V permanezcan constantes

Veamos un ejemplo 250 m. L de Cl 2 medidos a 273 K a una Presión de 1 atm son calentados a volumen constante hasta alcanzar una temperatura de 373 K. ¿Cuál será la Presión final del gas? Aplicando la Ley de Gay Lussac Datos: Pi = 1 atm Ti = 273 ° K Tf = 373 ° K Pf = ? Pi / T i = P f / T f Reordenando y Reemplazando Pf = (1 atm. 373 K) / 273 K Pf = 1, 37 atm Rta: Pf = 1, 37 atm

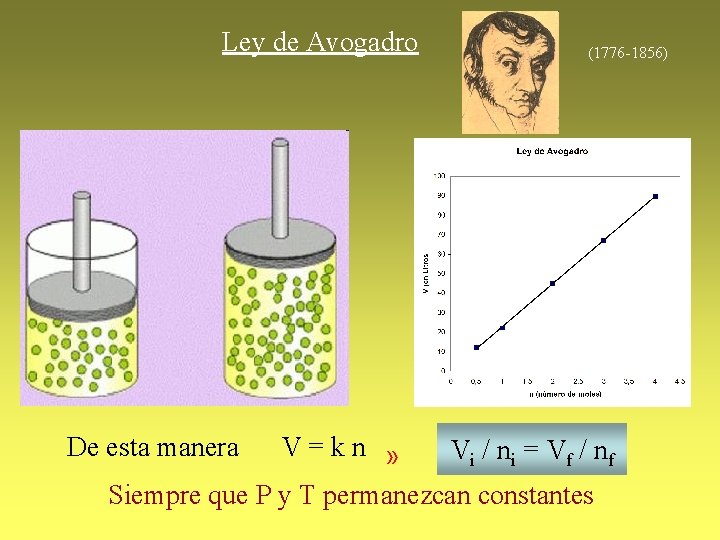
Ley de Avogadro De esta manera (1776 -1856) V=kn » Vi / ni = Vf / nf Siempre que P y T permanezcan constantes

Veamos un ejemplo Inicialmente se tiene 0, 5 moles de Cl 2 que ocupan un volumen de 11, 2 L. Si luego de cierto experimento a presión y temperatura constante se tienen 10 moles de Cl 2. ¿Cuál será el volumen final del gas? Aplicando la Ley de Avogadro Datos: Vi = 11, 2 L ni = 0, 5 moles nf = 10 moles Vf = ? Vi / ni = Vf / nf Reordenando y Reemplazando Vf = (11, 2 L. 10 moles) / 0, 5 moles Vf = 224 L Rta: Vf = 224 L

Ley Combinada de los gases V = k. 1/P (Ley de Boyle) Sabemos que: V = k. T (Ley de Charles) P = k. T (Ley de Gay Lussac) Si combinamos Entonces P. V=k T Pi. V i = Pf. V f Ti Tf Siempre que n sea constante

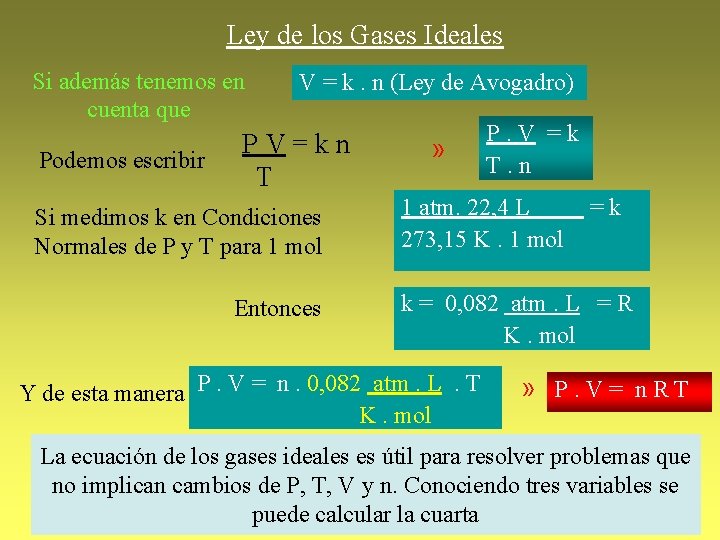
Ley de los Gases Ideales Si además tenemos en cuenta que Podemos escribir V = k. n (Ley de Avogadro) PV=kn T Si medimos k en Condiciones Normales de P y T para 1 mol Entonces » P. V =k T. n 1 atm. 22, 4 L 273, 15 K. 1 mol =k k = 0, 082 atm. L = R K. mol Y de esta manera P. V = n. 0, 082 atm. L. T K. mol » P. V= n. RT La ecuación de los gases ideales es útil para resolver problemas que no implican cambios de P, T, V y n. Conociendo tres variables se puede calcular la cuarta

Veamos un ejemplo El hexafluoruro de azufre es un gas incoloro e inodoro muy poco reactivo. Calcule la presión (en atm) ejercida por 1, 82 moles de dicho gas contenido en un recipiente de acero de 5, 43 L de volumen a 69, 5 °C. Datos n = 1, 82 moles V = 5, 43 L T = 69, 5°C = 342, 5 K Aplicando la ecuación P. V= n. RT P = n. RT V P = (1, 82 moles. 0, 082 atm L. 342, 5 K ) / 5, 43 L K. mol P = 9, 41 atm Rta: P = 9, 41 atm

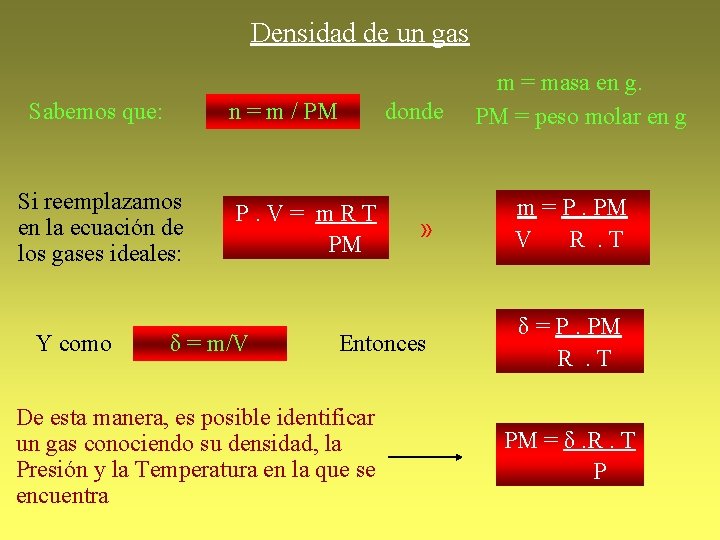
Densidad de un gas n = m / PM Sabemos que: Si reemplazamos en la ecuación de los gases ideales: Y como donde P. V= m. RT PM δ = m/V » Entonces De esta manera, es posible identificar un gas conociendo su densidad, la Presión y la Temperatura en la que se encuentra m = masa en g. PM = peso molar en g m = P. PM V R. T δ = P. PM R. T PM = δ. R. T P

Veamos un ejemplo Un químico ha sintetizado un compuesto gaseoso amarillo verdoso a partir de cloro y oxigeno, y encuentra que su densidad es 7, 71 gr / L a 36 °C y 2, 895 atm. Calcule el PM del compuesto y determine su formula molecular. Datos δ = 7, 71 gr/ L P = 2, 895 atm T = 36 °C = 309 K Aplicando PM = δ. R. T P PM = (7, 71 gr/L. 0, 082 atm L. 309 K) 2, 895 atm K. mol PM = 67, 48 g / mol Entonces 1 mol de Cl + 2 moles de O = 67, 45 gr / mol Rta: Cl. O 2

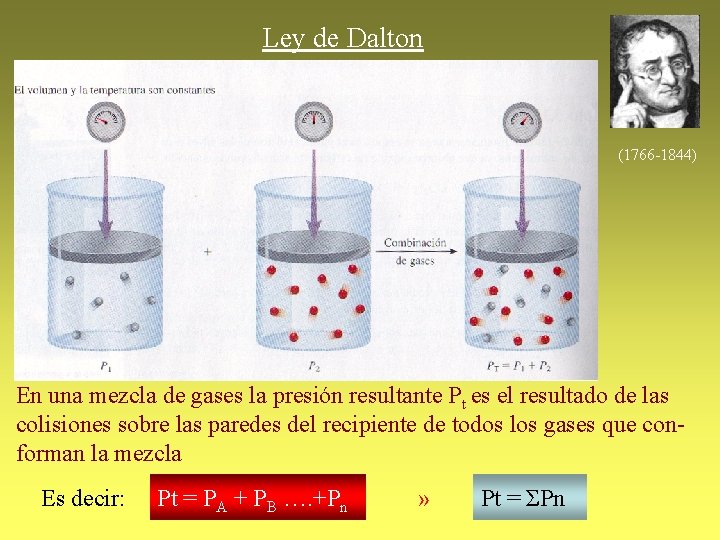
Ley de Dalton (1766 -1844) En una mezcla de gases la presión resultante Pt es el resultado de las colisiones sobre las paredes del recipiente de todos los gases que conforman la mezcla Es decir: Pt = PA + PB …. +Pn » Pt = ΣPn

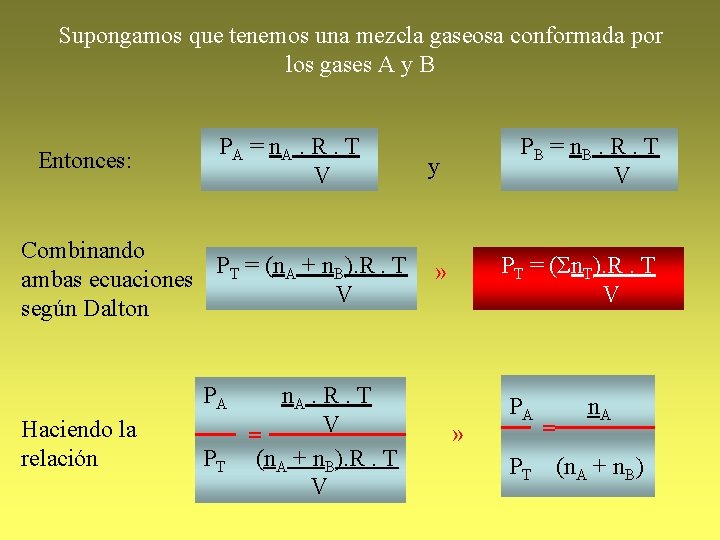
Supongamos que tenemos una mezcla gaseosa conformada por los gases A y B Entonces: P A = n. A. R. T V Combinando PT = (n. A + n. B). R. T ambas ecuaciones V según Dalton PA Haciendo la relación PT n. A. R. T V = (n. A + n. B). R. T V P B = n. B. R. T V y PT = (Σn. T). R. T V » » PA PT = n. A (n. A + n. B)

XA = n. A (n. A + n. B) Fracción Molar Por lo que PA = X A. PT Obsérvese que siempre se cumple que: XA + X B = 1 De esta manera, para un sistema que tiene Y componentes la presión parcial para cada uno de ellos es: Py = Xy. PT

Veamos un ejemplo Una mezcla gaseosa contiene 4. 46 moles de Ne, 0, 74 moles de Ar y 2, 15 moles de Xe. Calcule las presiones parciales de cada gas en la mezcla si la presión total del sistema es de 2, 00 atm a una dada temperatura n. A Datos XA = Utilizando n Ne = 4, 46 (n. A + n. B) n Ar = 0, 74 n Xe = 2, 14 n totales = 7, 34 XNe = 0, 6076 XAr = 0, 1008 XXe = 0, 2916 Pt = 2, 00 atm Pp. Ne = 1, 2152 atm Y aplicando Px = Xx. PT Se tiene que Pp. Ar = 0, 2016 atm Pp. Xe = 0, 5832 atm

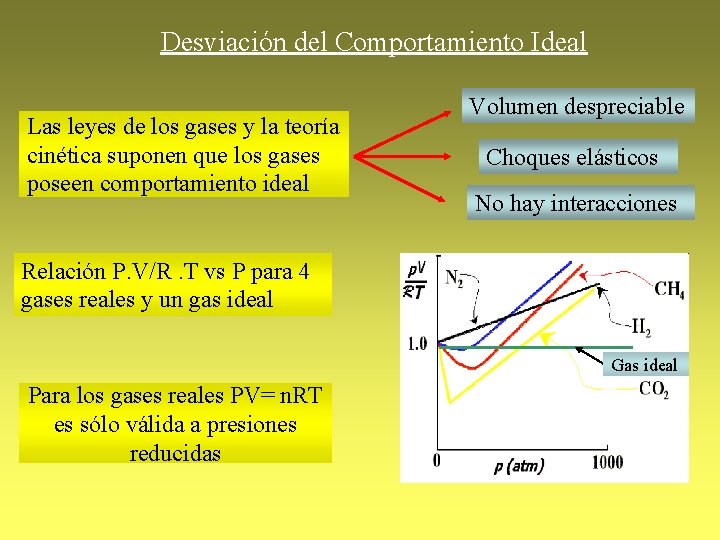
Desviación del Comportamiento Ideal Las leyes de los gases y la teoría cinética suponen que los gases poseen comportamiento ideal Volumen despreciable Choques elásticos No hay interacciones Relación P. V/R. T vs P para 4 gases reales y un gas ideal Gas ideal Para los gases reales PV= n. RT es sólo válida a presiones reducidas

Para estudiar el comportamiento de los gases reales con mayor exactitud hay que tener en cuenta las fuerzas intermoleculares y los volúmenes moleculares J. P. Van der Waals Propone una ecuación de estado modificada (P real + a n 2/V 2) (V – n b) = n R T (1837 -1923) Presión corregida Volumen corregido a y b = ctes de proporcionalidad y dependen de cada gas a α a la fuerza de atracción b α al volumen molecular a n 2/V 2 -nb Frecuencia de encuentros entre las moléculas del gas Volumen ocupado por las moléculas del gas

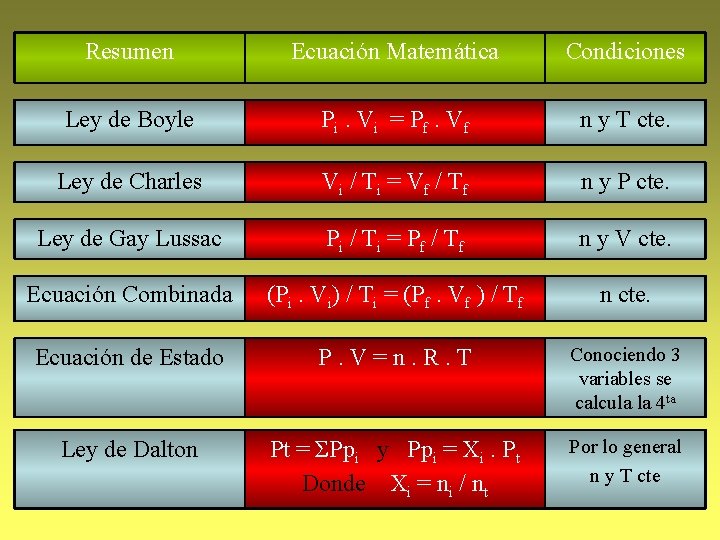
Resumen Ecuación Matemática Condiciones Ley de Boyle Pi. Vi = P f. Vf n y T cte. Ley de Charles Vi / T i = V f / T f n y P cte. Ley de Gay Lussac Pi / T i = P f / T f n y V cte. Ecuación Combinada (Pi. Vi) / Ti = (Pf. Vf ) / Tf n cte. Ecuación de Estado P. V=n. R. T Conociendo 3 variables se calcula la 4 ta Ley de Dalton Pt = ΣPpi y Ppi = Xi. Pt Donde Xi = ni / nt Por lo general n y T cte
 Disposicin
Disposicin Calcule a distância entre dois pontos a (-2 3) e b (1 -3)
Calcule a distância entre dois pontos a (-2 3) e b (1 -3) Triangulo exincentral
Triangulo exincentral Simplifique a expressao
Simplifique a expressao Con el se puede aplicar una fuerza a distancia
Con el se puede aplicar una fuerza a distancia Distancia de san francisco a napa valley
Distancia de san francisco a napa valley Longitud del eje menor de una elipse
Longitud del eje menor de una elipse Menor distancia entre dois pontos
Menor distancia entre dois pontos Angulo entre dos vectores
Angulo entre dos vectores Distância entre ripas telha cerâmica
Distância entre ripas telha cerâmica Konstruksifisme
Konstruksifisme Tema-tema teologi perjanjian lama
Tema-tema teologi perjanjian lama Delimitación del problema ejemplo
Delimitación del problema ejemplo El tema y sub tema
El tema y sub tema Tipos de entrevistas en investigacion
Tipos de entrevistas en investigacion Entre eu ou entre mim
Entre eu ou entre mim Quais os pronomes do caso oblíquo
Quais os pronomes do caso oblíquo Rgp consultas
Rgp consultas Matemticas
Matemticas Partiendo del mismo lugar dos ciclistas
Partiendo del mismo lugar dos ciclistas Distancia focal
Distancia focal Codigo de hamming
Codigo de hamming Distancia recorrida
Distancia recorrida Universo distancia
Universo distancia Pronombres de distancia
Pronombres de distancia Frequencia do som
Frequencia do som Distância de minkowski
Distância de minkowski Desigualdad triangular ejemplos
Desigualdad triangular ejemplos Patil andreti
Patil andreti