Tehniki fakultet Mihajlo Pupin u Zrenjaninu Industrijsko inenjerstvo


























- Slides: 30

Tehnički fakultet „Mihajlo Pupin“ u Zrenjaninu Industrijsko inženjerstvo u eksploataciji nafte i gasa Osnove tehnologije i tehnološki kompleksi (koji su uključeni u struku) 6. Realni gasovi Predavanja: Doc. dr. sc. Radoslav D. Mićić 1 rmicic@beotel. rs

Realni gasovi Kod jednačine idealnog gasnog stanja za molekule gasa se zanemaruje njihova zapremina i privlačne sile. Za realne fluide prvu jednačinu stanja uveo je Van der Waalsova jednačina stanja je jednačina stanja za fluide, koji se sastoji od čestica koje imaju neku zapreminu i udvojene privlačne međumolekularne sile (kao što su van der Waalsove sile). Izveo ju je Johannes Diderik van der Waals 1873. i za koju je dobio Nobelovu nagradu za fiziku 1910. Njegova jednačina je izmenjena jednačina stanja idealnog gasa i opisuje realne gasove. 2

ZAKON (NAČELO) KORESPODENTNIH STANJA (ZKS) Analiza velikog broja eksperimentalnih izotermo Zfaktora čistih materija pokazuje da su po obliku međusobno slične. Na osnovu toga Johannes Diderik van der Waals (1873) je postulirao načelo korespondentnih stanja za čiste materije: 3 "Ako se p, V i T izraze relativno prema odgovarajućim kritičnim svojstvima materije (tzv. redukovane veličine stanja) odnos redukovanog pritiska i redukovane zapremine postaje isti za sve materije ".

�Drugim rečima, prema zakonu korespondentnih stanja, ako čiste materije imaju iste vrednosti dveju redukovanih veličina stanja, imaće istu vrednost i treće redukovane veličine. �U skladu sa zakonom korespodentnih stanja 4 izvedene su zavisnosti za realne gasove.

Van der Waalsova jednačina stanja 5

6

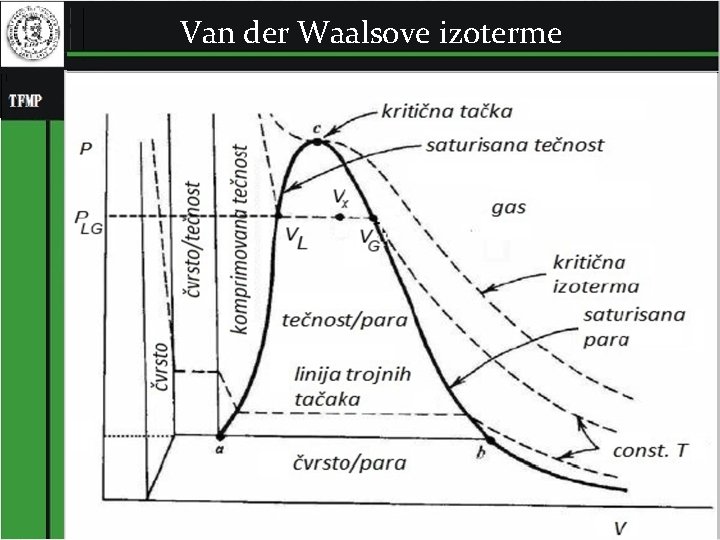
Van der Waalsove izoterme 7

Značenje konstanti a i b u van der Walsovoj jednačini stanja 8

Konstanta b je mera odbojnih sila izmedju molekula gasa. Zamislimo da su molekuli gasa krute sfere poluprečnika r. Kada se dva molekula gasa približe na rastojanje d = 2 r izmedju njih se javlja izuzetno jaka odbojna sila koja im ne dozvoljava da se više približe. Stoga molekulima gasa za kretanje nije dostupna cela zapremina suda V, već zapremina Vid = V -nb, tj zapremina suda umanjena za zapreminu koju ”zauzimaju” molekuli gasa. 9

Na osnovu van der Waals teorije mogu se odrediti parametri kritične tačke: 10

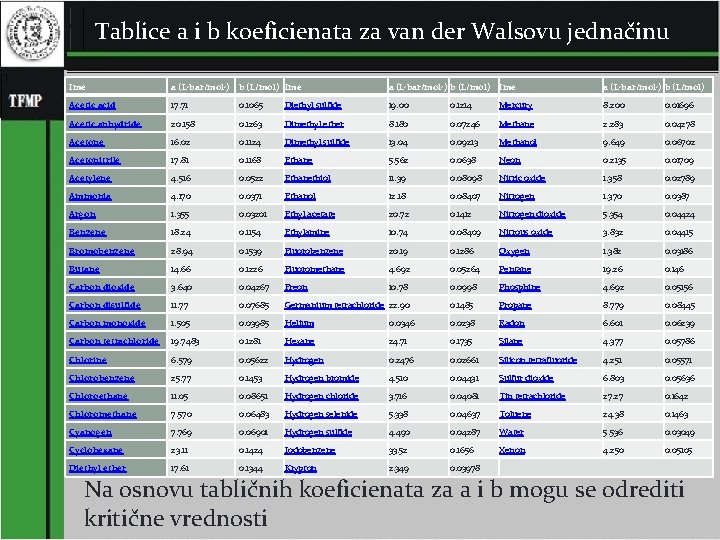
Tablice a i b koeficienata za van der Walsovu jednačinu Ime a (L 2 bar/mol 2) b (L/mol) Acetic acid 17. 71 0. 1065 Diethyl sulfide 19. 00 0. 1214 Mercury 8. 200 0. 01696 Acetic anhydride 20. 158 0. 1263 Dimethyl ether 8. 180 0. 07246 Methane 2. 283 0. 04278 Acetone 16. 02 0. 1124 Dimethyl sulfide 13. 04 0. 09213 Methanol 9. 649 0. 06702 Acetonitrile 17. 81 0. 1168 Ethane 5. 562 0. 0638 Neon 0. 2135 0. 01709 Acetylene 4. 516 0. 0522 Ethanethiol 11. 39 0. 08098 Nitric oxide 1. 358 0. 02789 Ammonia 4. 170 0. 0371 Ethanol 12. 18 0. 08407 Nitrogen 1. 370 0. 0387 Argon 1. 355 0. 03201 Ethyl acetate 20. 72 0. 1412 Nitrogen dioxide 5. 354 0. 04424 Benzene 18. 24 0. 1154 Ethylamine 10. 74 0. 08409 Nitrous oxide 3. 832 0. 04415 Bromobenzene 28. 94 0. 1539 Fluorobenzene 20. 19 0. 1286 Oxygen 1. 382 0. 03186 Butane 14. 66 0. 1226 Fluoromethane 4. 692 0. 05264 Pentane 19. 26 0. 146 Carbon dioxide 3. 640 0. 04267 Freon 10. 78 0. 0998 Phosphine 4. 692 0. 05156 Carbon disulfide 11. 77 0. 07685 Germanium tetrachloride 22. 90 0. 1485 Propane 8. 779 0. 08445 Carbon monoxide 1. 505 0. 03985 Helium 0. 0346 0. 0238 Radon 6. 601 0. 06239 Carbon tetrachloride 19. 7483 0. 1281 Hexane 24. 71 0. 1735 Silane 4. 377 0. 05786 Chlorine 6. 579 0. 05622 Hydrogen 0. 2476 0. 02661 Silicon tetrafluoride 4. 251 0. 05571 Chlorobenzene 25. 77 0. 1453 Hydrogen bromide 4. 510 0. 04431 Sulfur dioxide 6. 803 0. 05636 Chloroethane 11. 05 0. 08651 Hydrogen chloride 3. 716 0. 04081 Tin tetrachloride 27. 27 0. 1642 Chloromethane 7. 570 0. 06483 Hydrogen selenide 5. 338 0. 04637 Toluene 24. 38 0. 1463 Cyanogen 7. 769 0. 06901 Hydrogen sulfide 4. 490 0. 04287 Water 5. 536 0. 03049 Cyclohexane 23. 11 0. 1424 Iodobenzene 33. 52 0. 1656 Xenon 4. 250 0. 05105 Diethyl ether 17. 61 0. 1344 Krypton 2. 349 0. 03978 Na osnovu tabličnih koeficienata za a i b mogu se odrediti 11 kritične vrednosti

КOREKCIJA ZA REALNE GASOVE 12 �

Faktor stišljivosti (Z) Veličina kojom se opisuje neidealnost gasa, a koja se istovetno definiše i za tečnosti, je faktor stišljivosti (Z). Faktor stišljivosti se izračunava iz izraza: Veličina Vm u izrazu je molarna zapremina, p i T su, redom, apsolutni pritisak i temperatura, a R je univerzalna gasna konstanta. Zbog neidealnosti realnih fluida Za obične gasove na pritisku do 1 do 2 atm Z=1 13

Faktor stišljivosti (Z) Z = Z (Tr , Pr) Dvoparametarskim principom korespodentnih stanja faktor stišljivosti je definisan sa samo dva parametra, redukovanom temperaturom i redukovanim pritiskom Umesto apsolutne temperature i pritiska, uvedene su analogne redukovane veličine, redukovana temperatura (Tr) i redukovani pritisak (pr), kao mere udaljenosti osmatranog stanja od kritičnog, definisanog vrednostima kritične temperature (Tc) i kritičnog pritiska (pc). Redukovane veličine se izračunavaju preko sledećih izraza: 14


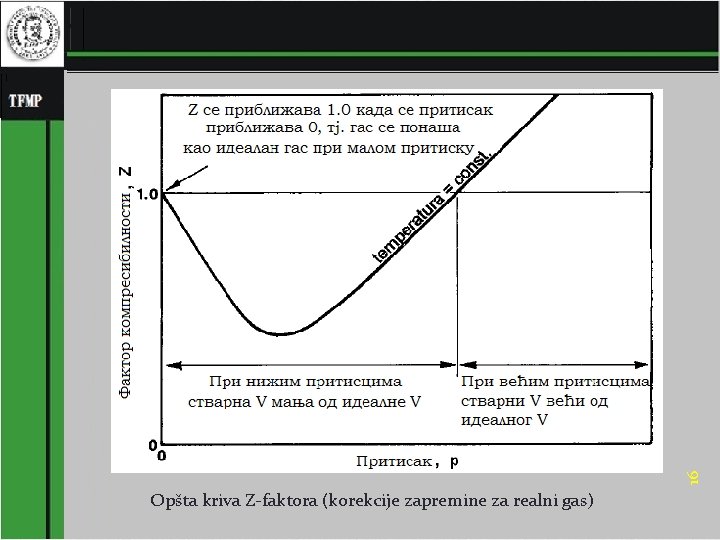
16 Opšta kriva Z-faktora (korekcije zapremine za realni gas)

Korekcija za realne gasove Zbog delovanja međumolekulskih sila, merena zapremine realnog gasa je u području nižeg pritiska manji, a u području višeg pritiska veća od zapremine, izračunate jednačinom stanja idealnog gasa Ovo odstupanje које је kvantitativno izraženo Z-faktorom (sinonimi: korekcioni faktor, faktor odstupanja ili faktor kompresibilnosti gasa; engl. gas compressibility factor, gas deviation factor), definisanim za 1 mol gasa: Dvoparametarskim principom korespodentnih stanja faktor stišljivosti je definisan sa samo dva parametra, redukovanom temperaturom i redukovanim pritiskom 17

Кorelacija eksperimentalnih izotermi Zfaktora nekih čistih materija 18 �

Primenjivost ZKS ispitana je stavljanjem podataka eksperimentalno određenih izotermo Z-faktora različitih istih materije (napr. metan, kiseonik, azot, itd. ) u isti dijagram, kao funkciju redukovanog pritiska i redukovane temperature. Iz dijagrama se vidi da u slučaju čistih supstanci zakon korespodentnih stanja daje sasvim dobre rezultate. 19

GENERALIZOVANA KORELACIJA ZA ODREĐIVANJE Z-FAKTORA SMEŠE � ZKS uopšteno ne daje idealno tačne rezultate, posebno u slučaju smesa raznorodnih spojeva. � Međutim, primenjen na gasove, srodne po hemijskoj građi (napr. parafinski ugljovodonici prirodnih ugljovodo-ničnih smesa) daje korelacije, koje su dovoljno tačne za prosečne inženjerske potrebe. � Direktne primena ZKS na smese srodnih prirodnih 20 ugljovodonika nije moguća, jer stvarne vrednosti kritičnih veličina smesa (pc, Tc ) eksperimentalno je teško odrediti.



ЈЕDNAČINA STANJA REALNOG GASA (ЈС, ЕНГЛ. COMPRESSIBILITY REAL GAS EQUATION) 23 �

Jednostavnost jednačine podrazumeva direktno i lako računanje zapreminskih karakteristika realnih gasova, ako je poznata tačna vrednost Zfaktora ispitivanog gasa pri zadatom p, T-uslovu (ili uslovima). Vrednost Z-faktora zavisi od pritiska, temperature i vrste (sastav, zi) gasa, tj. Z (p, T, zi) 24

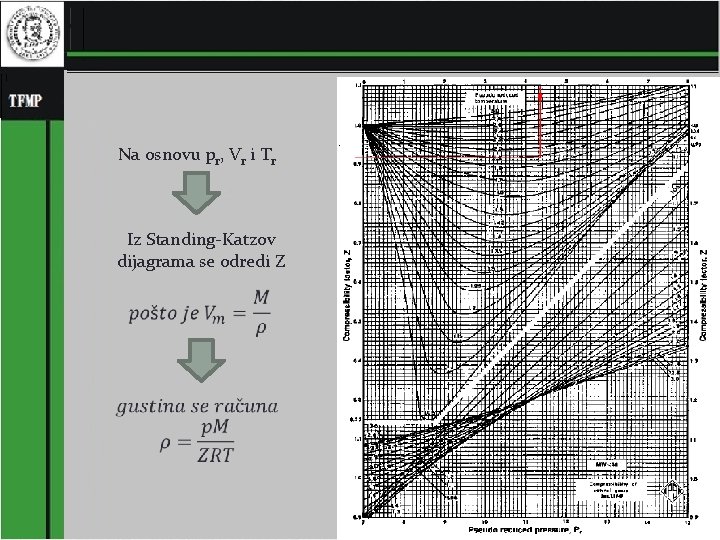
Određivanje faktora kompresibilnosti Z za čist gas Iz tablica za dati gas odrede se kritični parametri Odrede se pr, Vr i Tr 25

Na osnovu pr, Vr i Tr Iz Standing-Katzov dijagrama se odredi Z 26

Određivanje faktora kompresibilnosti Z za smešu Za smešu gasova, kritični pritisak i kritična temperatura smeše mogu se izračunati iz sledećih izraza: Određivanje faktora kompresibilnosti za prirodne gasove: ZC - faktor stišljivosti smeše ugljovodonika 27

28 Pokazalo se da korelacija daje dobre rezultate (odstupanja korelacijskih vrednost Z -faktora od merenih vrednosti su 2%) za tzv. "slatki" prirodni gas (engl. sweet gas), tj. Prirodni gas sa sadržajem "kiselih" neugljikovodičnih gasova (H 2 S i CO 2) te inertnog azota (N 2) manjim od 5 mol. %. Standing, M. B. and Katz, D. L. : “Density of Natural Gases”, Trans. AIME, 146, (1942) 140.

Zapreminski faktor realnog gasa (Bg). 29 �

30
 Tehniki
Tehniki Ets mihajlo pupin
Ets mihajlo pupin Fakultet u zrenjaninu
Fakultet u zrenjaninu Rfzr
Rfzr Azot 4 oksid
Azot 4 oksid Mehaničar pula
Mehaničar pula Dobijanje aluminijuma iz boksita
Dobijanje aluminijuma iz boksita Crteži geometrijskih tijela
Crteži geometrijskih tijela Tehniki
Tehniki Tehniki
Tehniki Tehniki
Tehniki Tehniki
Tehniki Tehniki
Tehniki Mihajlo strelec
Mihajlo strelec Mihajlo jovanovic
Mihajlo jovanovic Psykologisk fakultet
Psykologisk fakultet Poslovni fakultet singidunum
Poslovni fakultet singidunum Pravni fakultet univerziteta u travniku
Pravni fakultet univerziteta u travniku Pravni fakultet podgorica
Pravni fakultet podgorica Zaključak prezentacije
Zaključak prezentacije Kriminalistički fakultet banja luka
Kriminalistički fakultet banja luka Ekonomski fakultet banja luka
Ekonomski fakultet banja luka Ekonomski fakultet banja luka
Ekonomski fakultet banja luka Univerzitet za poslovne studije banja luka
Univerzitet za poslovne studije banja luka Ekonomski fakultet podgorica
Ekonomski fakultet podgorica Medicinski fakultet foca
Medicinski fakultet foca Nacrtna geometrija gradjevinski fakultet
Nacrtna geometrija gradjevinski fakultet Hemijski fakultet beograd
Hemijski fakultet beograd Katedra za astronomiju
Katedra za astronomiju Fakultet za računarske nauke i informatiku ljubljana
Fakultet za računarske nauke i informatiku ljubljana Inženjer brodogradnje
Inženjer brodogradnje






















































