TEHNIKA TERMODINAMIKA Re termodinamika u svom izvornom znaenju













- Slides: 16

TEHNI^KA TERMODINAMIKA § Re~ termodinamika u svom izvornom zna~enju predstavlja nauku o energiji. Naziv poti~e od starogr~kih re~i therme - toplota i dynamics – onaj koji poti~e od sile, {to je nekada ozna~avalo energiju. § Tehni~ka termodinamika opisuje i prou~ava procese uzajamnog pretvaranja toplote, kao i toplotne u mehani~ku energiju i obratno, i predstavlja osnov za razumevanje rada: toplotnih ma{ina i uredjaja (parnih kotlova i turbina, SUS motora, industrijskih pe}i, su{ara, sistema daljinskog grejanja i sl. ), rashladnih i klima uredjaja, procesa prostiranja toplote i sl.

§ - Radno telo u termodinamici § Radno telo u termodinamici je medijum koji obavlja termodinami~ki proces. To mo`e biti: idealan gas, vodena para, vla`an vazduh ili komprimovan vazduh. § - Pojam idealnog gasa § Idealni gas predstavlja gas ~iji se molekuli haoti~no kre}u i imaju oblik pravilnih loptica beskona~no malog pre~nika, ali kona~ne mase. Medju molekulima (sem u momentima sudara) vladaju beskona~no male sile. Neki realni gasovi pri niskim pritiscima i visokim temperaturama se pona{aju pribli`no idealnom gasu ~ime je njegovo uvodjenje opravdano. § U prakti~nom smislu to je gas ~ije je stanje daleko od stanja zasi}enja.

Oblici jedna~ine stanja idealnog gasa § Jedna~ina stanja idealnog gasa glasi: § p. V = m. RT. . . (1) § R - gasna konstanta koja zavisi od vrste gasa i predstavlja rad koji izvr{i 1 kg gasa kad mu se temperatura promeni za 1 K pri konstantnom pritisku ( R = p. V/m. T (J/kg. K)). Deljenjem jedna~ine sa (1) sa masom "m" dobijamo: § pv = RT. . . (2) § Ako se jedna~ina (2) pomno`i molarnom masom M (kg / kmol ) dobijamo: § p. VM = MRT = Ru· T / n § p. V = n·Ru·T ………(3) § n = m/M - br. molova § gde je: VM = v· M - zapremina jednog kmola VM = 22, 4 m 3/kmol = 22, 4 dm 3/mol § Ru = M· R - univerzalna gasna konstanta, Ru = 8 314 J/kmol. K = 8, 314 J/mol. K § Prema jedn. (2) mo`e se napisati: § p = RT § gde je: § (m 3/kg) - gustina gasa

§ § Entalpija ( I ) je veli~ina stanja i predstavlja termodinami~ki potencijal koji se sastoji iz termi~kog potencijala (U) i spolja{njeg mehani~kog potencijala (p. V), izra`enog preko veli~ine stanja materije: I = U + p. V ( J ) Nalazi veliku primenu kod vodene pare i pri analizi strujnih procesa. - § § - Entropija § Entropija (S) je veli~ina stanja koja povezuje apsolutnu temperaturu (T), takodje veli~inu stanja, sa toplotom (Q) koja se odvodi ili dovodi izmedju dva stanja preko izraza: § Q = ∫ T d. S § Kada S raste imamo dovodjene toplote, a kada opada odvodjenje. § Primenu nalazi kod formulacije Drugog zakona termodinamike i vodene pare.

§ - Prvi zakon termodinamike § Predstavlja oblik op{teg zakona o odr`anju energije koji je primenjen na toplotne promene stanja. § Najop{tija matemati~ka formulacija glasi: § Q 12 = U + L 12 § gde je: § U = U 2 - U 1 - promena unutra{nje energije izmedju stanja 1 i 2. § Q 12 - dovedena (odvedena) toplota radnom telu izmedju stanja 1 i 2. § L 12 - izvr{en (ulo`en) zapreminski rad izmedju stanja 1 i 2. § Dakle, jedan deo dovedene koli~ine toplote tro{i se na promenu unutra{nje energije radnog tela a drugi na vr{enje rada. Da bi se toplota odvela od tela potrebno je ulo`iti rad. § - Drugi zakon termodinamike § O uslovima koji moraju biti zadovoljeni pri transformaciji toplotne energije u rad govori drugi zakon termodinamike. § Na~elna formulaciija je da su svi termi~ki procesi nepovratni. Samim tim promena entropije ( S) adijabatski (toplotno) izolovanog sistema koga sa}injavaju: radno telo, toplotni izvor (zagreja~) i toplotni ponor (hladnjak) ne mo`e biti negativna. § Ekvivalentna formulacija bila bi da toplota ne mo`e spontano prelaziti sa hladnijeg na toplije telo bez ulaganja rada ili drugih kompenzacija u sistemu. Takodje, sva toplota izvora ne mo`e se pretvoriti u mehani~ki rad.

OSNOVNI TERMODINAMI^KI PROCESI


Izobarski proces u p-v i T-s dijagramu



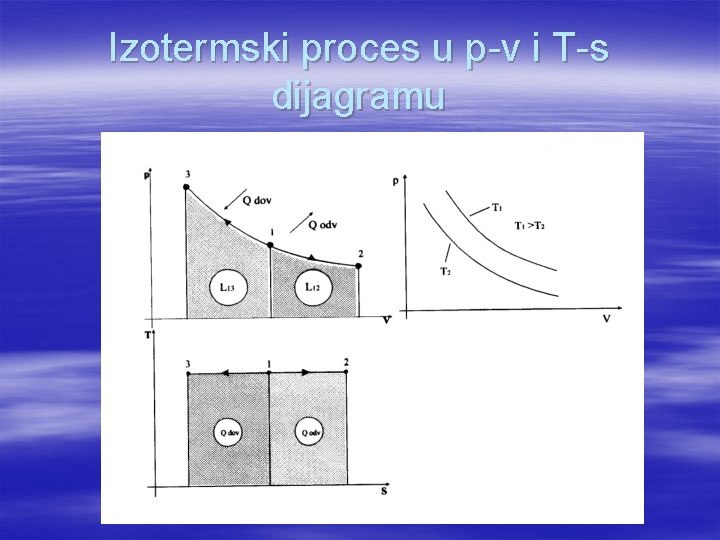
Izotermski proces u p-v i T-s dijagramu


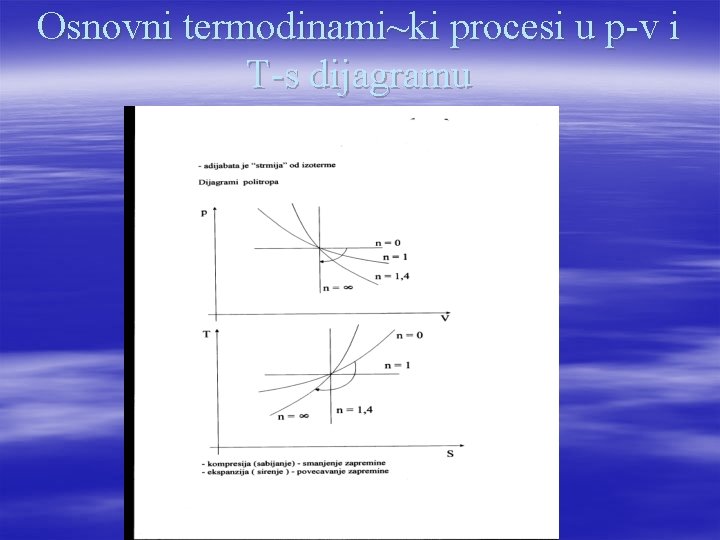
Osnovni termodinami~ki procesi u p-v i T-s dijagramu

Kružni ciklusi. Desnokretni i levokretni. Karno-ov kružni ciklus


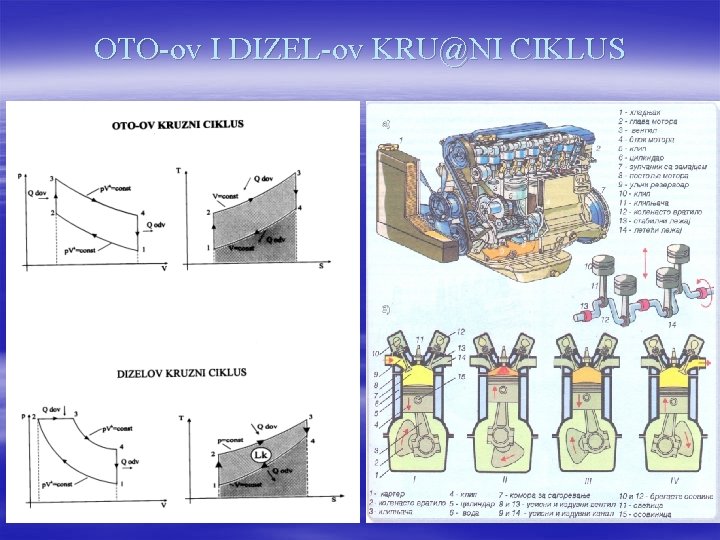
OTO-ov I DIZEL-ov KRU@NI CIKLUS
 Nije prorok bez časti doli u svom zavičaju
Nije prorok bez časti doli u svom zavičaju Termoterapija u fizikalnoj medicini
Termoterapija u fizikalnoj medicini Tehnika 6 šešira
Tehnika 6 šešira Spio tehnika
Spio tehnika Tehnika 3
Tehnika 3 Tehnika nominalne grupe
Tehnika nominalne grupe Digitalna tehnika
Digitalna tehnika Gantogram i tehnika mre
og plana
Gantogram i tehnika mre
og plana Rtg kolonografija
Rtg kolonografija Koliko je tezak disk za bacanje
Koliko je tezak disk za bacanje Merkur tehnika
Merkur tehnika Ramni kranovi
Ramni kranovi Lecuipe
Lecuipe Mahover tehnika
Mahover tehnika Frotra
Frotra Psihologija na maturi
Psihologija na maturi Stranac problematika
Stranac problematika