TECNOVIGILANCIA EN MXICO HISTORIA DE LA TECNOVIGILANCIA EN


















- Slides: 24

TECNOVIGILANCIA EN MÉXICO

HISTORIA DE LA TECNOVIGILANCIA EN MÉXICO 2012 IMPLEMENTACIÓN DE VIGENCIA DEL REGISTRO SANITARIO, SU CONTINUIDAD ESTÁ SUJETA A LA DEMOSTRACIÓN DE SEGURIDAD, CALIDAD Y EFICACIA 2005 1997 CLASIFICACIÓN E INCLUSIÓN DE LOS DISPOSITIVOS MÉDICOS EN LA LEY GENERAL DE SALUD CREACIÓN E IMPLEMENTACIÓN DE REGULACIÓN ESPECÍFICA EN LA MATERIA 1991 INCLUSIÓN DE LA COMUNIDAD Y SERVICIOS DE SALUD EN EL REPORTE DE EVENTOS ADVERSOS; ESTABLECIDO EN LA LEY GENERAL DE SALUD

HISTORIA DE LA TECNOVIGILANCIA EN MÉXICO NOM-240 -SSA 1 -2012 Instalación y Operación de la Tecnovigilancia Actualización del Suplemento para Dispositivos Médicos de la FEUM 2015 2013 Emisión de resoluciones con base a la evaluación del riesgo ( ISO 14971) Sistema de Notificación en línea de incidentes adversos. 2016

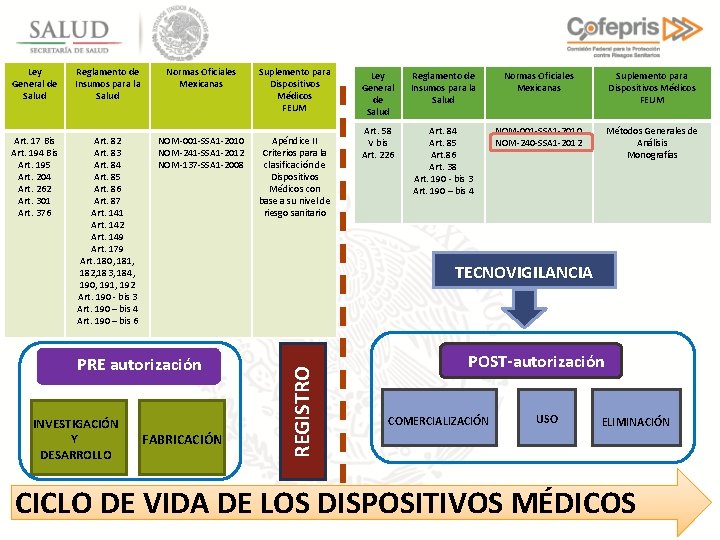
Ley General de Salud Reglamento de Insumos para la Salud Normas Oficiales Mexicanas Suplemento para Dispositivos Médicos FEUM Art. 17 Bis Art. 194 Bis Art. 195 Art. 204 Art. 262 Art. 301 Art. 376 Art. 82 Art. 83 Art. 84 Art. 85 Art. 86 Art. 87 Art. 141 Art. 142 Art. 149 Art. 179 Art. 180, 181, 182, 183, 184, 190, 191, 192 Art. 190 - bis 3 Art. 190 – bis 4 Art. 190 – bis 6 NOM-001 -SSA 1 -2010 NOM-241 -SSA 1 -2012 NOM-137 -SSA 1 -2008 Apéndice II Criterios para la clasificación de Dispositivos Médicos con base a su nivel de riesgo sanitario Reglamento de Insumos para la Salud Normas Oficiales Mexicanas Suplemento para Dispositivos Médicos FEUM Art. 58 V bis Art. 226 Art. 84 Art. 85 Art. 86 Art. 38 Art. 190 - bis 3 Art. 190 – bis 4 NOM-001 -SSA 1 -2010 NOM-240 -SSA 1 -2012 Métodos Generales de Análisis Monografías FABRICACIÓN REGISTRO TECNOVIGILANCIA PRE autorización INVESTIGACIÓN Y DESARROLLO Ley General de Salud POST-autorización COMERCIALIZACIÓN USO ELIMINACIÓN CICLO DE VIDA DE LOS DISPOSITIVOS MÉDICOS

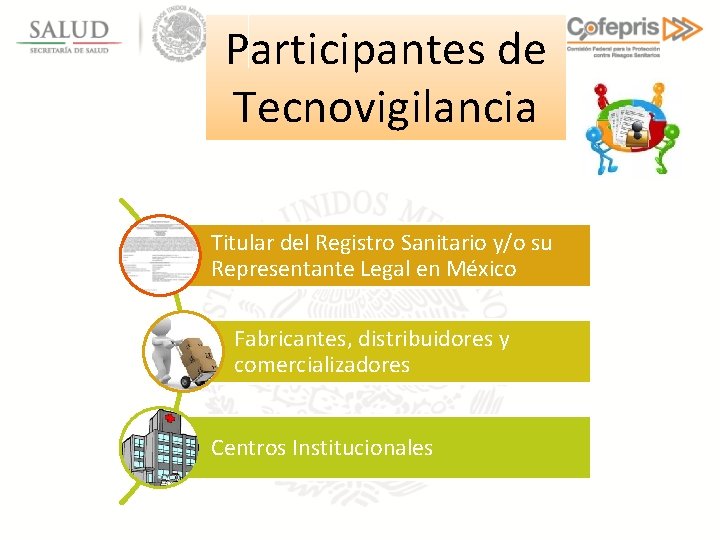
Participantes de Tecnovigilancia Titular del Registro Sanitario y/o su Representante Legal en México Fabricantes, distribuidores y comercializadores Centros Institucionales

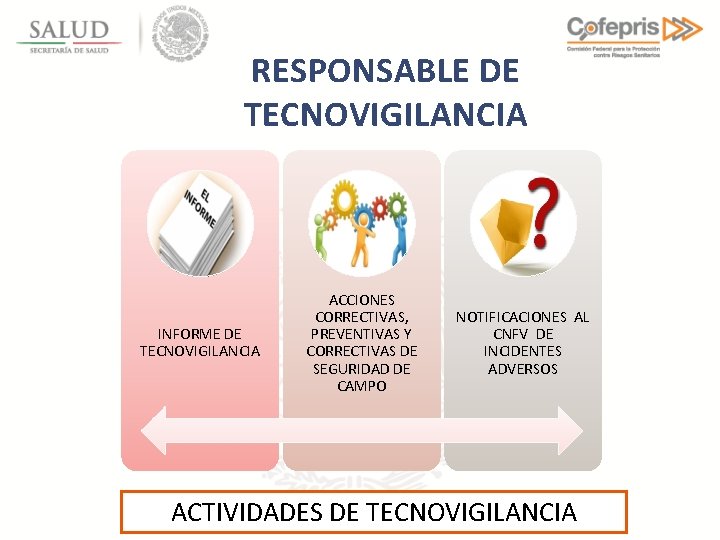
RESPONSABLE DE TECNOVIGILANCIA INFORME DE TECNOVIGILANCIA ACCIONES CORRECTIVAS, PREVENTIVAS Y CORRECTIVAS DE SEGURIDAD DE CAMPO NOTIFICACIONES AL CNFV DE INCIDENTES ADVERSOS ACTIVIDADES DE TECNOVIGILANCIA

SISTEMA DE NOTIFICACIÓN EN LÍNEA

¿PARA QUÉ REQUIERO EL INFORME DE TECNOVIGILANCIA? PARA LA RENOVACIÓN DEL REGISTRO SANITARIO

CHECK LIST

FUTURO DE LA TECNOVIGILANCIA EN MÉXICO 2018 Actualización de NOM-240 -SSA 1 -2012 para armonizar con las directrices IMDRF

FUTURO DE LA TECNOVIGILANCIA EN MÉXICO Titular del registro Profesionales de la Salud Pacientes/Usuarios Distribuidores Autoridad Sanitaria Actividad de responsabilidad compartida entre todos los agentes relacionados con dispositivos médicos. Centros de Investigación clinica Almacenes Farmacias La vigilancia Post. Comercialización deberá definir la renovación de los Registros Sanitarios de los Dispositivos Médicos.

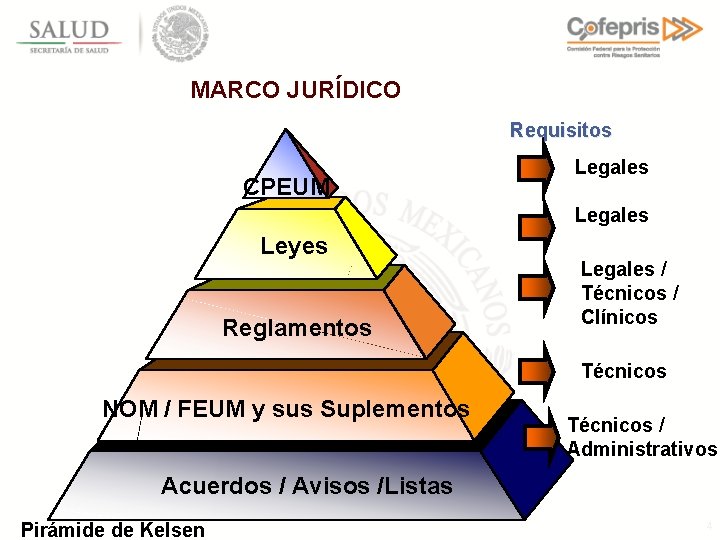
MARCO JURÍDICO Requisitos CPEUM Legales Leyes Reglamentos Legales / Técnicos / Clínicos Técnicos NOM / FEUM y sus Suplementos Técnicos / Administrativos Acuerdos / Avisos /Listas Pirámide de Kelsen 4

DEFINICIÓN DE FARMACOPEA EN MÉXICO Es el documento expedido por la Secretaría de Salud que consigna los métodos generales de análisis y los requisitos sobre identidad, pureza y calidad de los insumos para la salud. Art. 2 fracc. IX de la Reglamento de Insumos para la Salud 4

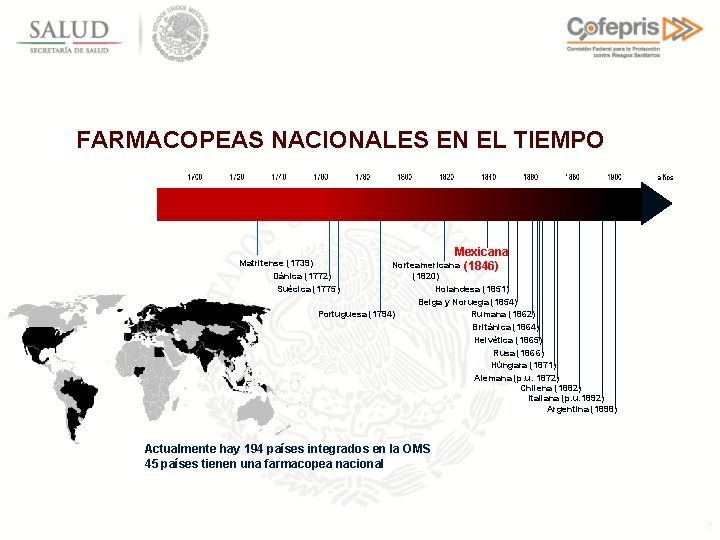
FARMACOPEAS NACIONALES EN EL TIEMPO años Matritense (1739) Dánica (1772) Suécica (1775) Mexicana Norteamericana (1846) Portuguesa (1794) (1820) Holandesa (1851) Belga y Noruega (1854) Rumana (1862) Británica (1864) Helvética (1865) Rusa (1866) Húngara (1871) Alemana (p. u. 1872) Chilena (1882) Italiana (p. u. 1892) Argentina (1898) Actualmente hay 194 países integrados en la OMS 45 países tienen una farmacopea nacional 7

Farmacopea Mexicana Elaborada por la Academia Farmacéutica de la Ciudad de la República 1846 Nueva Farmacopea Mexicana DISPOSITIVOS MÉDICOS EN EDICIONES DE LA FARMACOPEA MX: Algodón: 1874, 1884, 1930, 1952 (2) Gasas: 1896, 1930, 1952 1874 1884 1896 1904 1952 Elaboradas por la Sociedad Farmacéutica Mexicana Primera edición Segunda edición Tercera edición Cuarta edición Quinta edición Sexta edición Oficial Farmacopea Nacional de los Estados Unidos Mexicanos 1930 Medios de contraste: 2000 Suturas: FNEUM 1952 USP XII (1942), BPh. C (1930) 1925 1952 1962 1974 Tercera edición Cuarta edición Expedidas por el Estado Primera edición Segunda edición 8

Farmacopea de los Estados Unidos Mexicanos 1988 1994 Quinta ed. Sexta ed. 2000 Séptima ed. 2004 Octava ed. 2008 Novena ed. 2011 Décima ed. 2014 Undécima ed. 9

ANTECEDENTES DEL SUPLEMENTO PARA DISPOSITIVOS MÉDICOS DE LA FEUM De 1993 a 2005 sólo se generaron 47 NOM para DM específicos, ante un universo de más de 10 000 tipos de DM y 1. 5 millones de modelos (según OMS). En febrero de 2006 se publica en el DOF un decreto presidencial para modificar el artículo 195 de la LGS. Con esta modificación se establece que la FEUM normará los medicamentos y también a los demás insumos para la salud El Comité de dispositivos médicos de la FEUM se creó en 2006 y la 1 a ed. del Suplemento se presentó en noviembre de 2006. El Aviso de venta se publicó en el DOF el 06/sept/2007. Entró en vigor en noviembre de 2007. 10

Suplemento para dispositivos médicos OBJETIVO Contar con un documento que establezca las especificaciones sanitarias para Dispositivos médicos: equipos médicos, prótesis, órtesis, ayudas funcionales, agentes de diagnóstico, insumos de uso odontológico, materiales quirúrgicos y de curación, así como los métodos de análisis que permitan su comprobación.

SUPLEMENTO PARA DISPOSITIVOS MÉDICOS DE LA FEUM 3 ediciones del Suplemento para DM 2006 2011 2017 2014 Suplemento para dispositivos médicos 2012 2013 2015 2016 Suplementos anuales de la FEUM con actualizaciones de dispositivos médicos 11

El Suplemento para dispositivos médicos: § § § Tiene el mismo nivel que una NOM. Es un documento que está en constante actualización de sus contenidos. Es la Secretaría de Salud quien vigila su cumplimiento. Puede establecer monografías por familia de productos. Establece Métodos Generales de Análisis, cuando estos aplican a más de dos monografías, en caso contrario el método especifico se incluye dentro de la monografía del dispositivo.

SUPLEMENTO PARA DISPOSITIVOS MÉDICOS, 3 A. EDICIÓN CONTENIDO Capítulo de Generalidades Capítulo de Soluciones y reactivos 36 Métodos Generales de Análisis 25 Métodos Generales de Análisis específicos para DM 176 Monografías de producto 8 Apéndices: • Regulación sanitaria aplicable a DM • Criterios para clasificación de DM • Lineamientos para obtener el registro sanitario • Criterios de agrupación de DM para efectos de registro sanitario • Aplicación de la administración de riesgos de los DM • Conservación y manejo de cultivos microbianos de referencia • Análisis microbiológico de productos no estériles • Glosario 12

Organismos e instituciones integrantes del Comité de Dispositivos Médicos de la CPFEUM: 15

Modificaciones para la 4ª ed del Suplemento para dispositivos médicos Cambios en el Apéndice II: • Actualización de la definición de “Dispositivo médico” • Inclusión de definiciones complementarias. • Inclusión de árboles de decisión • Reglas originales para: • Agentes de diagnóstico • Productos higiénicos • DM de bajo riesgo Impacto de los cambios: • Armonización de la definición de “Dispositivo médico” con GHTF, IMDRF, OMS, ISO • Reglas de clasificación armonizadas parcialmente con Directivas Europeas y GHTF • Las definiciones complementarias facilitan la interpretación de las reglas de clasificación 2

¡GRACIAS! M. en C. Norma Morales Villa nmorales@cofepris. gob. mx Río Rhin 57, Col. Cuauhtémoc. CP 06500, Ciudad de México. Tel. : 55 5207 -6887 http: //www. farmacopea. org. mx @CPFEUM Farmacopea Mexicana @CPFEUM