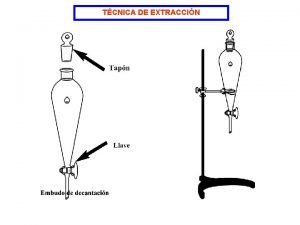
TECNICAS SEPARATIVAS Precipitacin lquido lquido Extraccin Clasificacin en







































- Slides: 61

TECNICAS SEPARATIVAS Precipitación. líquido - líquido Extracción Clasificación: en fase sólida Destilación Cromatografía 1

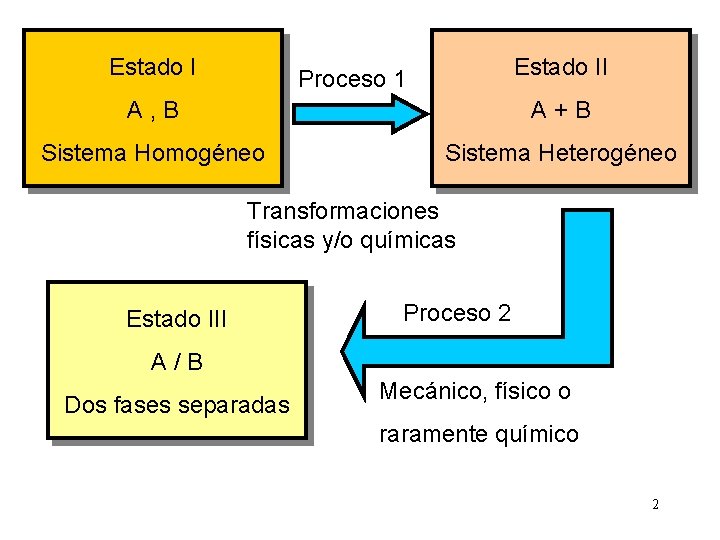
Estado II Proceso 1 A, B A+B Sistema Homogéneo Sistema Heterogéneo Transformaciones físicas y/o químicas Estado III Proceso 2 A/B Dos fases separadas Mecánico, físico o raramente químico 2

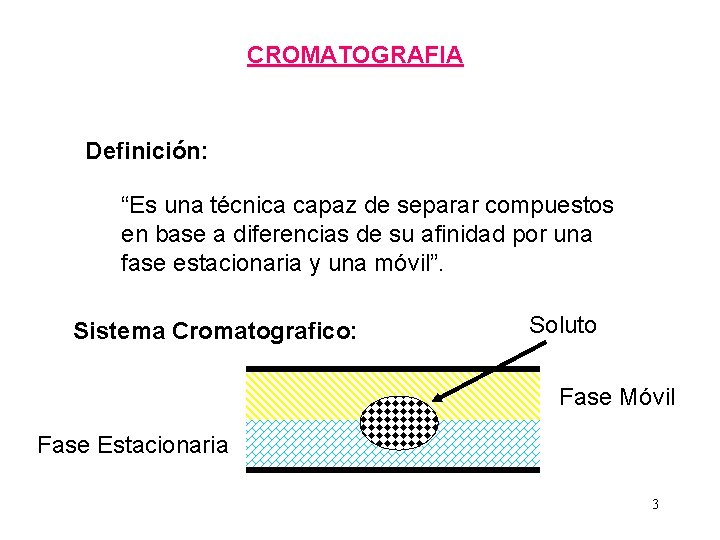
CROMATOGRAFIA Definición: “Es una técnica capaz de separar compuestos en base a diferencias de su afinidad por una fase estacionaria y una móvil”. Sistema Cromatografico: Soluto Fase Móvil Fase Estacionaria 3

Proceso Cromatográfico (1) Proceso físico - químico que rige la separación: -Adsorción: El soluto se adsorbe en la superficie de las partículas sólidas de la fase estacionaria. Es un fenómeno superficial, aumentado con la formación de puentes de hidrógeno. - Partición o Reparto: El soluto se equilibra entre el líquido de la fase estacionaria y la fase móvil, por diferencia de solubilidad. Hasta llegar a un equilibrio 4

Proceso Cromatográfico (2) - Intercambio Iónico: Los aniones o cationes se separan en base a una columna rellena con un intercambiador de iones ( resina) - Exclusión Molecular, Filtración o Permeación en Gel: No existen interacciones entre la fase estacionaria y el soluto. Se separa por tamaño de partícula. 5

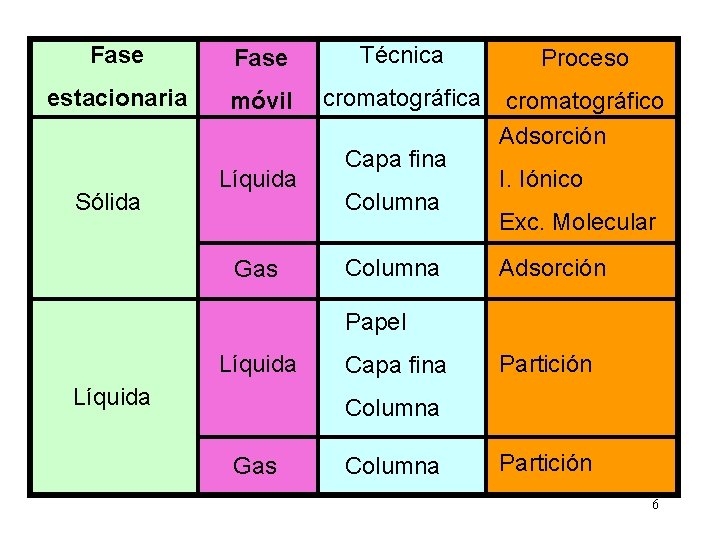
Fase Técnica Proceso estacionaria móvil cromatográfica cromatográfico Adsorción Sólida Líquida Gas Capa fina Columna I. Iónico Exc. Molecular Adsorción Papel Líquida Capa fina Partición Columna Gas Columna Partición 6

(cromatografía líquida) (cromatografía de capa fina o sobre papel) CROMATOGRAFIA SOBRE COLUMNA 7

8

9

Análisis cualitativo cromatográfico Los parámetros cromatográficos que se utilizan en el análisis cualitativo son dos: tiempo de retención(t. R) y volumen de retención (v. R) Procedimiento: ambos parámetros han de ser comparados con los de una sustancia patrón Inconvenientes: No se tiene siempre certeza de que ambos parámetros sean reproducibles, ni aún manteniendo condiciones de trabajo constantes. Es preferible utilizar valores relativos, en vez de absolutos. Bajo condiciones de flujo de fase móvil Fc constante: 10

Tiempo de retención tiempo de retención ajustado = t’r = tr - tm retención relativa = = t’r 2 / t’r 1 11

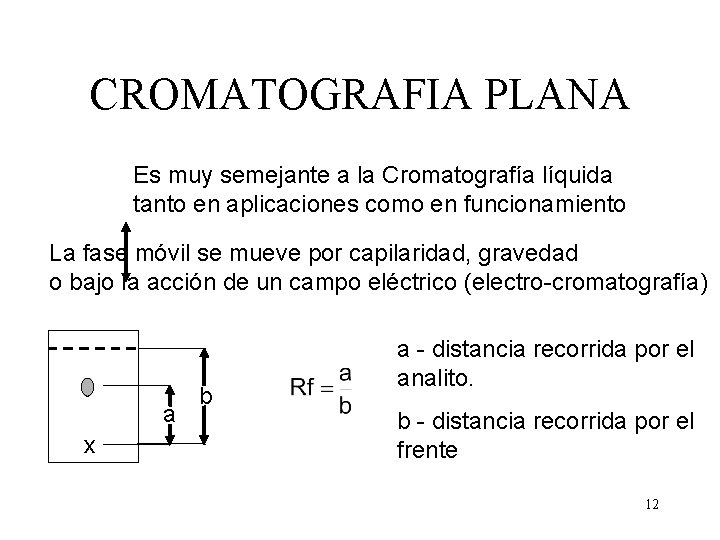
CROMATOGRAFIA PLANA Es muy semejante a la Cromatografía líquida tanto en aplicaciones como en funcionamiento La fase móvil se mueve por capilaridad, gravedad o bajo la acción de un campo eléctrico (electro-cromatografía) a x b a - distancia recorrida por el analito. b - distancia recorrida por el frente 12

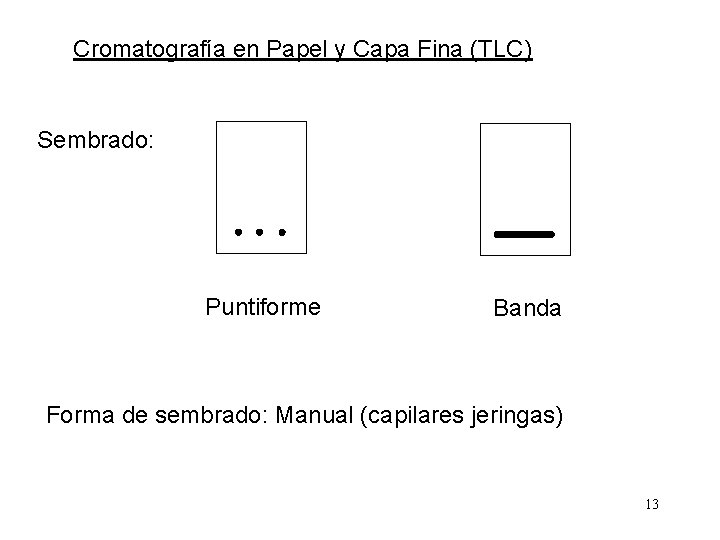
Cromatografía en Papel y Capa Fina (TLC) Sembrado: Puntiforme Banda Forma de sembrado: Manual (capilares jeringas) 13

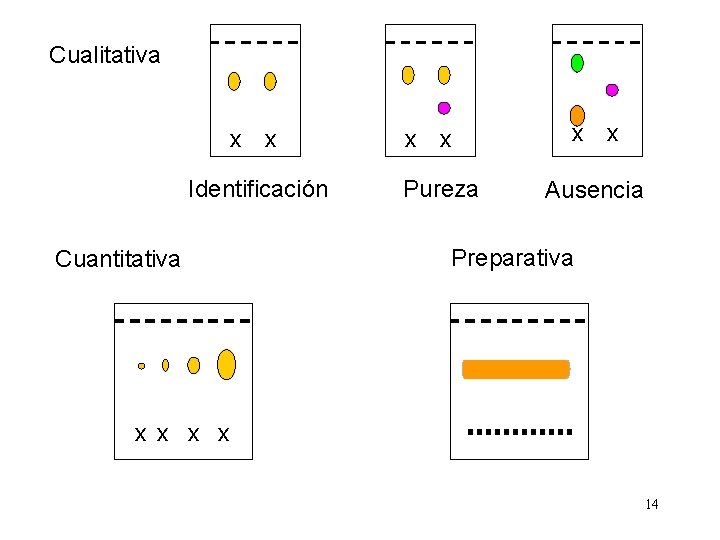
Cualitativa x x Identificación Cuantitativa x x Pureza x x Ausencia Preparativa x x 14

Fase Estacionaria (1): Partición: La fase estacionaria es líquida, sobre un soporte sólido inerte. 1 - Común (Agua) 2 - Reversa o Inversa (parafina) El papel contiene un 20 % de agua retenido aunque nosotros lo notemos seco, esa es la fase estacionaria. 15

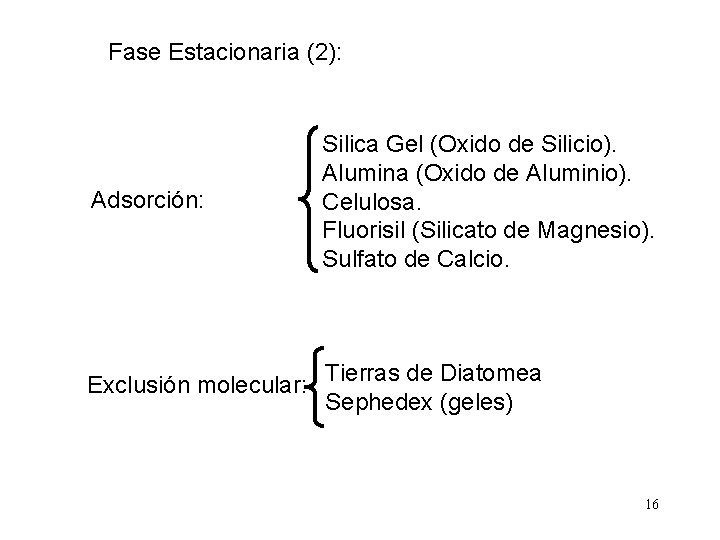
Fase Estacionaria (2): Adsorción: Silica Gel (Oxido de Silicio). Alumina (Oxido de Aluminio). Celulosa. Fluorisil (Silicato de Magnesio). Sulfato de Calcio. Exclusión molecular: Tierras de Diatomea Sephedex (geles) 16

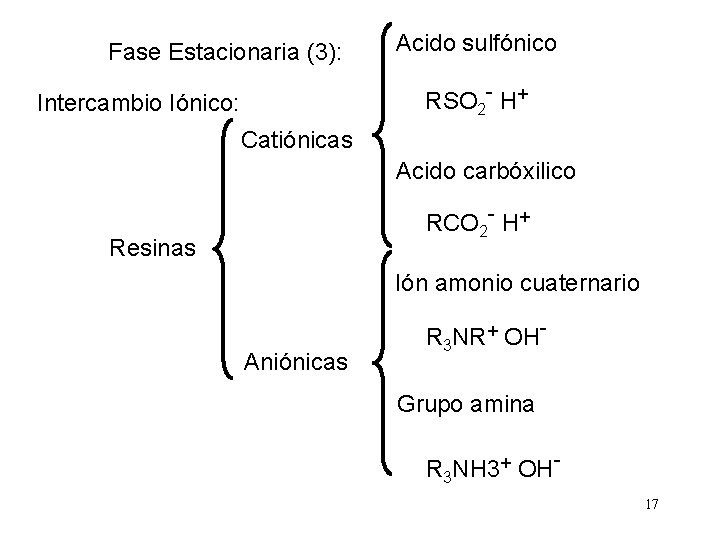
Fase Estacionaria (3): Acido sulfónico RSO 2 - H+ Intercambio Iónico: Catiónicas Acido carbóxilico RCO 2 - H+ Resinas Ión amonio cuaternario Aniónicas R 3 NR+ OHGrupo amina R 3 NH 3+ OH 17

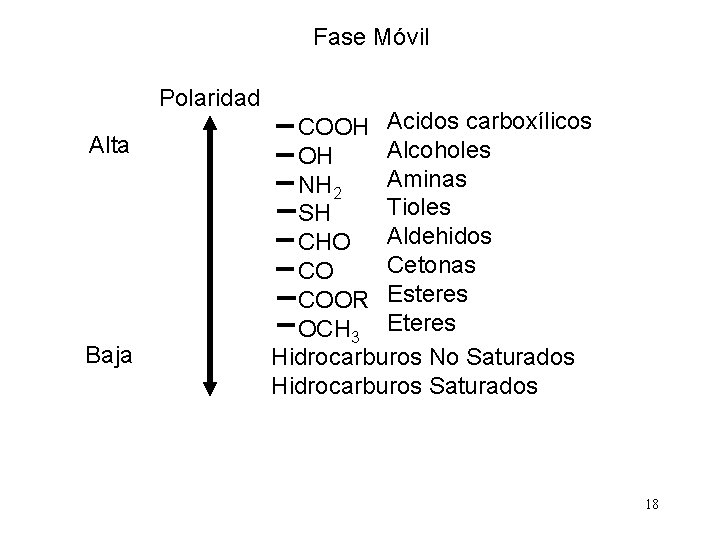
Fase Móvil Polaridad Alta Baja COOH Acidos carboxílicos Alcoholes OH Aminas NH 2 Tioles SH CHO Aldehidos Cetonas CO COOR Esteres OCH 3 Eteres Hidrocarburos No Saturados Hidrocarburos Saturados 18

Cromatografía de capa fina (1) 19

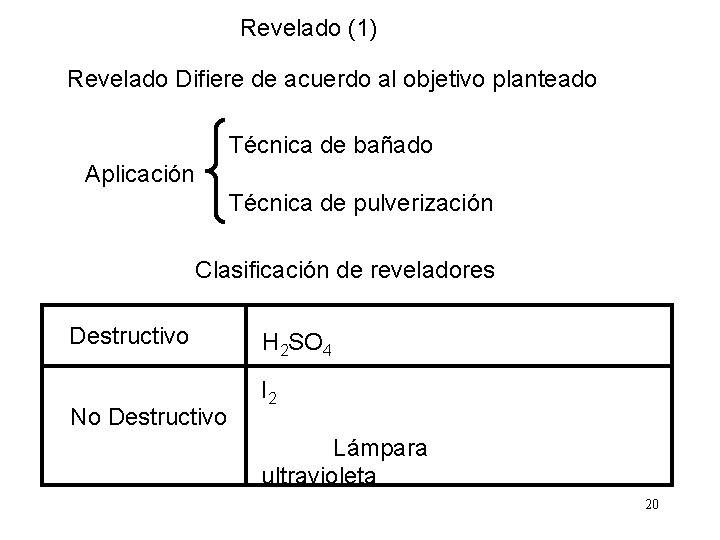
Revelado (1) Revelado Difiere de acuerdo al objetivo planteado Técnica de bañado Aplicación Técnica de pulverización Clasificación de reveladores Destructivo No Destructivo H 2 SO 4 I 2 Lámpara ultravioleta 20

Revelado (2) Generales H 2 SO 4 Lámpara ultravioleta Selectivo I 2 Ftalato de anilina (azúcares) Específico Ninhidrina (Amino-ácidos) Resorcina (Cetosas) Difenilamina + U. V. 254 (I. Clorados) 21

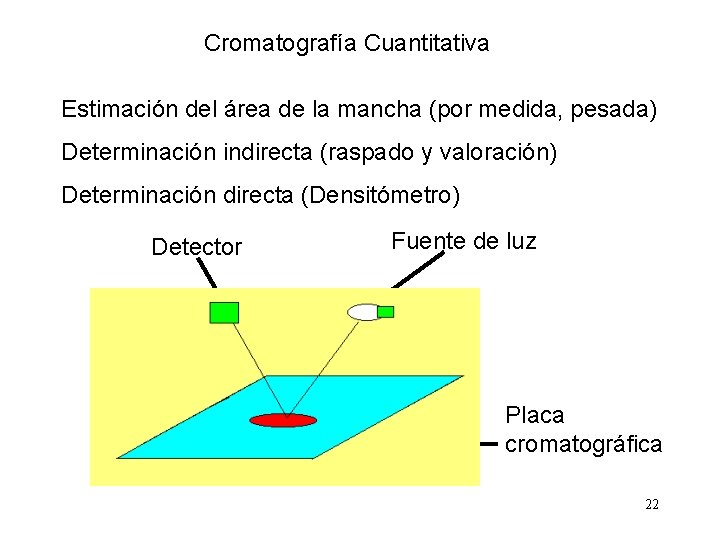
Cromatografía Cuantitativa Estimación del área de la mancha (por medida, pesada) Determinación indirecta (raspado y valoración) Determinación directa (Densitómetro) Detector Fuente de luz Placa cromatográfica 22

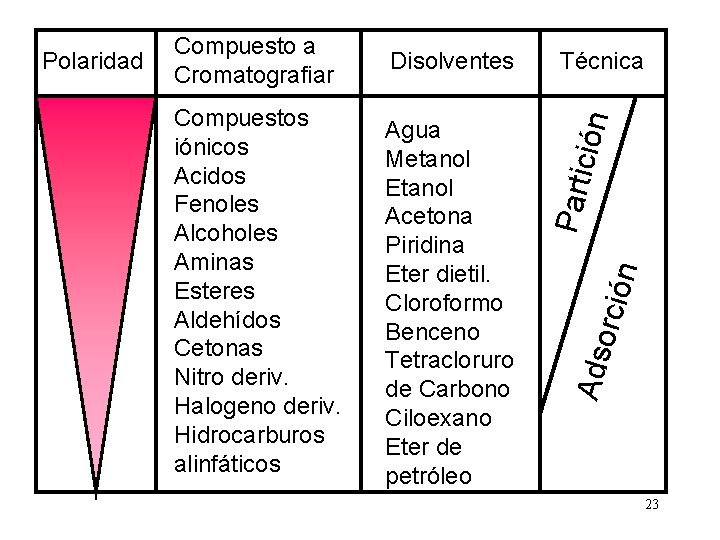
n Agua Metanol Etanol Acetona Piridina Eter dietil. Cloroformo Benceno Tetracloruro de Carbono Ciloexano Eter de petróleo orció Compuestos iónicos Acidos Fenoles Alcoholes Aminas Esteres Aldehídos Cetonas Nitro deriv. Halogeno deriv. Hidrocarburos alinfáticos Técnica Ads Disolventes Parti ción Polaridad Compuesto a Cromatografiar 23

Cromatografía Sobre Columna • Cromatografía Gas- Líquido • Cromatografía Líquida de Alta Resolución (HPLC) 24

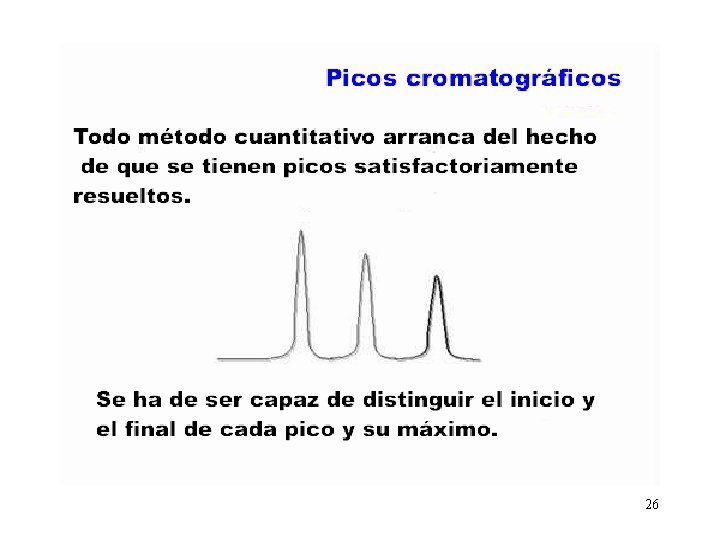
Fundamento Todo el proceso de separación acontece en la columna A la salida de la columna existe un detector que detecta cada componente eluído La respuesta adopta la forma de un pico mas o menos Gaussiano. La separación es tanto mas eficaz cuanto mas resueltos aparezcan los picos. 25

26

27

28

29

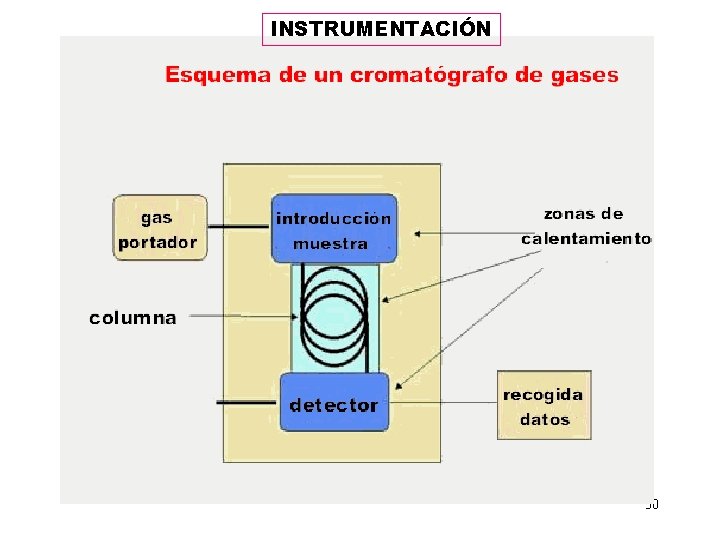
INSTRUMENTACIÓN 30

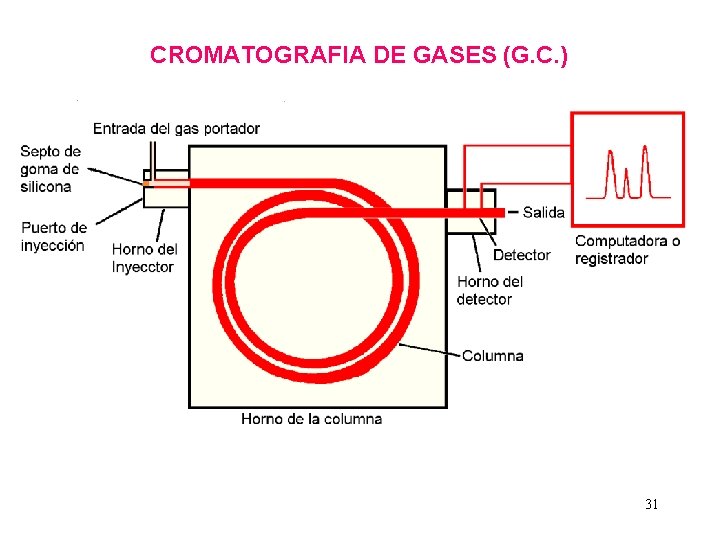
CROMATOGRAFIA DE GASES (G. C. ) 31

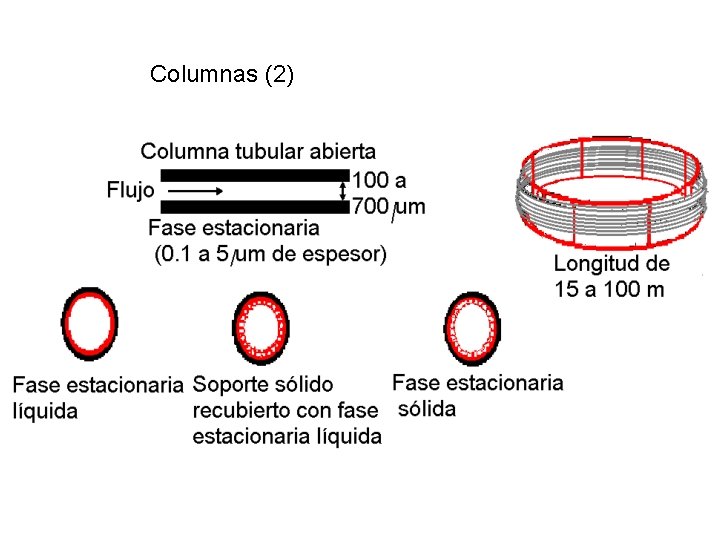
Columnas (1) Columnas empacadas Son de acero inoxidable o vidrio, tienen un diámetro de 3 a 6 mm y una longitud de 1 a 5 m. Se rellenan con la fase estacionaria sólida o un soporte inerte recubierto con la fase estacionaria Columnas tubulares abiertas o capilares Son de sílice fundida, son mucho más finas y mas largas que las empaquetadas. Tienen mayor resolución y sensibilidad. Tienen menor tiempo de análisis y se maneja menor cantidad de muestra 32

Columnas (2) 33

Gases Portadores La elección de la fase móvil influye en el funcionamiento de la columna y el detector. Los gases más utilizados son: H 2, He y N 2. Los flujos son distintos, mientras que el de N 2 es 10 cm/s, el H 2 y el He pueden utilizarse a un flujo mayor. Por lo tanto se debe mantener el el flujo del gas portador a una velocidad constante. 34

Inyección de la muestra (1) La muestra se inyecta con un jeringa a través de un septum de goma y se vaporiza. Generalmente 0. 1 a 10 L. Se controla la temperatura del horno de inyección. Para columnas tubulares se usan puertos de inyección más elaborados pues no pueden manejarse muestras tan grande. La inyección se fracciona: Sólo el 0. 1 a 10 % del volumen de 0. 1 a 2 L de muestra inyectada llega a la columna; el resto se elimina. 35

36

37

(CG) Ejemplos: Conductividad térmica ( general-no destructivo) Ionización en llama (destructivo) Captura electrónica (específico-no destructivo) 38

Detector de Conductividad Térmica (1) 39

Detector de Conductividad Térmica (2) Consiste en un filamento caliente de tungsteno. La resistencia eléctrica del filamento aumenta con su temperatura. Cuando de la columna emerge un soluto, la conductividad térmica de la corriente de gas disminuye, de modo que el filamento se enfría, baja la resistencia y se observa un cambio en la señal de salida. 40

Detector de Conductividad Térmica (3) 1 - Responde linealmente en cuarto órdenes de magnitud de concentración del soluto. 2 - El H 2 y He producen la mayor sensibilidad. Por ser los gases con mayor conductividad térmica. 3 - Para aumentar la sensibilidad: a- Se eleva la corriente del filamento b- Se reduce el gasto en el detector c- Se reduce la temperatura en el cuerpo del detector 41

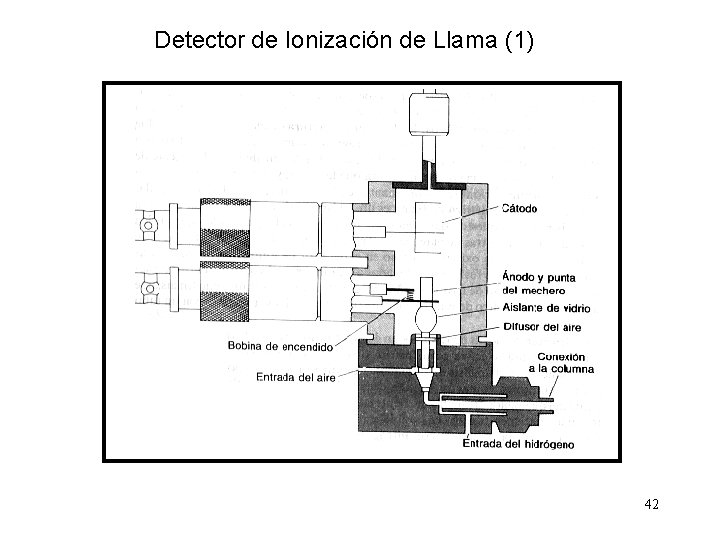
Detector de Ionización de Llama (1) 42

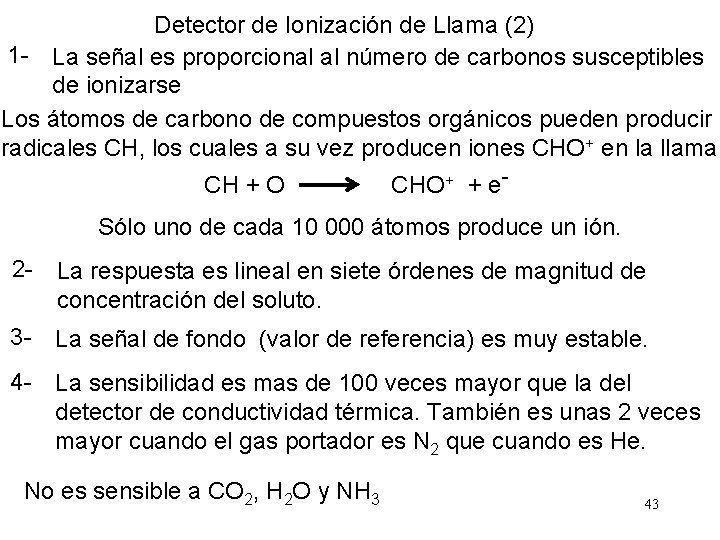
Detector de Ionización de Llama (2) 1 - La señal es proporcional al número de carbonos susceptibles de ionizarse Los átomos de carbono de compuestos orgánicos pueden producir radicales CH, los cuales a su vez producen iones CHO+ en la llama CH + O CHO+ + e- Sólo uno de cada 10 000 átomos produce un ión. 2 - La respuesta es lineal en siete órdenes de magnitud de concentración del soluto. 3 - La señal de fondo (valor de referencia) es muy estable. 4 - La sensibilidad es mas de 100 veces mayor que la del detector de conductividad térmica. También es unas 2 veces mayor cuando el gas portador es N 2 que cuando es He. No es sensible a CO 2, H 2 O y NH 3 43

Otros detectores (1): Detector de captura de electrones: El N 2 que entra al detector es ionizado por electrones de alta energía (rayos ) que se emiten de una lámina delgada que contiene 63 Ni o 3 H. Se produce una corriente hacia el ánodo constante. Cuando llega una molécula de analito con alta afinidad electrónica, capturan algunos de los electrones y la corriente hacia el ánodo disminuye. Es especialmente sensible a moléculas que contienen halógenos, grupos carbonilo conjugados, grupos nitrilo, compuestos nitro y compuestos organometálicos. No es sensible a hidrocarburos, alcoholes y cetonas. 44

Otros detectores (2): Detector fotométrico de llama Es un fotómetro de emisión óptica, útil para el análisis de compuestos que contienen fósforo (536 nm) y azufre (394 nm). Espectrofotómetros de masa Espectrofotómetros de infrarrojo de transformada de Fourier 45

Métodos Analíticos (1) Análisis Cualitativo Comparar el tiempo de retención del pico del problema con el de un patrón. Se agrega al problema una muestra conocida. Si el tiempo de retención es idéntico al de un componente del problema, el área de ese pico aumentará. Se debe identificar en dos o más tipos de columnas. 46

Métodos Analíticos (2) Análisis Cuantitativo El área de un pico es proporcional a la cantidad de ese componente. 1 - Los cromatógrafos modernos tienen integradores y computadoras que calculan las áreas 2 - Planímetro. 3 - Para un pico gaussiano, el producto de la altura por el ancho medido a la altura media es igual al 84 % del área total 4 - Puede dibujarse un triángulo con dos lados tangentes a los puntos de inflexión en cada lado del pico. El área es 96 % del área de un pico gaussiano. 47

Métodos Analíticos (3) Cómo los detectores no responden de la misma manera a todos los solutos, debe medirse un factor de respuesta empírico F Concentración del soluto Área del soluto =F Concentración del patrón Área del patrón 48

INSTRUMENTACIÓN 49

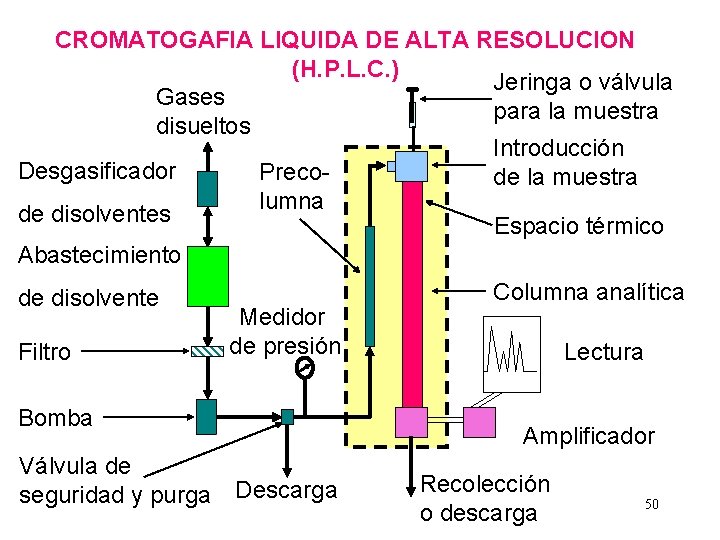
CROMATOGAFIA LIQUIDA DE ALTA RESOLUCION (H. P. L. C. ) Jeringa o válvula Gases para la muestra disueltos Introducción Desgasificador Precode la muestra lumna de disolventes Espacio térmico Abastecimiento de disolvente Filtro Medidor de presión Bomba Válvula de seguridad y purga Descarga Columna analítica Lectura Amplificador Recolección o descarga 50

Fase estacionaria Todos los tipos de cromatografía pueden realizarse en el modo de alta resolución. Un soporte común es el partículas microporosas de sílice con diámetro de 5 a 10 m. 51

Disolventes Los disolventes utilizados deben ser muy puros. Se puede utilizar un solo disolvente (elección isocrática). Se puede cambiar un solo disolvente por otro luego de un tiempo apropiado. Se puede cambiar continuamente de composición del disolvente (elección por gradiente). 52

Bombas La calidad de una bomba es determinada por el grado de estabilidad y reproducibilidad del flujo que genera Se trabaja hasta 10 m. L/min a presiones hasta de 40 Mpa (400 atm) 53

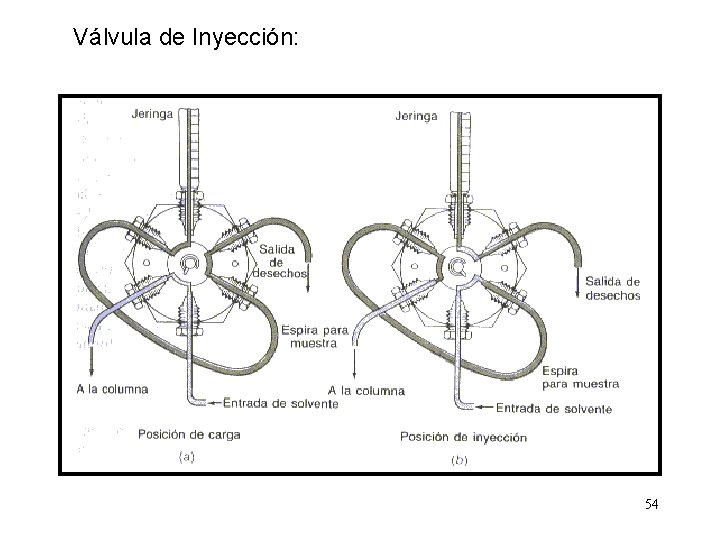
Válvula de Inyección: 54

HPLC (Detector de índice de refracción) 55

Detector Ultravioleta (1) Celda de flujo: 0. 5 cm de camino óptico y 10 L de capacidad 56

Detector Ultravioleta (2) Es el detector más utilizado, porque muchos solutos absorben dicha radiación y es bastante sensible a ella El sistema más simple emplea la emisión a 254 nm de una lámpara de mercurio y detección a una sola longitud de onda. También se utilizan una lámpara de deuterio y un monocromador para mediciones a longitud de onda variable. El intervalo lineal comprende cinco órdenes de magnitud de concentración de soluto 57

Detector de Índice de Refracción Es casi universal, responde a casi cualquier soluto. La sensibilidad es unas mil veces menor que la de un detector ultravioleta, y no es útil en gradiente. Detector Electroquímico Es bastante selectivo, porque sólo cientos analitos se oxidan o se reducen con facilidad. Pueden detectarse por oxidación: fenoles, aminas aromáticas, peróxido y mercaptanos. Y por reducción: cetonas, aldehidos y nitrilos. 58

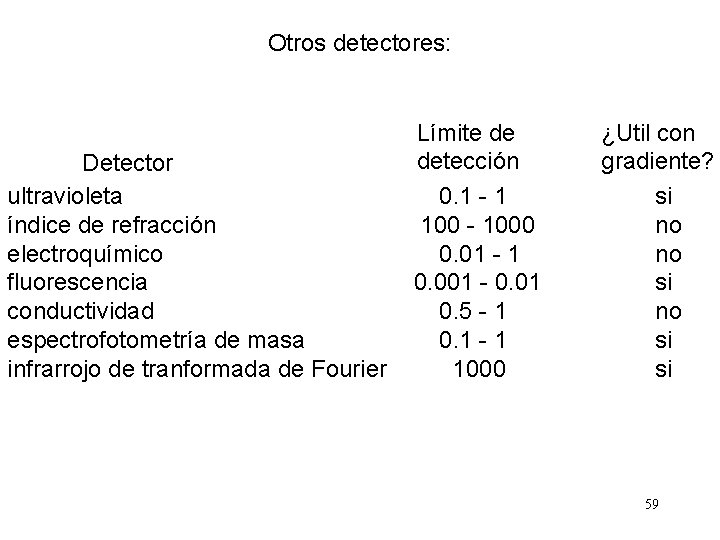
Otros detectores: Detector ultravioleta índice de refracción electroquímico fluorescencia conductividad espectrofotometría de masa infrarrojo de tranformada de Fourier Límite de detección 0. 1 - 1 100 - 1000 0. 01 - 1 0. 001 - 0. 01 0. 5 - 1 0. 1 - 1 1000 ¿Util con gradiente? si no no si si 59

CROMATOGRAFÍA LÍQUIDA vs CROMATOGRAFIA DE GASES Son al día de hoy dos poderosísimas herramientas de análisis Ambas admiten acoplamiento con otras técnicas de detección (hibridación de técnicas, por ejemplo con espectrometría de masas o plasmas. . etc) La cromatografía de gases, requiere muestras gaseosas o fácilmente volatilizables. El resto de muestras que no poseen esas características pueden ser analizadas por HPLC. Ambas técnicas por su versatilidad, y por las diversas posibilidades que ofrece la selección de la columna cromatográfica, permiten abordar análisis de multicomponentes en muestras de diversa procedencia, con elevada precisión y sensibilidad (dependiendo del detector). 60

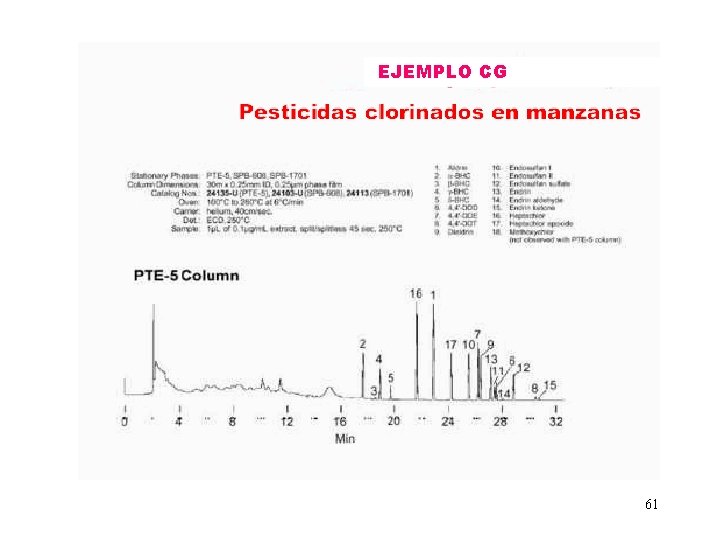
EJEMPLO CG 61
 Extraccin
Extraccin Los fluidos
Los fluidos Extraccin
Extraccin Condensación precipitación escurrimiento y evaporación
Condensación precipitación escurrimiento y evaporación Precipitacin
Precipitacin Precipitacin
Precipitacin Elaine ahumada
Elaine ahumada Clasificacion de los aceros
Clasificacion de los aceros Clasificacion de deuda publica
Clasificacion de deuda publica Marco legal de una empresa
Marco legal de una empresa Robert montal
Robert montal Clasificacin de empresas
Clasificacin de empresas Clasificacin de los animales
Clasificacin de los animales Clasificacin
Clasificacin Séptima generación de computadoras
Séptima generación de computadoras Los animales ppt
Los animales ppt A diversidade nas técnicas teatrais
A diversidade nas técnicas teatrais Técnicas de pregação
Técnicas de pregação Asertividad y manejo de conflictos
Asertividad y manejo de conflictos Tecnicas de amostragem
Tecnicas de amostragem Tecnica de evaluacion ejemplos
Tecnica de evaluacion ejemplos Tecnicas de conteo probabilidad
Tecnicas de conteo probabilidad Tecnicas de trabajo en equipo
Tecnicas de trabajo en equipo Tecnicas cooperativas simples
Tecnicas cooperativas simples Principio aditivo y multiplicativo
Principio aditivo y multiplicativo Modelo abcde de albert ellis
Modelo abcde de albert ellis Inventario de competencias cardinales
Inventario de competencias cardinales Técnicas narrativas contemporáneas
Técnicas narrativas contemporáneas Que son los planos tisulares
Que son los planos tisulares Técnicas escriptográficas
Técnicas escriptográficas Técnicas de cifrado
Técnicas de cifrado Campo aseptico
Campo aseptico Vendajes recurrentes
Vendajes recurrentes Aclaramiento en histologia
Aclaramiento en histologia Tecnicas de intervención psicopedagógica
Tecnicas de intervención psicopedagógica Tecnicas racionales
Tecnicas racionales Imágenes de técnicas de relajación
Imágenes de técnicas de relajación Mapa de ideas ejemplo
Mapa de ideas ejemplo Cuadro sinoptico de diseño de investigacion
Cuadro sinoptico de diseño de investigacion Terapia racional emotiva técnicas
Terapia racional emotiva técnicas Tecnicas de conteo
Tecnicas de conteo Técnicas de pesquisa quantitativa
Técnicas de pesquisa quantitativa Son técnicas del modelo cíclico del do.
Son técnicas del modelo cíclico del do. Técnicas de negóciação pdf
Técnicas de negóciação pdf Escuelas tecnicas raggio
Escuelas tecnicas raggio Les gusta probar ideas teorías y técnicas nuevas
Les gusta probar ideas teorías y técnicas nuevas Fisica mediciones y vectores
Fisica mediciones y vectores Tecnicas dinamicas
Tecnicas dinamicas Anacronía racconto
Anacronía racconto Un principio
Un principio Tecnicas de inmovilizacion
Tecnicas de inmovilizacion Tecnicas de comunicacion eficaz
Tecnicas de comunicacion eficaz Mediante tecnicas bioquimicas un biologo celular determino
Mediante tecnicas bioquimicas un biologo celular determino Probabilidad con técnicas de conteo: axiomas, teoremas.
Probabilidad con técnicas de conteo: axiomas, teoremas. Tecnicas del pop art
Tecnicas del pop art Tecnicas oculares de auditoria
Tecnicas oculares de auditoria Concepto de lectura intensiva
Concepto de lectura intensiva Clasificacion de las tecnicas proyectivas
Clasificacion de las tecnicas proyectivas Cuestionario de hábitos y técnicas de estudio
Cuestionario de hábitos y técnicas de estudio Colaboracion defensa portero balonmano
Colaboracion defensa portero balonmano 212 instalaciones tecnicas ejemplos
212 instalaciones tecnicas ejemplos Tecnicas de recuento microbiano
Tecnicas de recuento microbiano