Systmes Nationaux de Rglementation Pharmaceutique DIU Gestion des














































































- Slides: 89

Systèmes Nationaux de Réglementation Pharmaceutique DIU Gestion des approvisionnements 12 Février 2013 Alain PRAT, Conseiller technique, QSM/EMP/HSS

Contenu de la présentation l Introduction et rappel de quelques éléments de droit pharmaceutique l La réglementation du cycle de vie l La machinerie institutionnelle et les autorités en charge 2 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La dure réalité l Pakistan – Janvier 2012 – 120 morts, 400 hospitalisés – Confusion entre deux substances actives au cours de la fabrication – Pyrimethamine (ES: allongement de l’interval QTc) (au lieu de Isosorbide mononitrate : Traitement de l’angine de poitrine) 3 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les sources du droit pharmaceutique l Les sources internationales – Les actes juridiques de l'OMS – Le droit communautaire de l'UEMOA • Réglements • Directives • Décisions – Le droit communautaire de la CEDEAO • Décisions • Actes additionnels 4 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les sources du droit pharmaceutique l Les sources nationales – Constitution – Lois & Réglements (santé, douanes, propriété intellectuelle) – Circulaires administratives – Lignes directrices, guides de Bonnes Pratiques – Codes de conduite (Code de déontologie) 5 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les sources du droit pharmaceutique l Jurisprudence Droit pharmaceutique est un droit pénal –Ensemble des décisions prises par les différents tribunaux relativement à un problème juridique, qui permettent d'en déduire des principes de droit, qui servent de référence pour d'autres jugements 6 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La Pharmacopée l La Pharmacopée est un ouvrage réglementaire destiné à être utilisé par les professionnels de santé l Les normes ainsi établies font autorité pour toute substance ou produit y figurant l Elle définit notamment – les critères de pureté des matières premières ou des préparations entrant dans la fabrication des médicaments – les méthodes d'analyses à utiliser pour en assurer leur contrôle – Les monographies sur les produits finis (Pharm. Brit. et Pharm. Inter. ) l L’ensemble des critères permettant d’assurer une qualité optimale est regroupé et publié sous forme de monographies l La coexistence de plusieurs pharmacopées nationale, régionale et internationale 7 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

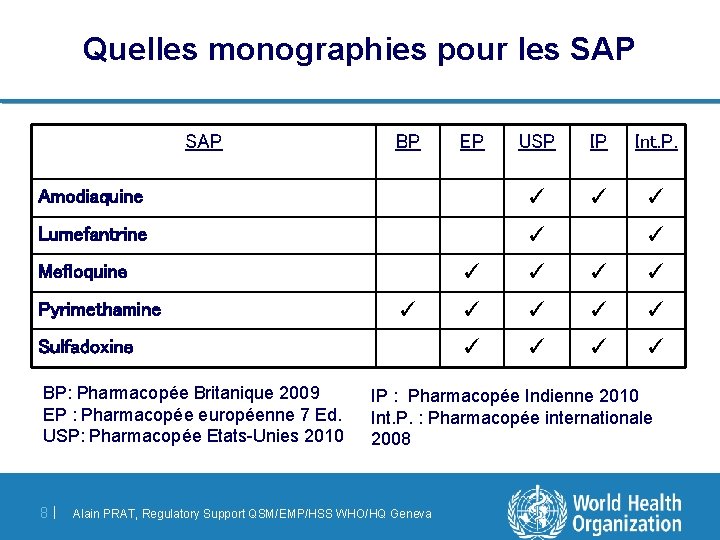
Quelles monographies pour les SAP BP USP IP Int. P. Amodiaquine ✓ ✓ ✓ Lumefantrine ✓ Mefloquine Pyrimethamine ✓ Sulfadoxine BP: Pharmacopée Britanique 2009 EP : Pharmacopée européenne 7 Ed. USP: Pharmacopée Etats-Unies 2010 8 | EP ✓ ✓ ✓ ✓ IP : Pharmacopée Indienne 2010 Int. P. : Pharmacopée internationale 2008 Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

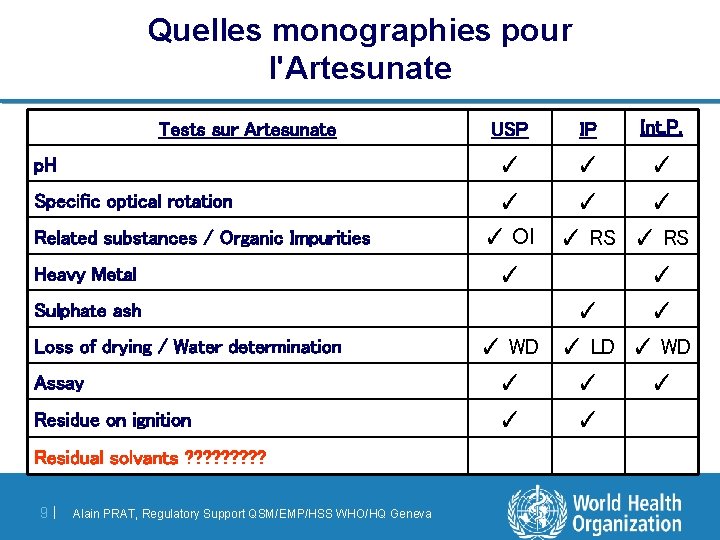
Quelles monographies pour l'Artesunate USP IP Int. P. p. H ✓ ✓ ✓ Specific optical rotation ✓ ✓ ✓ Tests sur Artesunate Related substances / Organic Impurities Heavy Metal ✓ OI ✓ ✓ ✓ Sulphate ash Loss of drying / Water determination ✓ RS ✓ WD ✓ LD ✓ WD Assay ✓ ✓ Residue on ignition ✓ ✓ Residual solvants ? ? ? ? ? 9 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva ✓ ✓

La définition du médicament "On entend par médicament toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l'égard des maladies humaines ou animales, ainsi que toute substance ou composition pouvant être utilisée chez l'homme ou chez l'animal ou pouvant leur être administrée, en vue d'établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique" EU, Dir 2001/83 "substance ou composition présentée comme possédant des propriétés curatives ou préventives à l’égard des maladies humaines, ainsi que tout produit pouvant être administré à l’homme en vue d’établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions organiques" UEMOA, Reg. 06 2010 10 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La définition du médicament l Des éléments additionnels "Les produits suivants ne sont pas considérés comme des médicaments" "En cas de doute, considéré comme médicaments" 11 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les éléments de la définition du médicament l La noton de médicament par présentation – le produit est produit présenté comme possédant des propriétés curatives ou préventives au moyen d'étiquettes, de notices, de présentations orales mais également de manière implicite (posologie, indications, …) l Le médicament par fonction – entendue de manière suffisamment large afin d'inclure les produits qui ont un effet réel sur les fonctions organiques (effet pharmacologique) l La notion de mode d'action pharmacologique, immunologique ou métabolique (exclusion des DM) 12 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La définition du médicament l Produits présentés comme cosmétiques mais dont la composition fait état de substances thérapeutiques actives l Produits diététiques associés à des indications thérapeutiques 13 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les différentes catégories de médicaments l Classification en fonction du mode de production – les médicaments magistraux • préparé extemporanément à l'officine – les médicaments officinaux • médicaments inscrits à la Pharmacopée française ou au Formulaire national – les médicaments spécialisés • tout médicament préparé à l'avance, présenté sous un conditionnement particulier et caractérisé par une dénomination spéciale – Les préparations hospitalières 14 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les différentes catégories de médicaments l Classification en fonction du mode de dispension – les médicaments à prescription restreinte • Utilisation hospitalière • Prescription initiale hospitalière • Prescription par un médecin specialise – les médicaments a prescription médicale – les médicaments sans prescription 15 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les différentes catégories de médicaments l Classification en fonction de la nature – – – 16 | Médicaments biologiques Médicaments immunologiques Médicaments dérivés du sang ou du plasma Médicaments radiopharmaceutiques Médicaments homéopathiques Médicaments à base de plantes et médicaments traditionnels Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les différentes catégories de médicaments l Classification en fonction du régime réglementaire spécifique – – 17 | Médicaments génériques Médicaments orphelins (AMM pour les maladies rares) Médicaments pédiatriques (plan d'investigation pédiatrique) Médicament avec autorisation temporaire d'utilisation (nominative ou de cohorte) • Pour des maladies graves ou rares, • Pas de traitement approprié existant, • Efficacité et sécurité présumées en l'état des connaissances Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les différentes catégories de médicaments l Cas des produits frontières – Décision au cas par l'autorité E -TRANS® (fentanyl HCl) 18 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le monopole pharmaceutique l Repose sur l'idée de sauvegarde du malade – Utilisateur de possédant pas toutes les connaissances pour aprécier la qualité – Fabrication, distribution réglementé et confié à des personnes possèdant un diplome spécifique: Pharmacien – Profession est soumise au contrôle de l'ordre des pharmacie, responsabilité disciplinaire – Exclusivité de la vente et de la fabrication dans des entreprises pharmaceutiques – Obligations plus sévères que celles des fabricants non pharmaceutiques 19 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le monopole pharmaceutique l Contenu au monopole – La préparation des médicaments destinés à l'usage de la médecine humaine ; – La préparation des objets de pansements et de tous articles présentés comme conformes à la pharmacopée – La vente en gros, la vente au détail et toute dispensation au public des médicaments, produits et objets mentionnés supra – La vente des plantes médicinales inscrites à la pharmacopée – La vente au détail et toute dispensation de dispositifs médicaux de diagnostic in vitro destinés à être utilisés par le public. 20 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le monopole pharmaceutique l Dérogations au monopole – Médicaments vétérinaires (vétérinaires), – Contraceptifs & appareils utilisés à des fins abortives (centre de planning familial), – Plantes et parties de plantes pour usage médical (herboristes), – …. 21 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

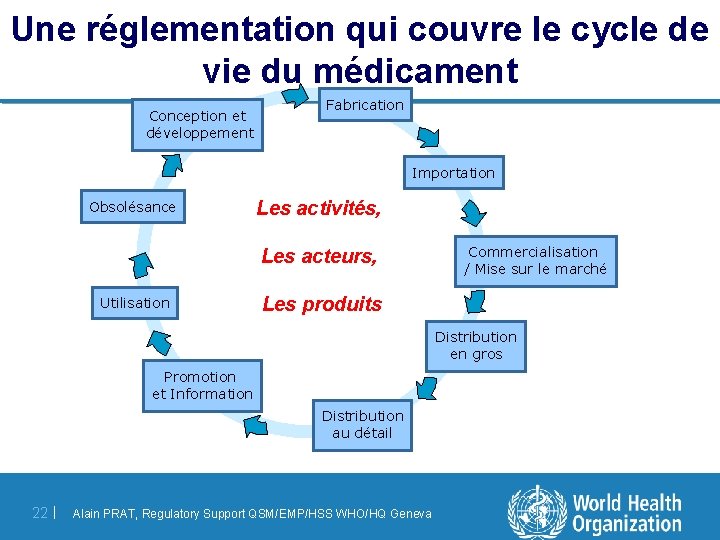
Une réglementation qui couvre le cycle de vie du médicament Conception et développement Fabrication Importation Obsolésance Les activités, Les acteurs, Utilisation Commercialisation / Mise sur le marché Les produits Distribution en gros Promotion et Information Distribution au détail 22 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La conception et le développement Source: Leem 23 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La conception et le développement l Les études non-cliniques – L'autorisation des lieux d'essais – Le respect des bonnes pratiques de laboratoire (d'essai) 24 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La conception et le développement l Les études cliniques – L'autorisation des lieux d'essais (locaux, matériel, personnel) – L'autorisation des essais proprement dits (protocole, formulaires, . . ) • L’autorisation par l’ANRP • L’autorisation par le comité d’Ethique – L'autorisation des produits pour investigations • Le dossier qualité – L'autorisation des fabricants, des importateurs et des distributeurs de produits pour essai – L'autorisation d'importation des produits – Le respect des bonnes pratiques applicables (éthiques, cliniques, BPF) – Les obligations de vigilance 25 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le développement industriel l Les obligations nouvelles relatives au developpement industriel du medicament sont décrites dans des lignes directrices sur le développement pharmaceutique – – 26 | Caractéristiques de la Substance active pharmaceutique Choix de la formulation (choix des excipients) Choix du contenant Choix du procédé de fabrication Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La fabrication et l'importation l L'autorisation des établissements de production, de conditionnement, de contrôle et d'importation – Le respect des exigences propres aux locaux, personnels, procédures, flux … – Les obligations relatives aux dirigeants – Les obligations relatives aux personnels pharmaceutiques – Les obligations de tracabilité – La notion de dossier d'état des lieux – L'obligation de se soumettre aux contrôles et inspections l Etablissements de fabrication des SAP et des FPP 27 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La fabrication l Le respect des bonnes pratiques de fabrication – – Personnel Locaux Matériel Documentation – De nouvelles lignes directrices sur les systèmes de gestion de la qualité des établissements de fabrication • Cycle de vie du produit: qualité dans la conception du produit/procédé • Amélioration continue • Introduction des principes de gestion des risques 28 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La fabrication l Le contenu d’une autorisation de fabrication – – La référence à une demande Le nom du demandeur L’emplacement exact des locaux Les activités autorisées • Production, contrôle, conditionnement, stérilisation, … – Les formes pharmaceutiques • Solides, liquides/pâteux • Injectables – Le responsable des opérations pharmaceutiques – Les obligations / engagements 29 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La mise sur le marché l La première mise à disposition à titre onéreux ou gratuit 30 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

L'autorisation de mise sur le marché (AMM) l Notion d'autorisation de mise sur le marché préalable à la commercialisation – Le dossier de demande d'AMM démontrant la qualité, sécurité et l'efficacité – Le contenu de la demande d'AMM • Les cinq modules – Information administrative – Résumés du CTD – Qualité – Rapports des études non-cliniques – Rapports des études cliniques – Le format (CTD) et les procédures à suivre – L'attribution de cette autorisation à une personne désignée (physique ou morale), liées à certaines conditions à satisfaire, ppour une durée déterminée 31 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les lignes directrices l La nécessité de compléter la réglementation par des lignes directrices spécifiques – – sur la qualité, sur la sécurité sur l’efficacité du produit Sur l’information relative aux produits l Les éléments annexes: – Liste des produits de comparaison pour les génériques – Liste des pharmacopées reconnues 32 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

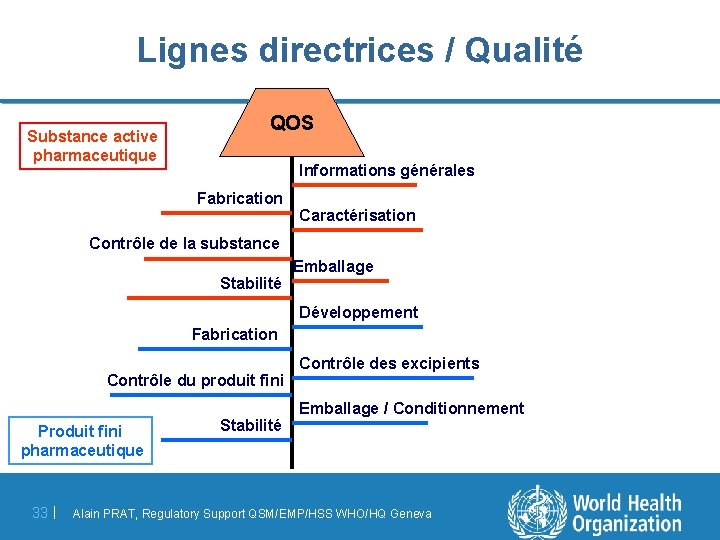
Lignes directrices / Qualité Substance active pharmaceutique QOS Informations générales Fabrication Caractérisation Contrôle de la substance Stabilité Emballage Développement Fabrication Contrôle du produit fini Produit fini pharmaceutique 33 | Stabilité Contrôle des excipients Emballage / Conditionnement Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les exigences spécifiques relatives à la présentation l L'étiquetage, l'emballage extérieur et le conditionnement primaire – Les mentions obligatoires et facultatives l La notice pour le patient – Les mentions obligatoires l La notice pour les professionels de santé Toujours sur la base du Résumé des Caractéristiques du Produit (RCP) approuvé 34 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

L'autorisation de mise sur le marché (AMM) l Cas particuliers: Le médicament générique – la même quantité – du ou des même(s) principe(s) actif(s) sous la même forme galénique, s'ils satisfont à des – Des normes identiques ou comparables et s'ils sont destinés à être administrés par la même voie. – La dérogation à la démonstration de la sécurité et de l'efficacité si bioéquivalence démontrée par des études appropriées – Cas de dérogation de la démonstration de la BE par des dissolutions comparatives l Cas particuliers: La combinaison de SAP autorisées 35 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

L'autorisation de mise sur le marché (AMM) l Exceptions à l'obligation d'obtenir une AMM – L'usage compassionnel – Les programmes médicaux d'urgence 36 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

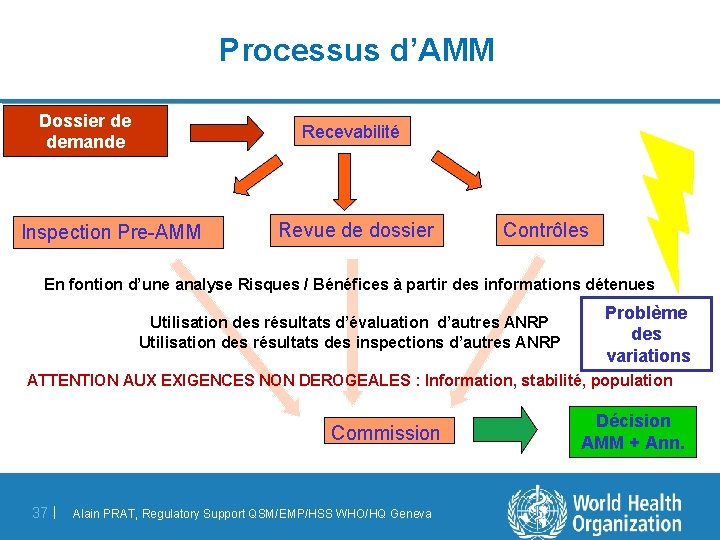
Processus d’AMM Dossier de demande Recevabilité Inspection Pre-AMM Revue de dossier Contrôles En fontion d’une analyse Risques / Bénéfices à partir des informations détenues Utilisation des résultats d’évaluation d’autres ANRP Utilisation des résultats des inspections d’autres ANRP Problème des variations ATTENTION AUX EXIGENCES NON DEROGEALES : Information, stabilité, population Commission 37 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva Décision AMM + Ann.

L'autorisation de mise sur le marché (AMM) l Le contenu d’une AMM – – – – 38 | La référence au dossier de demande Le nom du titulaire Le nom de la SAP, la forme pharmaceutique et la concentration L’identifiant unique La date de péremption de l’AMM Le résumé des caractéristiques du produit L’étiquetage primaire et secondaire Les engagements du titulaire Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

L'autorisation de mise sur le marché (AMM) l L'importance du résumé des caractéristique du produit 39 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

L'autorisation de mise sur le marché (AMM) l La déclaration de commercialisation effective l Les variations à l'autorisation initiale – L'extension d'AMM: nouvelle indications – La classification des modifications (majeure, mineure, nouveau médicament) • Remplacement ou ajout d’un site de fabrication (emballage extérieur, conditionnement primaire, production) – Les procédures applicables aux modifications • Exigences documentaires en fonction dur risque pour le produit l Le renouvellement, la suspension, le retrait 40 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La réglementation des importations l Les lieux identifiés d’entrée dans le pays – aéroport, poste frontière l Les catégories de produits – PFP, SAP, produits pour investigations, matériel promotionnel l Les produits autorisés ayant une AMM, autres autorisations l Les établissements autorisés pour importer l L’autorisation de l’acte d’importation en lui même l Les obligations de tracabilité 41 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La chaîne de distribution du médicament l Le distributeur en gros l La distribution au détail – L'officine – La Pharmacie à usage intérieure – La "Boutique de santé" l La mise à disposition par des personnes autorisés – Médecins, sages femmes, infirmières 42 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La chaîne de distribution du médicament l Les autorisation propres aux différents acteurs de la distribution – – – 43 | La définition des différents types d'activité Les conditions relatives à la propriété de l'établissement Les conditions relatives aux produits Les conditions relatives au personnel Les exigences relatives à la documentation Les conditions relatives aux locaux et aux équipements Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La chaîne de distribution du médicament l Les autorisation propres aux différents acteurs de la distribution – La procédure à suivre et les documents à fournir • L’intervention de l’ordre – Les bonnes pratiques applicables – Les exigences spécifiques du domaine • Identification & affichage, • présence du personnel qualifié, • Enregistrements • Obligations de service (garde, liste des produits, ) • Tracabilité des produits, . . – L’obligation de signifier l’ouverture effective, les modifications, 44 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La tracabilité l Les obligations relatives aux personnes – Approvisionnement auprès de personnes autorisées – Distribution aux établissements autorisés et aux personnes habilitées l Les obligations relatives aux documents à conserver – Factures – Bons de livraison l Les obligations relatives aux mentions – Le nom des produits, sources et destinataires, lot reçus et expédiés et quantités 45 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le reconditionnement l L'interdiction d'affecter défavorablement l'état originaire du produit l L'indication de l'identité de celui qui a reconditionné et fabriqué le produit l La présentation du produit reconditionné Une opération de fabrication ? ? ? 46 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La réglementation de la publicité La publicité est l’ «Action d’information et d’incitation menée qui vise à promouvoir, la prescription, la délivrance, la vente ou la consommation des produits pharmaceutiques. » 47 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La réglementation de la publicité l Les médias publicitaires recouvrent : • les annonces (presse, télévision), • les brochures, • les publications scientifiques ou médicales, • les mailings, • les affiches, • les présentoirs, 48 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La publicité au sens stricte l La distinction entre information et publicité / promotion l L'interdiction de certaine publicité – Certains produits : vendu sur ordonnance, non enregistrés – Certains publics : enfants l L’interdiction de certains mentions – Induire en erreur sur l’efficacité ou l’innocuité du produit l L’autorisation préalable des supports publicitaires – La publicité destinée au public (préalable) – La publicité destinée aux professionnels de la santé l Les procédures d'obtention des autorisation 49 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La promotion des médicaments l La gestion des professionnels de la promotion – Autorisation des agences de promotion – Autorisation des représentants • Les diplômes • Les formations – La place reconnue des codes de bonne conduite pour les industriels l Les limites données aux échantillons médicaux l Les questions controversées – Les informations relatives à l'entreprise 50 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le respect des engagements du titulaire l La mise en place d’un système de pharmacovigilance sous la responsabilité du titulaire l Les résultats des études de stabilité l Les résultats des plans de gestion des risques l Les résultats des études post-autorisations 51 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La pharmacovigilance l Les étapes du processus • • • La notification spontanée, rapport périodique actualisé (PSUR) Le recueil des signalements L'imputabilité : lien de cuasalité entre le produit et l’effet La réévaluation du rapport B/R Les décisions : information des professionnels, adaptation de la notice, adaptation des modalités de délivrance, suspension ou retrait de l’AMM l Les acteurs de la pharmacovigilance 52 | • Le titulaire de l'AMM • Les fabricants, importateurs et acteurs de la chaîne de distribution • Les professionnels de la santé • Les patients • Les autorités nationales Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le respect des engagements du titulaire l Le plans de gestion des risques – Description du profil de sécurité d’emploi du médicament prenant en compte les données pré/cliniques et cliniques – Plan de pharmacovigilance – Evaluation ou non d’activité de minimisation des risques – Plan de minimisation des risques – Programme d’éducation, d’information, modifications des modalités d’accès 53 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le plan de gestion des risques EPAR-Scientific discussion – Eurartesim : Dihydroartemisinine / Pipéraquine phosphate Risk management plan Risques identifiés Activitiés proposées Toxicité cardiaque PV : Suivi particuliers des EI relatifs aux aspects cardiaques Prolongation du QTc (sur la base des études sur animaux) 54 | Etude registre AMin. R: RCP contre-indications, précautions spéciales pour les patients à risque d’aryhtmie Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

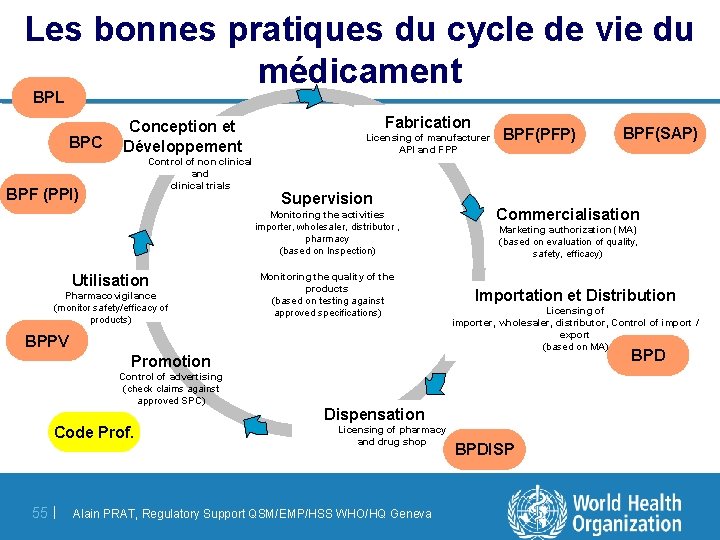
Les bonnes pratiques du cycle de vie du médicament BPL BPC Conception et Développement Control of non clinical and clinical trials BPF (PPI) Fabrication Licensing of manufacturer API and FPP Supervision Monitoring the activities importer, wholesaler, distributor , pharmacy (based on Inspection) Utilisation Pharmacovigilance (monitor safety/efficacy of products) Monitoring the quality of the products (based on testing against approved specifications) BPPV BPF(PFP) Commercialisation Marketing authorization (MA) (based on evaluation of quality, safety, efficacy) Importation et Distribution Licensing of importer, wholesaler, distributor, Control of import / export (based on MA) BPD Promotion Control of advertising (check claims against approved SPC) Code Prof. 55 | BPF(SAP) Dispensation Licensing of pharmacy and drug shop Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva BPDISP

Le choix de la machinerie institutionnelle l Il appartient en premier lieu au législateur l Les différentes responsabilités déterminées par la réglementation sont attribués à une ou plusieurs autorités – – – 56 | Autoriser les produits Autoriser les établissements Autoriser les professionnels Contrôler les produits Inspecter les établissements Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le choix de la machinerie institutionnelle l Les différentes responsabilités déterminées par la réglementation peuvent être déléguées au niveau national 57 | – Aux ordres professionnels • Enregistrement de certains professionnels, Action Disciplinaire – Aux associations professionnels • Charte des professionnels pour la promotion – A d'autres entités jugées plus compétentes dans des domaines spécifiques • Conseil nationaux d'Ethique – A d'autres ministères • Cas des pharmacies des hôpitaux Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le choix de la machinerie institutionnelle l Les différentes responsabilités déterminées par la réglementation peuvent être décentralisés au niveau régional ou local – Autorisation et inspection des pharmacies – Autorisation et inspection des "Boutiques de santé" 58 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

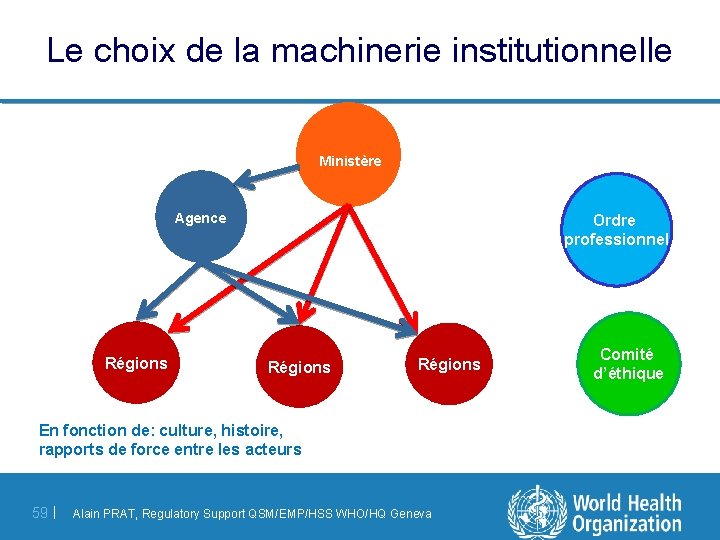
Le choix de la machinerie institutionnelle Ministère Agence Régions Ordre professionnel Régions En fonction de: culture, histoire, rapports de force entre les acteurs 59 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva Comité d’éthique

Le système national de réglementation pharmaceutique l L'arrangement institutionnel d'entité nationale et/ou régionale et/ou locale en charge de la mise en oeuvre et de la supervision de la réglementation pharmaceutique 60 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Le choix de la machinerie institutionnelle l Une grande tendance : La création d'Agence – La définition et le suivi de la politique est laissée au ministère – La mise en oeuvre est déléguée à des agence semiautonomes dans une logique de type managériale inspirée l'entreprise • Plus de flexibilité dans la gestion des ressources et des dépenses • Indépendance de l'expertise technique vav du politique • Amélioration des procédures administratives 61 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La réglementation propre aux autorités l Une base légale à partir d’un statut pré-existant (établissement public ou para-publique) l Les rôles, les responsabilités et les pouvoirs clairs l La mise à disposition des ressources humaines, matérielles et financières l Le respect des procédures réglementaires l Le respect des règles de bonne gouvernance (indépendance, impartialité, confidentialité. . ) l Les modalités de surveillance et pour rendre compte 62 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

L'importance du mode de gouvernance l La structure organisationnelle doit être adaptée aux termes de référence – Un directeur général et des directeurs adjoints avec leurs fonctions respectives – Des organes de gestion, d'orientation scientifique – Des organes de contrôle ou de supervision – L'établissements de commissions d’experts l Cette structure doit être adaptée mais aussi adaptable à l'environnement 63 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Base légale et système de gouvernance l définit ses principales ressources – – Le personnel mis à disposition, Le budget alloué, L'utilisation des taxes et redevances relevées au nom de l'état, Le recours à l’expertise externe, l définit ses responsabilités, ses pouvoirs (termes de référence) mais aussi ses obligations notamment les modalités pour rendre compte 64 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Termes de référence de l’autorité / 1 l Les activités de prestations de service réglementaire définis par les textes – – – – 65 | Autoriser les fabricants, les Importateurs et les distributeurs Autoriser les pharmacies et autres détaillants pharmaceutiques Autoriser le personnel pharmaceutique Homologuer les médicaments selon les différentes procédures Autoriser les importations et les exportations Autoriser les essais cliniques Autoriser la publicité et de la promotion Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Termes de référence de l’autorité / 2 l Les activités de supervision, de vérification du respect des dispositions par tous les acteurs – Contrôler la qualité des produits • Tester les médicaments dans des laboratoires de contrôle – Contrôler le respect des pratiques et obligations • Réaliser les inspections réglementaires – Suivre et traiter les signalements d'effets indésirables, les problèmes qualité – Prendre les dispositions et les décisions qui garantissent la sécurité sanitaire des populations 66 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Termes de référence de l’autorité / 3 l Proposer des amendements aux lois et réglements l Conseiller le ministre sur les futurs lois et réglements l Décider sur les problèmes de classification l Préparer et publier les guides d’interprétation, des lignes directrices l Collecter les redevances et les taxes l Disséminer l’information sur les produits et les établissements 67 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Board of Directors Mats Larson, Chairman Internal Audit Director-General Registration and Information Management Christina Åkerman IT Management Secretariat Strategic Planning Enrique Arias Finance and Budget Human Resources Eva-Britt Örtegren Legal Affairs Joakim Brandberg Support and Services Steve Thell Facilities and Services Security Procurement and Purchasing Communications Lars Dagerholt Communications Evaluation and Regulatory Administration Lena Björk Scientific and Regulatory Strategies Efficacy and Safety 1 Efficacy and Safety 2 Tomas Salmonson Efficacy and Safety 4 Pharma. Clinical Product Regulatory Herbal ceutics Pharmaco. Trials and Informa- Administra. Medicinal vigilance and Bio. Special tion Products technology Permissions Supervision and Scientific Information Gert Ragnarsson Medical Devices 68 | Efficacy and Safety 3 Official Supervision of Narcotics Rational Use Drug Medicines Cosmetics and Unauthorised of Medicines Inspectorate Control Medicinal Products Laboratory Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva Swedish Poisons Information Centre

69 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

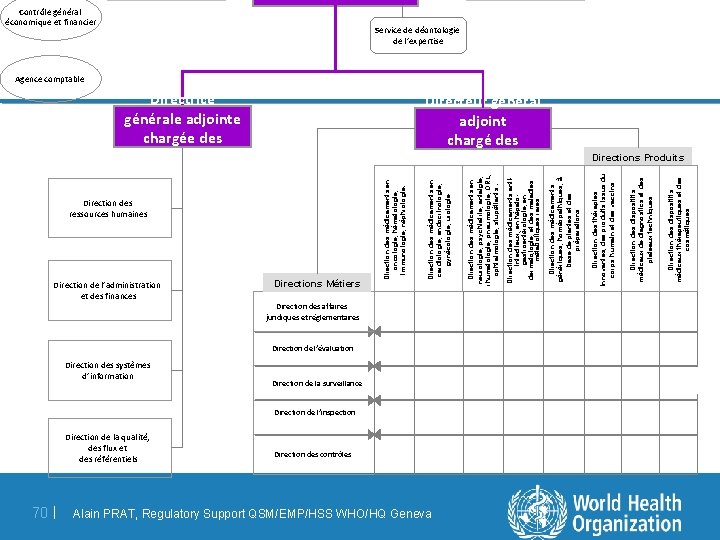
Direction des ressources humaines Direction de l’administration et des finances Direction des systèmes d’information Direction de la qualité, des flux et des référentiels 70 | Directions Métiers Direction des affaires juridiques et réglementaires Direction de l’évaluation Direction de la surveillance Direction de l’inspection Direction des contrôles Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva Direction des dispositifs médicaux thérapeutiques et des cosmétiques Direction des dispositifs médicaux de diagnostics et des plateaux techniques Directeur général adjoint chargé des opérations Direction des thérapies innovantes, des produits issus du corps humain et des vaccins Direction des médicaments génériques, homéopathiques, à base de plantes et des préparations Direction des médicaments antiinfectieux, en hépatogastroentérologie, en dermatologie, et des maladies métaboliques rares Direction des médicaments en neurologie, psychiatrie, antalgie, rhumatologie, pneumologie, ORL, ophtalmologie, stupéfiants. Directrice générale adjointe chargée des ressources Direction des médicaments en cardiologie, endocrinologie, gynécologie, urologie Direction des médicaments en oncologie, hématologie, immunologie, néphrologie. Contrôle général économique et financier Service de déontologie de l’expertise Agence comptable Directions Produits

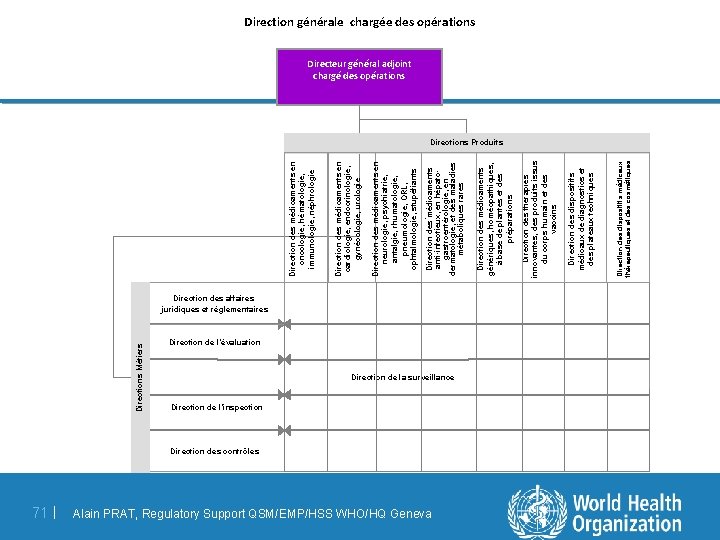
Directions Métiers 71 | Direction des affaires juridiques et réglementaires Direction de l’évaluation Direction de la surveillance Direction de l’inspection Direction des contrôles Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva Direction des dispositifs médicaux thérapeutiques et des cosmétiques Direction des dispositifs médicaux de diagnostics et des plateaux techniques Direction des thérapies innovantes, des produits issus du corps humain et des vaccins Direction des médicaments génériques, homéopathiques, à base de plantes et des préparations Direction des médicaments en neurologie, psychiatrie, antalgie, rhumatologie, pneumologie, ORL, ophtalmologie, stupéfiants. Direction des médicaments anti-infectieux, en hépatogastroentérologie, en dermatologie, et des maladies métaboliques rares Direction des médicaments en cardiologie, endocrinologie, gynécologie, urologie Direction des médicaments en oncologie, hématologie, immunologie, néphrologie Direction générale chargée des opérations Directeur général adjoint chargé des opérations Directions Produits

Gestion de la qualité des autorités l Politique et objectifs qualité l Responsible qualité désigné avec rôles et responsabilités attribués l Contrôle de la documentation l Manuel qualité l Processus documentés l Audit périodique l Gestion des corrections, des actions correctives et préventives 72 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

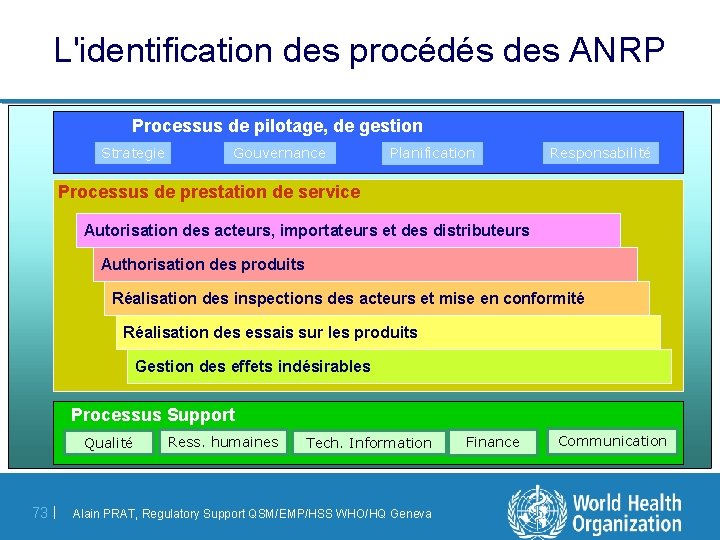
L'identification des procédés des ANRP Processus de pilotage, de gestion Strategie Gouvernance Planification Responsabilité P r o c e s s u s d e p r e s ta ti o n d e s e r v i c e Autorisation des acteurs, importateurs et des distributeurs Authorisation des produits Réalisation des inspections des acteurs et mise en conformité Réalisation des essais sur les produits Gestion des effets indésirables Processus Support Qualité 73 | Ress. humaines Tech. Information Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva Finance Communication

Gestion des ressources humaines l Organigramme l Identification des personnes clés l Fiches de fonctions établies l Système d’évaluation des performances l Sélection et recrutement basés sur des critères prétablis l Programme de formation spécifique aux nouveaux arrivants l Code de conduite du personnel l Plan de formation du personnel 74 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Obligations de transparence l Informations sur la législation, les règlements, les procédures et les lignes directrices l Processus de prise de décision l Informations sur les raisons de la base des décisions prises incluant les décisions négatives l Informations sur les produits et les établissements autorisés l Informations sur les sanctions et les pénalités l Informations sur les produits retirés, les rappels et les mises en garde aux professionnels 75 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Obligations de confidentialité l Dispositions légales sur la confidentialité – Données personnelles – Données de propriété intellectuelle l Dispositions légales sur la mise à disposition des données par les administrations publiques l Politique d’accès aux informations – Procédures pour accèder aux informations réglementaires l Dispositions pour le personnel de l’autorité et pour les experts externes (code de conduite) 76 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les pouvoirs de l’autorité l Les pouvoirs doivent être fournis au regard des responsabilités attribuées – Les pouvoirs de police sanitaire • Suspendre et retirer les autorisations que l’autorité délivre • Demander le retrait des produits du marché – Les pouvoirs d’investigations • De disposer d’une inspection pharmaceutique • De mobiliser d’autres services d'inspection ou de vérification 77 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les pouvoirs de l’autorité l Les pouvoirs doivent être fournis au regard des responsabilités attribuées – Les pouvoirs de contrôle • De disposer des moyens pour effectuer les contrôles sur les produits – Les pouvoirs de représsion • Saisir le procureur de la République • Saisir la justice ordinales • Délivrer des amendes (Anglo-saxons) 78 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les inspecteurs l Les pouvoirs d'investigation étendus • • Accès aux locaux, lieux ou se trouvent les produits Entendre les personnes Demander communication de documents Demander communication des données informatiques l Des modalités de désignation, d’habilitation spécifiques – Désignation formelle par l'Autorité – Prestations de serment devant le tribunal d'instance 79 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Les inspecteurs l Les prérogatives propres aux officiers de police judiciaire • Faire des prélèvements • Dresser des procès-verbaux – prélèvements, audition/déposition ou de constatations, • Faire des saisies • Effectuer des consignations • Faire appel à la force publique notamment pour accéder aux locaux • Entraver les missions des inspecteurs est un délit 80 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Ue autre autorité reconnue: L'Ordre l Les missions – Veuiller au respect des valeurs fondamentales de la profession de pharmacien dont il assure la défense et la promotion – Veuiller au respect des principes de moralité, de probité et de dévouement indispensable à l'exercice de la pharmacie et l'observance par tous les membres devoirs professionnels ainsi que des régles édictées par le code de déontologie des pharmaciens – Défendre l'honneur et l'independence professionnelle des pharmaciens dont les décisions ne peuvent être dictées par des considérations autres que l'intérêt du patient et de la santé publique – Assurer la confidentialité des données personnelles de santé – Exiger une compétence reconnue garantissant la qualité et la sécurité des actes accomplis au service des patients et de la population • Loi N° 27/2012 BF l Les organes: le conseil national, les conseils régionaux 81 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

Ue autre autorité reconnue: L'Ordre l La juridiction ordinale – 1ère instance: conseil régional se constitue en Chambre de discipline, présidé par un magistrat du siège – 2ème instance conseil national, présidé par un magistrat du siège – Appel auprès du conseil d'Etat – Les sanctions: • l'avertissement, • Le blâme, • L'interdiction temporaire • La radiation 82 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La déontologie pharmaceutique l Le respect du secret professionnel l L'exercice personnel de la pharmacie l La publicité et l'information de l'officine l L'identification des pharmaciens et des préparateurs l La contribution à l'information et à l'éducation sanitaire des population 83 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La déontologie pharmaceutique l L'exercice illégal l La prohibition de certaines conventions et ententes l La concurrence déloyale l Les relations avec l'administration 84 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La responsabilité du pharmacien l La responsabilité civile: réparation d'un dommage – Dommage subis par un patient – Faute comise par un pharmacien – Lien de causalité entre la faute et le dommage l La responsabilité pénale – Element matériel: le fait ou l'abstention, générateur de l'infraction – Element moral. La volonté – Element légal: prévu et puni par le code pénal 85 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

La responsabilité du pharmacien l Le code de la santé est un code d'inspiration pénal l D'autres codes peuvent être mis en oeuvre – Code de la consommation, responsabilité du fait des produits – Code des contracts 86 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

L’évolution des réglementations basées sur la gestion des risques l La notification des variations sur les protocoles des essais cliniques l La planification des missions d’inspection l La transmission des signalements périodiques de pharmacovigilance 87 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva

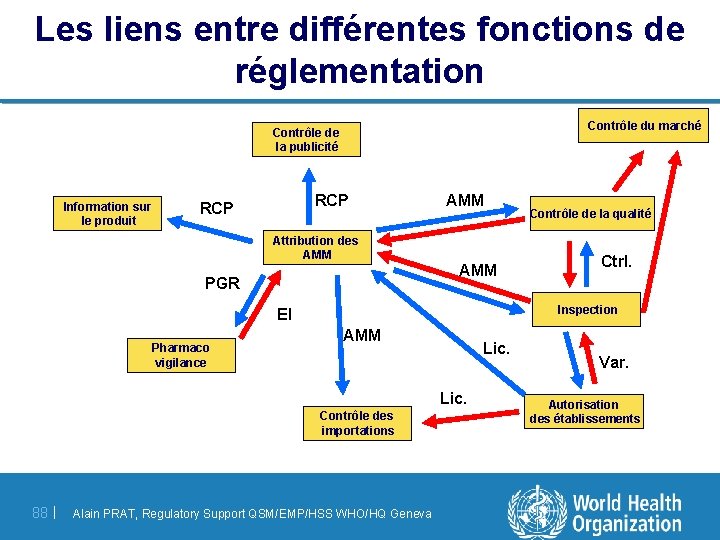
Les liens entre différentes fonctions de réglementation Contrôle du marché Contrôle de la publicité Information sur le produit RCP Attribution des AMM PGR AMM AMM Lic. Contrôle des importations 88 | Ctrl. Inspection EI Pharmaco vigilance Contrôle de la qualité Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva Var. Autorisation des établissements

Merci de votre attention 89 | Alain PRAT, Regulatory Support QSM/EMP/HSS WHO/HQ Geneva
 Phynotoine
Phynotoine Veille pharmaceutique
Veille pharmaceutique Cartographie des risques gestion des stocks
Cartographie des risques gestion des stocks Système technique définition
Système technique définition Dassault
Dassault Systmes
Systmes Https://gestion.parcoursup.fr/gestion/authentification
Https://gestion.parcoursup.fr/gestion/authentification Des des des
Des des des Linestrol
Linestrol Blc diu
Blc diu Diu payment system
Diu payment system Naxos diu echographie
Naxos diu echographie Funda de plastico latex que evita el paso de espermatozoide
Funda de plastico latex que evita el paso de espermatozoide A diu siatz
A diu siatz Zahid hasan diu
Zahid hasan diu Cse diu
Cse diu Hasna hena diu
Hasna hena diu Physics 1 lab final exam
Physics 1 lab final exam Diu eee faculty
Diu eee faculty Diu superbiam
Diu superbiam Logiciel gestion des connaissances
Logiciel gestion des connaissances Gestion des nomenclatures
Gestion des nomenclatures Gestion de données 6ème
Gestion de données 6ème Xcap gestion des programmes et dnc
Xcap gestion des programmes et dnc Gestion des stocks
Gestion des stocks Olivier caleff
Olivier caleff Modalits
Modalits Gestion internationale des ressources humaines cours
Gestion internationale des ressources humaines cours Méthode peps et cump
Méthode peps et cump Un cadencier
Un cadencier Knowledge management définition
Knowledge management définition Td gestion des risques
Td gestion des risques Processus ressources humaines exemple
Processus ressources humaines exemple Cmup en fin de période
Cmup en fin de période Gestion des actifs industriels
Gestion des actifs industriels Gestion des connaissances
Gestion des connaissances Gestion des déchets au laboratoire de microbiologie
Gestion des déchets au laboratoire de microbiologie Gestion des techniques urbaines
Gestion des techniques urbaines Comprendre la gestion des fichiers
Comprendre la gestion des fichiers Formule de wilson stock
Formule de wilson stock Gestion des championnats
Gestion des championnats Gestion centralisée des lits et places
Gestion centralisée des lits et places Organisation maintenance industrielle
Organisation maintenance industrielle Historique de la gestion des ressources humaines
Historique de la gestion des ressources humaines Sance 8
Sance 8 Robin des bois des alpes
Robin des bois des alpes Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Volume d un corps
Volume d un corps Des in network security
Des in network security 6 modes verbaux
6 modes verbaux Volume des liquides et des solides
Volume des liquides et des solides Budget des ventes
Budget des ventes Des phrases et des bases affiche soviétique 1952
Des phrases et des bases affiche soviétique 1952 Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs La diffusion des idées des lumières
La diffusion des idées des lumières Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Dictionnaire de données
Dictionnaire de données Les dimensions de la gestion de classe
Les dimensions de la gestion de classe Gestion ple
Gestion ple Despacho
Despacho Herramienta de gestión de competencias
Herramienta de gestión de competencias Macmillan education organizaciones principales
Macmillan education organizaciones principales Www.mimantenimiento
Www.mimantenimiento Calidad aplicada a la gestion empresarial unidad 1
Calidad aplicada a la gestion empresarial unidad 1 Anular factura face
Anular factura face Pert gantt
Pert gantt Facultad psicologia uab
Facultad psicologia uab Servicio nacional de gestión de riesgos y emergencias
Servicio nacional de gestión de riesgos y emergencias Gestion de projet cours résumé
Gestion de projet cours résumé Pge marketing et gestion du sport
Pge marketing et gestion du sport Dimension organizativa de la gestion escolar
Dimension organizativa de la gestion escolar Gestión de la diversidad
Gestión de la diversidad Norme gestion de projet
Norme gestion de projet Gestion departamental
Gestion departamental Norma iso 15489 de gestión de documentos
Norma iso 15489 de gestión de documentos Fondamentaux de la gestion de projet ppt
Fondamentaux de la gestion de projet ppt Gestion du linge en établissement de santé
Gestion du linge en établissement de santé Gestión de residuos hospitalarios
Gestión de residuos hospitalarios Exercice
Exercice Informe de gestion educativa
Informe de gestion educativa Gestion de crise alimentaire
Gestion de crise alimentaire Wbs rbs
Wbs rbs Sistemas de trabajo con conocimientos (kws)
Sistemas de trabajo con conocimientos (kws) Dominique jaccard
Dominique jaccard Dialogue de gestion eple
Dialogue de gestion eple Outil gestion sponsoring
Outil gestion sponsoring Gestion urbana
Gestion urbana Cabinet conseil en gestion de projet
Cabinet conseil en gestion de projet Projet gestion de stock
Projet gestion de stock Freddy and freddy
Freddy and freddy