Switch a INSTI NNRTI Switch a DTG RPV




- Slides: 11

Switch a INSTI + NNRTI § Switch a DTG + RPV ‒ Estudio SWORD § Switch a CAB LA + RPV LA IM ‒ Estudio LATTE-2 ‒ FLAIR ‒ ATLAS

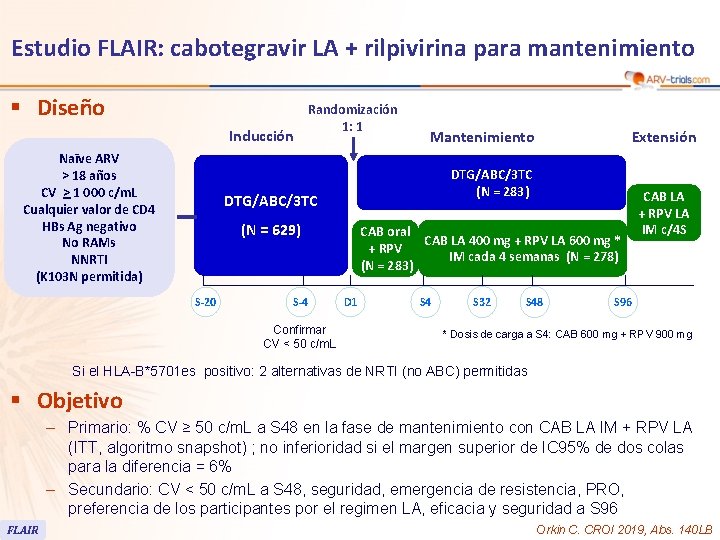
Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento § Diseño Inducción Naīve ARV > 18 años CV > 1 000 c/m. L Cualquier valor de CD 4 HBs Ag negativo No RAMs NNRTI (K 103 N permitida) Randomización 1: 1 Mantenimiento DTG/ABC/3 TC (N = 283) DTG/ABC/3 TC (N = 629) S-20 S-4 Confirmar CV < 50 c/m. L Extensión CAB oral CAB LA 400 mg + RPV LA 600 mg * + RPV IM cada 4 semanas (N = 278) (N = 283) D 1 S 4 S 32 S 48 CAB LA + RPV LA IM c/4 S S 96 * Dosis de carga a S 4: CAB 600 mg + RPV 900 mg Si el HLA-B*5701 es positivo: 2 alternativas de NRTI (no ABC) permitidas § Objetivo – Primario: % CV ≥ 50 c/m. L a S 48 en la fase de mantenimiento con CAB LA IM + RPV LA (ITT, algoritmo snapshot) ; no inferioridad si el margen superior de IC 95% de dos colas para la diferencia = 6% – Secundario: CV < 50 c/m. L a S 48, seguridad, emergencia de resistencia, PRO, preferencia de los participantes por el regimen LA, eficacia y seguridad a S 96 FLAIR Orkin C. CROI 2019, Abs. 140 LB

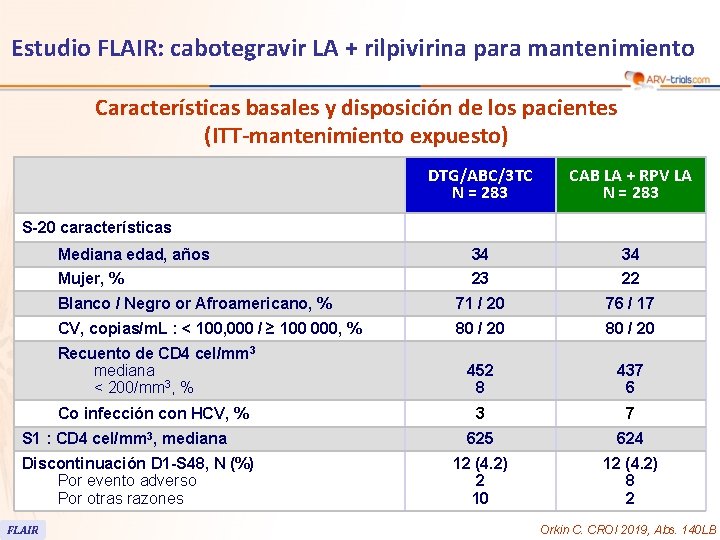
Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento Características basales y disposición de los pacientes (ITT-mantenimiento expuesto) DTG/ABC/3 TC N = 283 CAB LA + RPV LA N = 283 Mediana edad, años 34 34 Mujer, % 23 22 Blanco / Negro or Afroamericano, % 71 / 20 76 / 17 CV, copias/m. L : < 100, 000 / ≥ 100 000, % 80 / 20 Recuento de CD 4 cel/mm 3 mediana < 200/mm 3, % 452 8 437 6 Co infección con HCV, % 3 7 625 624 12 (4. 2) 2 10 12 (4. 2) 8 2 S-20 características S 1 : CD 4 cel/mm 3, mediana Discontinuación D 1 -S 48, N (%) Por evento adverso Por otras razones FLAIR Orkin C. CROI 2019, Abs. 140 LB

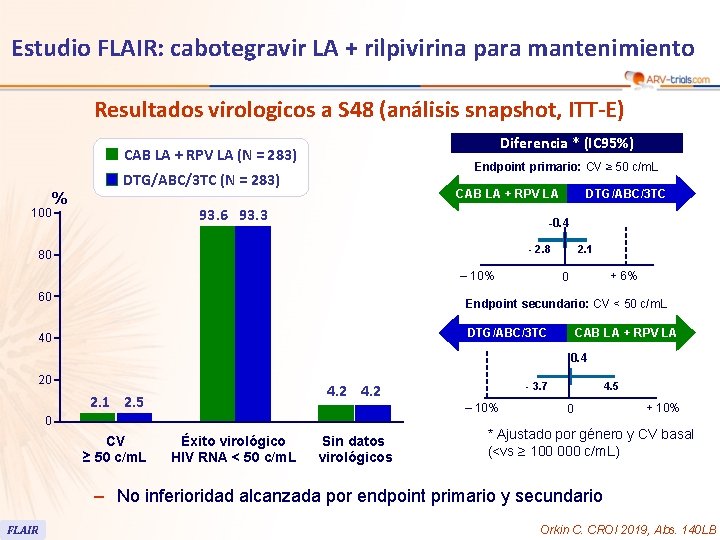
Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento Resultados virologicos a S 48 (análisis snapshot, ITT-E) Diferencia * (IC 95%) CAB LA + RPV LA (N = 283) Endpoint primario: CV ≥ 50 c/m. L DTG/ABC/3 TC (N = 283) 100 % CAB LA + RPV LA 93. 6 93. 3 DTG/ABC/3 TC -0. 4 - 2. 8 80 ‒ 10% 60 2. 1 + 6% 0 Endpoint secundario: CV < 50 c/m. L DTG/ABC/3 TC 40 CAB LA + RPV LA 0. 4 20 2. 1 2. 5 ‒ 10% 0 CV ≥ 50 c/m. L - 3. 7 4. 2 Éxito virológico HIV RNA < 50 c/m. L Sin datos virológicos 4. 5 0 + 10% * Ajustado por género y CV basal (<vs ≥ 100 000 c/m. L) – No inferioridad alcanzada por endpoint primario y secundario FLAIR Orkin C. CROI 2019, Abs. 140 LB

Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento § Fallo virológico confirmado (CVF) – Definido como 2 CV consecutivas ≥ 200 c/m. L – DTG/ABC/3 TC, N = 3 (S 8, S 12, S 16): sin emergencia de resistencia – CAB LA + RPV LA, N = 3 Fallos virológicos confirmados, rama CAB LA + RPV LA (N = 3) Sexo, país, Subtipo HIV, CV basal (c/m. L) F, Rusia, A 1, 54 000 M, Rusia, A 1, 23 000 F, Rusia, A 1, 20 000 Genotipo basal en plasma RAMs NNRTI No No No INSTI L 41 Sospecha de fallo virológico (SVF) S 20 S 28 S 48 CV (c/m. L) SVF / CVF 373 / 456 287 / 299 488 / 440 Genotipo plasmático RAMs a la SVF Cambio en sensibilidad a la SVF NNRTI INSTI E 138 E/A/K/T L 74 I, Q 148 R RPV 7. 1 CAB 5. 2 DTG 1. 0 K 101 E L 74 I, G 140 R RPV 2. 6 CAB 6. 7 DTG 1. 0 E 138 K L 74 I, Q 148 R RPV 1. 0 CAB 9. 4 DTG 1. 1 – Las concentraciones plasmáticas de CAB y RPV al momento del fallo fueron inferiores a la media poblacional FLAIR Orkin C. CROI 2019, Abs. 140 LB

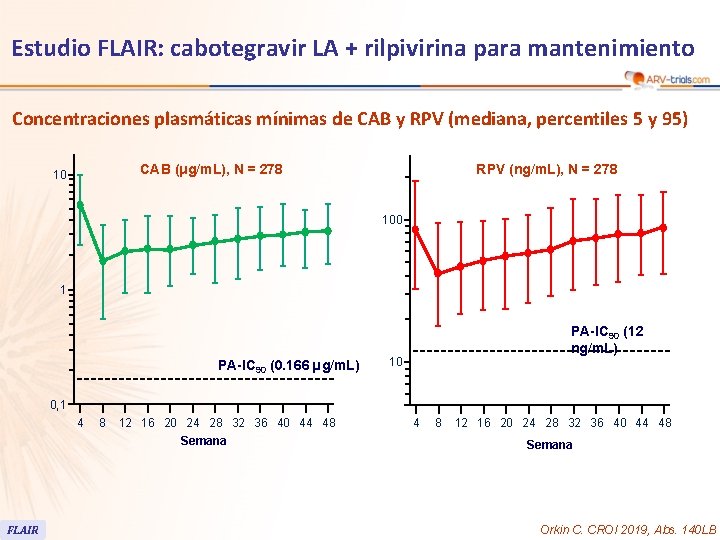
103 Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento Concentraciones plasmáticas mínimas de CAB y RPV (mediana, percentiles 5 y 95) RPV (ng/m. L), N = 278 CAB (μg/m. L), N = 278 10 100 1 PA-IC 90 (0. 166 µg/m. L) PA-IC 90 (12 ng/m. L) 10 0, 1 4 8 12 16 20 24 28 32 36 40 44 48 Semana FLAIR 4 8 12 16 20 24 28 32 36 40 44 48 Semana Orkin C. CROI 2019, Abs. 140 LB

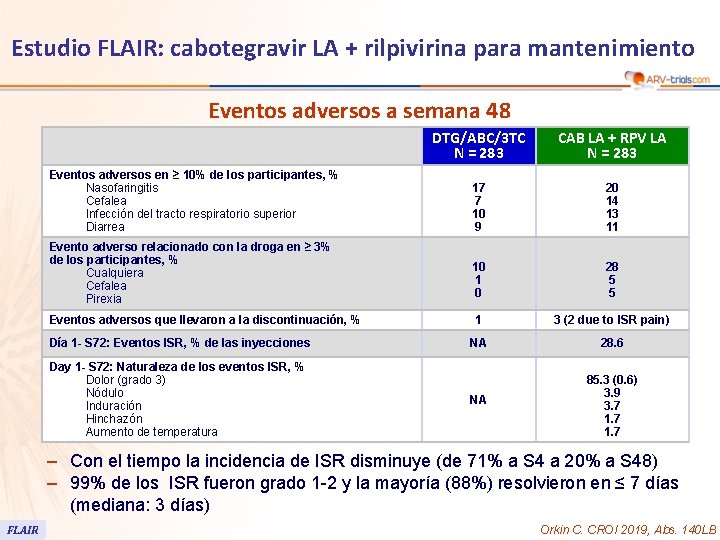
Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento Eventos adversos a semana 48 Eventos adversos en ≥ 10% de los participantes, % Nasofaringitis Cefalea Infección del tracto respiratorio superior Diarrea Evento adverso relacionado con la droga en ≥ 3% de los participantes, % Cualquiera Cefalea Pirexia Eventos adversos que llevaron a la discontinuación, % Día 1 - S 72: Eventos ISR, % de las inyecciones Day 1 - S 72: Naturaleza de los eventos ISR, % Dolor (grado 3) Nódulo Induración Hinchazón Aumento de temperatura DTG/ABC/3 TC N = 283 CAB LA + RPV LA N = 283 17 7 10 9 20 14 13 11 10 1 0 28 5 5 1 3 (2 due to ISR pain) NA 28. 6 NA 85. 3 (0. 6) 3. 9 3. 7 1. 7 – Con el tiempo la incidencia de ISR disminuye (de 71% a S 4 a 20% a S 48) – 99% de los ISR fueron grado 1 -2 y la mayoría (88%) resolvieron en ≤ 7 días (mediana: 3 días) FLAIR Orkin C. CROI 2019, Abs. 140 LB

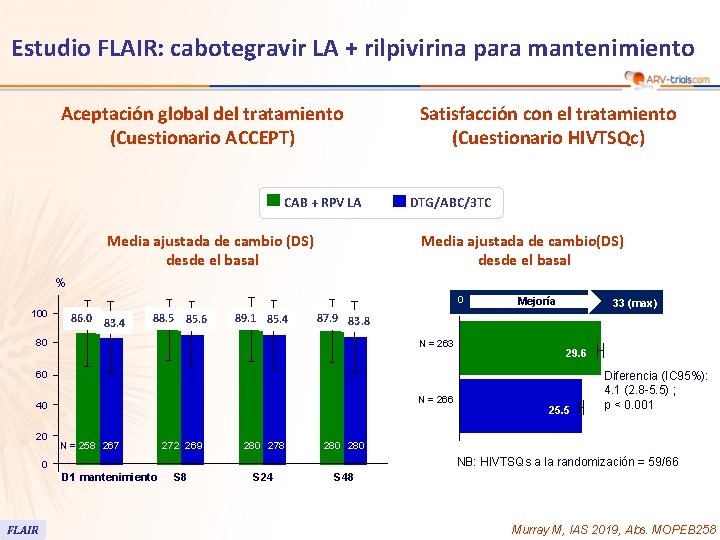
Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento § Resultados reportados por el paciente – Cambio en la satisfacción con el tratamiento actual vs fase de inducción (HIVTSQc a S 48), puntaje total promedio • LA CAB + RPV: 29. 6/33 • DTG/ABC/3 TC: 25. 5/33 (p < 0. 001) – Preferencia del participante a S 48 • Prefiere LA: 91% • Prefiere tratamiento oral diario: 1% FLAIR Orkin C. CROI 2019, Abs. 140 LB

Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento Aceptación global del tratamiento (Cuestionario ACCEPT) CAB + RPV LA Media ajustada de cambio (DS) desde el basal Satisfacción con el tratamiento (Cuestionario HIVTSQc) DTG/ABC/3 TC Media ajustada de cambio(DS) desde el basal % 0 100 86. 0 83. 4 88. 5 85. 6 89. 1 85. 4 Mejoría 33 (max) 87. 9 83. 8 80 N = 263 29. 6 60 N = 266 40 20 N = 258 267 272 269 280 278 280 NB: HIVTSQs a la randomización = 59/66 0 D 1 mantenimiento FLAIR 25. 5 Diferencia (IC 95%): 4. 1 (2. 8 -5. 5) ; p < 0. 001 S 8 S 24 S 48 Murray M, IAS 2019, Abs. MOPEB 258

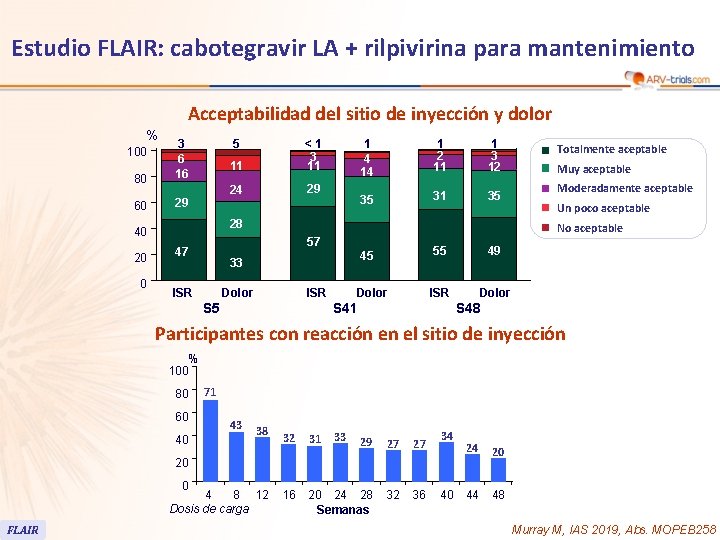
50 Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento Acceptabilidad del sitio de inyección y dolor % 80 3 6 16 60 29 100 5 0 24 29 1 4 14 1 2 11 1 3 12 35 31 35 28 40 20 11 <1 3 11 45 33 ISR Muy aceptable Moderadamente aceptable Un poco aceptable No aceptable 57 47 Totalmente aceptable Dolor ISR S 5 Dolor 55 49 ISR Dolor S 41 S 48 Participantes con reacción en el sitio de inyección 100 80 60 40 % 71 43 38 33 32 31 29 27 27 16 20 24 28 Semanas 32 36 34 24 20 44 48 20 0 4 8 12 Dosis de carga FLAIR 40 Murray M, IAS 2019, Abs. MOPEB 258

Estudio FLAIR: cabotegravir LA + rilpivirina para mantenimiento § Conclusiones – CAB LA IM + RPV LA cada 4 semanas fue no inferior al tratamiento oral diario con DTG/ABC/3 TC a S 48 • Por proporción de rebote virológico: CV ≥ 50 c/m. L en 2. 1% vs 2. 5% • Por proporción de mantenimiento de la supresión – Tres participantes en cada rama tuvieron fallo virológico confirmado • Sin emergencia de resistencia en la rama DTG/ABC/3 TC • Emergencia de mutaciones de resistencia a NNRTI y INSTI resistencia en 3/3 en la rama LA, todas tenían HIV-1 subtipo A 1 – Las reacciones en el sitio de inyección fueron frecuentes pero mayormente grado 1 o 2, con pocas discontinuaciones asociadas – Alta satisfacción y preferencia al tratamiento con LA FLAIR Orkin C. CROI 2019, Abs. 140 LB