Studio di fattori di trascrizione lesempio delle proteine




- Slides: 9

Studio di fattori di trascrizione: l’esempio delle proteine SREBP Shimano & Sato, NRC 2017 Näär et al. , PNAS 1998

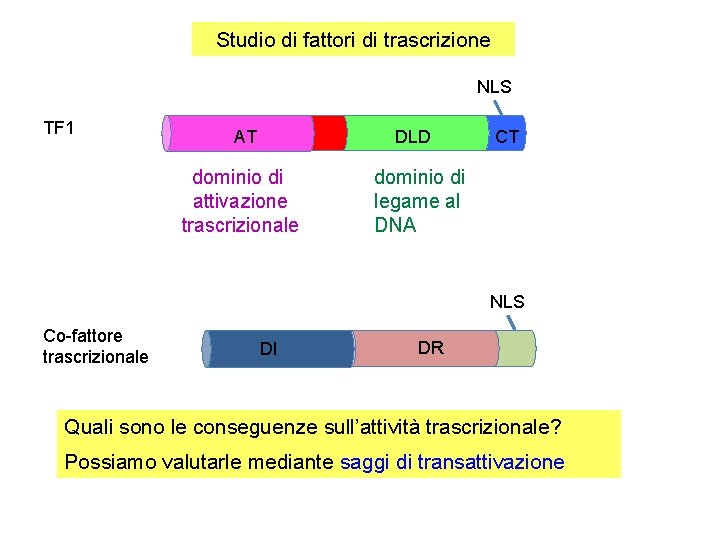
Studio di fattori di trascrizione NLS TF 1 DLD AT dominio di attivazione trascrizionale CT dominio di legame al DNA NLS Co-fattore trascrizionale DI DR Quali sono le conseguenze sull’attività trascrizionale? Possiamo valutarle mediante saggi di transattivazione

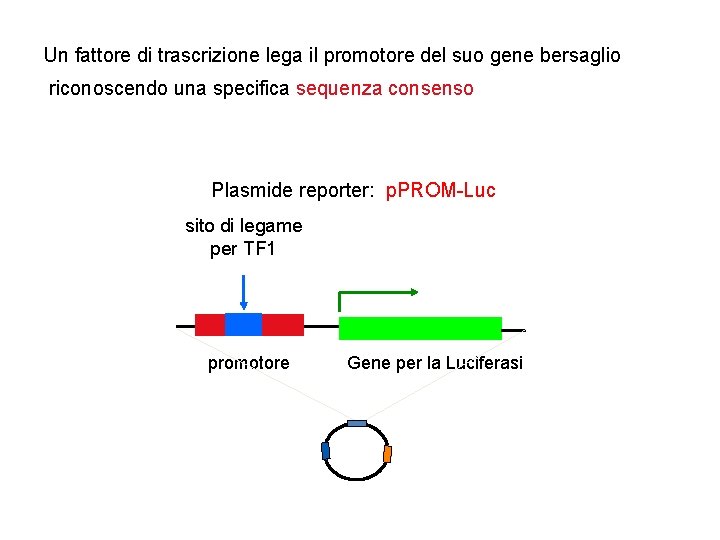
Un fattore di trascrizione lega il promotore del suo gene bersaglio riconoscendo una specifica sequenza consenso Plasmide reporter: p. PROM-Luc sito di legame per TF 1 promotore Gene per la Luciferasi

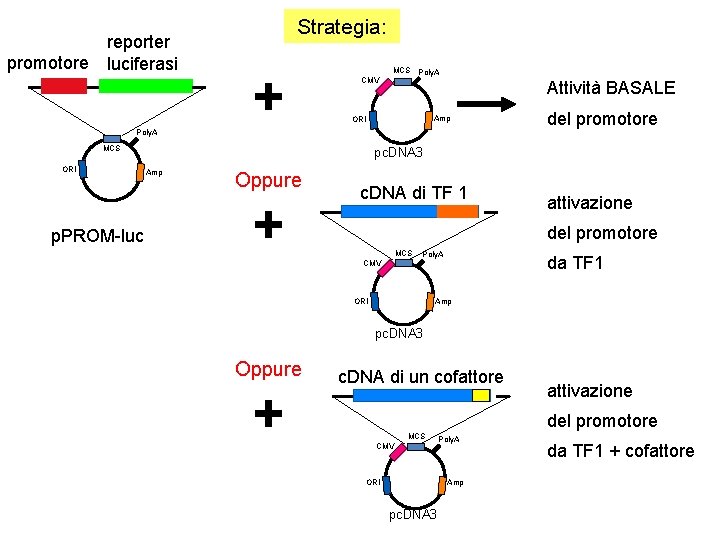
reporter promotore luciferasi Strategia: + CMV MCS Poly. A Attività BASALE Amp ORI Poly. A MCS ORI p. PROM-luc del promotore pc. DNA 3 Amp Oppure + c. DNA di TF 1 attivazione del promotore MCS CMV Poly. A da TF 1 Amp ORI pc. DNA 3 Oppure + c. DNA di un cofattore attivazione del promotore MCS CMV Poly. A Amp ORI pc. DNA 3 da TF 1 + cofattore

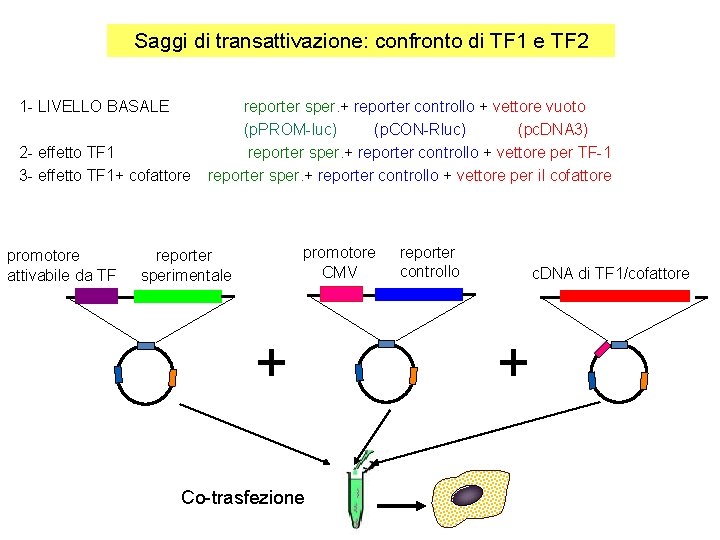
Saggi di transattivazione: confronto di TF 1 e TF 2 1 - LIVELLO BASALE 2 - effetto TF 1 3 - effetto TF 1+ cofattore promotore attivabile da TF reporter sper. + reporter controllo + vettore vuoto (p. PROM-luc) (p. CON-Rluc) (pc. DNA 3) reporter sper. + reporter controllo + vettore per TF-1 reporter sper. + reporter controllo + vettore per il cofattore promotore CMV reporter sperimentale + Co-trasfezione reporter controllo c. DNA di TF 1/cofattore +

Esperimento: trasfezione con lipofectamina (lipide) L: 5 min a TA 150 l terreno Optimem + 2 l Lipofectamina D: 5 min a TA 150 l terreno Optimem + DNA = reporter A (p. PROMLuc) + reporter B (p. CONRLuc) + vettore di espressione vuoto, o con TF 1 o TF 1 + cofattore Mix L+D: 20 min a TA formazione complessi LIPIDE-DNA Aggiungere i complessi alle cellule

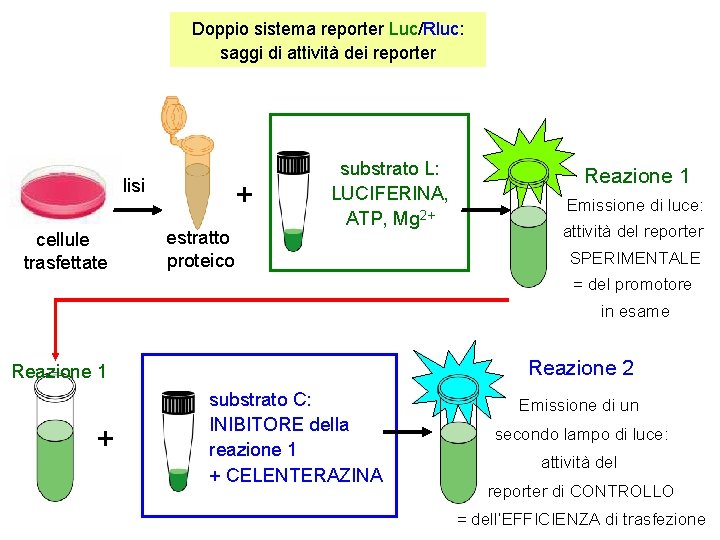
Doppio sistema reporter Luc/Rluc: saggi di attività dei reporter lisi cellule trasfettate + estratto proteico substrato L: LUCIFERINA, ATP, Mg 2+ Reazione 1 Emissione di luce: attività del reporter SPERIMENTALE = del promotore in esame Reazione 2 Reazione 1 + substrato C: INIBITORE della reazione 1 + CELENTERAZINA Emissione di un secondo lampo di luce: attività del reporter di CONTROLLO = dell’EFFICIENZA di trasfezione

NORMALIZZAZIONE: Se ho più campioni con efficienze diverse, divido il valore misurato di ciascun campione per la propria efficienza di trasfezione (oppure per il valore letto per il reporter enzimatico) Val. misurato 1 = Val. corretto= 20 10/ efficienza 0, 5 “ “ 2= 20/ “ “ 3= 20/ “ 0, 5 “ 0, 25 Val. corretto= 40 (2 x) Val. corretto= 80 (4 x) Risultato: TF 1 attiva il promotore, aumentando la trascrizione del reporter di 2 volte l’aggiunta del cofattore ha un’attività trascrizionale superiore, poichè aumenta la trascrizione del reporter di 4 volte.