Struttura atomica e legami Storia dellatomo 17 secolo






















- Slides: 39

Struttura atomica e legami

Storia dell’atomo • 17° secolo. Robert Boyle: gli elementi sono costituiti da “semplici corpi” non costituiti da altri corpi. • 19° secolo. John Dalton: la materia è costituita da piccole particelle dette atomi (a privativo, tome separazione). • 19° secolo. Henri Becquerel e Marie e Pierre Curie (Francia): introduzione del concetto di radioattività (nuclei atomici instabili o radioattivi decadono in nuclei con minore energia, più stabile); Joseph J. Thompson: scoperta degli elettroni. • 1910. Ernest Rutherford: scoperta dei protoni. • 1932. James Chadwick: scoperta dei neutroni.

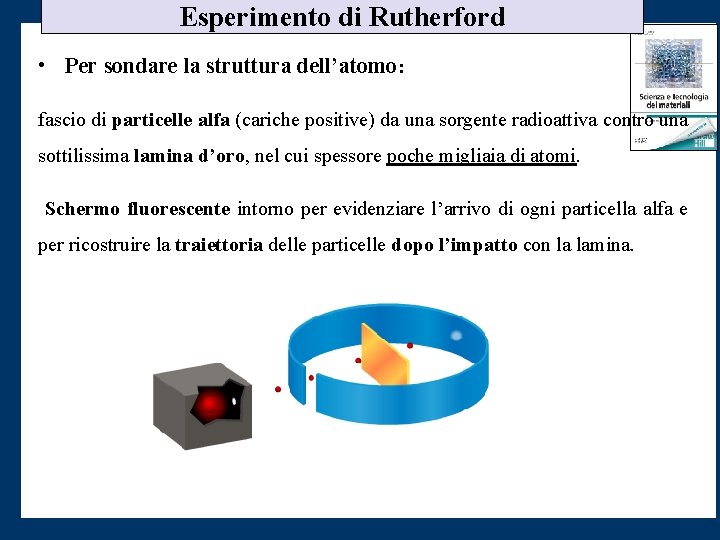
Esperimento di Rutherford • Per sondare la struttura dell’atomo: fascio di particelle alfa (cariche positive) da una sorgente radioattiva contro una sottilissima lamina d’oro, nel cui spessore poche migliaia di atomi. Schermo fluorescente intorno per evidenziare l’arrivo di ogni particella alfa e per ricostruire la traiettoria delle particelle dopo l’impatto con la lamina.

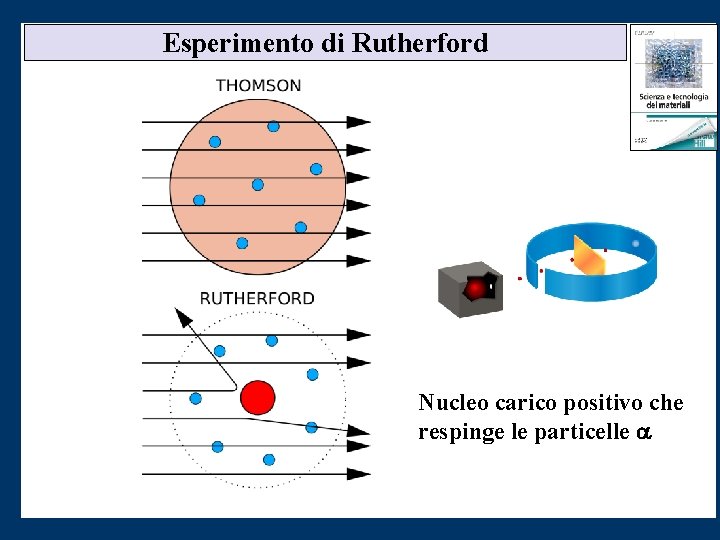
Esperimento di Rutherford Modello di Thomson (allora maggioritario): le particelle alfa avrebbero dovuto attraversare il foglio d'oro venendo deflesse al più di pochi gradi: misurando la deflessione si potevano ricavare informazioni sulla distribuzione di carica elettrica all'interno dell'atomo. Alcune particelle riflesse ad angoli anche maggiori di 90°: evento imprevisto poiché i leggerissimi elettroni non erano in grado di deviare le pesanti particelle alfa. Sistema con la maggior parte della massa positiva dell'atomo concentrata in un nucleo molto piccolo che respinge le particelle positive e non le devia. • Animazione

Esperimento di Rutherford Nucleo carico positivo che respinge le particelle a

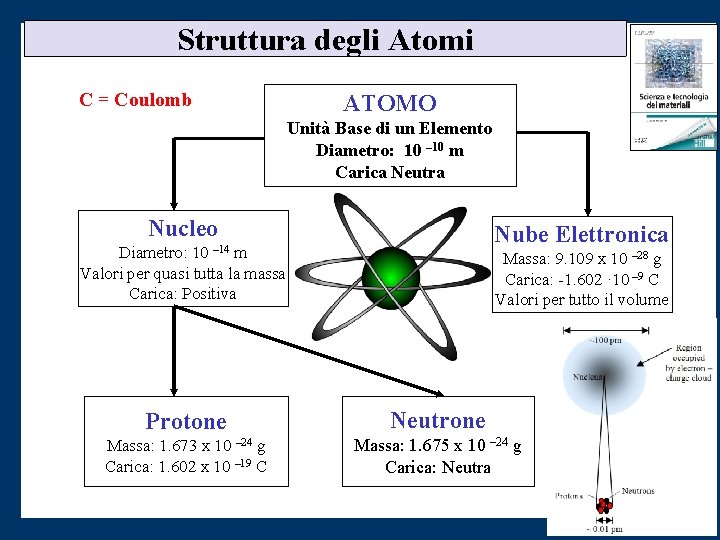
Struttura degli Atomi C = Coulomb ATOMO Unità Base di un Elemento Diametro: 10 – 10 m Carica Neutra Nucleo Nube Elettronica Diametro: 10 m Valori per quasi tutta la massa Carica: Positiva – 14 Massa: 9. 109 x 10 – 28 g Carica: -1. 602 · 10 – 9 C Valori per tutto il volume Protone Neutrone Massa: 1. 673 x 10 – 24 g Carica: 1. 602 x 10 – 19 C Massa: 1. 675 x 10 – 24 g Carica: Neutra

Numero Atomico e Massa Atomica • Numero Atomico = Numero di Protoni nel nucleo (= n. elettroni in atomo neutro) • Identifica l’elemento ed è unico Ø Esempi: Idrogeno = 1, Uranio = 92 • Numero di massa (A): somma dei protoni e dei neutroni nel nucleo di un atomo Ø Esempio: il carbonio ha 6 Protoni e 6 Neutroni A = 12 • Massa atomica relativa = Massa in grammi pari a 6. 203 x 1023 atomi (Numero di Avogadro) • Unità di Massa Atomica è 1/12 di massa di un atomo di C (massa 12 u) • Un (grammo)mole = UM massa atomica di un elemento • Isotopo: variazioni di un elemento con lo stesso numero atomico, ma diverso numero di massa Un grammo mole Atomi contenuti in 12 Grammi di Carbonio 6. 023 x 1023

Teoria di Planck • Max Planck: atomi e molecole emettono energia solo in alcune quantità discrete, dette quanti (fotone) • Non tutti i valori di energia sono permessi: legge della meccanica quantistica • Maxwell: la natura della luce (visibile) è in forma di radiazione elettromagnetica • E = hυ = hc/λ • υ = frequenza • h = cost di Planck • c = velocità della luce • l = lunghezza d’onda

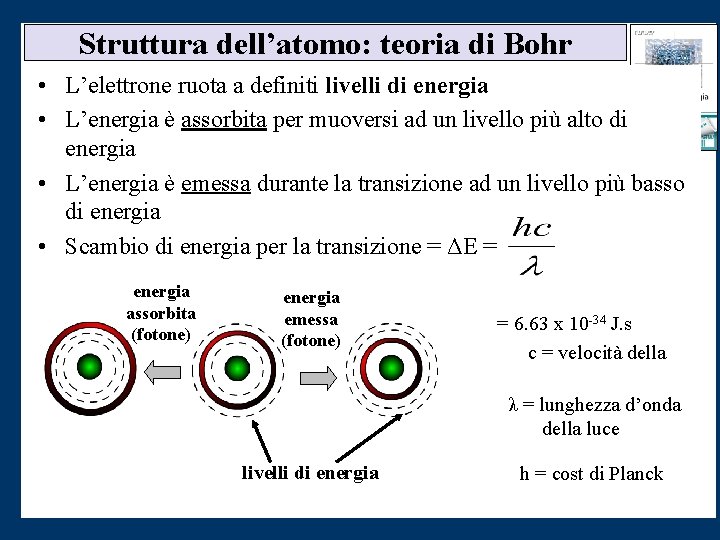
Struttura dell’atomo: teoria di Bohr • L’elettrone ruota a definiti livelli di energia • L’energia è assorbita per muoversi ad un livello più alto di energia • L’energia è emessa durante la transizione ad un livello più basso di energia • Scambio di energia per la transizione = ΔE = energia h=costante di Planck assorbita (fotone) energia emessa (fotone) = 6. 63 x 10 -34 J. s c = velocità della luce λ = lunghezza d’onda della luce livelli di energia h = cost di Planck

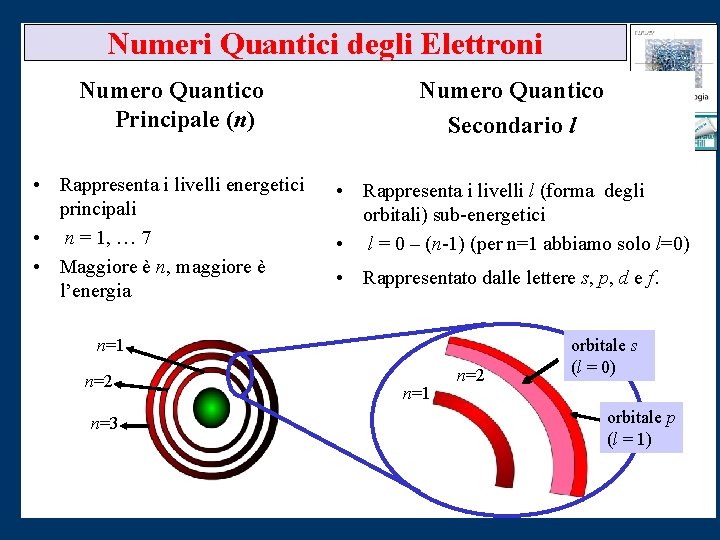
Numeri Quantici degli Elettroni Numero Quantico Principale (n) Numero Quantico Secondario l • Rappresenta i livelli energetici principali • n = 1, … 7 • Maggiore è n, maggiore è l’energia • Rappresenta i livelli l (forma degli orbitali) sub-energetici • l = 0 – (n-1) (per n=1 abbiamo solo l=0) • Rappresentato dalle lettere s, p, d e f. n=1 n=2 n=3 n=1 n=2 orbitale s (l = 0) orbitale p (l = 1)

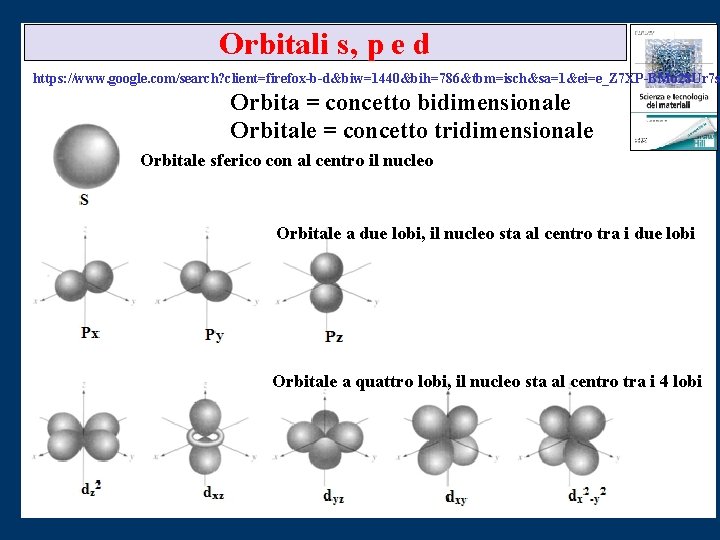
Orbitali s, p e d https: //www. google. com/search? client=firefox-b-d&biw=1440&bih=786&tbm=isch&sa=1&ei=e_Z 7 XP-BMo 28 Ur 7 s Orbita = concetto bidimensionale Orbitale = concetto tridimensionale Orbitale sferico con al centro il nucleo Orbitale a due lobi, il nucleo sta al centro tra i due lobi Orbitale a quattro lobi, il nucleo sta al centro tra i 4 lobi

Il modello quanto-meccanico e la Tavola Periodica • Gli elementi sono classificati a seconda della loro configurazione elettronica 2 -21 W. Smith, J. Hashemi, Scienza e tecnologia dei materiali, 4 ed – © Mc. Graw-Hill Education (Italy) srl

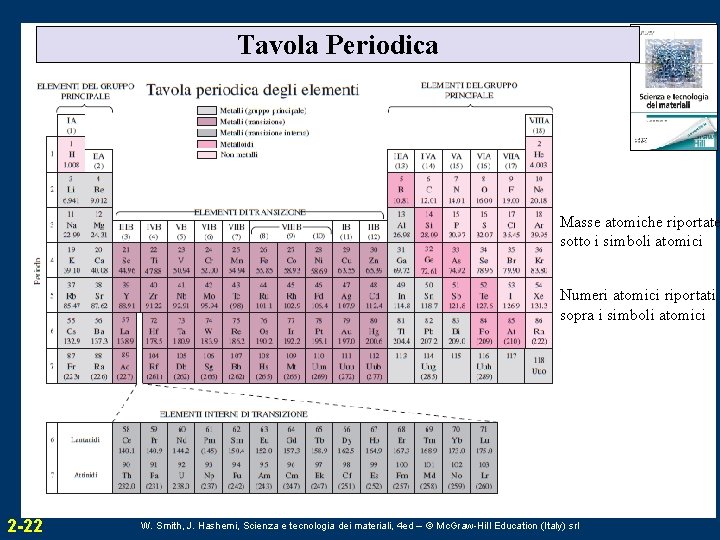
Tavola Periodica Masse atomiche riportate sotto i simboli atomici Numeri atomici riportati sopra i simboli atomici 2 -22 W. Smith, J. Hashemi, Scienza e tecnologia dei materiali, 4 ed – © Mc. Graw-Hill Education (Italy) srl

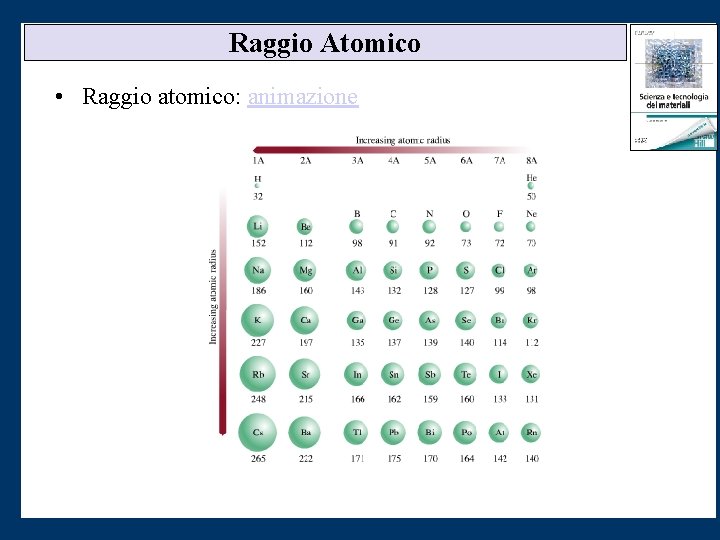
Variazioni Periodiche nella Dimensione Atomica • Dimensione atomica: raggio • Influenzato dal numero quantico principale e dalla dimensione del nucleo.

Raggio Atomico • Raggio atomico: animazione

Energia di Ionizzazione • Energia richiesta per rimuovere un elettrone dal suo atomo • L’atomo che acquista o perde un elettrone diventa uno ione (processo di ionizzazione) • Prima energia di ionizzazione: gioca il ruolo chiave nella reattività chimica • Quando il primo elettrone più esterno è rimosso, occorre più energia per rimuovere il secondo elettrone

Numero di Ossidazione • Numero positivo di ossidazione: numero di elettroni più esterni che un atomo può avere mediante processo di ionizzazione

Struttura elettronica e attività chimica • Gli elementi elettropositivi forniscono elettroni durante le reazioni chimiche per formare cationi • Gli elementi elettronegativi accettano elettroni durante la reazione chimica • L’elettronegatività è il grado al quale l’atomo attrae elettroni a sé N. B. : due elementi con pari elettronegatività sono stabili, elettronegatività diverse innescano reazioni chimiche (concetto importante quando parleremo di soluzioni) • Affinità elettronica: tendenza ad accettare uno o più elettroni e rilasciare energia

Metalli, Metalloidi e Non Metalli • Metalli reattivi (o metalli): i materiali elettropositivi hanno la naturale tendenza a perdere elettroni e nel processo formano cationi. • Non Metalli reattivi (o non metalli): elettronegativi, hanno la naturale tendenza ad accettare elettroni e nel processo formano anioni. • Metalloidi: possono comportarsi come Metalli o Non metalli – Esempi: Ø il carbonio, il silicio e il germanio, sono metalloidi mentre stagno e piombo sono metalli; Ø l’azoto e il fosforo sono non metalli, arsenico e antimonio sono metalliodi e il bismuto è un metallo.

Legami Atomici e Molecolari I legami tra gli atomi abbassano l’energia potenziale di ogni atomo portando ad uno stato più stabile • Tre combinazioni di legame: 1) metallo-non metallo, 2) non metallo-non metallo, 3) metallo-metallo • Legami ionici: forti dovuti al trasferimento di elettroni • Legami covalenti: grande forza di interazione dovuta alla condivisione di elettroni • Legami metallici: legami non direzionali formati dalla condivisione di elettroni Dipolo elettrico: sistema formato da due cariche elettriche uguali e di segno opposto, a distanza fissata

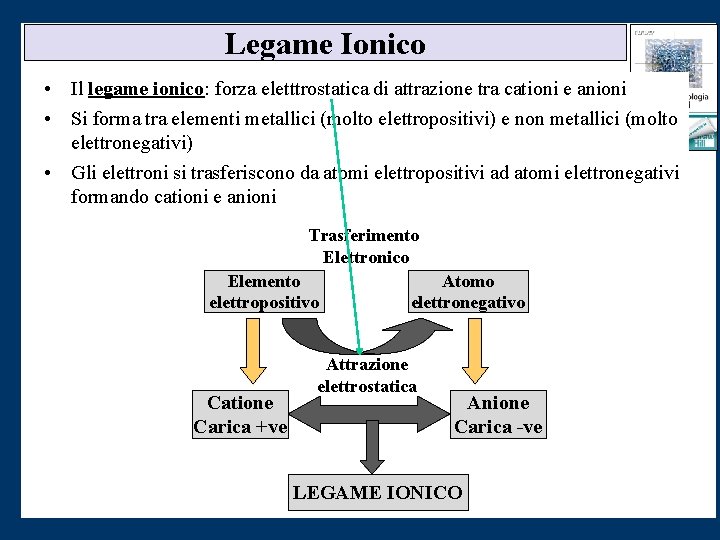
Legame Ionico • Il legame ionico: forza eletttrostatica di attrazione tra cationi e anioni • Si forma tra elementi metallici (molto elettropositivi) e non metallici (molto elettronegativi) • Gli elettroni si trasferiscono da atomi elettropositivi ad atomi elettronegativi formando cationi e anioni Trasferimento Elettronico Elemento elettropositivo Catione Carica +ve Atomo elettronegativo Attrazione elettrostatica Anione Carica -ve LEGAME IONICO

Legame Ionico • Tra ioni di segno opposto (cationi e anioni): significativa riduzione di energia potenziale • Grande differenza in elettronegatività • Metallo che forma un catione riduce il suo raggio • Metallo che forma un anione aumenta il suo raggio

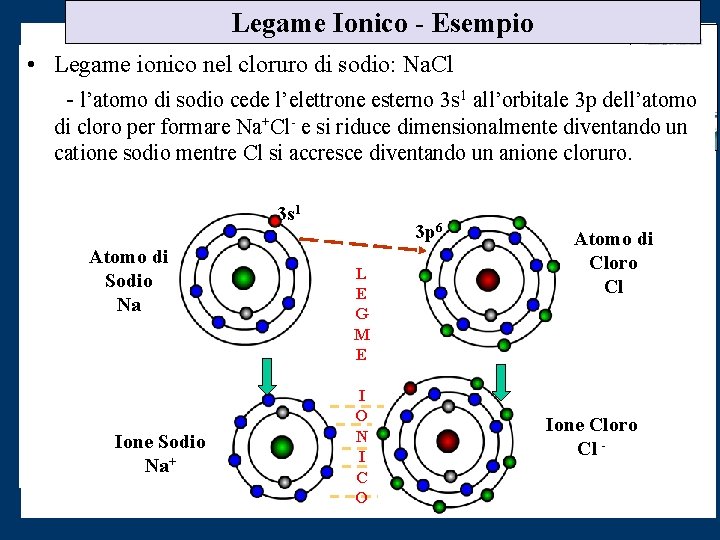
Legame Ionico - Esempio • Legame ionico nel cloruro di sodio: Na. Cl - l’atomo di sodio cede l’elettrone esterno 3 s 1 all’orbitale 3 p dell’atomo di cloro per formare Na+Cl- e si riduce dimensionalmente diventando un catione sodio mentre Cl si accresce diventando un anione cloruro. 3 s 1 Atomo di Sodio Na Ione Sodio Na+ 3 p 6 L E G M E I O N I C O Atomo di Cloro Cl Ione Cloro Cl -

Forza Ionica per Coppia Ionica • Il nucleo di uno ione attrae un elettrone di un altro ione • Le nubi elettroniche degli ioni, però, si respingono a vicenda quando sono sufficientemente vicine perchè cominciano ad interagire • Se le forze attrattive uguagliano quelle repulsive si bilanciano e la distanza interionica, a 0, di equilibrio viene raggiunta e si forma un legame Forza vs distanza di separazione per una coppia di ioni con carica opposta 2 -35 W. Smith, J. Hashemi, Scienza e tecnologia dei materiali, 4 ed – © Mc. Graw-Hill Education (Italy) srl

Energie inter. Ioniche per Coppia Ionica Enetta = Etot = Eattratt + Erepulsiva Minima alla distanza di equilibrio a 0

Disposizioni Ioniche nei Solidi Ionici tridimensionali • I legami ionici sono non direzionali: attrazione tra le cariche indipendente dall’orientazione delle stesse. • Le disposizioni geometriche sono presenti nei solidi per mantenere la neutralità di carica. Ø Esempio: in Na. Cl, sei ioni Cl- si impacchettano attorno allo ione centrale Na+ Ø In Cs. Cl otto ioni di Cl possono circondare uno ione di Cesio Impacchettamento ionico Cs. Cl Na. Cl

Energia di Legame e Temperatura di Fusione • Le energie di reticolo e le temperature di fusione dei solidi con legami ionici sono alti. • L’energia di reticolo diminuisce all’aumentare della dimensione dello ione perchè gli elettroni di legame negli ioni più grandi, poichè più lontani, sono meno influenzati dalle forze di attrazione dei nuclei positivi. Ø Esempio: Na. Cl Energia di reticolo = 766 KJ/mol Punto di fusione = 801°C Cs. Cl Energia di reticolo = 649 KJ/mol Punto di fusione = 646°C Ba. O Energia di reticolo = 3127 KJ/mol Punto di fusione = 1923°C

Energia di Reticolo, Proprietà dei Materiali • I solidi ionici sono duri, rigidi, resistenti e fragili • Eccellenti isolanti

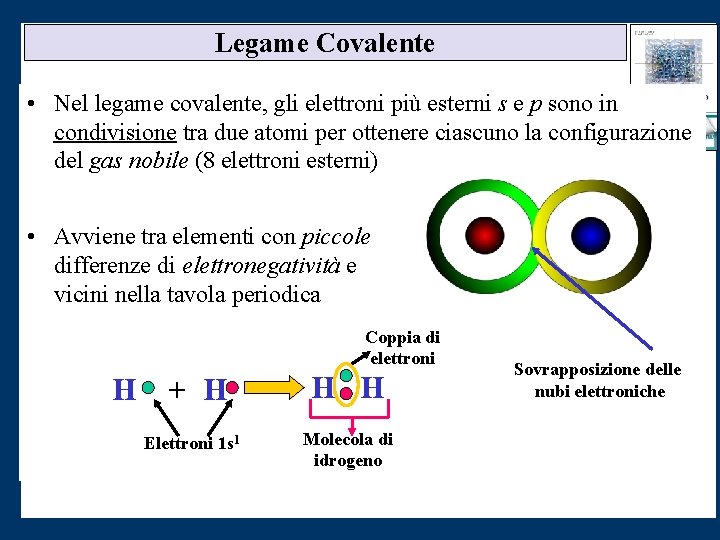
Legame Covalente • Nel legame covalente, gli elettroni più esterni s e p sono in condivisione tra due atomi per ottenere ciascuno la configurazione del gas nobile (8 elettroni esterni) • Avviene tra elementi con piccole differenze di elettronegatività e vicini nella tavola periodica Coppia di elettroni H + H Elettroni 1 s 1 H H Molecola di idrogeno Sovrapposizione delle nubi elettroniche H H

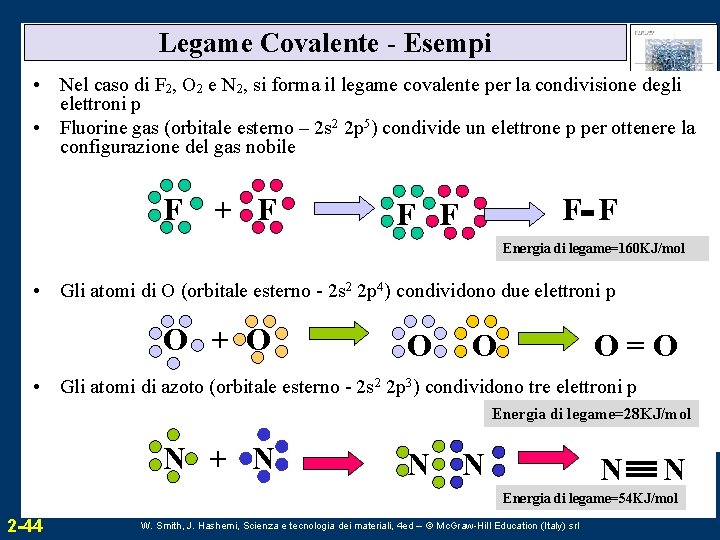
Legame Covalente - Esempi • Nel caso di F 2, O 2 e N 2, si forma il legame covalente per la condivisione degli elettroni p • Fluorine gas (orbitale esterno – 2 s 2 2 p 5) condivide un elettrone p per ottenere la configurazione del gas nobile F + F F F Energia di legame=160 KJ/mol • Gli atomi di O (orbitale esterno - O + O H 2 p 4) condividono due elettroni p 2 s 2 O O O=O • Gli atomi di azoto (orbitale esterno - 2 s 2 2 p 3) condividono tre elettroni p Energia di legame=28 KJ/mol N + N N N Energia di legame=54 KJ/mol 2 -44 W. Smith, J. Hashemi, Scienza e tecnologia dei materiali, 4 ed – © Mc. Graw-Hill Education (Italy) srl

Legame Covalente nel Carbonio • Il carbonio ha configurazione elettronica 1 s 2 2 p 2 Disposizione dello stato base 1 s La configurazione indica che il carbonio 2 s 2 p forma due Due orbitali 2 p occupati a 1/2 legami covalenti • L’ibridizzazione comporta che uno degli orbitali 2 s è promosso all’orbitale 2 p. Risultato quattro orbitali covalenti sp 3. Indica che si formano quattro legami covalenti 1 s 2 p Quattro e ½ orbitali sp 3 occupati (tetravalenza) 2 -46 W. Smith, J. Hashemi, Scienza e tecnologia dei materiali, 4 ed – © Mc. Graw-Hill Education (Italy) srl

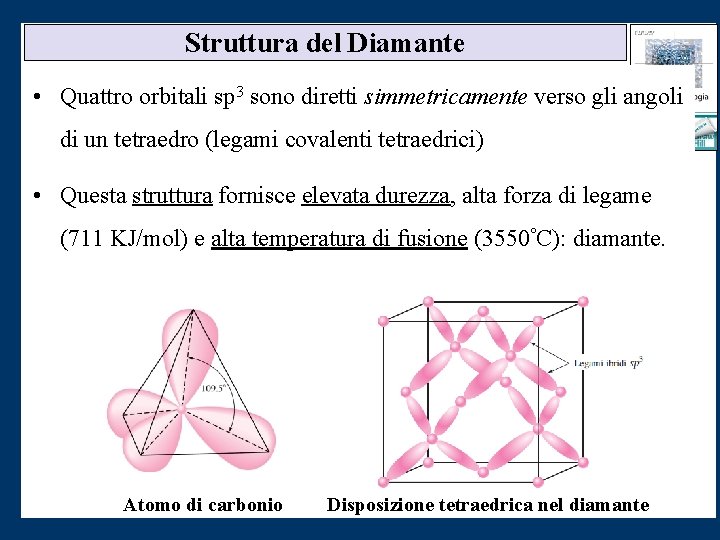
Struttura del Diamante • Quattro orbitali sp 3 sono diretti simmetricamente verso gli angoli di un tetraedro (legami covalenti tetraedrici) • Questa struttura fornisce elevata durezza, alta forza di legame (711 KJ/mol) e alta temperatura di fusione (3550°C): diamante. Atomo di carbonio Disposizione tetraedrica nel diamante

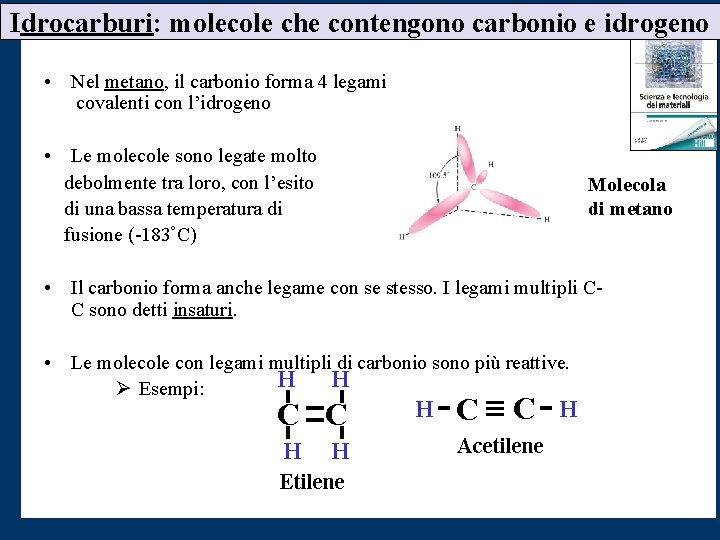
Idrocarburi: molecole che contengono carbonio e idrogeno • Nel metano, il carbonio forma 4 legami covalenti con l’idrogeno • Le molecole sono legate molto debolmente tra loro, con l’esito di una bassa temperatura di fusione (-183°C) Molecola di metano • Il carbonio forma anche legame con se stesso. I legami multipli CC sono detti insaturi. • Le molecole con legami multipli di carbonio sono più reattive. H H Ø Esempi: C C H H Etilene H C C Acetilene H

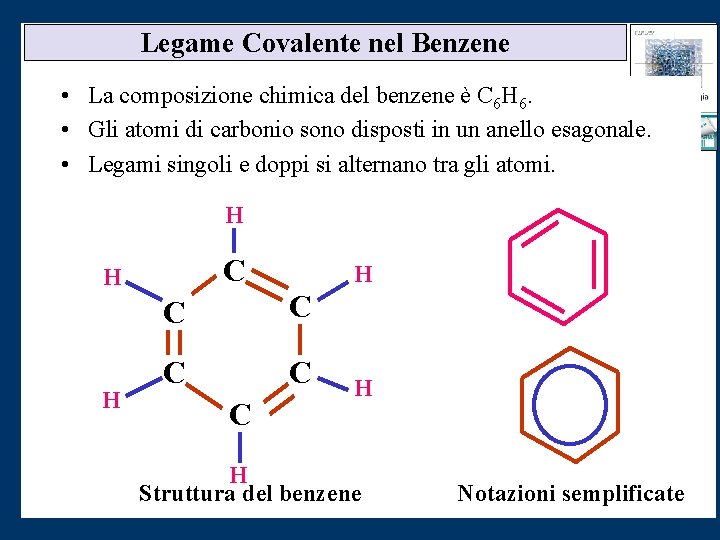
Legame Covalente nel Benzene • La composizione chimica del benzene è C 6 H 6. • Gli atomi di carbonio sono disposti in un anello esagonale. • Legami singoli e doppi si alternano tra gli atomi. H C H H H C C C H H Struttura del benzene Notazioni semplificate

Legame Metallico • Gli atomi nei metalli sono impacchettati in una struttura cristallina ripetitiva • Elettroni di valenza: legati debolmente, attratti verso il nucleo di altri atomi (elettroni liberi) • Nube elettronica: formata dagli elettroni liberi • Questi elettroni liberi sono la causa di conducibilità elettrica e di duttilità (scorrimento degli atomi senza rompere i legami: deformazione) Ione positivo Ioni positivi: atomi senza elettroni di valenza Schema di un metallo Nube carica di elettroni di valenza

Legame Metallico • Legami fino al raggiungimento della minima energia: livello stabile. • L’energia complessiva dei singoli atomi è minore per i legami metallici. • L’energia minima tra gli atomi si ha alla distanza di equilibrio a 0. Ø Esempio: Na Energia di legame = 108 KJ/mol Temperatura di fusione = 97. 7°C • Maggiore è il numero di elettroni di valenza coinvolto, maggiore è l’energia di legame. Ø Esempio: Ca Energia di legame = 177 KJ/mol Temperatura di fusione = 851°C Le Energie di legame e la Temperatura di fusione variano molto da metallo

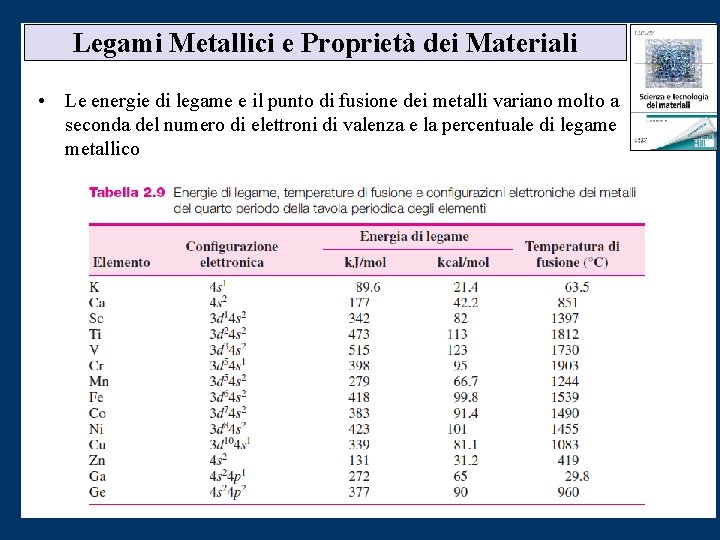
Legami Metallici e Proprietà dei Materiali • Le energie di legame e il punto di fusione dei metalli variano molto a seconda del numero di elettroni di valenza e la percentuale di legame metallico

Legami Metallici e Proprietà dei Materiali • I metalli puri sono significativamente più malleabili dei materiali ionici o covalenti. • La resistenza meccanica di un metallo puro può essere significativamente aumentata mediante formazione di lega. • I metalli puri sono eccellenti conduttori di calore e di elettricità.

Legami Misti • • Ionico-Covalente Metallico-Ionico-Covalente-Metallico