STRUTTURA ATOMICA Agli inizi del 1900 dopo la































![Lo strato n=3 inizia a riempirsi con il sodio Z=11 [Ne] 3 s 1 Lo strato n=3 inizia a riempirsi con il sodio Z=11 [Ne] 3 s 1](https://slidetodoc.com/presentation_image_h/c25a5bfde074a2533a4cf3e2b8b6367d/image-51.jpg)
![Successivamente inizia il riempimento dell'orbitale 4 s con K Z=19 [Ar] 4 s 1 Successivamente inizia il riempimento dell'orbitale 4 s con K Z=19 [Ar] 4 s 1](https://slidetodoc.com/presentation_image_h/c25a5bfde074a2533a4cf3e2b8b6367d/image-52.jpg)
![Sc Z=21 [Ar] 4 s 2 3 d 1 Ti Z=22 [Ar] 4 s Sc Z=21 [Ar] 4 s 2 3 d 1 Ti Z=22 [Ar] 4 s](https://slidetodoc.com/presentation_image_h/c25a5bfde074a2533a4cf3e2b8b6367d/image-53.jpg)









































- Slides: 117

STRUTTURA ATOMICA Agli inizi del 1900 (dopo la scoperta dell’elettrone) si pensava che le leggi della meccanica classica (Newton) potessero essere applicate con successo per la descrizione del moto degli elettroni attorno al nucleo. In realtà, tramite l’applicazione delle leggi della fisica classica un gran numero di risultati sperimentali non potevano essere riprodotti. Per questo nei primi 25 anni del 1900 venne formulata una nuova teoria, la teoria quantistica, in grado di spiegare sia i risultati precedentemente compresi sia i nuovi esperimenti. Tra i cambiamenti che portarono allo sviluppo di questa nuova teoria fu la scoperta che le particelle possiedono proprietà simili a quelle di un’onda e in questo senso la struttura elettronica degli atomi è strettamente legata alla natura delle onde elettromagnetiche (luce e spettri atomici)

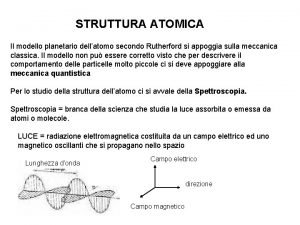
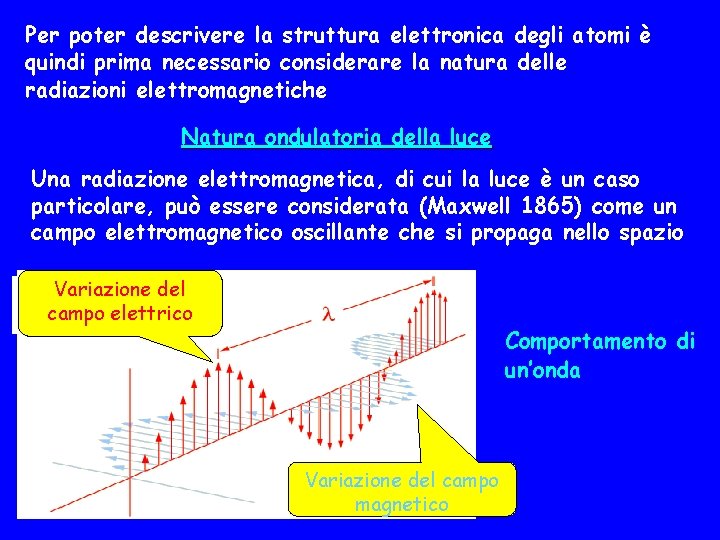
Per poter descrivere la struttura elettronica degli atomi è quindi prima necessario considerare la natura delle radiazioni elettromagnetiche Natura ondulatoria della luce Una radiazione elettromagnetica, di cui la luce è un caso particolare, può essere considerata (Maxwell 1865) come un campo elettromagnetico oscillante che si propaga nello spazio Variazione del campo elettrico Comportamento di un’onda Variazione del campo magnetico

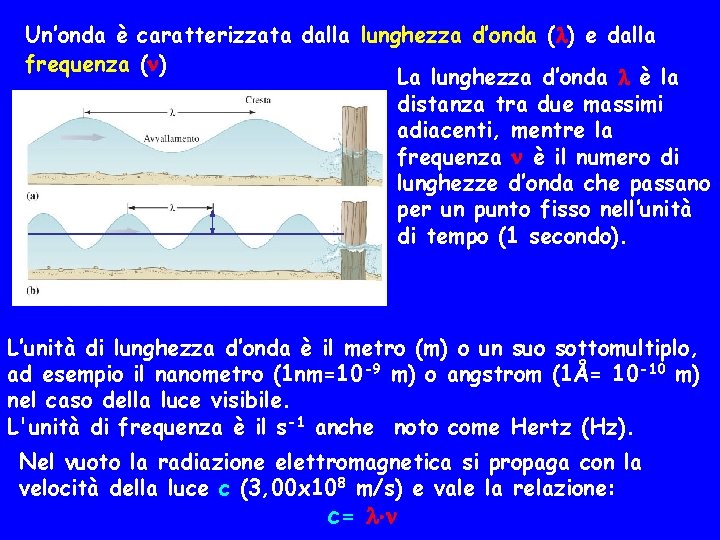
Un’onda è caratterizzata dalla lunghezza d’onda ( ) e dalla frequenza ( ) La lunghezza d’onda è la distanza tra due massimi adiacenti, mentre la frequenza è il numero di lunghezze d’onda che passano per un punto fisso nell’unità di tempo (1 secondo). L’unità di lunghezza d’onda è il metro (m) o un suo sottomultiplo, ad esempio il nanometro (1 nm=10 -9 m) o angstrom (1Å= 10 -10 m) nel caso della luce visibile. L'unità di frequenza è il s-1 anche noto come Hertz (Hz). Nel vuoto la radiazione elettromagnetica si propaga con la velocità della luce c (3, 00 x 108 m/s) e vale la relazione: c=

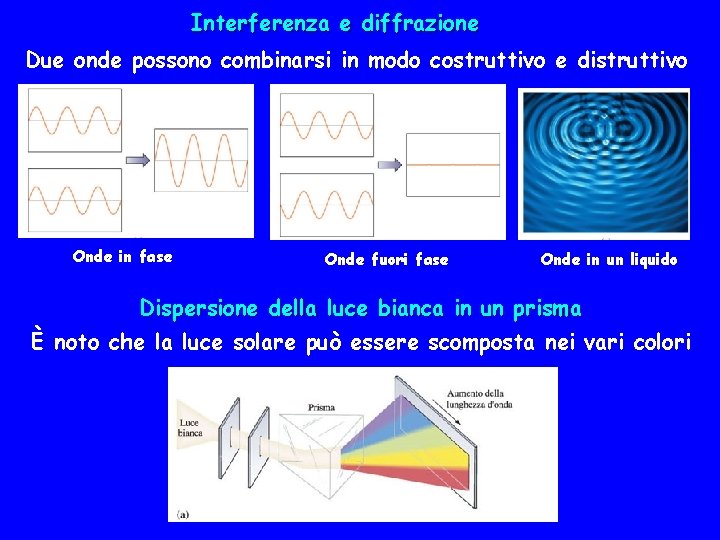
Interferenza e diffrazione Due onde possono combinarsi in modo costruttivo e distruttivo Onde in fase Onde fuori fase Onde in un liquido Dispersione della luce bianca in un prisma È noto che la luce solare può essere scomposta nei vari colori

L'intero intervallo di lunghezze d'onda e frequenze delle radiazioni eletttromagnetiche è detto spettro elettromagnetico e spazia dalle onde radio (1 -1000 m) ai raggi (10 -11 -10 -13 m). La luce visibile costituisce un piccolo intervallo di questo spettro da 4 x 10 -7 m (violetto) a 7 x 10 -7 m (rosso)

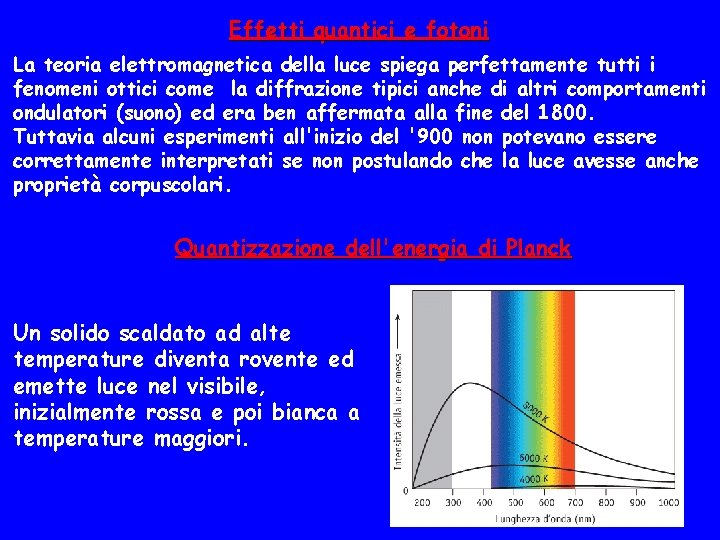
Effetti quantici e fotoni La teoria elettromagnetica della luce spiega perfettamente tutti i fenomeni ottici come la diffrazione tipici anche di altri comportamenti ondulatori (suono) ed era ben affermata alla fine del 1800. Tuttavia alcuni esperimenti all'inizio del '900 non potevano essere correttamente interpretati se non postulando che la luce avesse anche proprietà corpuscolari. Quantizzazione dell'energia di Planck Un solido scaldato ad alte temperature diventa rovente ed emette luce nel visibile, inizialmente rossa e poi bianca a temperature maggiori.

Planck (1900) riuscì a spiegare questo fenomeno ipotizzando che gli atomi del solido vibrano con la stessa frequenza della radiazione emessa e che ogni atomo che vibra può avere solo energie multiple di una certa quantità h· E= nh n=1, 2, 3, . . . in cui h è la costante di Planck h=6, 63 x 10 -34 J s Le uniche energie di un atomo che vibra possono dunque essere: h , 2 h , 3 h , . . . I numeri n che determinano le energie sono detti numeri quantici In tali casi si dice che l'energia è quantizzata cioè può assumere solo certi valori determinati e non valori intermedi.

Effetto fotoelettrico Quando la superficie di un metallo è esposta ad una radiazione elettromagnetica si ha espulsione di un elettrone. Gli elettroni sono espulsi solo se la luce ha una frequenza maggiore di un certo valore di soglia E 0 caratteristico del particolare metallo. Inoltre anche se la frequenza raggiunge il valore di soglia all'aumentare dell'intensità della luce utilizzata la velocità degli elettroni espulsi non aumenta, aumenta solo il loro numero. Solo se > 0 Questo fenomeno non era spiegabile con la fisica classica secondo cui l'energia di una radiazione elettromagnetica dipende solo dall'ampiezza dell'onda e non dalla frequenza E (Ampiezza)2 intensità

Einstein (1905) postulò che la luce consisteva di particelle chiamate fotoni che possedevano energia: E= h Un singolo elettrone poteva essere espulso dal metallo quando veniva colpito da un singolo fotone con energia sufficiente per vincere la forza di attrazione del metallo. Per strappare un elettrone a un metallo occorre un’energia E 0 detta funzione lavoro. Se h è maggiore di E 0 l’elettrone ha energia cinetica: Energia cinetica degli elettroni espulsi ½mv 2= h -E 0 Quando il fotone colpisce il metallo la sua energia h è assorbita dall’elettrone e il fotone cessa di esistere come particella. Questo illustra il dualismo onda-particella della luce che si comporta come onda nei fenomeni macroscopici ottici (diffrazione) e come particella nei fenomeni microscopici (interazione con gli elettroni).

TEORIA DI BOHR DELL’ATOMO DI IDROGENO Secondo il modello nucleare di Rutherford l’atomo è formato da un nucleo con carica positiva attorno al quale si muovono gli elettroni. Nel caso più semplice, l’idrogeno, si ha un elettrone che si muove attorno ad un protone. Tale modello pose subito un grosso dilemma: secondo la fisica classica una particella carica che orbita attorno ad un centro deve perdere continuamente energia e seguire un’orbita a spirale che lo porta sul nucleo. orbita nucleo elettrone +

TEORIA DI BOHR DELL’ATOMO DI IDROGENO (1913) Bohr riuscì a spiegare la stabilità dell'atomo di idrogeno e il suo spettro a righe con una teoria basata sui seguenti postulati 1. Un elettrone in un atomo può avere solo valori specifici dell'energia noti come livelli energetici. Tale idea è ripresa dalla quantizzazione dell'energia di Planck. Sulla base di considerazioni elettrostatiche egli derivò inoltre la seguente formula per i livelli energetici dell'elettrone nell'atomo di idrogeno: in cui RH= 2, 18 x 10 -18 J è nota come costante di Rydberg e n come numero quantico principale

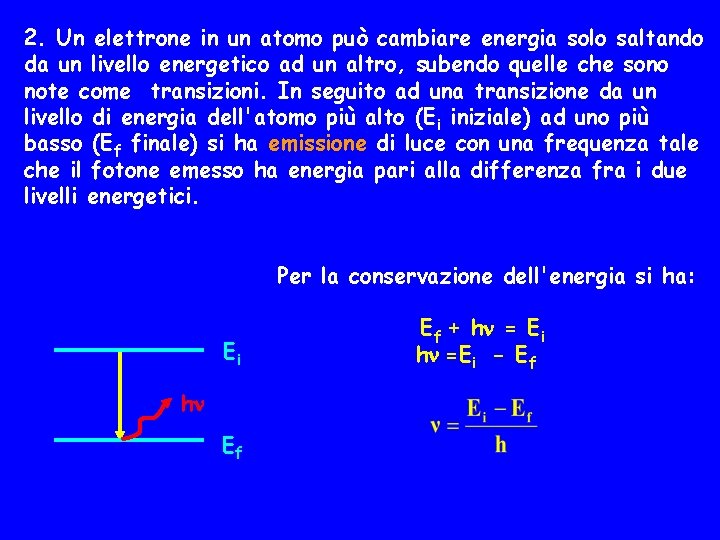
2. Un elettrone in un atomo può cambiare energia solo saltando da un livello energetico ad un altro, subendo quelle che sono note come transizioni. In seguito ad una transizione da un livello di energia dell'atomo più alto (Ei iniziale) ad uno più basso (Ef finale) si ha emissione di luce con una frequenza tale che il fotone emesso ha energia pari alla differenza fra i due livelli energetici. Per la conservazione dell'energia si ha: Ei h Ef Ef + h = Ei h =Ei - Ef

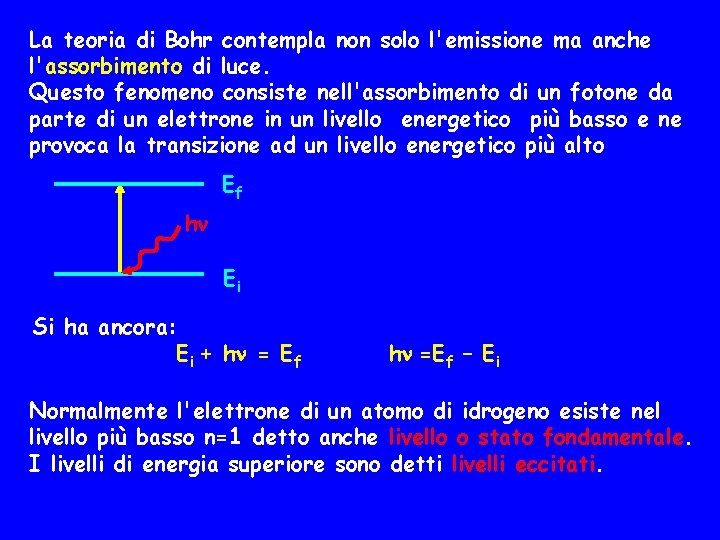
La teoria di Bohr contempla non solo l'emissione ma anche l'assorbimento di luce. Questo fenomeno consiste nell'assorbimento di un fotone da parte di un elettrone in un livello energetico più basso e ne provoca la transizione ad un livello energetico più alto Ef h Ei Si ha ancora: Ei + h = Ef h =Ef – Ei Normalmente l'elettrone di un atomo di idrogeno esiste nel livello più basso n=1 detto anche livello o stato fondamentale. I livelli di energia superiore sono detti livelli eccitati.

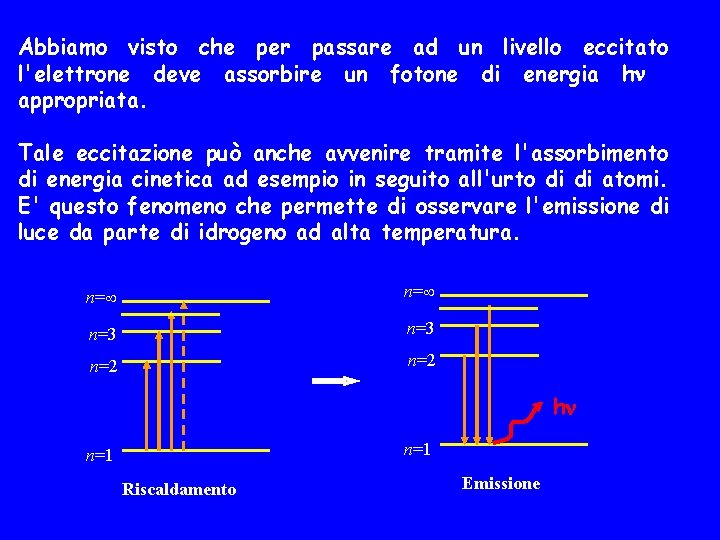
Abbiamo visto che per passare ad un livello eccitato l'elettrone deve assorbire un fotone di energia h appropriata. Tale eccitazione può anche avvenire tramite l'assorbimento di energia cinetica ad esempio in seguito all'urto di di atomi. E' questo fenomeno che permette di osservare l'emissione di luce da parte di idrogeno ad alta temperatura. n= n=3 n=2 h n=1 Riscaldamento Emissione

MECCANICA QUANTISTICA La teoria di Bohr, tra l'altro, prevedeva anche l'elettrone avesse un'orbita circolare con un raggio che poteva essere calcolato per ogni livello energetico, cioè per ogni n. Sebbene la teoria di Bohr riuscisse a spiegare con successo vari aspetti sperimentali dell'atomo di idrogeno, essa era molto specifica e non poteva essere generalizzata al caso di atomi con più elettroni. Le idee correnti sulla struttura atomica si basano sulla meccanica quantistica, una teoria che sostituisce la meccanica classica nel caso di particelle microscopiche e tiene conto della loro natura ondulatoria.

Relazione di De Broglie (1923) Abbiamo visto come la luce non ha solo proprietà di un'onda ma anche quelle di una particella (nei fenomeni microscopici), il fotone, energia E= h De Broglie propose anche le particelle di materia potessero manifestare proprietà ondulatorie. In particolare sulla base di analogie con la luce postulò che una particella di massa m e velocità v ha una lunghezza d'onda associata

Principio di indeterminazione di Heisemberg (1927) Come conseguenza della natura ondulatoria delle particelle microscopiche esiste una limitazione sulla determinazione simultanea della posizione e della velocità di tali particelle: in altre parole non è possibile conoscere con esattezza sia la posizione che la velocità della particella (no traiettoria) In particolare Heisemberg derivò l'omonimo principio di indeterminazione secondo il quale il prodotto dell'incertezza sulla posizione e di quella sulla quantità di moto (massa x velocità) di una particella è maggiore o uguale alla costante di Planck divisa per 4 In cui x è l'incertezza sulla coordinata x della particella, vx quella sulla velocità nella direzione x e m la sua massa.

Per una particella macroscopica (m grande) le incertezze sono piccole e del tutto trascurabili. Per una particella microscopica (m piccola) le incertezze diventano significative (l'incertezza sulla posizione dell'elettrone è circa uguale alla grandezza dell'atomo) e fanno perdere significato al concetto di traiettoria. Conoscere la traiettoria di una particella vuol dire conoscere le coordinate (x, y, z) in ogni istante successivo, cioè x(t), y(t) e z(t). Questo però è proibito dal principio di indeterminazione di Heisemberg perchè corrisponderebbe a conoscere esattamente posizione e velocità, dx(t)/dt è la velocità vx, della particella. Questo principio dunque pone un limite alla determinazione simultanea di posizione e velocità di un elettrone.

Funzioni d'onda Schrödinger formulò nel 1926 una teoria nota come meccanica quantistica o meccanica ondulatoria che permette di descrivere matematicamente le proprietà ondulatorie delle particelle microscopiche ed in particolare dell'elettrone. In particolare la meccanica quantistica cambia il modo stesso di concepire il moto delle particelle che è basato sulla meccanica classica e sul concetto di traiettoria. Invece di una traiettoria, Schrödinger associò all'elettrone una funzione detta funzione d'onda (x, y, z) tale che il suo quadrato | (x, y, z)|2 dà la probabilità di trovare la particella nel punto dello spazio di coordinate (x, y, z).

Quindi: alla visione deterministica della meccanica classica – posizione esatta della particella ad ogni istante t – si sostituisce la visione statistica della meccanica quantistica – probabilità di trovare la particella in un punto dello spazio. Sulla base di analogie con il moto delle onde Schrödinger ricavò l'equazione fondamentale della meccanica quantistica, nota come equazione di Schrödinger. Tale equazione è matematicamente complicata ma le proprietà delle sue soluzioni – le funzioni d’onda – hanno notevoli implicazioni in fisica e in chimica.

Orbitali atomici e numeri quantici In accordo con la meccanica quantistica ogni elettrone in un atomo è descritto da una funzione d'onda (x, y, z) che dà la probabilità di trovare l'elettrone nei vari punti nello spazio. (x, y, z) è una funzione d’onda che descrive la particella, ma in sé non ha un significato fisico, è solo un artificio matematico. Una funzione d'onda di un elettrone in un atomo è chiamata orbitale atomico

Un orbitale atomico è definito da tre numeri quantici (n, , m ) che formalmente sono una conseguenza matematica della soluzione dell'equazione di Schrodinger. L'elettrone è poi caratterizzato da un quarto numero quantico ms legato al moto di spin dell'elettrone (rotazione attorno all'asse)

Numero quantico principale n: determina l'energia dell'elettrone e può assumere qualsiasi valore intero positivo: n = 1, 2, 3. . Più grande è n maggiore è l'energia Per gli atomi monoelettronici (H, He+, Li 2+) l'energia dipende solo da n, per atomi polielettronici dipende anche dal numero quantico . Il numero quantico n determina anche la dimensione dell'orbitale: più grande è n più grande è l'orbitale. Orbitali con lo stesso numero quantico n si dice che appartengono allo stesso strato elettronico. Gli strati elettronici sono designati con le seguenti lettere. Strato n K 1 L 2 M 3 N 4

Numero quantico del momento angolare : è detto anche numero quantico azimutale e distingue la forma di orbitali con lo stesso n. Per ogni dato n, può assumere tutti i valori interi compresi tra 0 e n-1 = 0, 1, 2, 3, . . . , n-1 Ad esempio nello strato M con n=3 si possono avere tipi di orbitali distinti dai valori di n=3 =0, 1, 2 n-1=3 -1=2 ciascuno dei quali ha una diversa forma cioè una diversa distribuzione di probabilità nello spazio I diversi orbitali sono indicati con le seguenti lettere: lettera s 0 p 1 d 2 f 3 g 4

Gli orbitali vengono indicati scrivendo prima il numero principale n (1, 2, 3, . . ) e poi la lettera corrispondente al numero quantico (s, p, d, f, . . ). Orbitali aventi lo stesso n e diverso si dice che appartengono allo stesso sottostrato o stesso sottolivello. Esempi: Per n=1 si può avere =0 cioè l'orbitale 1 s Per n=2 si può avere =0 =1 cioè l'orbitale 2 s Per n=3 si può avere Per n=4 si può avere =0 =1 =2 =3 cioè l'orbitale 2 p cioè l'orbitale 3 s cioè l'orbitale 3 p cioè l'orbitale 3 d cioè l'orbitale 4 s cioè l'orbitale 4 p cioè l'orbitale 4 d cioè l'orbitale 4 f

Numero quantico del momento magnetico m : determina l'orientamento spaziale di orbitali con n e con dimensione e forma definite. definiti, cioè m può assumere tutti i valori interi tra - e + , cioè m = - , - +1, . . , 0, 1, . . . , -1, Per ogni dato compresi Ad esempio =0 s m =0 1 orbitale s =1 p m =-1, 0, +1 3 orbitali p =2 d m =-2, -1, 0, +1, +2 5 orbitali d Orbitali con lo stesso ma diverso m hanno la stessa forma ma diversa nello spazio. =3 orientazione f m =-3, -2, -1, 0, +1, +2, +3 7 orbitali Perf un dato sono possibili 2 +1 orientazioni diverse (n di orbitali dello stesso tipo)

Numero quantico di spin ms: determina le due possibili orientazioni dell'asse di spin di un elettrone e può assumere i valori ms=+1/2 e ms=-1/2 Un elettrone si comporta come la terra ruotando intorno ad un asse e il valore di ms determina il verso di rotazione. Problema: Determinare quale dei seguenti gruppi di numeri quantici è possibile per un elettrone in un atomo n=1 n=3 n=2 n=0 n=2 n=3 =1 =1 =1 =0 =1 =3 =2 m =0 ms=+1/2 NO m =-2 ms=-1/2 NO m =0 ms=+1/2 SI m =0 ms=+1 ms=-1/2 NO m =0 ms=-1/2 NO NO m =2 ms=0 NO

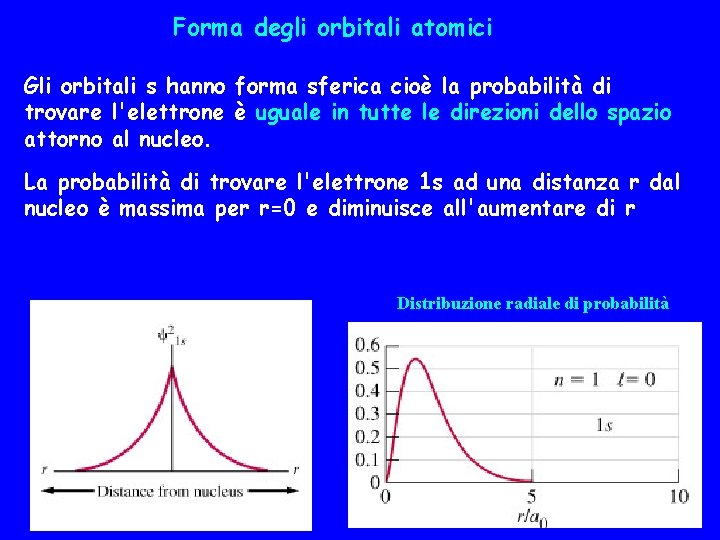
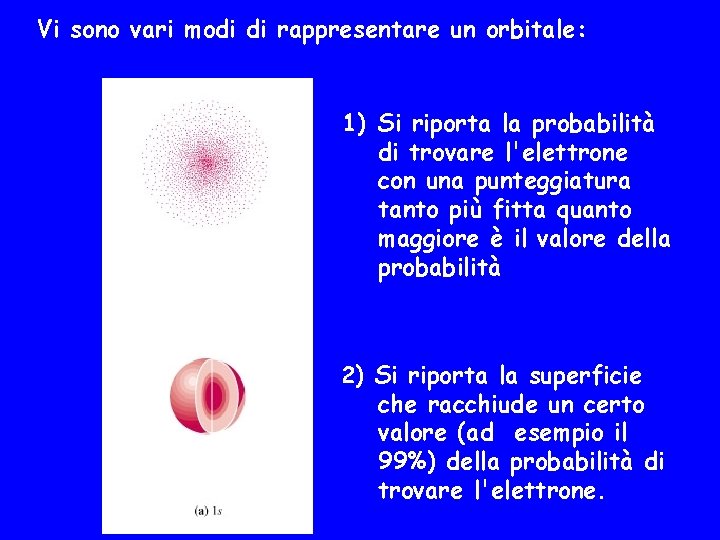
Forma degli orbitali atomici Gli orbitali s hanno forma sferica cioè la probabilità di trovare l'elettrone è uguale in tutte le direzioni dello spazio attorno al nucleo. La probabilità di trovare l'elettrone 1 s ad una distanza r dal nucleo è massima per r=0 e diminuisce all'aumentare di r Distribuzione radiale di probabilità

Vi sono vari modi di rappresentare un orbitale: 1) Si riporta la probabilità di trovare l'elettrone con una punteggiatura tanto più fitta quanto maggiore è il valore della probabilità 2) Si riporta la superficie che racchiude un certo valore (ad esempio il 99%) della probabilità di trovare l'elettrone.

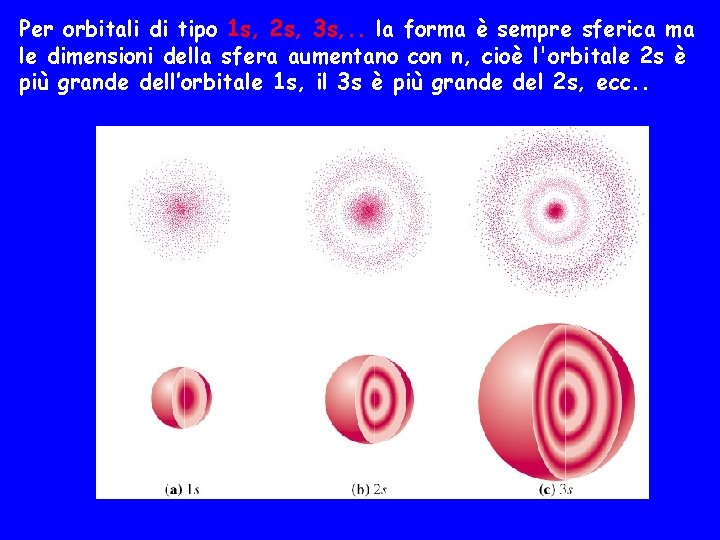
Per orbitali di tipo 1 s, 2 s, 3 s, . . la forma è sempre sferica ma le dimensioni della sfera aumentano con n, cioè l'orbitale 2 s è più grande dell’orbitale 1 s, il 3 s è più grande del 2 s, ecc. .

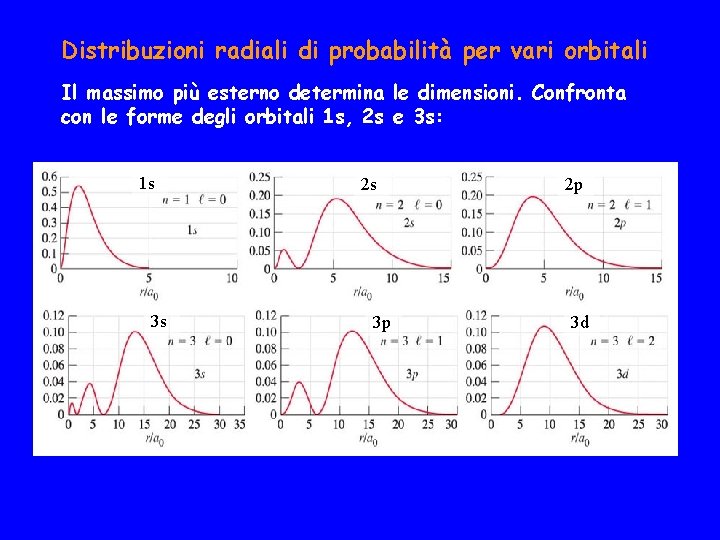
Distribuzioni radiali di probabilità per vari orbitali Il massimo più esterno determina le dimensioni. Confronta con le forme degli orbitali 1 s, 2 s e 3 s: 1 s 3 s 2 s 3 p 2 p 3 d

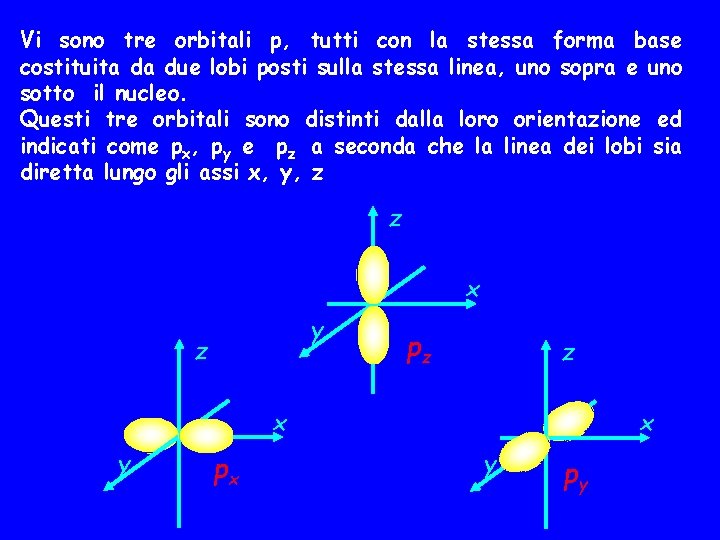
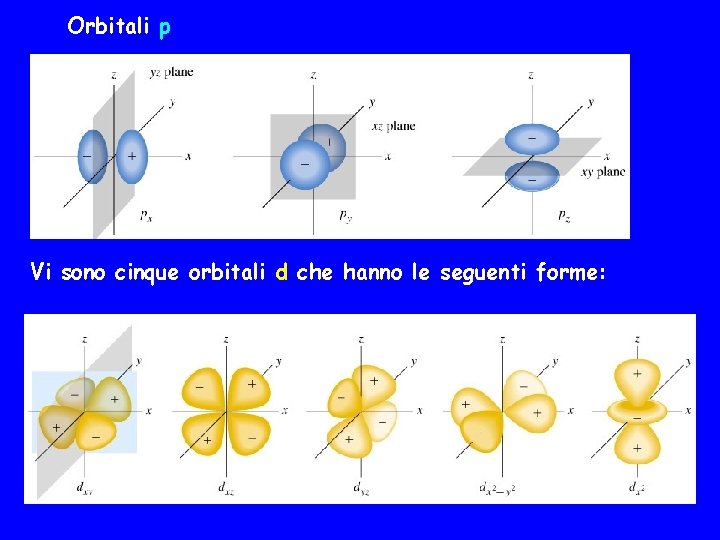
Vi sono tre orbitali p, tutti con la stessa forma base costituita da due lobi posti sulla stessa linea, uno sopra e uno sotto il nucleo. Questi tre orbitali sono distinti dalla loro orientazione ed indicati come px, py e pz a seconda che la linea dei lobi sia diretta lungo gli assi x, y, z z x y z pz z x y px x y py

Orbitali p Vi sono cinque orbitali d che hanno le seguenti forme:

Riassumendo

Spin elettronico Per spiegare completamente le proprietà atomiche è necessario associare all'elettrone il numero quantico di spin ms che determina i due possibili orientamenti dell'asse di rotazione dell'elettrone corrispondenti a ms=+1/2 e -1/2. L'elettrone si comporta come se fosse una sfera carica in rotazione ed in conseguenza di ciò si comporta come un dipolo magnetico (di fatto un piccolo magnete) nella direzione dell'asse magnetico. A causa di restrizioni quantiche sono possibili solo due direzioni del momento magnetico corrispondenti ai numeri quantici di spin ms=+1/2 e -1/2.

Per l'atomo di idrogeno e gli ioni monoelettronici l'energia degli orbitali dipende solo da n Energia 4 s 3 s 2 s 1 s 4 p 4 d 3 p 3 d 4 f 2 p L’unico elettrone si trova nell’orbitale 1 s nello stato fondamentale e in un orbitale superiore negli stati eccitati

Configurazioni elettroniche di atomi polielettronici Una configurazione elettronica di un atomo è una particolare distribuzione degli elettroni fra i vari sottostrati ovvero fra i vari orbitali senza la specificazone degli m. Essa è indicata dalla successione dei simboli dei sottostrati con un indice in alto a destra che indica il numero di elettroni presenti nel sottostrato. Ad esempio una configurazione per l'atomo di litio (Z=3 e quindi 3 elettroni) è 1 s 2 2 s 1 Si fa spesso uso di una rappresentazione grafica in cui ogni orbitale è rappresentato da un cerchio (o da un quadrato) e sono riportati tutti gli orbitali possibili per ogni sottostrato. La presenza di un elettrone in un orbitale è indicata da una freccia che punta verso l'alto per ms=+1/2 e verso il basso per ms=-1/2.

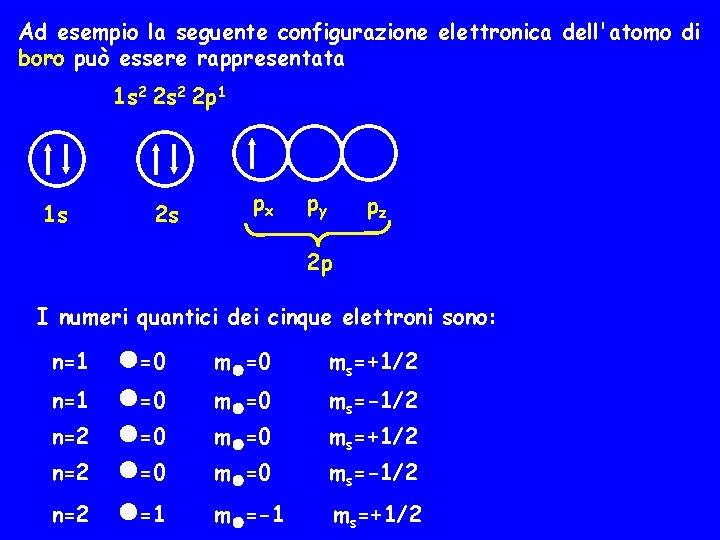
Ad esempio la seguente configurazione elettronica dell'atomo di boro può essere rappresentata 1 s 2 2 p 1 1 s 2 s px py pz 2 p I numeri quantici dei cinque elettroni sono: n=1 n=2 n=2 =0 =0 =1 m =0 ms=+1/2 m =0 ms=-1/2 m =-1 ms=+1/2

Non tutte le possibili configurazioni elettroniche sono fisicamente permesse. Ciò è regolato dal principio di esclusioni di Pauli che afferma che due elettroni in un atomo non possono avere tutti e quattro i numeri quantici uguali. Poiché un elettrone in un dato orbitale ha i numeri quantici n, e m fissati ne segue che il restante numero quantico ms può assumere solo i valori ms=+1/2 e ms=-1/2, quindi un dato orbitale può essere occupato al massimo da due elettroni con spin opposto. Ad esempio l'orbitale 1 s è caratterizzato dai numeri quantici n=1 =0 e m =0 e può contenere solo due elettroni con ms=+1/2 e ms= -1/2. Ciò può essere rappresentato graficamente da un cerchietto con due frecce con verso opposto

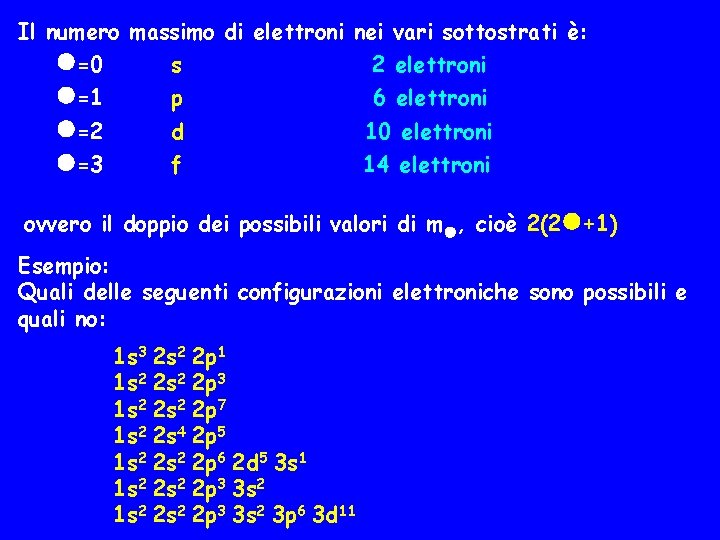
Il numero massimo di elettroni nei vari sottostrati è: =0 s 2 elettroni =1 =2 =3 p 6 elettroni d 10 elettroni f 14 elettroni ovvero il doppio dei possibili valori di m , cioè 2(2 +1) Esempio: Quali delle seguenti configurazioni elettroniche sono possibili e quali no: 1 s 3 2 s 2 2 p 1 1 s 2 2 p 3 1 s 2 2 p 7 1 s 2 2 s 4 2 p 5 1 s 2 2 p 6 2 d 5 3 s 1 1 s 2 2 s 2 2 p 3 3 s 2 3 p 6 3 d 11

Principio di Aufbau Per un atomo vi sono infinite configurazioni elettroniche possibili. Fra queste una corrisponde allo stato a più bassa energia dell'atomo, nota come stato fondamentale. Tutte le altre configurazioni corrispondono a stati a più alta energia noti come stati eccitati. Per determinare lo stato fondamentale di un dato atomo si riempiono gli orbitali in ordine di energia crescente compatibilmente con il principio di esclusione di Pauli. Ad esempio per l'atomo di litio (Z=3 e quindi 3 elettroni) : 1 s 2 2 s 1 1 s 2 2 p 1 1 s 1 2 s 2. . . . Configurazione corrispondente allo stato fondamentale Configurazioni corrispondenti a stati eccitati

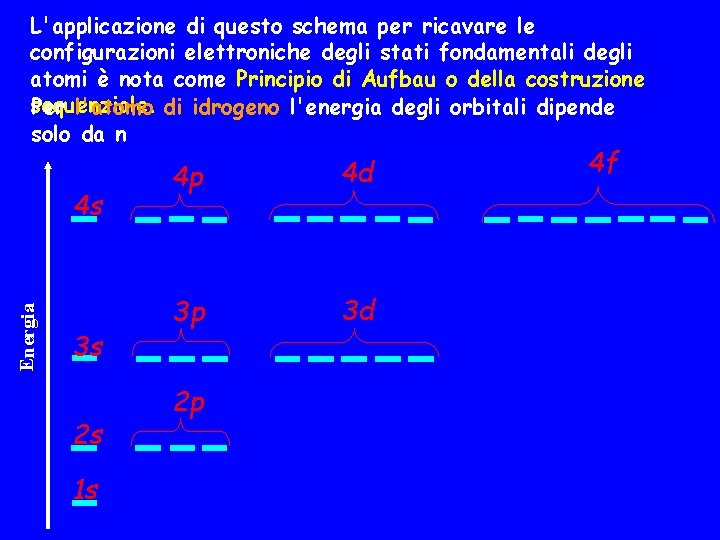
L'applicazione di questo schema per ricavare le configurazioni elettroniche degli stati fondamentali degli atomi è nota come Principio di Aufbau o della costruzione sequenziale. Per l'atomo di idrogeno l'energia degli orbitali dipende solo da n Energia 4 s 3 s 2 s 1 s 4 p 4 d 3 p 3 d 2 p 4 f

Per un atomo polielettronico l’energia dipende anche da , ma non da m per cui si dovrebbe parlare di energia dei sottostrati. Al crescere di n la dipendenza dell'energia da può essere così forte che orbitali di uno strato superiore possono essere più bassi di quelli dello strato inferiore con elevato: E(4 s)<E(3 d) L’energia totale di un atomo dipende non soltanto dalle energie dei sottostrati ma anche dalle energie di interazione tra i diversi strati

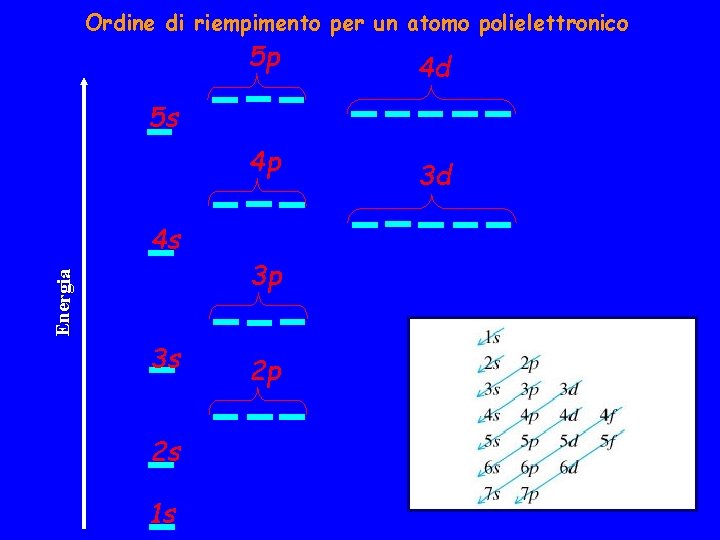
Ordine di riempimento per un atomo polielettronico 5 p 4 d 5 s 4 p Energia 4 s 3 s 2 s 1 s 3 p 2 p 3 d

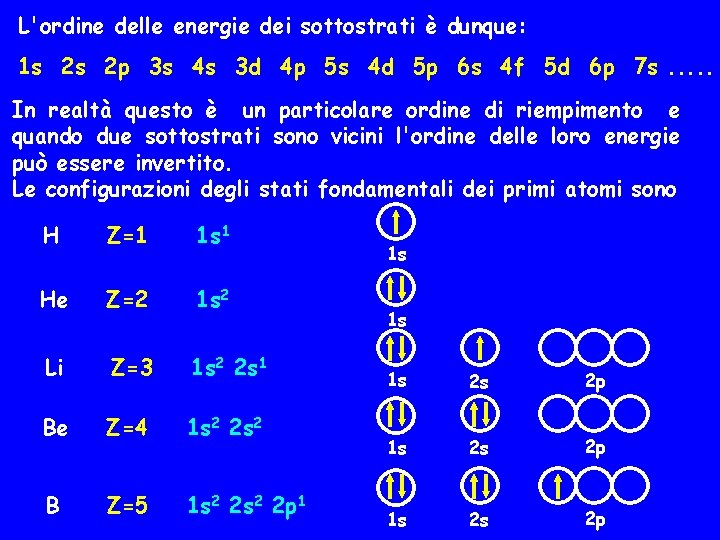
L'ordine delle energie dei sottostrati è dunque: 1 s 2 s 2 p 3 s 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s. . . In realtà questo è un particolare ordine di riempimento e quando due sottostrati sono vicini l'ordine delle loro energie può essere invertito. Le configurazioni degli stati fondamentali dei primi atomi sono H Z=1 1 s 1 He Z=2 1 s 2 Li Z=3 1 s 2 2 s 1 Be Z=4 1 s 2 2 s 2 B Z=5 1 s 2 2 p 1 1 s 1 s 1 s 2 s 2 p

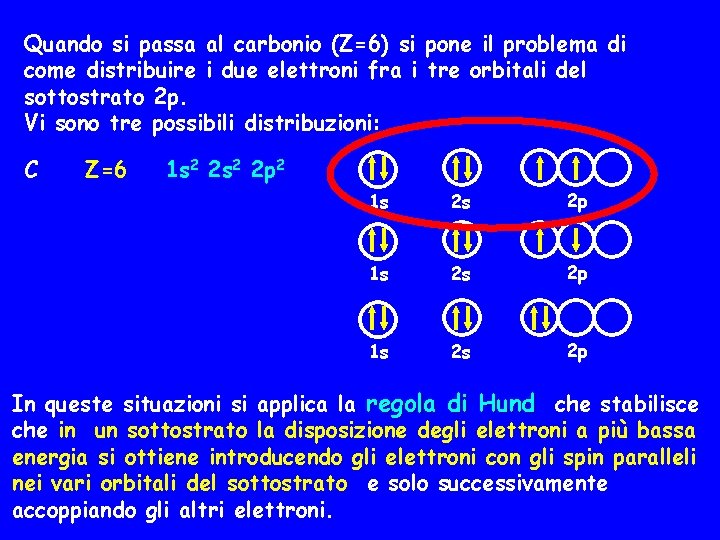
Quando si passa al carbonio (Z=6) si pone il problema di come distribuire i due elettroni fra i tre orbitali del sottostrato 2 p. Vi sono tre possibili distribuzioni: C Z=6 1 s 2 2 p 2 1 s 2 s 2 p In queste situazioni si applica la regola di Hund che stabilisce che in un sottostrato la disposizione degli elettroni a più bassa energia si ottiene introducendo gli elettroni con gli spin paralleli nei vari orbitali del sottostrato e solo successivamente accoppiando gli altri elettroni.

Per il carbonio e gli atomi successivi del secondo periodo si ha quindi: C Z=6 1 s 2 2 p 2 N Z=7 1 s 2 2 p 3 O Z=8 1 s 2 2 p 4 F Z=9 1 s 2 2 p 5 Ne Z=10 1 s 2 2 p 6 1 s 2 s 2 p 1 s 2 s 2 p

Proprietà magnetiche Le proprietà magnetiche di una sostanza possono fornire informazioni sulla disposizione degli elettroni nell'atomo (o, come vedremo dopo, nella molecola) Un elettrone in un atomo si comporta come un piccolo magnete e genera un campo magnetico. Gli effetti dei campi magnetici associati a due elettroni a spin opposto si eliminano a vicenda. Di conseguenza un atomo che ha solo orbitali doppiamente occupati non presenta un magnetismo di spin. Al contrario un atomo in cui sono presenti elettroni spaiati (cioè che occupano singolarmente un orbitale) mostra un magnetismo di spin. Nel primo caso la sostanza è diamagnetica (non attratta o lievemente respinta da un campo magnetico) mentre nel secondo caso la sostanza è paramagnetica (debolmente attratta da un campo magnetico). Ad esempio sono diamagnetici l’elio e il neon e paramagnetici l’idrogeno e il litio (in forma atomica gassosa, normalmente non è così, ad es. H 2)

Configurazioni elettroniche e tavola periodica Ritorniamo ora al riempimento successivo dei sottostrati fra gli elementi finora considerati, l'elio He ed il neon Ne hanno gli strati n=1 e n=2 completi cosa che conferisce a queste configurazioni una particolare stabilità e rende gli elementi non reattivi He Z=2 1 s 2 Ne Z=10 1 s 2 2 p 6 Per semplicità nella configurazione di un atomo si scrive [He] per indicare lo strato n=1 mentre si sta riempiendo lo strato n=2 o [Ne] per indicare gli strati n=1 e n=2 mentre si sta riempiendo lo strato n=3. Ad esempio: C 1 s 2 2 p 2 oppure [He] 2 s 2 2 p 2

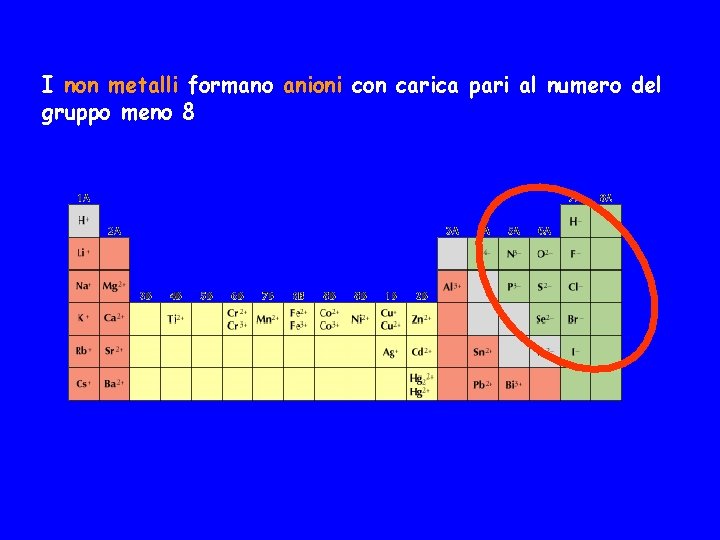
![Lo strato n3 inizia a riempirsi con il sodio Z11 Ne 3 s 1 Lo strato n=3 inizia a riempirsi con il sodio Z=11 [Ne] 3 s 1](https://slidetodoc.com/presentation_image_h/c25a5bfde074a2533a4cf3e2b8b6367d/image-51.jpg)
Lo strato n=3 inizia a riempirsi con il sodio Z=11 [Ne] 3 s 1 Mg Z=12 [Ne] 3 s 2 Al Z=13 [Ne] 3 s 23 p 1 Z=18 [Ne] 3 s 23 p 6 oppure 1 s 2 2 p 6 3 s 1 …… Na Ar Anche se non si è completato lo strato n=3 il sottostrato rimanente, il 3 d, è molto più in alto in energia del 3 p, persino più del 4 s. Pertanto la configurazione con il sottostrato 3 p riempito è particolarmente stabile e l'argo è un elemento non reattivo.
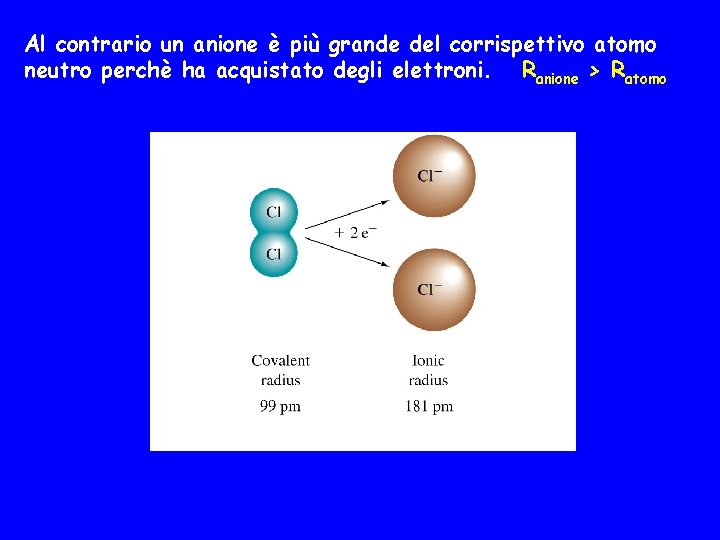
![Successivamente inizia il riempimento dellorbitale 4 s con K Z19 Ar 4 s 1 Successivamente inizia il riempimento dell'orbitale 4 s con K Z=19 [Ar] 4 s 1](https://slidetodoc.com/presentation_image_h/c25a5bfde074a2533a4cf3e2b8b6367d/image-52.jpg)
Successivamente inizia il riempimento dell'orbitale 4 s con K Z=19 [Ar] 4 s 1 Ca Z=20 [Ar]4 s 2 ovvero 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 A questo punto inizia a riempirsi il sottostrato 3 d con i metalli di transizione, 10 elementi perchè sono gli elettroni che possono occupare i cinque orbitali del sottostrato 3 d.
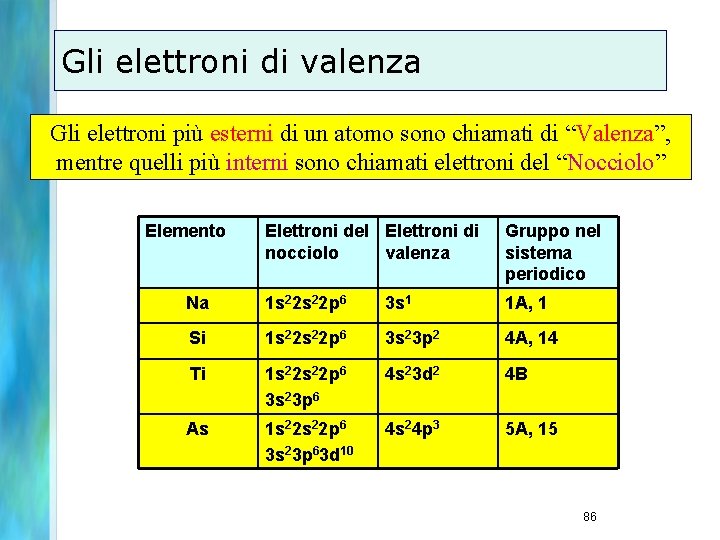
![Sc Z21 Ar 4 s 2 3 d 1 Ti Z22 Ar 4 s Sc Z=21 [Ar] 4 s 2 3 d 1 Ti Z=22 [Ar] 4 s](https://slidetodoc.com/presentation_image_h/c25a5bfde074a2533a4cf3e2b8b6367d/image-53.jpg)
Sc Z=21 [Ar] 4 s 2 3 d 1 Ti Z=22 [Ar] 4 s 2 3 d 2 V Z=23 [Ar] 4 s 2 3 d 3 …… Cr Z=24 non [Ar] 4 s 2 3 d 4 ma [Ar] 4 s 1 3 d 5 Zn Z=30 [Ar] 4 s 2 3 d 10

Ordine di riempimento per un atomo polielettronico 5 p 4 d 5 s 4 p Energia 4 s 3 s 2 s 1 s 3 p 2 p 3 d

Successivamente si riempie il sottostrato 4 p che è poco più alto del 3 d con gli elementi Ga Z=31 [Ar] 4 s 2 3 d 10 4 p 1 Ge Z=32 [Ar] 4 s 2 3 d 10 4 p 2 …… Kr Z=36 [Ar] 4 s 2 3 d 10 4 p 6 Il riempimento del sottostrato 4 p conduce di nuovo ad una configurazione stabile (il 4 d è molto più alto in energia, perfino più del 5 s) e ad un elemento poco reattivo (il kripto)

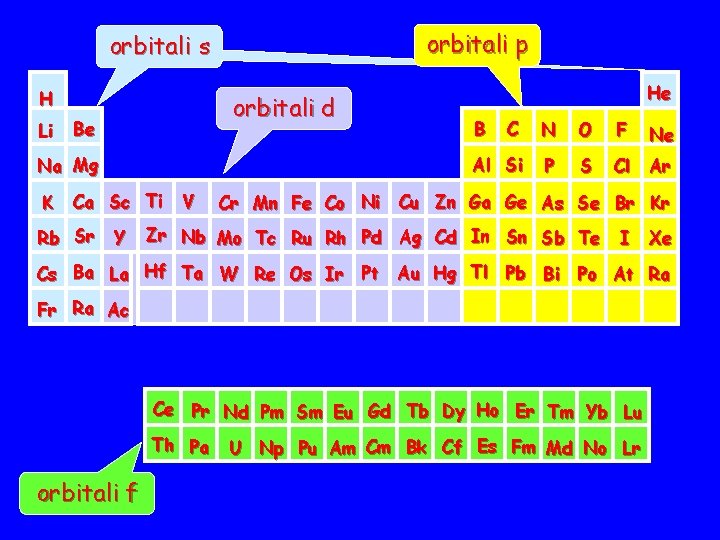
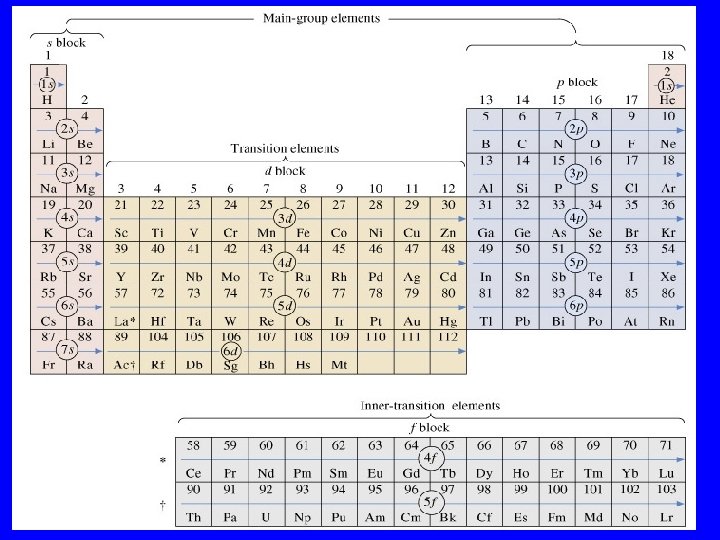
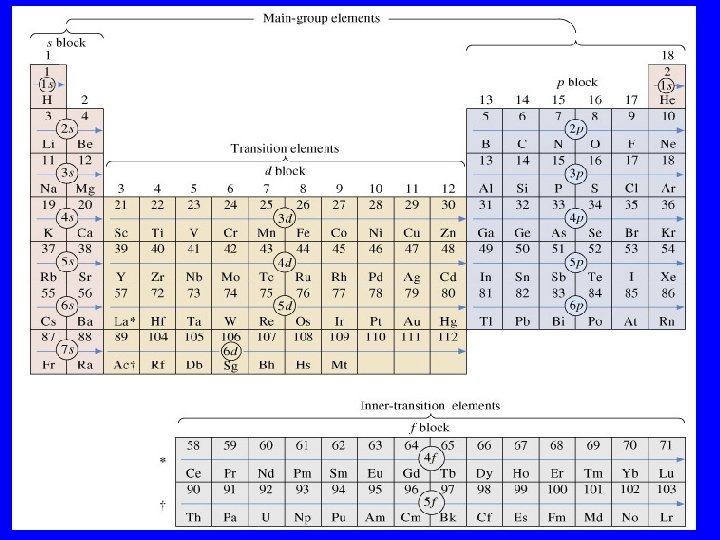
E’ possibile notare che le configurazioni elettroniche degli atomi viste finora seguono un preciso schema che permette di interpretare la tavola periodica. Ricordiamo che nella tavola periodica si possono distinguere sette righe note come periodi e diciotto colonne note come gruppi.

orbitali p orbitali s H Li orbitali d Be Na Mg K Ca Sc Ti Rb Sr Y V He B C N O F Ne Al Si P S Cl Ar Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ra Fr Ra Ac Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Th Pa orbitali f U Np Pu Am Cm Bk Cf Es Fm Md No Lr

Gli elementi del gruppo più a destra corrispondono al riempimento completo di un sottostrato p (eccetto l’He), che è molto più basso in energia del sottostrato successivo, e quindi ad una configurazione molto stabile. Tali elementi He elio Ne neon Ar argon Kr kripton 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 sono quindi non reattivi e noti come gas nobili e costituiscono il gruppo VIII A della tavola periodica

Uno strato (o guscio) è stato definito come un gruppo di orbitali aventi lo stesso n. Questo implica che le posizioni medie degli elettroni in ogni guscio sono vicine fra loro, ma lontane da quelle di orbitali con n diverso. Gli elettroni di valenza sono quelli che occupano lo strato più esterno, quello che viene dopo la configurazione del gas nobile che lo precede. Gli elettroni dei gusci più interni sono in media più vicini al nucleo ed hanno energie più basse (sono più fortemente legati) degli elettroni più esterni. Gli elettroni appartenenti ai gusci più interni sono detti elettroni di core. Quindi elementi successivi ai gas nobili in un gruppo qualsiasi della tavola periodica sono costituiti da un core o nocciolo a gas nobile più una configurazione analoga per i restanti elettroni di valenza.

Elementi dello stesso gruppo (colonna) della tavola periodica hanno configurazioni elettroniche di valenza analoghe. Le proprietà e il comportamento chimico di un atomo dipendono proprio dalla configurazione elettronica di valenza. Ad esempio gli elementi del gruppo IA hanno configurazioni: H Li Na K idrogeno litio sodio potassio 1 s 1 (eccezione) [He] 2 s 1 [Ne] 3 s 1 [Ar] 4 s 1 hanno tutti un solo elettrone di valenza ed una configurazione ns 1 Essi sono noti come metalli alcalini (eccetto H) ed hanno proprietà chimiche molto simili; ad esempio formano facilmente ioni Li+, Na+, K+, . . ciò perchè sono solo gli elettroni di valenza ad essere coinvolti nelle reazioni chimiche per cui configurazioni degli elettroni di valenza simili implicano proprietà chimiche simili.

Uno dei maggiori successi della meccanica quantistica è proprio la capacità di spiegare gli andamenti periodici scoperti dai chimici con l'introduzione della tavola periodica Consideriamo gli elementi del gruppo IIA: Be Mg Ca Sr berillio magnesio calcio stronzio [He] 2 s 2 [Ne] 3 s 2 [Ar] 4 s 2 [Kr] 5 s 2 Essi sono noti come metalli alcalino-terrosi ed hanno tutti una configurazione degli elettroni di valenza ns 2 e proprietà chimiche simili La somiglianza tra le configurazioni degli elettroni di valenza spiegano la somiglianza tra le proprietà chimiche all'interno dei gruppi. In molti casi è sufficiente solo conoscere la configurazione di valenza che si può ricavare dal numero del gruppo.

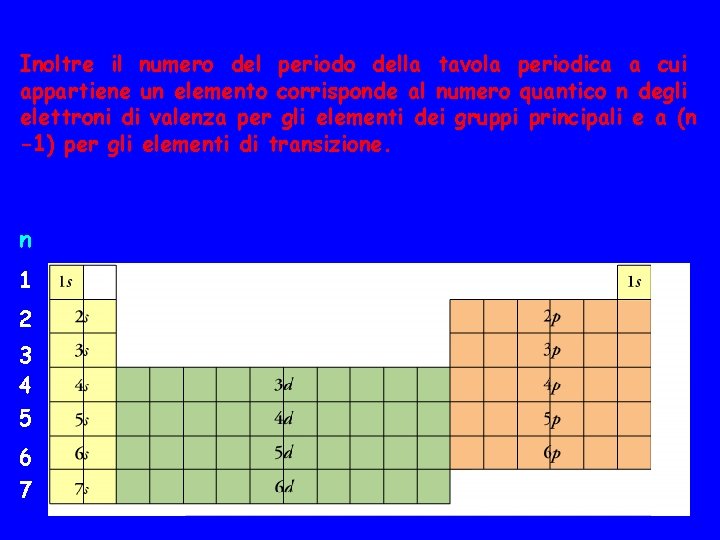
Inoltre il numero del periodo della tavola periodica a cui appartiene un elemento corrisponde al numero quantico n degli elettroni di valenza per gli elementi dei gruppi principali e a (n -1) per gli elementi di transizione. n 1 2 3 4 5 6 7

All’interno di un periodo l’energia di prima ionizzazione aumenta con il numero atomico: essa è quindi minima per i metalli alcalini e massima per i gas nobili. Nel primo caso si ha un elettrone esterno ad una configurazione con sottostrato p completo e che può essere perso facilmente. Nel secondo caso si deve togliere un elettrone da una configurazione con sottostrato p completo, molto stabile, e ciò richiede notevole energia.

Raggio atomico Un atomo non ha una grandezza definita in quanto la distribuzione statistica degli elettroni non termina bruscamente ad una certa distanza ma diminuisce gradualmente con la distanza dal nucleo. Di conseguenza le dimensioni di un atomo sono definite in maniera alquanto arbitraria e diverse definizioni di raggi atomici sono possibili. La più comune si riferisce ai raggi covalenti, ricavati dalla distanza fra i nuclei in composti molecolari H 2, Cl 2, ecc. I raggi atomici seguono il seguente andamento: - diminuiscono da sinistra a destra lungo un periodo - aumentano scendendo lungo il gruppo


Questo andamento può essere spiegato sulla base dei fattori che influenzano le dimensioni dell'orbitale più esterno: 1. maggiore è il numero quantico n più grande è l'orbitale 2. maggiore è la carica nucleare efficace più piccolo è l'orbitale La carica nucleare efficace è la carica positiva netta di cui un elettrone risente tenendo conto dell'azione di schermo degli elettroni più interni. Li litio 1 s 2 2 s 1 Z=3 Zeff=3 -2=1 per l'elettrone 2 s La carica nucleare efficace aumenta lungo un periodo perchè aumenta Z ma non gli elettroni del core.


Energia di ionizzazione L'energia (o potenziale) di prima ionizzazione è l'energia minima necessaria per rimuovere l'elettrone più esterno di un atomo neutro allo stato gassoso. Ad esempio per l'atomo di litio: Li (1 s 2 2 s 1) Li+ (1 s 2) + e. Le energie di ionizzazione sono in genere riferite ad una mole di atomi e riportate in k. J/mol. Talvolta esse sono riportate in elettronvolt (e. V) che è l'energia acquistata da un elettrone quando è accelerato da una differenza di potenziale di 1 volt.

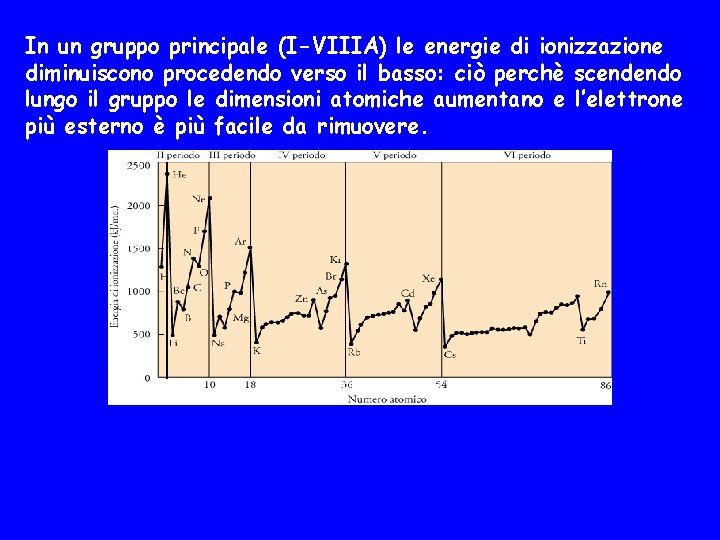
In un gruppo principale (I-VIIIA) le energie di ionizzazione diminuiscono procedendo verso il basso: ciò perchè scendendo lungo il gruppo le dimensioni atomiche aumentano e l’elettrone più esterno è più facile da rimuovere.

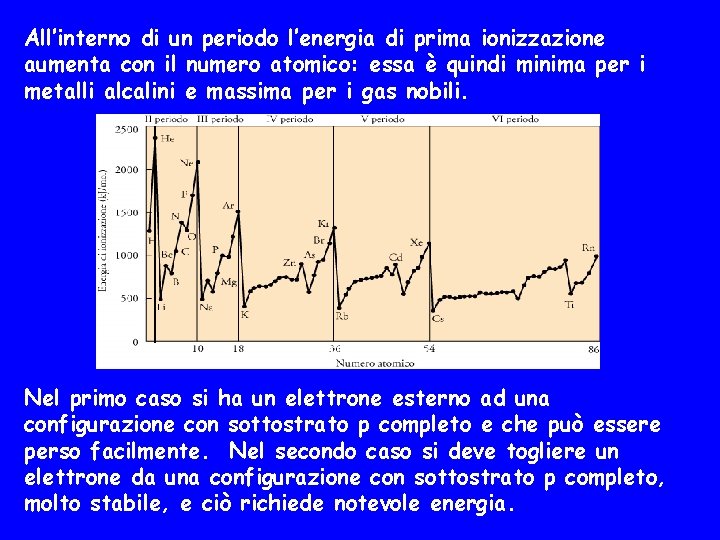
All’interno di un periodo l’energia di prima ionizzazione aumenta con il numero atomico: essa è quindi minima per i metalli alcalini e massima per i gas nobili. Nel primo caso si ha un elettrone esterno ad una configurazione con sottostrato p completo e che può essere perso facilmente. Nel secondo caso si deve togliere un elettrone da una configurazione con sottostrato p completo, molto stabile, e ciò richiede notevole energia.

All’interno di un periodo l’energia di prima ionizzazione aumenta con il numero atomico: essa è quindi minima per i metalli alcalini e massima per i gas nobili. Nel primo caso si ha un elettrone esterno ad una configurazione con sottostrato p completo e che può essere perso facilmente. Nel secondo caso si deve togliere un elettrone da una configurazione con sottostrato p completo, molto stabile, e ciò richiede notevole energia.

E’ possibile rimuovere da un atomo più di un elettrone. Le energie richieste sono note come energie di prima ionizzazione, seconda ionizzazione, terza ionizzazione, ecc. . M M+ + e. M+ M 2+ + e- (prima) ionizzazione seconda ionizzazione M 2+ M 3+ + e- terza ionizzazione Le energie di ionizzazione aumentano progressivamente. Si ha inoltre un brusco aumento in corrispondenza della rimozione del primo elettrone di core Dopo la rimozione di tutti gli elettroni di valenza si ha una configurazione a gas nobile particolarmente stabile.

Affinità elettronica L‘affinità elettronica è la variazione di energia per il processo di addizione di un elettrone ad un atomo neutro allo stato gassoso per dare uno ione negativo. A(g) + e- A-(g) Se lo ione negativo è stabile la variazione di energia ha un valore negativo. Le affinità elettroniche sono in genere riferite ad una mole di atomi e riportate in k. J/mol. Grandi valori negativi indicano uno ione molto stabile, mentre valori positivi indicano uno ione instabile rispetto alla dissociazione in un elettrone e l’atomo neutro.

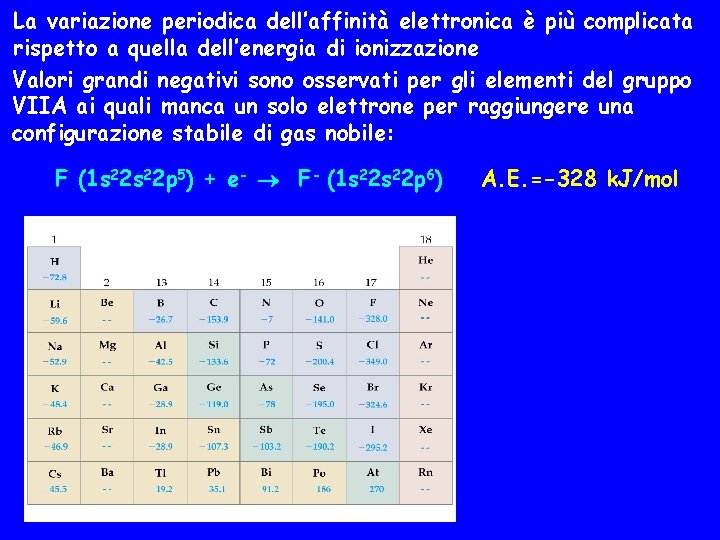
La variazione periodica dell’affinità elettronica è più complicata rispetto a quella dell’energia di ionizzazione Valori grandi negativi sono osservati per gli elementi del gruppo VIIA ai quali manca un solo elettrone per raggiungere una configurazione stabile di gas nobile: F (1 s 22 p 5) + e- F- (1 s 22 p 6) A. E. =-328 k. J/mol

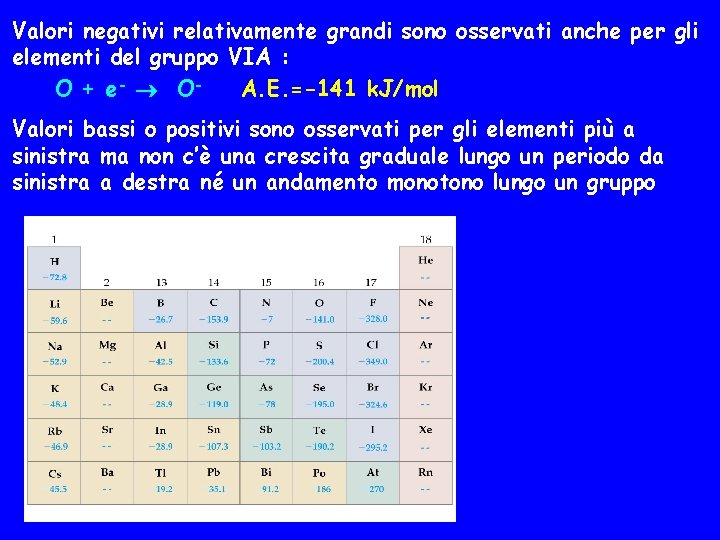
Valori negativi relativamente grandi sono osservati anche per gli elementi del gruppo VIA : O + e- OA. E. =-141 k. J/mol Valori bassi o positivi sono osservati per gli elementi più a sinistra ma non c’è una crescita graduale lungo un periodo da sinistra a destra né un andamento monotono lungo un gruppo

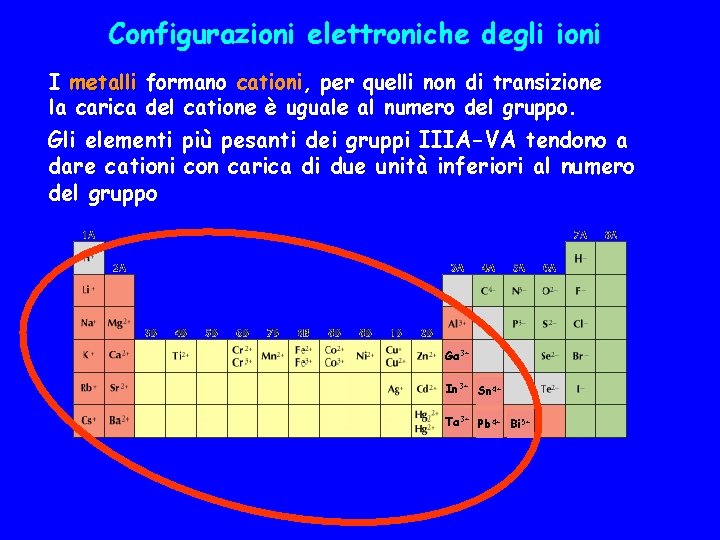
Configurazioni elettroniche degli ioni I metalli formano cationi, per quelli non di transizione la carica del catione è uguale al numero del gruppo. Gli elementi più pesanti dei gruppi IIIA-VA tendono a dare cationi con carica di due unità inferiori al numero del gruppo Ga 3+ In 3+ Sn 4+ Ta 3+ Pb 4+ Bi 5+

La maggior parte dei cationi derivano dagli atomi degli elementi metallici dei gruppi principali togliendo tutti gli elettroni di valenza di modo che essi assumano una configurazione elettronica a gas nobile: Na([Ne]3 s 1) Na+([Ne]) Mg([Ne]3 s 2) Mg 2+([Ne]) Al([Ne]3 s 23 p 1) Al 3+([Ne]) Le energie di ionizzazione successive aumentano progressivamente ma rimangono accettabilmente basse fino a che si rimuovono solo elettroni di valenza. Nei gruppi IIIA-VA la tendenza a formare cationi M 3+-M 5+ aumenta scendendo lungo il gruppo poiché diminuisce l'energia di ionizzazione ed aumenta il carattere metallico. Ad esempio non esiste B 3+ ma esistono Al 3+, Ga 3+, ecc.

Gli elementi più pesanti dei gruppi IIIA-VA tendono a conservare gli elettroni ns 2 per dare cationi con carica di due unità inferiori al numero del gruppo, M+-M 3+ In ([Kr]4 d 105 s 25 p 1) In+ ([Kr]4 d 105 s 2) Sn ([Kr]4 d 105 s 25 p 2) Sn 2+ ([Kr]4 d 105 s 2) Sb ([Kr]4 d 105 s 25 p 3) Sb 3+ ([Kr]4 d 105 s 2) Ciò è particolarmente vero per gli atomi dei gruppi IVA-VA che non danno di fatto ioni +4 o +5. 5 p 5 s In ([Kr]4 d 105 s 25 p 1) 5 p 5 s In+ ([Kr]4 d 105 s 2) 5 p 5 s In 3+ ([Kr]4 d 10)

I non metalli formano anioni con carica pari al numero del gruppo meno 8

Gli elementi dei gruppi VIA-VIIA hanno le più alte e negative affinità elettroniche e formano anioni con carica -2 e -1 in modo da conseguire la configurazione elettronica a gas nobile O ([He]2 s 25 p 4) O 2 - ([He]2 s 2 2 p 6) O 2 - ([Ne]) F ([He]2 s 25 p 5) F- ([He]2 s 2 2 p 6) Malgrado le affinità elettroniche più basse i non metalli del gruppo V, azoto e fosforo, possono acquistare tre elettroni per dare trianioni, quali N 3 - e P 3 - , con la configurazione elettronica di gas nobile. N ([He]2 s 25 p 3) N 3 - ([He]2 s 2 2 p 6) N 3 - ([Ne]) Solo il carbonio, nel gruppo IV, può formare un tetranione, C 4 - , particolarmente instabile e reattivo. C ([He]2 s 25 p 2) C 4 - ([He]2 s 2 2 p 6) C 4 - ([Ne])

Raggi ionici Sono riferiti alla regione sferica attorno al nucleo dello ione entro la quale è più probabile trovare l'elettrone. La definizione è in qualche modo arbitraria come per i raggi atomici (es. distanze tra i nuclei dei cristalli, diffrazione ai raggi X). Un catione è più piccolo del corrispettivo atomo neutro perchè ha perso gli elettroni di valenza o parte di essi. Rcatione < Ratomo

Al contrario un anione è più grande del corrispettivo atomo neutro perchè ha acquistato degli elettroni. Ranione > Ratomo

I raggi ionici aumentano scendendo lungo un gruppo a causa dell'aumento del numero di elettroni. I raggi ionici diminuiscono lungo un periodo (cationi ed anioni vanno considerati separatamente) Ione raggio (Å) Na+ 0, 95 Mg 2+ 0, 65 Al 3+ 0, 50 Isoelettronici con Ne S 21, 84 Cl 1, 81 Isoelettronici con Ar

Nomenclatura Chimica Le regole di nomenclatura attualmente in uso sono state formulate dalla COMMISSIONE dell’UNIONE di CHIMICA PURA e APPLICATA (IUPAC). In base a tali regole è possibile stabilire la formula del composto e risalire al nome dalla formula. • Ad ogni numero atomico (Z) corrisponde un dato elemento. • Ogni elemento può essere rappresentato con un simbolo. 84

VALENZA La valenza di un elemento in un composto rappresenta il numero di legami che tale elemento instaura con atomi di altri elementi, o anche il numero di elettroni ceduti, acquistati o messi in compartecipazione dall’elemento del composto considerato Elementi: zerovalenti H, Cl, Br…: monovalenti Ca in Ca. Cl 2, Mg in Mg. F 2: bivalenti N in NH 3, P in PH 3: trivalenti C in CH 4: tetravalenti La valenza coincide con il numero di atomi di idrogeno, o di altri atomi equivalenti che un elemento può legare o sostituire 85

Gli elettroni di valenza Gli elettroni più esterni di un atomo sono chiamati di “Valenza”, mentre quelli più interni sono chiamati elettroni del “Nocciolo” Elemento Elettroni del Elettroni di nocciolo valenza Gruppo nel sistema periodico Na 1 s 22 p 6 3 s 1 1 A, 1 Si 1 s 22 p 6 3 s 23 p 2 4 A, 14 Ti 1 s 22 p 6 3 s 23 p 6 4 s 23 d 2 4 B As 1 s 22 p 6 3 s 23 p 63 d 10 4 s 24 p 3 5 A, 15 86

Gli elettroni di valenza si possono rappresentare con il simbolo di Lewis nel quale gli elettroni vengono rappresentati con puntini Tutti gli elementi tendono a raggiungere la configurazione elettronica del gas nobile più vicino (s 2 p 6 o s 2 per quelli vicino all’elio). Gli elementi tendono a raggiungere la configurazione elettronica ad ottetto s 2 p 6, condividendo, strappando o cedendo elettroni (regola dell’ottetto). 87

NUMERO DI OSSIDAZIONE Rappresenta lo stato di combinazione di un elemento in un composto, da un punto di vista formale e pratico. Esso consiste nella carica elettrica formale che l’elemento assume in un composto se si pensa di associare gli elettroni di ciascun legame all’atomo considerato più elettronegativo. Il numero di ossidazione può quindi assumere valori sia positivi che negativi. Quando gli elettroni di legame vengono assegnati all’elemento più elettronegativo, esso si carica di tante cariche negative quanti sono gli elettroni acquistati. NON SEMPRE LA VALENZA COINCIDE CON IL NUMERO DI OSSIDAZIONE CH 4 C 2 H 6 C 2 H 4 C 2 H 2 Valenza 4 4 4 4 N. ossidaz. -4 -3 -2 -188

Numero di ossidazione 1. Numeri di ossidazione del carbonio: C = 0; CH 4 = -4; CO= + 2; CO 2= + 4; H 2 CO 3 = ? ; C 3 H 6 = ? ; C 6 H 6 = ? 2. Numeri di ossidazione dell’azoto: N 2 = 0, NO = +2; NH 3 = -3; HNO 3 = ? HNO 2 = ? N 2 H 4 = ? 3. O in OH-: ? ; N in NH 4+ = ? ; S in SO 42 - = ? In una molecola la somma algebrica dei n. o. degli atomi è 0. In uno ione la somma algebrica è uguale alla carica dello ione 89

DETERMINAZIONE DEL NUMERO DI OSSIDAZIONE DEGLI ELEMENTI NEI LORO COMPOSTI Il n. o. di un atomo in una molecola può essere determinato in base alle seguenti semplici regole: 1) Il n. o. di una specie elementare è zero. 2) Nel calcolo del n. o. non si tiene conto dei legami tra atomi dello stesso elemento. 3) Il n. o. di un catione o di un anione corrisponde alla propria carica. 4) L’idrogeno H ha sempre n. o. +1, tranne che negli idruri (composti binari con i metalli) in cui presenta n. o. – 1. 5) L’ossigeno O ha sempre n. o. – 2, tranne in OF 2 (n. o. +2) nei perossidi (-O-O-, n. o. – 1) e nei superossidi (n. o. – 1/2). 90

• Il fluoro F ha sempre n. o. – 1. • Il cloro Cl ha sempre n. o. – 1, tranne nei legami con F e con O n. o. positivi. • Il Br ha sempre n. o. – 1 tranne nei legami con F, O e Cl n. o. positivi. • I metalli hanno sempre n. o. positivi; i metalli alcalini: n. o. +1 • I metalli alcalino terrosi, Zn e Cd: n. o. + 2. • Il B e l’Al: n. o. +3 • In una molecola la somma algebrica dei n. o. di tutti gli atomi deve essere zero. • In uno ione (positivo o negativo) la somma algebrica dei n. o. deve essere uguale alla carica dello ione stesso. 91

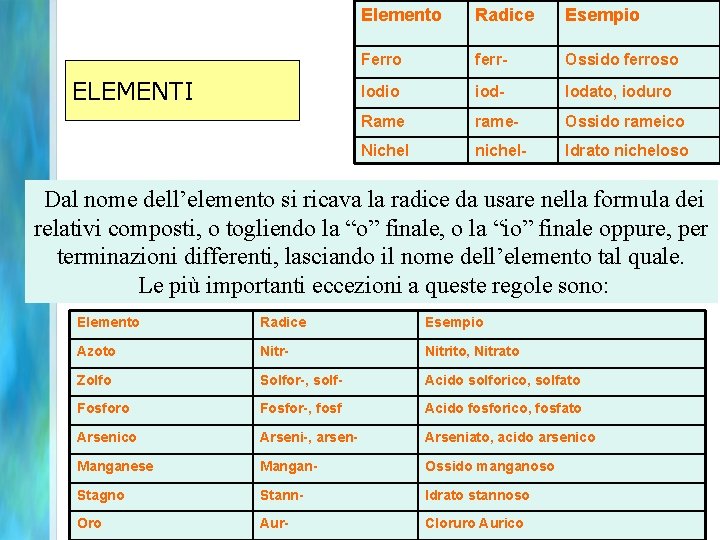
ELEMENTI Elemento Radice Esempio Ferro ferr- Ossido ferroso Iodio iod- Iodato, ioduro Rame rame- Ossido rameico Nichel nichel- Idrato nicheloso Dal nome dell’elemento si ricava la radice da usare nella formula dei relativi composti, o togliendo la “o” finale, o la “io” finale oppure, per terminazioni differenti, lasciando il nome dell’elemento tal quale. Le più importanti eccezioni a queste regole sono: Elemento Radice Esempio Azoto Nitr- Nitrito, Nitrato Zolfo Solfor-, solf- Acido solforico, solfato Fosfor-, fosf Acido fosforico, fosfato Arsenico Arseni-, arsen- Arseniato, acido arsenico Manganese Mangan- Ossido manganoso Stagno Stann- Idrato stannoso Oro Aur- Cloruro Aurico 92

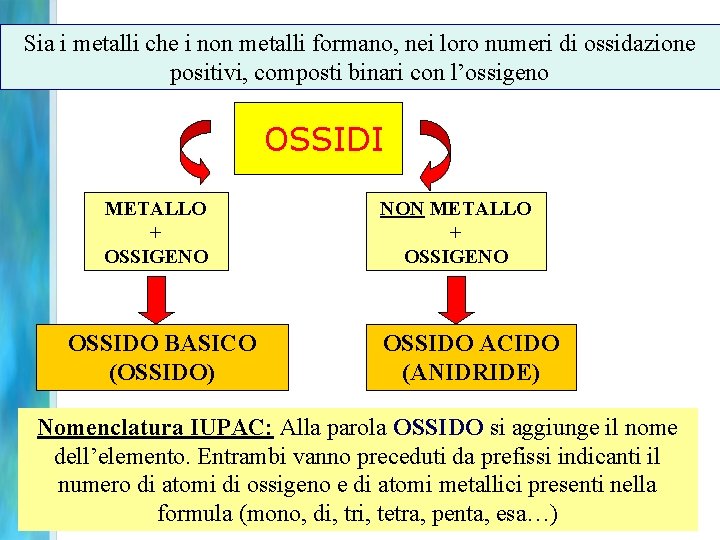
Sia i metalli che i non metalli formano, nei loro numeri di ossidazione positivi, composti binari con l’ossigeno OSSIDI METALLO + OSSIGENO OSSIDO BASICO (OSSIDO) NON METALLO + OSSIGENO OSSIDO ACIDO (ANIDRIDE) Nomenclatura IUPAC: Alla parola OSSIDO si aggiunge il nome dell’elemento. Entrambi vanno preceduti da prefissi indicanti il numero di atomi di ossigeno e di atomi metallici presenti nella formula (mono, di, tri, tetra, penta, esa…) 93

Metallo + Ossigeno: Mx. Oy Gli indici x e y dipendono dai rispettivi numeri di ossidazione: Si semplificano gli indici nel caso siano divisibili per uno stesso numero M(+1) + O(2 -) M 2 O M(+2) + O(2 -) MO M(+3) + O(2 -) M 2 O 3 M(+4) + O(2 -) MO 2 Non metallo + Ossigeno: Mx. Oy x e y dipendono dai rispettivi numeri di ossidazione: E(+1) + O(2 -) E 2 O E(+2) + O(2 -) EO E(+3) + O(2 -) E 2 O 3 E(+4) + O(2 -) EO 2 E(+5) + O(2 -) E 2 O 5 E(+7) + O(2 -) E 2 O 7 94

Ossidi metallici Na 2 O: Monossido di disodio Fe 2 O 3: Triossido di diferro Ba. O: Monossido di bario Li 2 O: Monossido di dilitio Sn. O 2: Diossido di stagno 95

Ossidi non metallici Cl 2 O: Monossido di dicloro Cl 2 O 3: Triossido di dicloro Cl 2 O 5: Pentossido di dicloro Cl 2 O 7: Eptossido di dicloro CO: Monossido di carbonio CO 2: Diossido di carbonio SO 2: Diossido di zolfo SO 3: Triossido di zolfo 96

Nomenclatura Tradizionale Ossidi metallici Se l’elemento ha un solo numero di ossidazione: Alla parola OSSIDO si fa seguire il nome dell’elemento; si può anche usare la proposizione di, seguita dal nome dell’elemento Se l’elemento ha due numeri di ossidazione: Alla parola OSSIDO si aggiunge un attributo costituito dalla radice del nome dell’elemento e da un suffisso: -OSO riferito al numero di ossidazione più basso -ICO riferito al numero di ossidazione più alto (anche usato per composti derivati da elementi con n. o. unico) 97

Nomenclatura Tradizionale Ossidi non metallici o anidridi Alcuni non metalli (soprattutto gli alogeni) presentano più di due n. o. positivi. Il loro nome si indica con la parola anidride seguita da un attributo al femminile con gli stessi suffissi OSA e ICA. Si utilizzano, oltre ai suffissi, anche i prefissi IPO- e PER- per distinguere i possibili composti: +1 Cl 2 O anidride ipoclorosa +3 Cl 2 O 3 anidride clorosa +5 Cl 2 O 5 anidride clorica +7 Cl 2 O 7 anidride perclorica Rapporto: 2 a 3 prefisso sesqui 98

IDROSSIDI (BASI) Derivano formalmente dalla reazione di ossidi basici (ossidi metallici) con acqua: K 2 O + H 2 O 2 KOH Sono costituiti dallo ione METALLICO positivo Mn+ e da n IONI OSSIDRILI OH-. Valgono le stesse regole per la nomenclatura: Na. OH Fe(OH)2 Fe(OH)3 Ca(OH)2 (Mono)Idrossido di sodio Diidrossido di ferro Triidrossido di ferro Diidrossido di calcio Se l’elemento ha un solo numero di ossidazione si può utilizzare la sola preposizione di: Mg(OH)2: Idrossido di magnesio 99

Nomenclatura tradizionale Valgono le stesse regole per i suffissi utilizzati con gli ossidi: IDROSSIDO ____ -OSO IDROSSIDO ____-ICO radice del metallo la formula si costruisce ponendo accanto al simbolo del metallo tanti gruppi OH quanti ne indica il numero di ossidazione del metallo: idrossido sodico Na. OH idrossido ferroso Fe(OH)2 idrossido ferrico Fe(OH)3 Na 2 O + H 2 O 2 Na. OH (idrossido di sodio, soda caustica) Ca. O (calce viva) + H 2 O Ca(OH)2 (diidrossido di calcio, calce spenta) 100

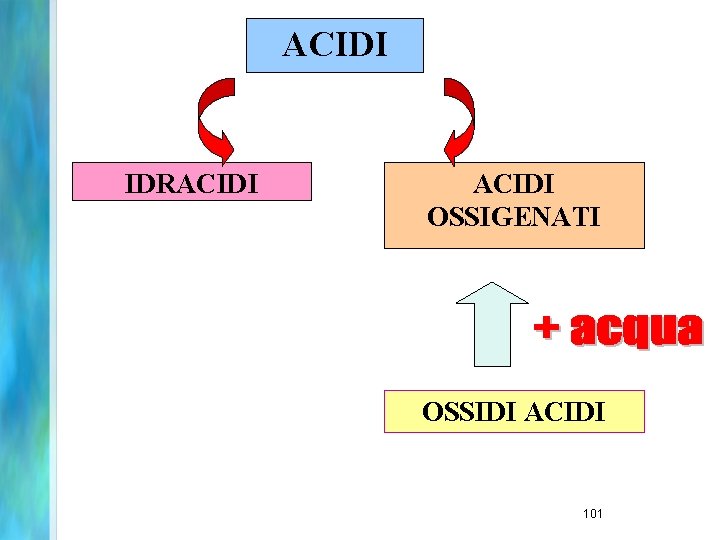
ACIDI IDRACIDI OSSIGENATI OSSIDI ACIDI 101

IDRACIDI Gli alogeni e lo zolfo formano nei loro n. o. negativi, acidi binari con l’H. Si indicano col suffisso –IDRICO (essi fanno comunque parte di una classe più vasta, detta dei composti binari, il cui nome sistematico IUPAC si ottiene ponendo dapprima la radice del nome dell’alogeno, più elettronegativo dell’idrogeno, a cui va aggiunta la desinenza –URO, seguito dalla preposizione DI e dal nome del primo costituente) HF HCl H 2 S HBr HI HCN acido fluoridrico (fluoruro di idrogeno) acido cloridrico (cloruro di idrogeno) acido solfidrico (solfuro di idrogeno) acido bromidrico (bromuro di idrogeno) acido iodidrico (ioduro di idrogeno) acido cianidrico (cianuro di idrogeno) 102

Acidi Ossigenati • Derivano dalle anidridi per formale addizione di H 2 O. • Nella formula si scrive dapprima l’H, quindi il simbolo dell’elemento, ed infine l’ossigeno. • Al nome dell’acido si associano gli stessi prefissi e suffissi dell’anidride da cui deriva. (anidride solforosa) SO 2 + H 2 O H 2 SO 3 (acido solforoso) (anidride solforica) SO 3 + H 2 O H 2 SO 4 (acido solforico) (anidride nitrica) N 2 O 5 + H 2 O H 2 N 2 O 6 2 HNO 3 (acido nitrico) (anidride carbonica) CO 2 + H 2 O H 2 CO 3 (acido carbonico) 103

Acidi Ossigenati (Anidride ipoclorosa) Cl 2 O + H 2 O H 2 Cl 2 O 2 2 HCl. O (acido ipocloroso) (Anidride clorosa) Cl 2 O 3 + H 2 O H 2 Cl 2 O 4 2 HCl. O 2 (acido cloroso) (Anidride clorica) Cl 2 O 5 + H 2 O H 2 Cl 2 O 6 2 HCl. O 3 (acido clorico) (Anidride perclorica) Cl 2 O 7 + H 2 O H 2 Cl 2 O 8 2 HCl. O 4 (acido perclorico) (Anidride bromica) Br 2 O 5 + H 2 O H 2 Br 2 O 6 2 HBr. O 3 (acido bromico) (Anidride bromosa) Br 2 O 3 + H 2 O H 2 Br 2 O 4 2 HBr. O 2 (acido bromoso) 104

Ioni Poliatomici, ossoanioni v. Quello che resta di un acido ossigenato perdita di atomi di idrogeno si chiama radicale acido. Per ogni idrogeno tolto si aggiunge una carica negativa. ØIl numero delle cariche costituisce la valenza del radicale Si usano suffissi diversi da quelli dei corrispondenti acidi: -OSO -ITO -ICO -ATO Cl. OIone CO 32 Ione carbonato NO 2 Ione nitrito NO 3 Ione nitrato SO 32 Ione solfito SO 42 Ione solfato Cl. O 2 Ione Cl. O 3 Ione Cl. O 4 Ione Br. O 4 Ione ipoclorito clorato perclorato Br. OIone Br. O 2 Ione Br. O 3 Ione ipobromito bromato perbromato 105

Ossoanioni contenenti idrogeno La perdita parziale di ioni H+ dà luogo a radicali ionici negativi indicati col prefisso IDROGENO-: HSO 4 - ione idrogenosolfato E, se necessario, anche i prefissi mono-, di-, tri- per indicare il numero di ioni H+: H 2 PO 4 - ione diidrogenofosfato HPO 42 H 2 PO 4 HCO 3 HSO 4 HSO 3 Ione Ione Idrogeno Diidrogeno Idrogeno -fosfato -carbonato -solfito Bicarbonato, bisolfito Nomenclatura corrente: prefisso “bi” 106

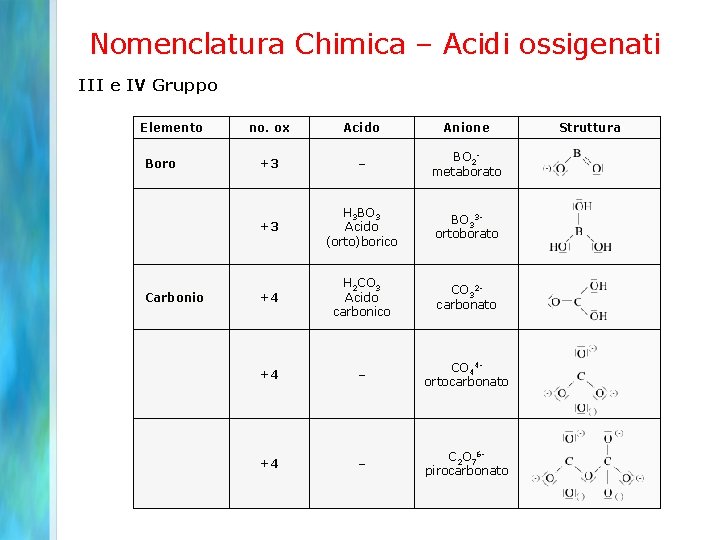
Nomenclatura Chimica – Acidi ossigenati III e IV Gruppo Elemento Boro Carbonio no. ox Acido Anione +3 – BO 2 metaborato +3 +4 +4 +4 H 3 BO 3 Acido (orto)borico BO 33 ortoborato H 2 CO 3 Acido carbonico CO 32 carbonato – CO 44 ortocarbonato – C 2 O 76 pirocarbonato Struttura

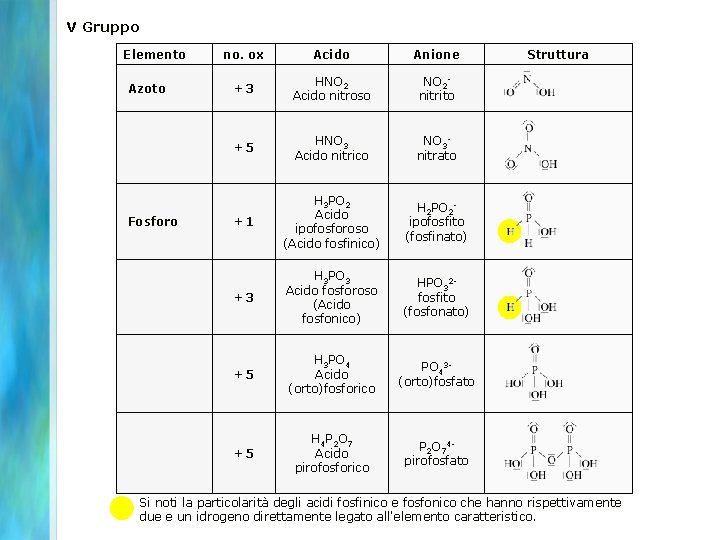
V Gruppo Elemento no. ox Acido Anione Struttura Azoto +3 HNO 2 Acido nitroso NO 2 nitrito +5 HNO 3 Acido nitrico NO 3 nitrato H 3 PO 2 Acido ipofosforoso (Acido fosfinico) H 2 PO 2 ipofosfito (fosfinato) H 3 PO 3 Acido fosforoso (Acido fosfonico) HPO 32 fosfito (fosfonato) H 3 PO 4 Acido (orto)fosforico PO 43(orto)fosfato Fosforo +1 +3 +5 +5 H 4 P 2 O 7 Acido pirofosforico P 2 O 74 pirofosfato Si noti la particolarità degli acidi fosfinico e fosfonico che hanno rispettivamente due e un idrogeno direttamente legato all'elemento caratteristico.

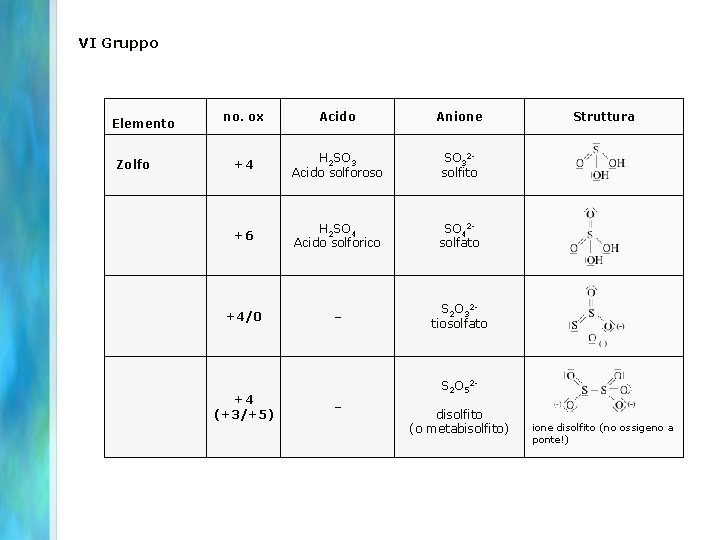
VI Gruppo no. ox Acido Anione Zolfo +4 H 2 SO 3 Acido solforoso SO 32 solfito +6 H 2 SO 4 Acido solforico SO 42 solfato +4/0 – S 2 O 32 tiosolfato Elemento +4 (+3/+5) S 2 O 52– disolfito (o metabisolfito) Struttura ione disolfito (no ossigeno a ponte!)

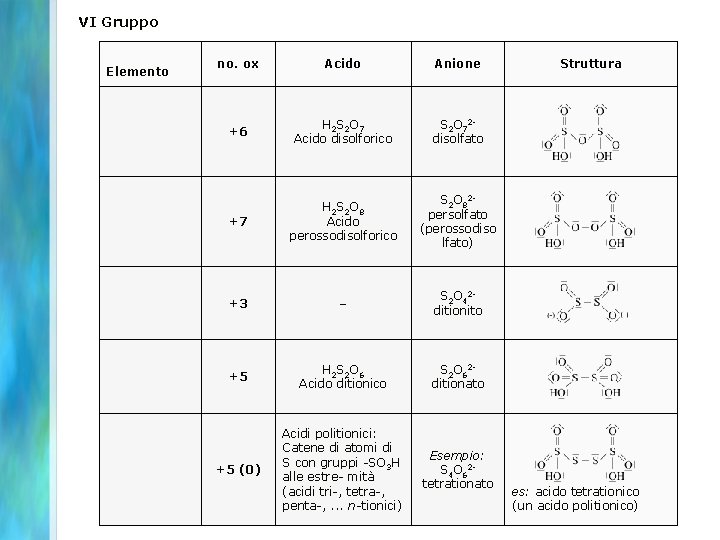
VI Gruppo no. ox Acido Anione Struttura +6 H 2 S 2 O 7 Acido disolforico S 2 O 72 disolfato +7 H 2 S 2 O 8 Acido perossodisolforico S 2 O 82 persolfato (perossodiso lfato) +3 – S 2 O 42 ditionito +5 H 2 S 2 O 6 Acido ditionico S 2 O 62 ditionato +5 (0) Acidi politionici: Catene di atomi di S con gruppi -SO 3 H alle estre- mità (acidi tri-, tetra-, penta-, . . . n-tionici) Elemento Esempio: S 4 O 62 tetrationato es: acido tetrationico (un acido politionico)

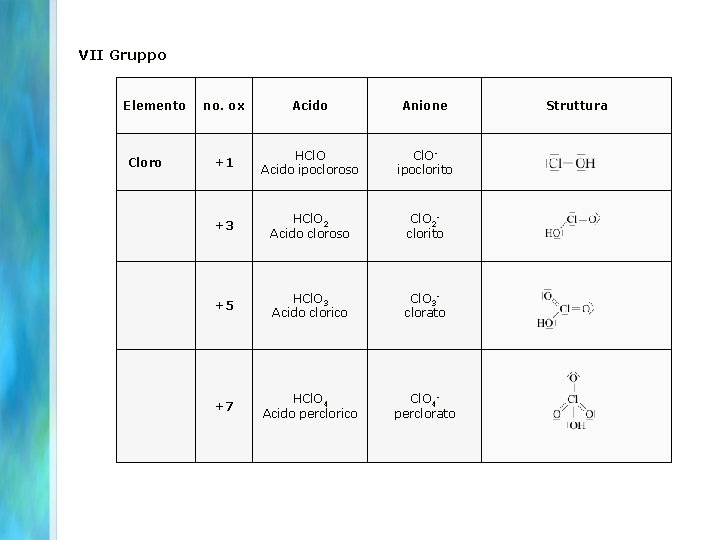
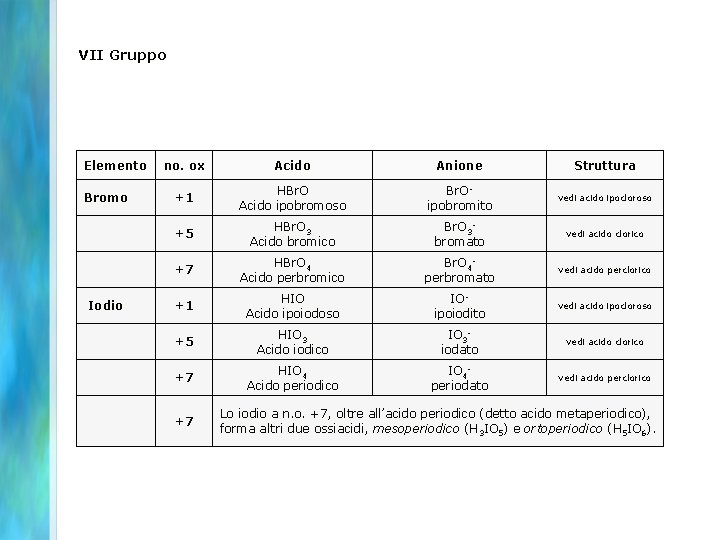
VII Gruppo Elemento no. ox Acido Anione Struttura Cloro +1 HCl. O Acido ipocloroso Cl. Oipoclorito +3 HCl. O 2 Acido cloroso Cl. O 2 clorito +5 HCl. O 3 Acido clorico Cl. O 3 clorato +7 HCl. O 4 Acido perclorico Cl. O 4 perclorato

VII Gruppo Elemento no. ox Acido Anione Struttura Bromo +1 HBr. O Acido ipobromoso Br. Oipobromito vedi acido ipocloroso +5 HBr. O 3 Acido bromico Br. O 3 bromato vedi acido clorico +7 HBr. O 4 Acido perbromico Br. O 4 perbromato vedi acido perclorico Iodio +1 HIO Acido ipoiodoso IOipoiodito vedi acido ipocloroso +5 HIO 3 Acido iodico IO 3 iodato vedi acido clorico +7 HIO 4 Acido periodico IO 4 periodato vedi acido perclorico +7 Lo iodio a n. o. +7, oltre all’acido periodico (detto acido metaperiodico), forma altri due ossiacidi, mesoperiodico (H 3 IO 5) e ortoperiodico (H 5 IO 6).

COMPOSTI BINARI CON L’IDROGENO Oltre agli IDRACIDI, esistono altri composti binari con l’idrogeno üL’ossigeno, come lo zolfo in H 2 S, forma l’acqua H 2 O üGli elementi del Vo gruppo si legano ad H nei loro n. o. negativi (-3): NH 3 ammoniaca PH 3 fosfina As. H 3 arsina Sb. H 3 stibina ü Il carbonio, il silicio e il boro formano i seguenti composti: CH 4 metano Si. H 4 silano BH 3 borano üI metalli si combinano con l’idrogeno avente n. o. – 1 formando composti comunemente detti IDRURI METALLICI: Al. H 3 idruro di alluminio Li. H idruro di litio Fe. H 3 idruro ferrico 113

I sali si originano per reazione tra un composto derivato da un metallo (ossido basico, idrossido o il metallo stesso) e un composto derivato da un non metallo (anidride, acido o lo stesso non metallo) Un sale è costituito da una parte metallica (ione del metallo o altro catione tra quelli descritti) e da una parte non metallica (un radicale acido o altri anioni). Il NOME del sale è dato dal corrispondente Radicale acido completo di suffissi e prefissi, seguito dal nome dello ione positivo con i suffissi –OSO e –ICO a seconda del n. o. La FORMULA di un sale si compone del simbolo del metallo (o dello ione positivo) seguito dal simbolo del radicale acido. Al primo diamo come indice la valenza del secondo e viceversa, poi, se è possibile, si semplificano gli indici dividendoli per uno stesso numero. 114

Esempi SOLFATO FERROSO: CARBONATO SODICO: S (zolfo), non metallo, n. o. +6 (suffisso –ATO) SO 3: anidride solforica H 2 SO 4: acido solforico SO 42 - : radicale solfato (valenza 2) Fe (ferro), metallo, n. o. +2 (suffisso – OSO) Fe 2+ ione ferroso (valenza 2) C (carbonio), non metallo, n. o. +4 (suffisso –ATO) CO 2: anidride carbonica H 2 CO 3: acido carbonico CO 32 -: radicale carbonato (valenza 2) Na (sodio), metallo, n. o. +1 (suffisso – ICO) Na+: ione sodico (valenza 1) Fe 2(SO 4)2 semplificando Fe. SO 4 Na 2 CO 3 115

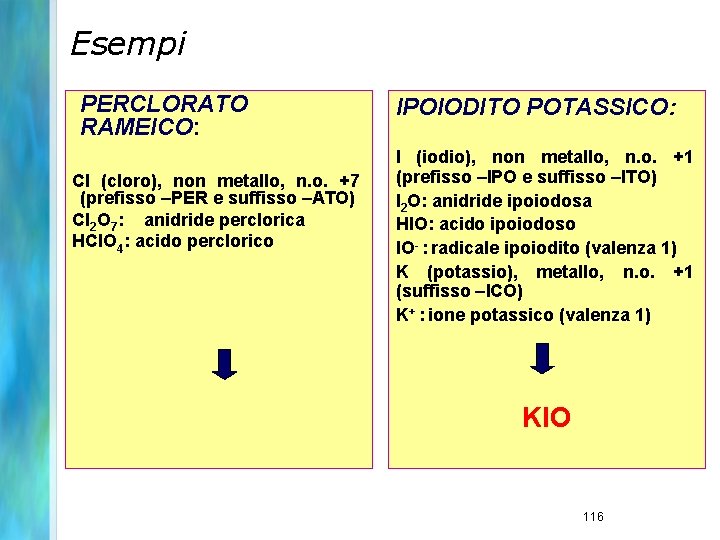
Esempi PERCLORATO RAMEICO: Cl (cloro), non metallo, n. o. +7 (prefisso –PER e suffisso –ATO) Cl 2 O 7: anidride perclorica HCl. O 4: acido perclorico IPOIODITO POTASSICO: I (iodio), non metallo, n. o. +1 (prefisso –IPO e suffisso –ITO) I 2 O: anidride ipoiodosa HIO: acido ipoiodoso IO- : radicale ipoiodito (valenza 1) K (potassio), metallo, n. o. +1 (suffisso –ICO) K+ : ione potassico (valenza 1) KIO 116

Esempi K 2 CO 3: Cu(NO 3)2: Cu. Cl: Fe. Cl 3: Fe 2(SO 3)3: Na 2 SO 4: Ba. SO 4: Na 3 PO 4: Al 2 S 3: Al. PO 4: Mn. Cl 2: KMn. O 4: NH 4 Cl: carbonato potassico nitrato rameico cloruro rameoso cloruro ferrico solfito ferrico solfato sodico solfato di bario fosfato sodico solfuro di alluminio fosfato di alluminio cloruro di manganese permanganato di potassio cloruro di ammonio 117
 Tu inizi
Tu inizi La sera di quello stesso giorno il primo dopo il sabato
La sera di quello stesso giorno il primo dopo il sabato Esempio menu dopo sleeve
Esempio menu dopo sleeve Lo storico chi è
Lo storico chi è Avanti e dopo cristo
Avanti e dopo cristo La quiete dopo la tempesta poesia
La quiete dopo la tempesta poesia Dopo la tricodinia ricrescono i capelli
Dopo la tricodinia ricrescono i capelli Avanti cristo
Avanti cristo Diarrea gelato
Diarrea gelato Laser argon convalescenza
Laser argon convalescenza George steiner dopo babele
George steiner dopo babele Vistabex
Vistabex Dopo la quaresima
Dopo la quaresima Frasi enunciative esempi
Frasi enunciative esempi Medrol 16 mg prima o dopo i pasti
Medrol 16 mg prima o dopo i pasti Cortisone dopo estrazione dente
Cortisone dopo estrazione dente La industria de la aguja del 1900 al 1930
La industria de la aguja del 1900 al 1930 Notacion atomica
Notacion atomica Numero di massa e numero atomico
Numero di massa e numero atomico Atomos
Atomos Spettroscopia di emissione
Spettroscopia di emissione Como saber a massa atomica
Como saber a massa atomica Masa absoluta formula
Masa absoluta formula La mole schema
La mole schema Massa atomica e massa molecolare
Massa atomica e massa molecolare S masa atomica
S masa atomica Masa atmica
Masa atmica Torcia al plasma rifiuti
Torcia al plasma rifiuti Massa isotópica relativa
Massa isotópica relativa Massa atomica
Massa atomica Densidade atomica planar
Densidade atomica planar Microscopia electrica
Microscopia electrica Icp
Icp Atomo de dalton
Atomo de dalton Massa atômica
Massa atômica Legge di proust
Legge di proust Configuracion electronica de 12mg
Configuracion electronica de 12mg Ordem de grandeza exemplos
Ordem de grandeza exemplos Disyunción tabla de verdad
Disyunción tabla de verdad Teoria atomica della materia
Teoria atomica della materia Masa atomica a carbonului
Masa atomica a carbonului Teoria atomica di dalton zanichelli
Teoria atomica di dalton zanichelli La teoria atomica
La teoria atomica La primera teoria atomica
La primera teoria atomica Atomic weight
Atomic weight Tavola periodica numeri di ossidazione
Tavola periodica numeri di ossidazione Massa atômica
Massa atômica Osapre
Osapre Democrito teoria atomica
Democrito teoria atomica Espectrometria de massa
Espectrometria de massa Nuclide definizione
Nuclide definizione Programmazione orientata agli oggetti roma tre
Programmazione orientata agli oggetti roma tre Sigma ammissibile
Sigma ammissibile Nomi dei triangoli rispetto agli angoli
Nomi dei triangoli rispetto agli angoli Non trattare gli altri come non vorresti essere trattato
Non trattare gli altri come non vorresti essere trattato Lo è la metrica la nebbia agli irti colli
Lo è la metrica la nebbia agli irti colli Elementi uniti similitudine
Elementi uniti similitudine Ic forte dei marmi
Ic forte dei marmi Introduzione agli algoritmi e strutture dati
Introduzione agli algoritmi e strutture dati Soluzioni capitolo a1 chimica organica
Soluzioni capitolo a1 chimica organica Programmazione orientata agli oggetti java
Programmazione orientata agli oggetti java Complicata agli estremi
Complicata agli estremi Punti notevoli triangolo isoscele
Punti notevoli triangolo isoscele Caratteristiche del testo argomentativo
Caratteristiche del testo argomentativo Struttura di una storia
Struttura di una storia Cos'è un testo teatrale
Cos'è un testo teatrale Sequenze testo narrativo
Sequenze testo narrativo Visibilin
Visibilin Primo mobile paradiso
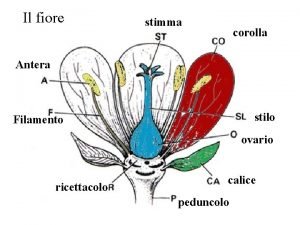
Primo mobile paradiso Struttura del fiore
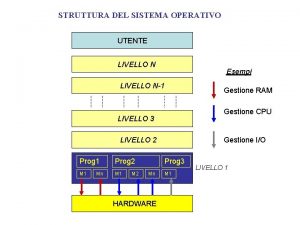
Struttura del fiore Struttura del pc
Struttura del pc Slidetodoc. com
Slidetodoc. com Schema saggio breve esempio
Schema saggio breve esempio Struttura romanzo
Struttura romanzo Luca malavoglia muore
Luca malavoglia muore Struttura del computer
Struttura del computer Focalizzazione zero esempi
Focalizzazione zero esempi Sistema monoprogrammato
Sistema monoprogrammato Struttura del calcolatore
Struttura del calcolatore Struttura del vangelo di luca
Struttura del vangelo di luca Limerick poesia
Limerick poesia Analisi testo argomentativo
Analisi testo argomentativo Taglio alto giornale
Taglio alto giornale Sistema operativo onion skin
Sistema operativo onion skin Magazzino portuale
Magazzino portuale Struttura primaria del dna
Struttura primaria del dna Le anacronie
Le anacronie Struttura inferno purgatorio e paradiso
Struttura inferno purgatorio e paradiso Struttura del testo drammatico
Struttura del testo drammatico Struttura del testo teatrale
Struttura del testo teatrale Boccaccio e il suo tempo
Boccaccio e il suo tempo Struttura del dna
Struttura del dna Esempio di saggio breve
Esempio di saggio breve 1750-1900 portfolio map
1750-1900 portfolio map Bumblebee totem pole
Bumblebee totem pole Characteristic of the romantic period
Characteristic of the romantic period The rise of industrial america 1865-1900
The rise of industrial america 1865-1900 Four features of industrial manufacturing (1865-1900)
Four features of industrial manufacturing (1865-1900) Lacey act 1900
Lacey act 1900 Sigmund freud 1900
Sigmund freud 1900 Shridhar steels pvt ltd
Shridhar steels pvt ltd 1820-1900
1820-1900 Revolutionary leaders 1900-1939
Revolutionary leaders 1900-1939 1997-1910
1997-1910 Kapcie emu 1900
Kapcie emu 1900 Moda 1910
Moda 1910 Arnulf øverland modernisme
Arnulf øverland modernisme Gegenströmung naturalismus
Gegenströmung naturalismus 1900 max planck
1900 max planck Språkdebatten 1900
Språkdebatten 1900 Resssucitar
Resssucitar Inf 1900
Inf 1900 Massasamenleving 1900
Massasamenleving 1900 1900 children's clothing
1900 children's clothing 1910 era fashion
1910 era fashion Bürgerliches wohnen um 1900
Bürgerliches wohnen um 1900 Scoperte scientifiche dal 1850 al 1900
Scoperte scientifiche dal 1850 al 1900 Cdmvt navigation
Cdmvt navigation