STRUKTURA ATOMA I PERODNI SISTEM ELEMENATA RAZVOJ TEORIJE






























- Slides: 70

STRUKTURA ATOMA I PERODNI SISTEM ELEMENATA

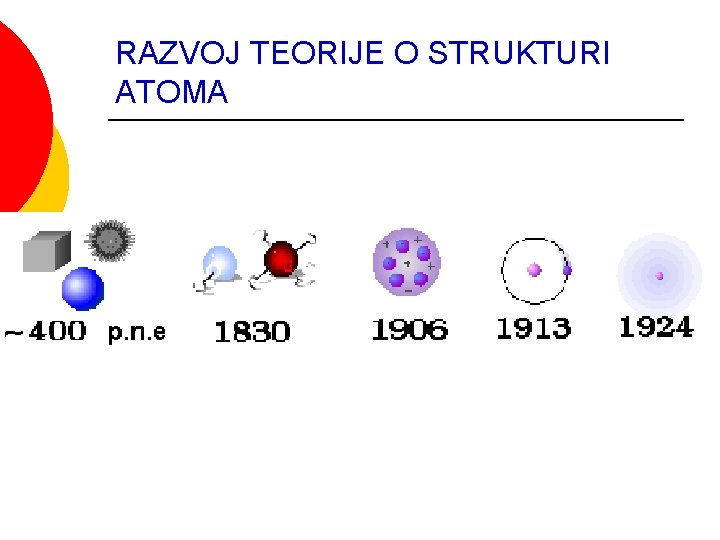
RAZVOJ TEORIJE O STRUKTURI ATOMA

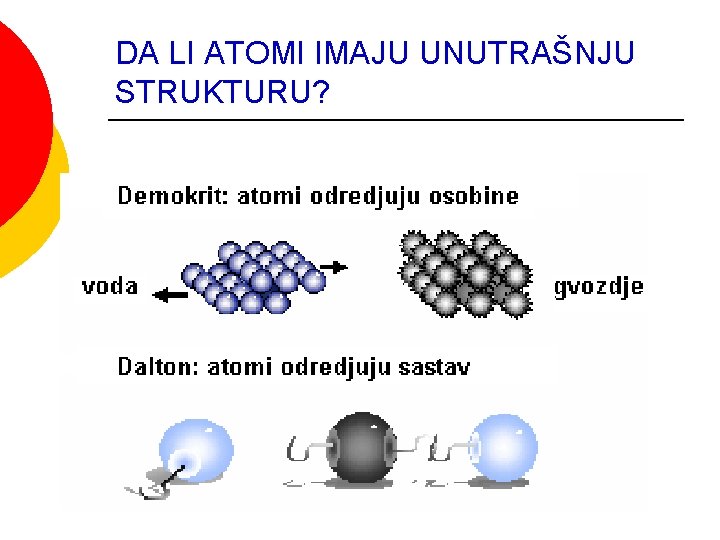
DA LI ATOMI IMAJU UNUTRAŠNJU STRUKTURU?

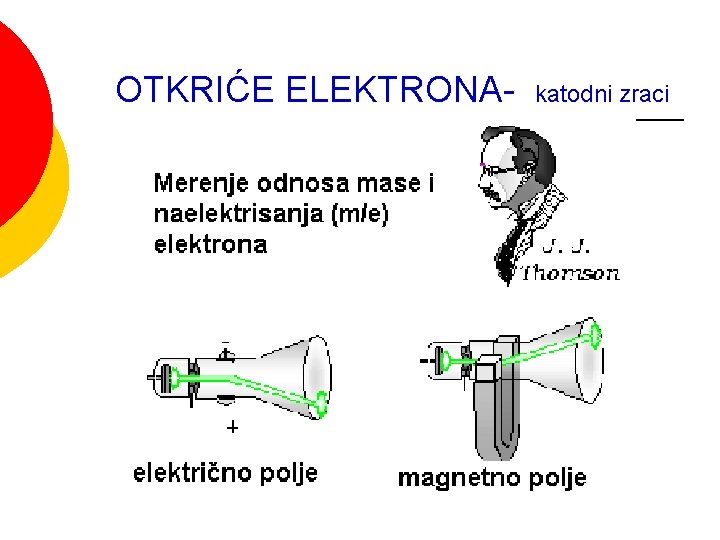
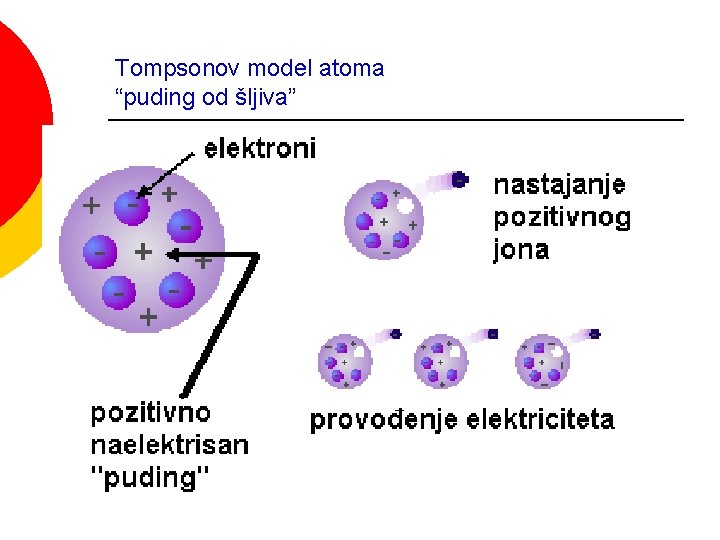
RAZVOJ MODELA ATOMA Dalton daje atomsku strukturu materije (1805) ¡ Goldstien otkriva “kanalne zrake” (kasnije nazvani protoni, polaze od anode-anodni zraci i prolaze kroz kanale na katodi) (1866) ¡ J. J. Thompson otkriva elektron (1897) (nastaju na katodi i kreću se ka anodi) ¡ Thompsonov model atoma “puding od šljiva”(1906) ¡ E. Raderford otkriva atomsko jezgro i daje planetarni model atoma (1910) ¡ Borov model atoma (1913) ¡ Talasno- mehanički model atoma Hajzenbergov princip neodređenosti (1925) ¡ Šredinger daje “talasnu mehaniku” (1926) ¡ Dirak integriše prethodna dva modela (1926) ¡ Čedvik otkriva neutron (1932) ¡

OTKRIĆE ELEKTRONA- katodni zraci

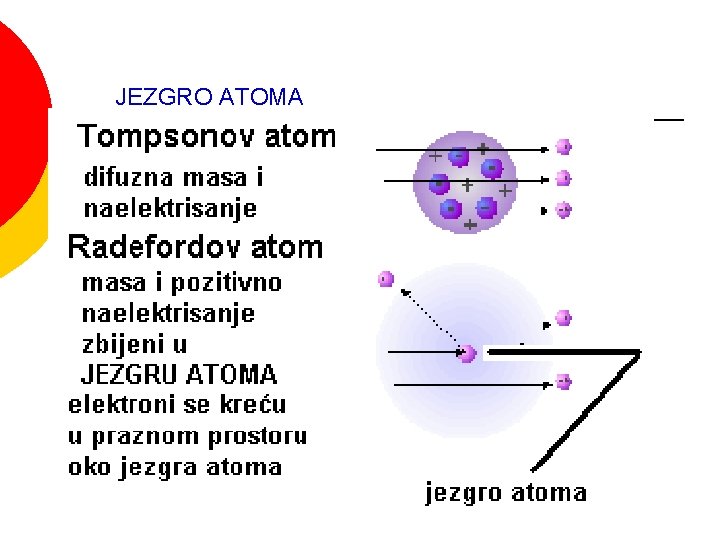
Tompsonov model atoma “puding od šljiva”

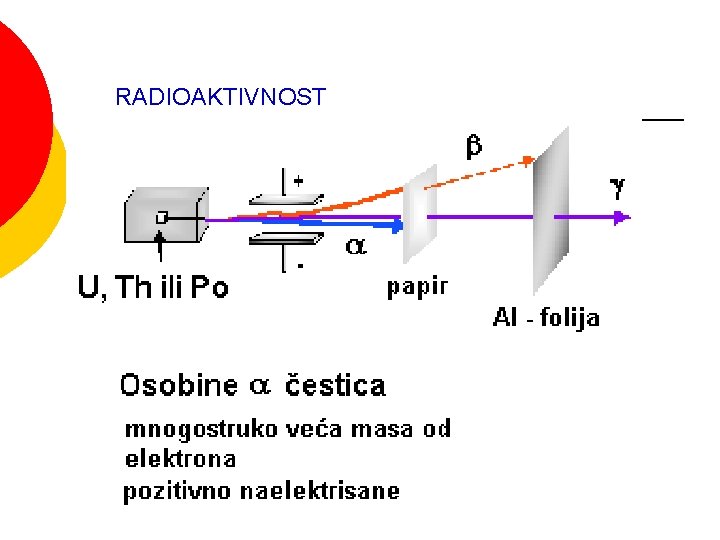
RADIOAKTIVNOST

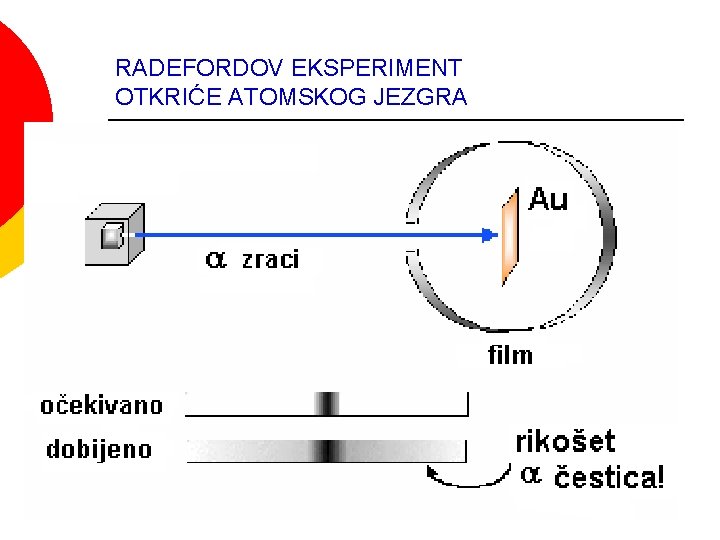
RADEFORDOV EKSPERIMENT OTKRIĆE ATOMSKOG JEZGRA

JEZGRO ATOMA

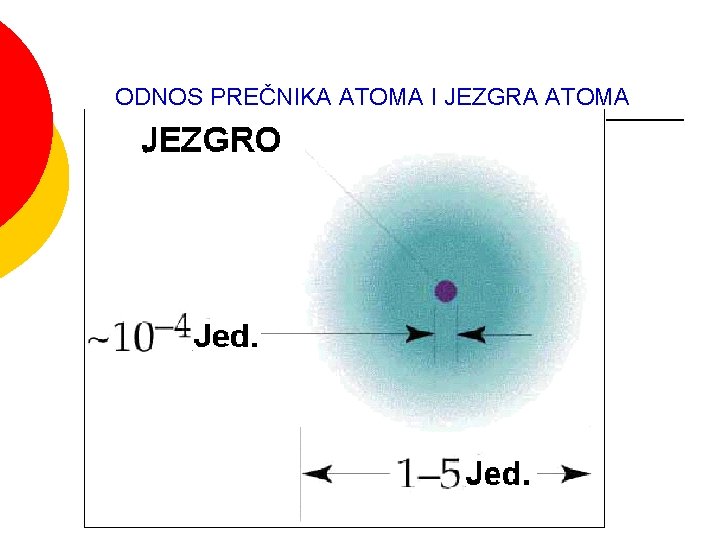
ODNOS PREČNIKA ATOMA I JEZGRA ATOMA

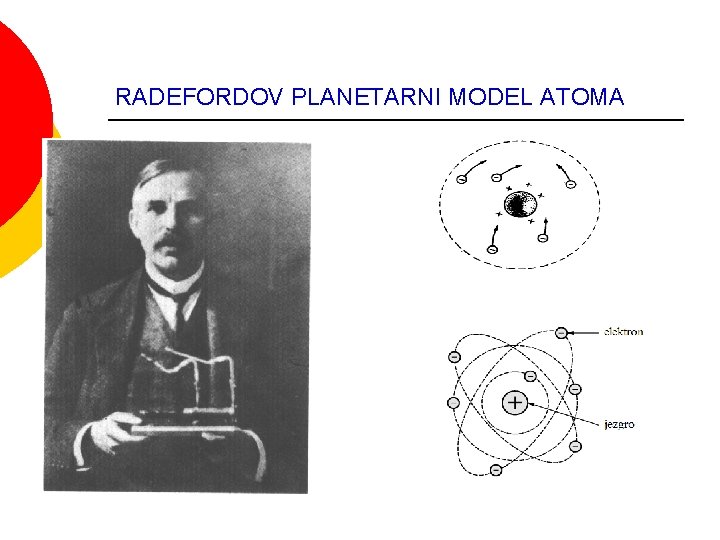
RADEFORDOV PLANETARNI MODEL ATOMA

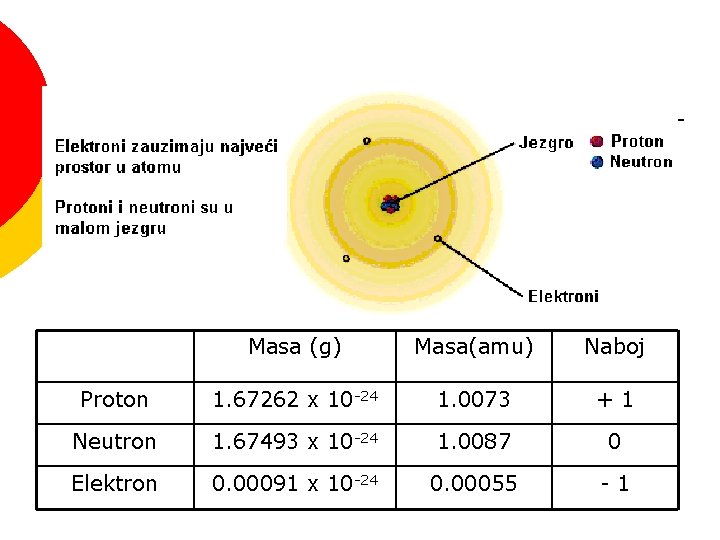
MODEL ATOMA SA JEZGROM Masa (g) Masa(amu) Naboj Proton 1. 67262 x 10 -24 1. 0073 +1 Neutron 1. 67493 x 10 -24 1. 0087 0 Elektron 0. 00091 x 10 -24 0. 00055 -1

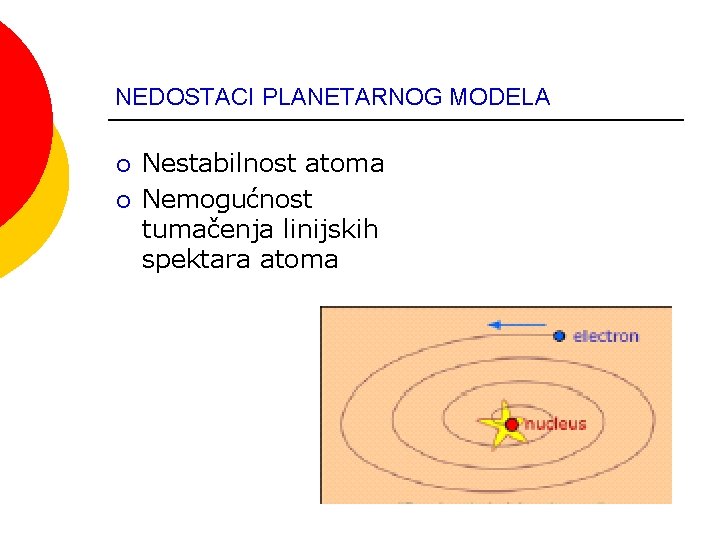
NEDOSTACI PLANETARNOG MODELA ¡ ¡ Nestabilnost atoma Nemogućnost tumačenja linijskih spektara atoma

Mosli (Moseley) 1913 - atomski broj ¡ ¡ ¡ Atomski broj elementa jednak broju pozitivnih naelektrisanja (protona) u atomskom jezgru. Hemijski elemenat je čista supstancija čiji atomi imaju isti atomski, tj redni broj, odnosno svi atomi sadrže isti broj protona u jezgru. Atomi elemenata moraju imati isti broj elektrona jer su atomi električno neutralni. Masa atoma pojedinog hemijskog elementa zavisi od broja protona i neutrona u jezgru pa se zbir protona i neutrona naziva maseni broj

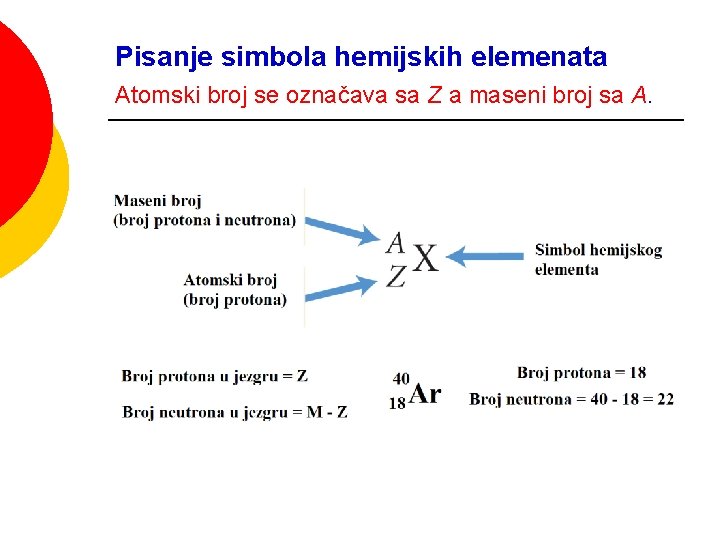
Pisanje simbola hemijskih elemenata Atomski broj se označava sa Z a maseni broj sa A.

Izotopi atomi jednog elementa međusobno razlikuju po atomskoj masi usled različitog broja neutrona u jezgru. ¡ stalan broj protona ¡

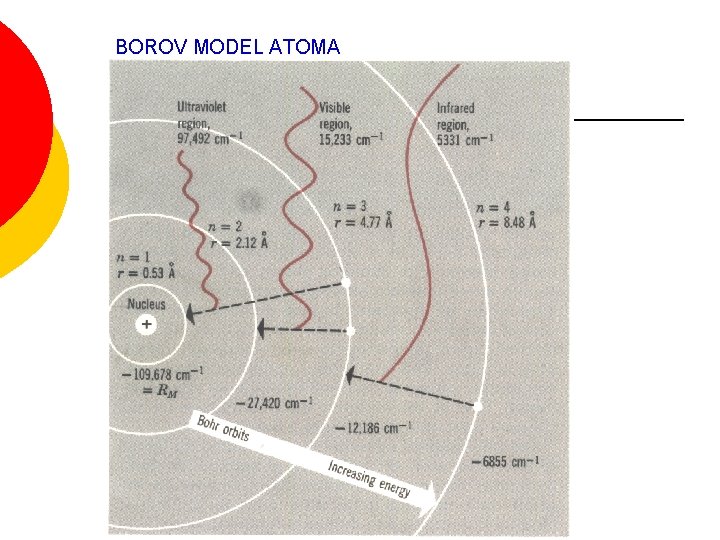
BOROV MODEL ATOMA ¡ ¡ Niels Bohr daje svoj model atoma na osnovu: Kvantne teorije Linijskih spektara atoma Činjenice da su atomi stabilni

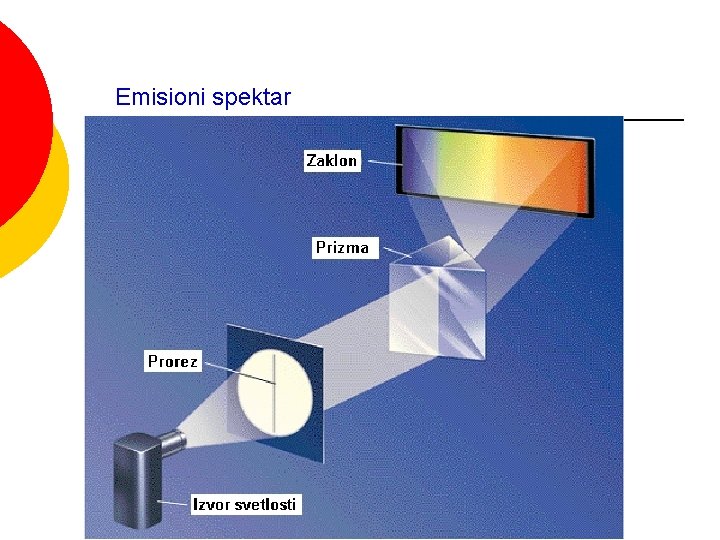
Emisioni spektar

Linijski spektri Na i H

Energija je kvantizovana Energija zračenja se može emitovati ili apsorbovati samo kao celobrojni umnožak određenog najmanjeg kvantuma energije, kvanta, koji je za svaku frekvencu različit i njoj proporcionalan. E = h·ν h = 6, 6256 · 10 -34 Js E = n·h·ν

BOROVI POSTULATI 1. 2. Elektron kruži oko jezgra atoma po određenim, dopuštenim, putanjama a da pri tome ne emituje energiju. To je stacionarno stanje. Najniža od tih putanja je osnovno ili normalno stanje atoma. Apsorpcija i emitovanje energije od strane atoma se dešava samo prilikom skoka elektrona sa jedne dopuštene putanje na drugu. E 2 – E 1 = h·ν

BOROV MODEL ATOMA

NEDOSTACI BOROVOG MODELA ATOMA ¡ ¡ ¡ Pokazao je dobre rezultate samo kod atoma vodonika Kod atoma sa više od jednog elektrona nije dao dobre rezultate Borov atomski model kombinuje teoriju kvanta i originalna shvatanja o stacionarnim stanjima atoma, omogućio je sadašnje shvatanje strukture i mnogo složenijih atoma. Za svoj atomski model N. Bohr je 1922. godine dobio Nobelovu nagradu za fiziku

KVANTNO-MEHANIČKI MODEL ATOMA Hajzenbergov princip neodređenosti ¡ ¡ Dvojna priroda materije: talas – korpuskula (de Brolji) Nemoguće je istovremeno tačno ustanoviti brzinu i položaj elektrona u prostoru. Δp · Δx = h/m

POSLEDICE PRINCIPA NEODREĐENOSTI Elektronu u atomu se ne može pripisati određena putanja ¡ Elektron je u prostoru raspoređen između jezgra i beskonačnosti ¡ Umesto putanje imamo verovatnoću nalaženja elektrona ¡ ¡ Orbitala je prostor oko jezgra atoma gde je najveća verovatnoća nalaženja elektrona (oko 90%)

TALASNA JEDNAČINA ELEKTRONA Šredingerova jednačina ¡ ¡ ¡ Obuhvata talasnu i korpuskularnu prirodu elektrona Složena jednačina Talasna funkcija opisuje kretanje elektrona i verovatnoću nalaženja

Opšta talasna funkcija za H

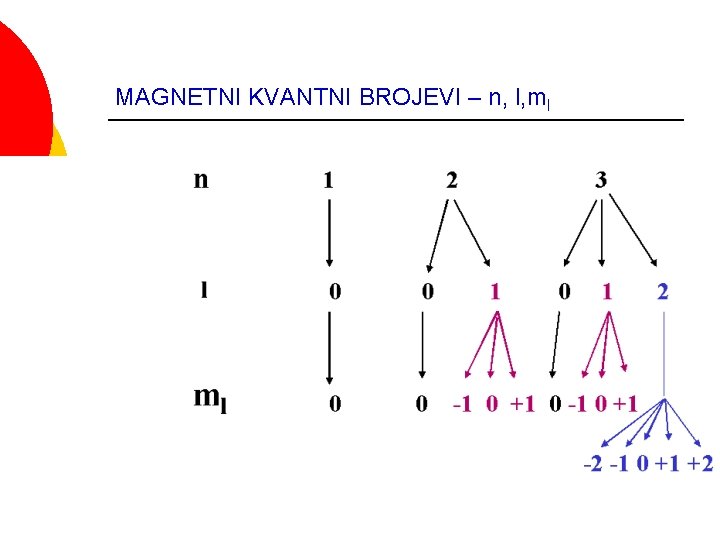
KVANTNI BROJEVI Proizilaze iz rešenja talasne funkcije ¡ Kvantni brojevi daju opštu lokaciju elektrona u atomu i opšti oblik orbitala u kojima se nalaze ¡ Po Šredingeru imamo tri kvantna broja ¡ Glavni kvantni broj n ¡ Sporedni kvantni broj l ¡ Magnetni kvantni broj ml ¡

GLAVNI KVANTNI BROJ - n Određuje kvantni nivo u kome se nalaze elektroni-ukupnu energiju orbitale ¡ Određuje rastojanje od jezgra gde je najveća verovatnoća nalaženja elektrona ¡ Ima vrednosti n = 1, 2, 3, 4, 5, 6, 7. . . ∞ ¡

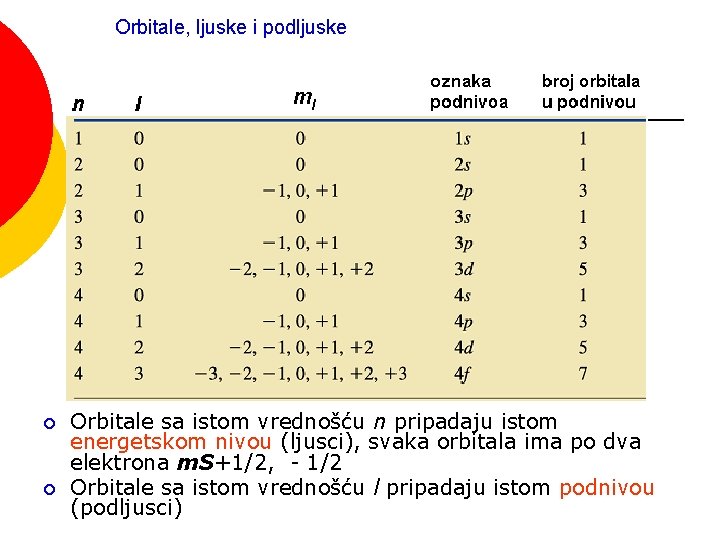
SPOREDNI KVANTNI BROJ - l ¡ ¡ ¡ Definiše kvantne podnivoe u okviru glavnog kvantnog nivoa Definiše opšte oblike orbitala Ima vrednosti od 0 do n – 1 Na primer, za n = 2 l = 0, 1 Slovne oznake za sporedni kvantni broj: Vrednosti l 0 1 2 3 Slovne oznake Tip orbitale s p d f

MAGNETNI KVANTNI BROJ - ml Opisuje pravce protezanja orjentaciju orbitala u prostoru ¡ Ima sve celobrojne vrednosti od –l do +l - l, . . . -2, -1, 0, +1, +2, . . . +l Na primer, ako je l = 0 ml = 0 ako je l = 1 ml = -1, 0, +1 ¡

SPIN ¡ ¡ Dirak i Pauli kasnije uvode i četvrti kvantni broj – spinski kvantni broj Ovaj kvantni broj definiše obrtanje elektrona oko sopstvene ose u orbitali, m. S +1/2, - 1/2

MAGNETNI KVANTNI BROJEVI – n, l, ml

Orbitale, ljuske i podljuske ¡ ¡ Orbitale sa istom vrednošću n pripadaju istom energetskom nivou (ljusci), svaka orbitala ima po dva elektrona m. S+1/2, - 1/2 Orbitale sa istom vrednošću l pripadaju istom podnivou (podljusci)

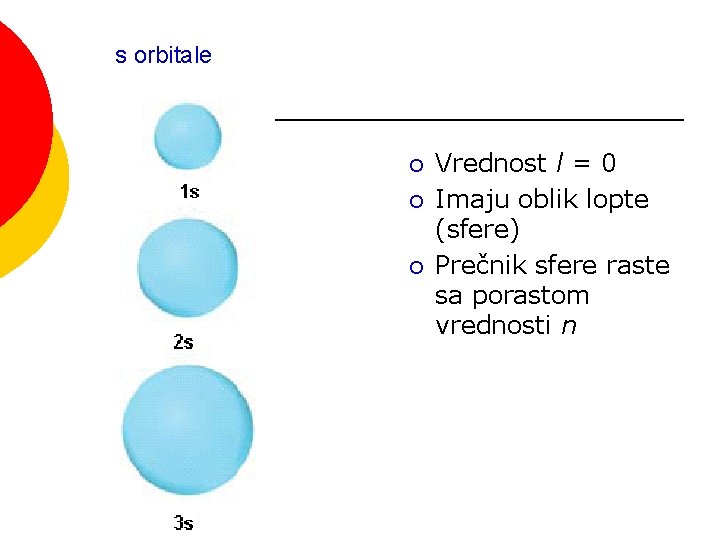
s orbitale ¡ ¡ ¡ Vrednost l = 0 Imaju oblik lopte (sfere) Prečnik sfere raste sa porastom vrednosti n

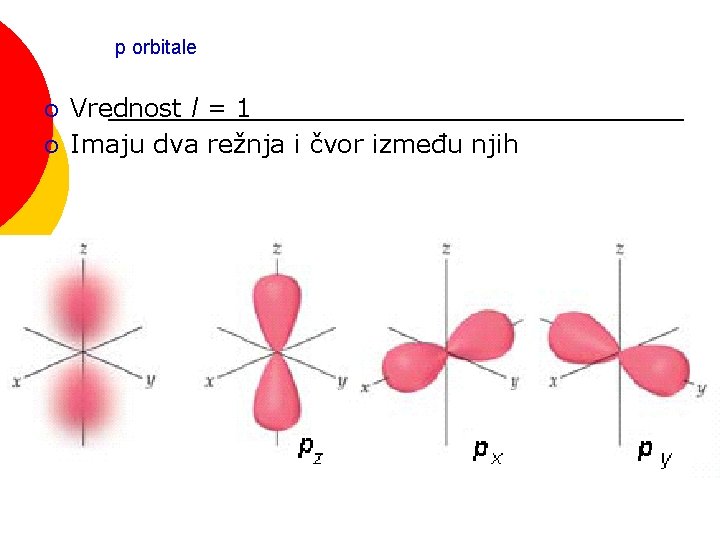
p orbitale ¡ ¡ Vrednost l = 1 Imaju dva režnja i čvor između njih

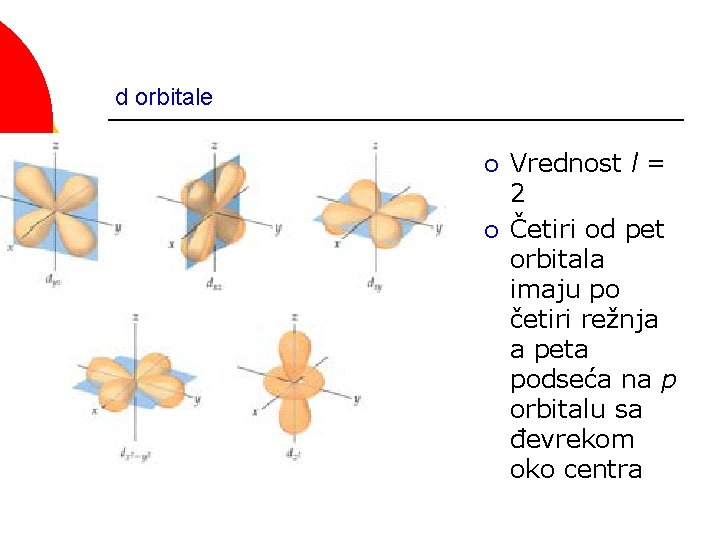
d orbitale ¡ ¡ Vrednost l = 2 Četiri od pet orbitala imaju po četiri režnja a peta podseća na p orbitalu sa đevrekom oko centra

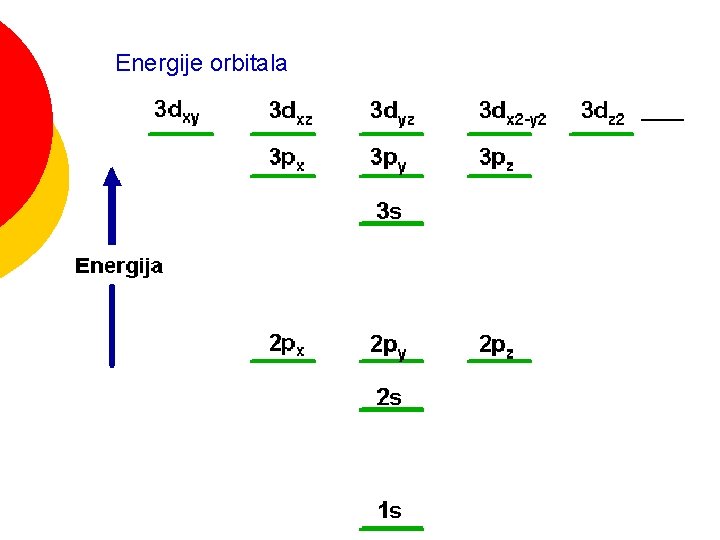
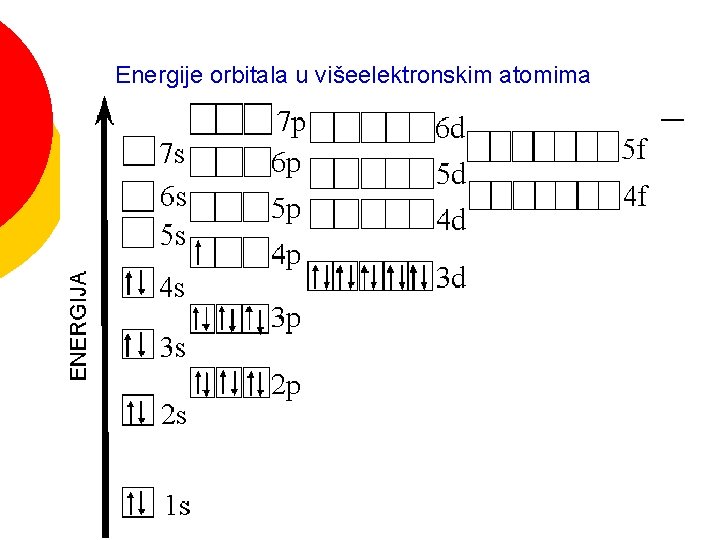
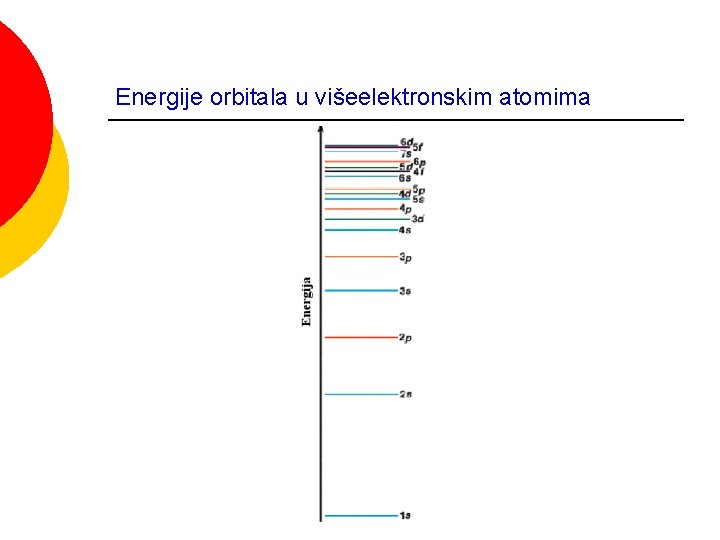
Energije orbitala

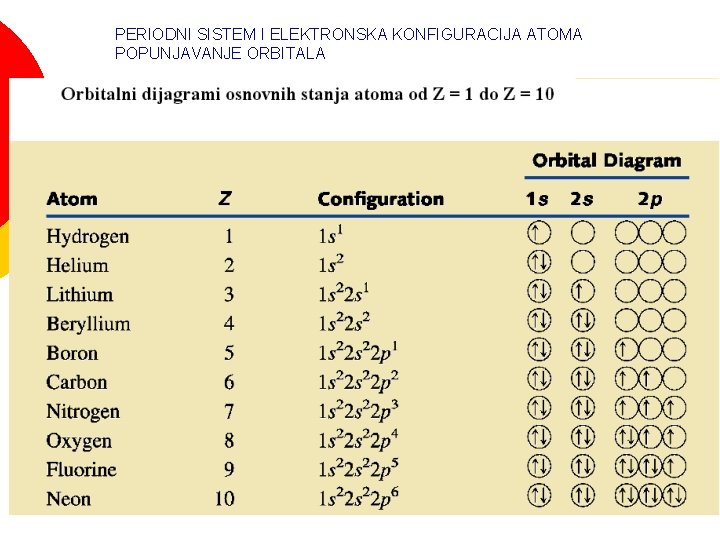
Elektronske konfiguracije Popunjavanje atomskih orbitala Pravila Paulijev princip isključenja ¡ Princip najmanje energije ¡ Hundovo pravilo ¡

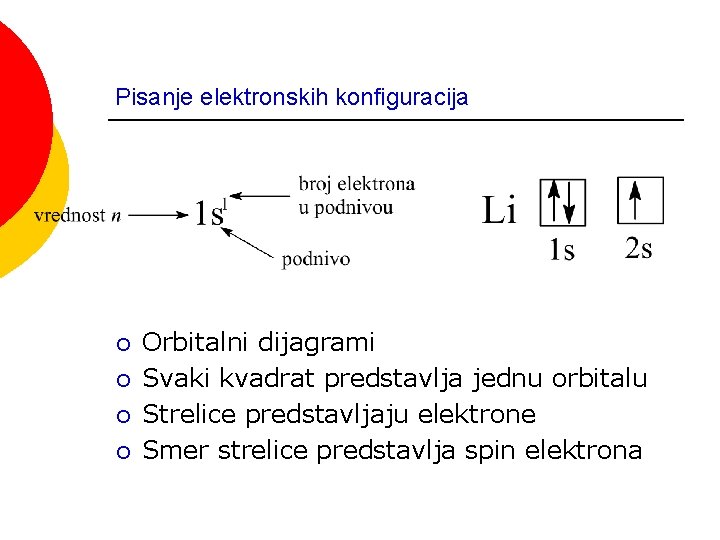
Pisanje elektronskih konfiguracija ¡ ¡ Orbitalni dijagrami Svaki kvadrat predstavlja jednu orbitalu Strelice predstavljaju elektrone Smer strelice predstavlja spin elektrona

Paulijev princip isključenja ¡ ¡ ¡ U istom atomu dva elektrona ne mogu imati iste vrednosti energije Odnosno, dva elektrona u atomu ne mogu imati sva četiri ista kvantna broja U jednoj orbitali se mogu naći najviše dva elektrona koji se razlikuju po spinu


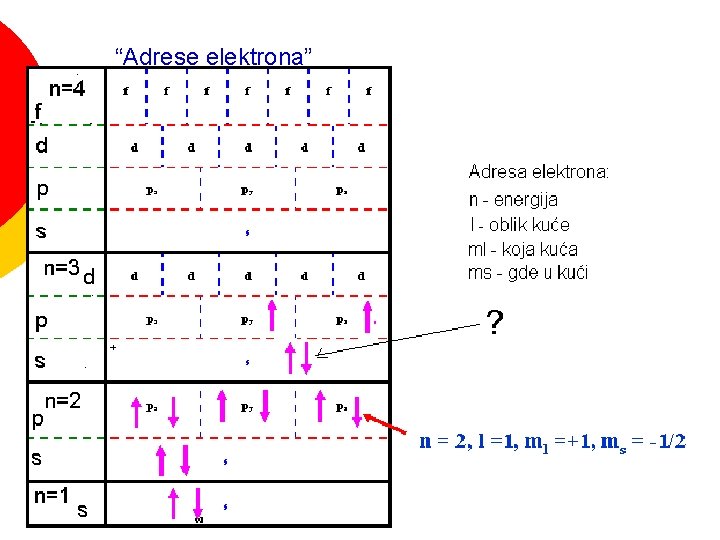
“Adrese elektrona”

Hundovo pravilo ¡ ¡ Elektroni u podnivou zauzimaju maksimalni broj orbitala Elektroni popunjavaju podnivo tako da se dobije maksimalni sumarni spin

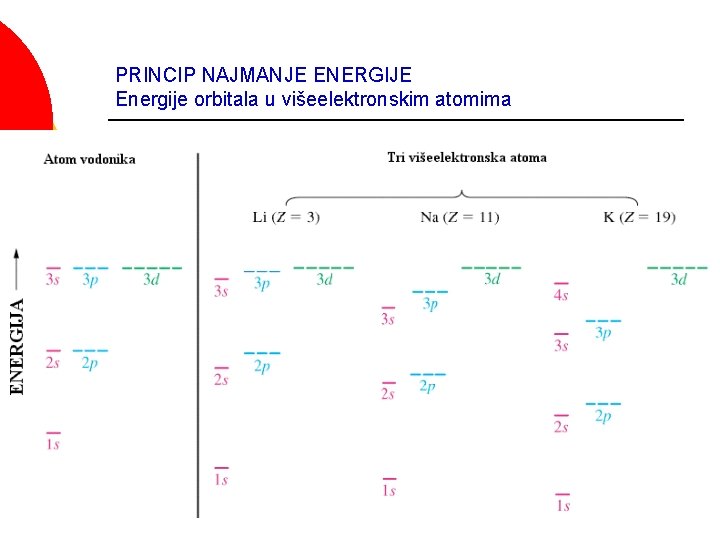
PRINCIP NAJMANJE ENERGIJE Energije orbitala u višeelektronskim atomima

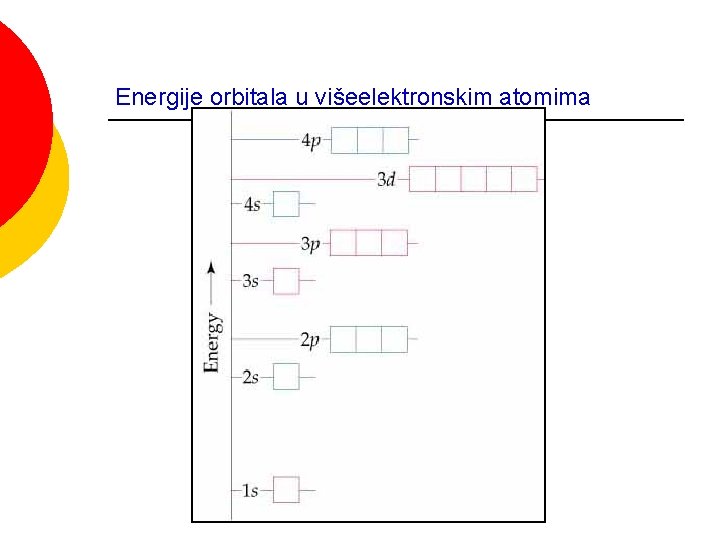
Energije orbitala u višeelektronskim atomima

Energije orbitala u višeelektronskim atomima

Energije orbitala u višeelektronskim atomima

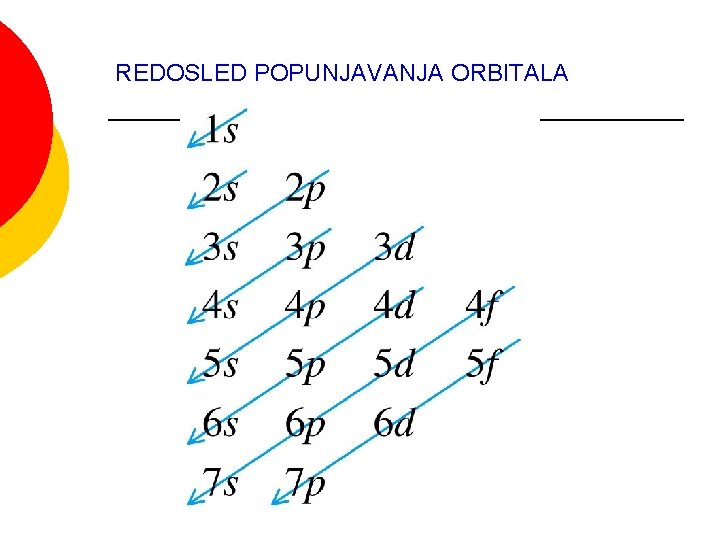
REDOSLED POPUNJAVANJA ORBITALA

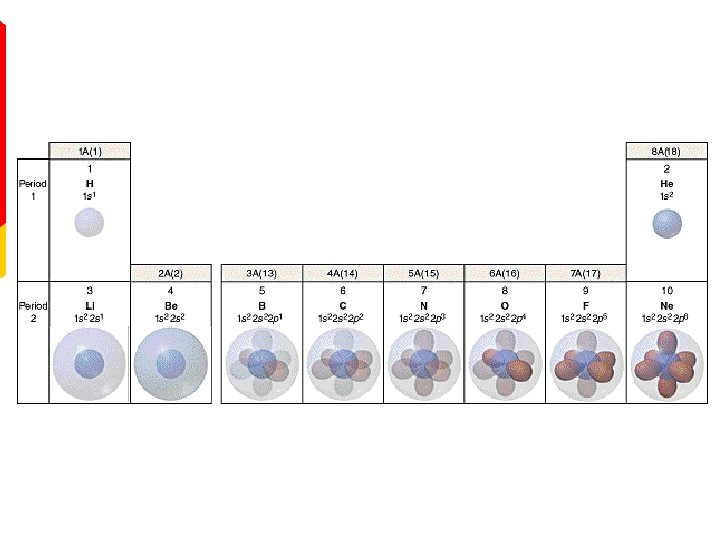
PERIODNI SISTEM I ELEKTRONSKA KONFIGURACIJA ATOMA POPUNJAVANJE ORBITALA


PERIODNI SISTEM I ELEKTRONSKA STRUKTURA ATOMA


PLEMENITI GASOVI Elektronska konfiguracija Broj elektrona 1 s 2 Element 2 He 1 s 2 2 s 22 p 6 10 Ne 1 s 2 2 s 22 p 6 3 s 23 p 6 18 Ar 1 s 2 2 s 22 p 6 3 s 23 p 6 4 s 23 d 104 p 6 36 Kr 1 s 2 2 s 22 p 6 3 s 23 p 6 4 s 23 d 104 p 6 5 s 24 d 105 p 6 54 Xe 1 s 2 2 s 22 p 6 3 s 23 p 6 4 s 23 d 104 p 6 5 s 24 d 105 p 6 6 s 24 f 14 5 d 106 p 6 86 Rn

Valencioni i unutrašnji elektroni ¡ ¡ ¡ ¡ Valencioni elektroni – Elektroni van popunjenih i zatvorenih nivoa (konfiguracija plemenitih gasova). Ovi elektroni učestvuju u hemijskim reakcijama. Unutrašnji elektroni – Elektroni u popunjenim i zatvorenim nivoima. Ne učestvuju u hemijskim reakcijama. Natrijum 11 elektrona Valencioni elektroni Unutrašnji elektroni Hlor 17 elektrona Valencioni elektroni Unutrašnji elektroni [Na] 3 s 1 --- jedan 1 s 2 2 p 6 --- deset [Ne] 3 s 2 3 p 5 ---- sedam 1 s 2 2 p 6 --- deset

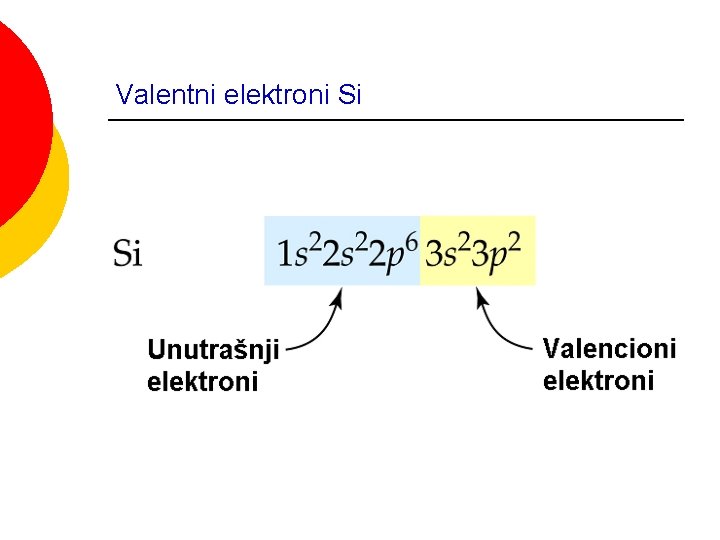
Valentni elektroni Si

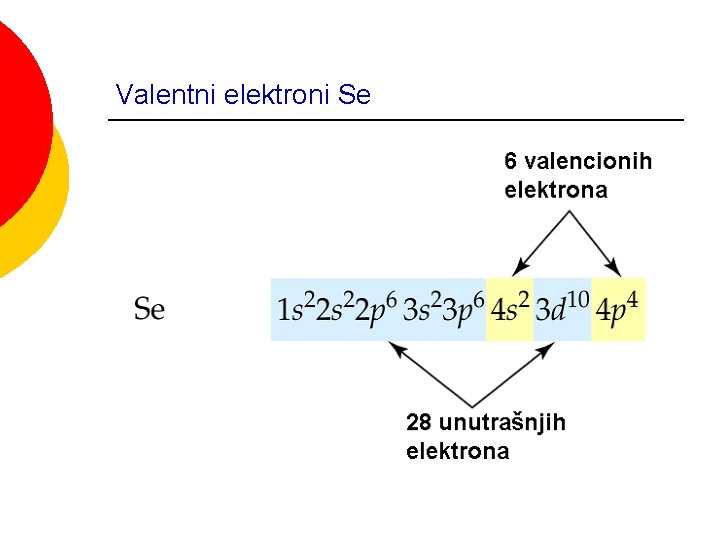
Valentni elektroni Se

Utvrđivanje broja nesparenih elektrona Primena Hundovog pravila

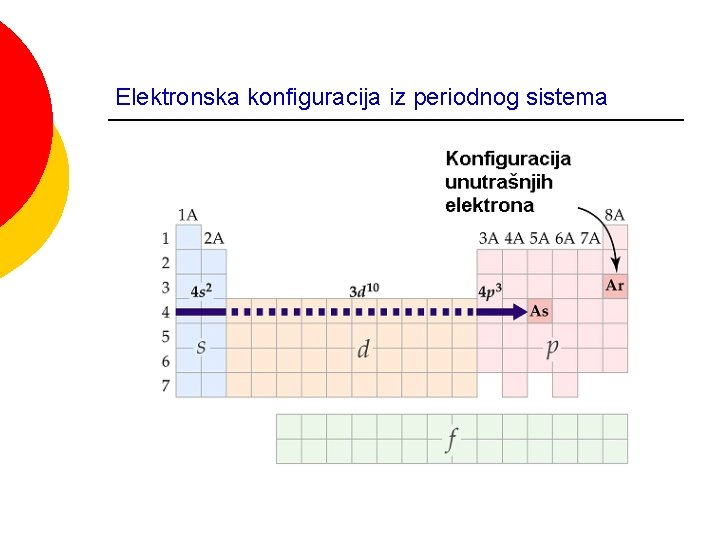
Elektronska konfiguracija iz periodnog sistema

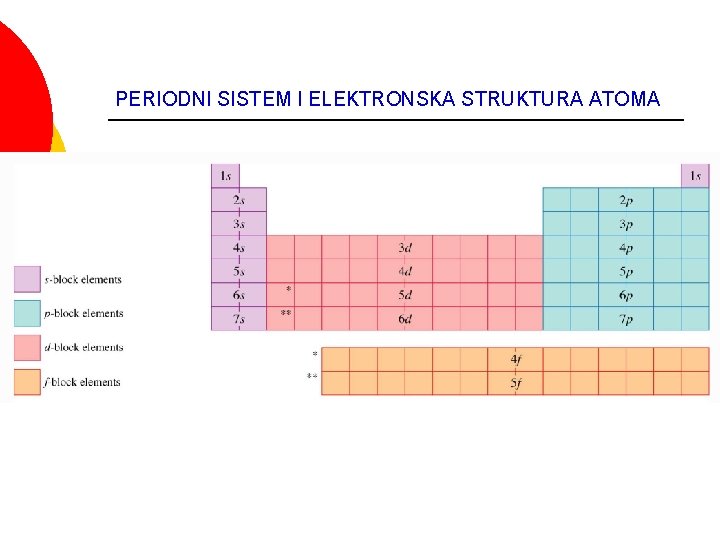
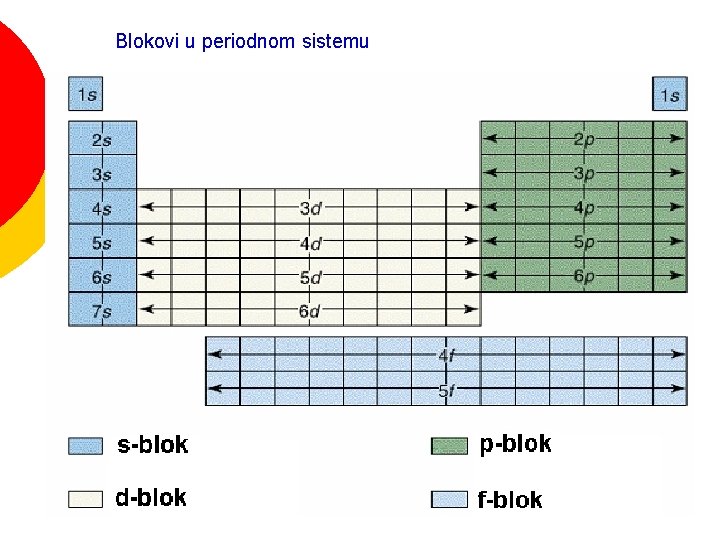
Blokovi u periodnom sistemu

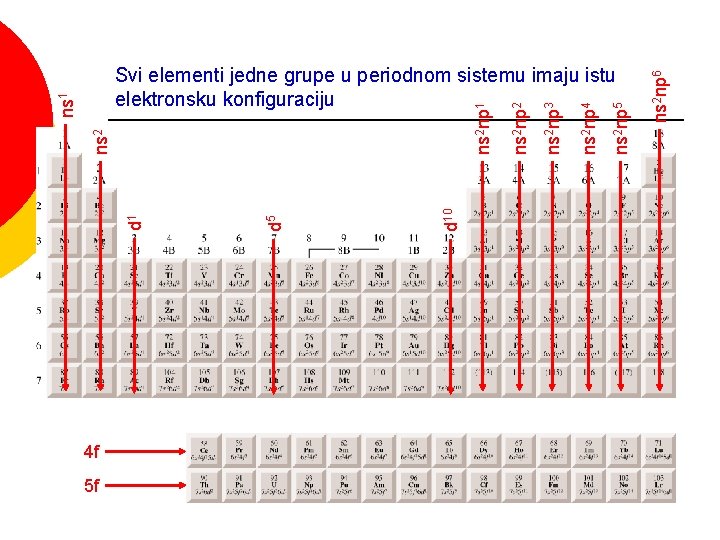
4 f 5 f ns 2 np 6 ns 2 np 5 ns 2 np 4 ns 2 np 3 ns 2 np 2 ns 2 np 1 d 10 d 5 d 1 ns 2 ns 1 Svi elementi jedne grupe u periodnom sistemu imaju istu elektronsku konfiguraciju

Periodičnost promene nekih svojstava elemenata u periodnom sistemu ¡ ¡ ¡ Pravilnost i periodičnost izmene elektronskih konfiguracija valencionih elektrona u periodi uslovljava i pravilnost u izmeni svojstava elemenata Pravilnost u izmeni svojstava je zapažena pre otkrića strukture atoma Sličnost elektronskih konfiguracija u grupi uslovljava i sličnost svojstava elemenata Periodni zakon : Elektronska struktura i svojstva atoma hemijskih elemenata periodna su funkcija atomskog broja, s tim što primarnu funkciju atomskog broja predstavlja i broj spoljašnjih elektrona koji učestvuju u formiranju hemijske veze.

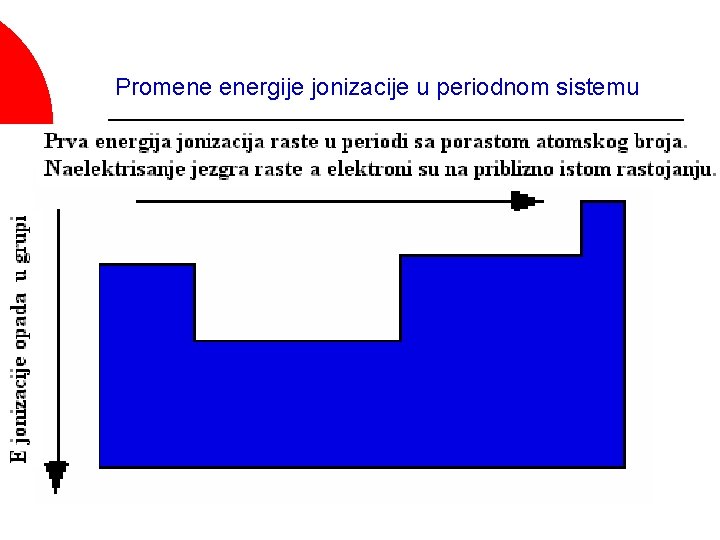
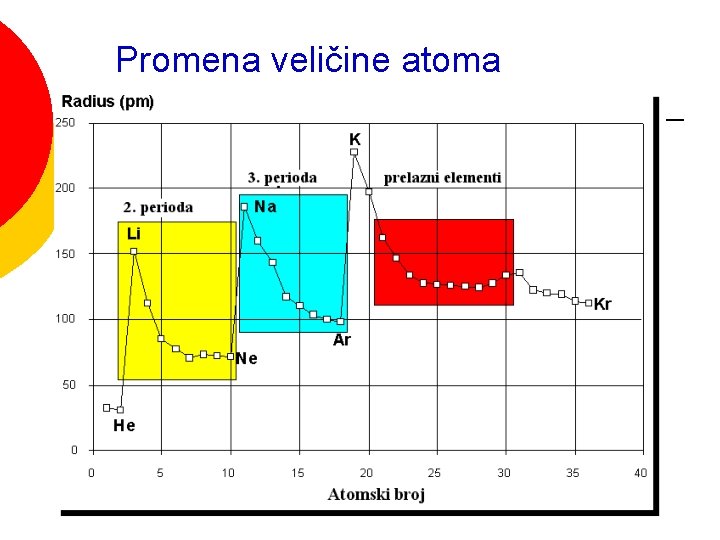
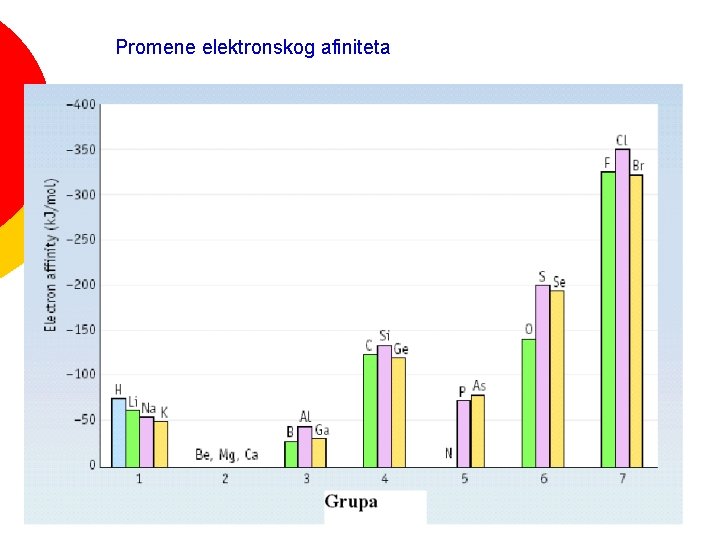
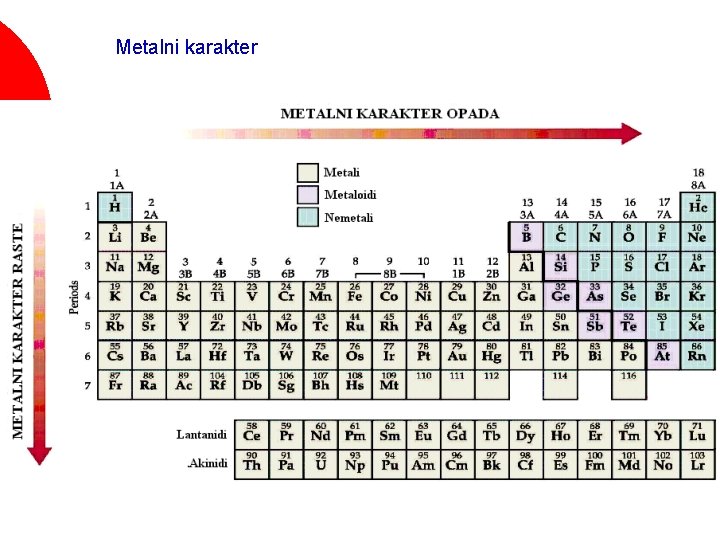
Veliki broj svojstava elemenata se periodično menja u periodnom sistemu Veličina atoma ¡ Energija jonizacije ¡ Tačka topljenja ¡ Gustina ¡ Atomska zapremina ¡ Elektronski afinitet ¡ Metalni karakter. . . ¡

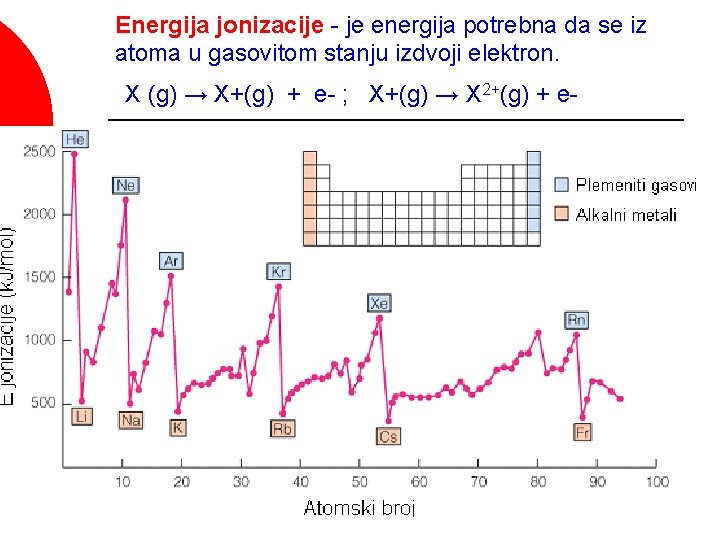
Energija jonizacije (ili jonizacioni potencijal) je energija koju je potrebno dovesti jednom molu atoma ili jona u gasovitom stanju da bi se odstranio jedan mol elektrona. ¡ Mg(g) → Mg+(g) + e- (prva E jonizacije) ¡ Mg+(g) → Mg 2+(g) + e- (druga E jonizacije) ¡

Energija jonizacije - je energija potrebna da se iz atoma u gasovitom stanju izdvoji elektron. X (g) → X+(g) + e- ; X+(g) → X 2+(g) + e-

Promene energije jonizacije u periodnom sistemu

Promena veličine atoma

Elektronski afinitet Atomi nekih elemenata primaju elektrone i grade anjone ¡ Elektronski afinitet je energija koju atom u gasovitom stanju prima ili otpušta kada prima elektron i postaje anjon ¡ Cl(g) + e- → Cl- (g) ΔH = - 349 k. J/mol ¡

Promene elektronskog afiniteta

Metalni karakter