STRUKTUR MOLEKUL TEORI VALENCE SHELL ELECTRON REPULSION VSEPR






















- Slides: 27

STRUKTUR MOLEKUL

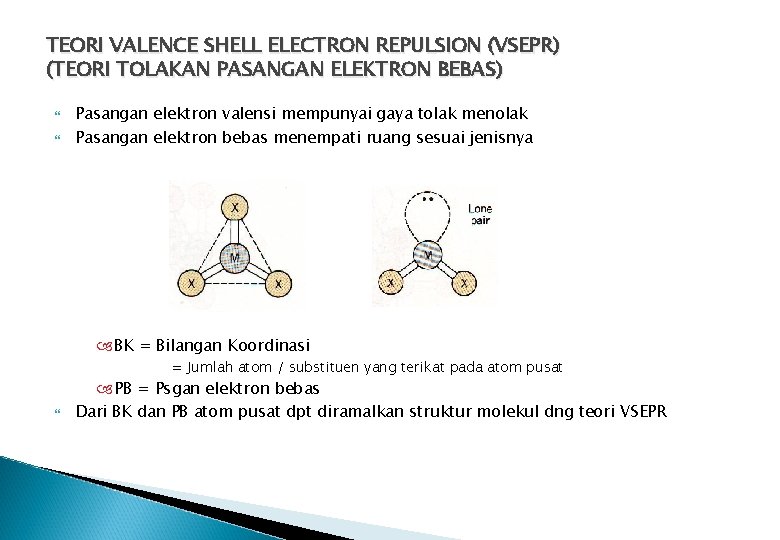
TEORI VALENCE SHELL ELECTRON REPULSION (VSEPR) (TEORI TOLAKAN PASANGAN ELEKTRON BEBAS) Pasangan elektron valensi mempunyai gaya tolak menolak Pasangan elektron bebas menempati ruang sesuai jenisnya BK = Bilangan Koordinasi = Jumlah atom / substituen yang terikat pada atom pusat PB = Psgan elektron bebas Dari BK dan PB atom pusat dpt diramalkan struktur molekul dng teori VSEPR

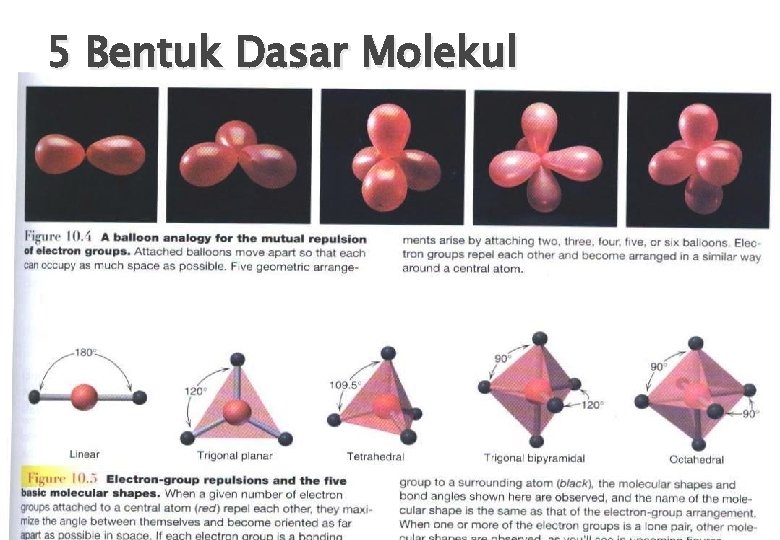
TEORI VSEPR ATURAN : – Atom pusat yg tdk memiliki PEB mempunyai bentuk ideal sesuai dng BK nya • BK = 2 struktur molekul linier • BK = 3 struktur molekul segitiga • BK = 4 struktur molekul tetrahedron • BK = 5 struktur molekul trigonal bipiramid • BK = 6 struktur molekul oktahedron – Urutan daya tolak psgan elektron : • PEB – PEI – PEI = Psgan elektron terikat – Bila ada PEB pada ikatan, sudut ikatan lebih kecil daripada yang diramalkan pada poin pertama – Urutan daya tolak psgn elektron terikat : • Ikatan rangkap 3 rangkap 2 tunggal – Urutan daya tolak atom atau substituen : • Kurang elektronegatif lebih elektronegatif

5 Bentuk Dasar Molekul


TEORI VSEPR MERAMALKAN STRUKTUR MOLEKUL 1. Menulis Rumus / struktur Lewis molekul 2. Menghitung jumlah BK dan PB atom pusat (disebut sebagai kelompok pasangan) 3. Menentukan tipe senyawa sesuai aturan KETERBATASAN TEORI VSEPR Tidak dapat menerangkan molekul – molekul yg lebih rumit dan mempunyai bilangan koordinasi lebih dari 6

2. TEORI DOMAIAN ELEKTRON Teori domain elektron merupakan penyempurnaan dari teori VSEPR. Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron, dengan jumlah domain ditentukan sebagai berikut : a. Setiap elektron ikatan (baik itu ikatan tunggal, rangkap, atau rangkap (tiga) berarti 1 domain. b. Setiap pasangan elektron bebas berarti 1 domain.


Teori domain elektron mempunyai prinsip-prinsip dasar sebagai berikut a. Antardomain elektron pada kulit luar atom pusat saling tolak-menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa, sehingga tolak-menolak di antaranya menjadi minimum. b. Bentuk molekul hanya ditentukan oleh pasangan elektron terikat.


c. Urutan kekuatan tolak-menolak di antara domain elektron adalah: tolakan antardomain elektron bebas > tolakan antara domain elektron bebas dengan domain elektron ikatan > tolakan antardomain elektron ikatan. Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas. Hal ini juga terjadi dengan domain yang mempunyai ikatan rangkap atau rangkap tiga, yang pasti mempunyai daya tolak lebih besar daripada domain yang hanya terdiri dari sepasang elektron.

RUMUS TIPE MOLEKUL Jumlah domain (pasangan elektron) dalam suatu molekul dapat dinyatakan sebagai berikut : • Atom pusat dinyatakan dengan lambang A. • Domain elektron ikatan dinyatakan dengan X. • m menyatakan banyak DEI • Domain elektron bebas dinyatakan dengan E. • n menyatakan anyaknya DEB TIPE MOLEKUL : AXm. En

CARA MENENTUKAN TIPE MOLEKUL Tipe molekul dapat dinyatakan dengan menggunakan langkah-langkah sebagai berikut : 1) Menentukan jumlah elektron valensi atom pusat (EV). 2) Menentukan jumlah domain elektron ikatan (X). 3) Menentukan jumlah domain elektron bebas (E).


Untuk senyawa biner yang berikatan rangkap atau ikatan kovalen koordinasi, maka jumlah elektron yang digunakan untuk membentuk pasangan terikat menjadi dua kali jumlah ikatan.


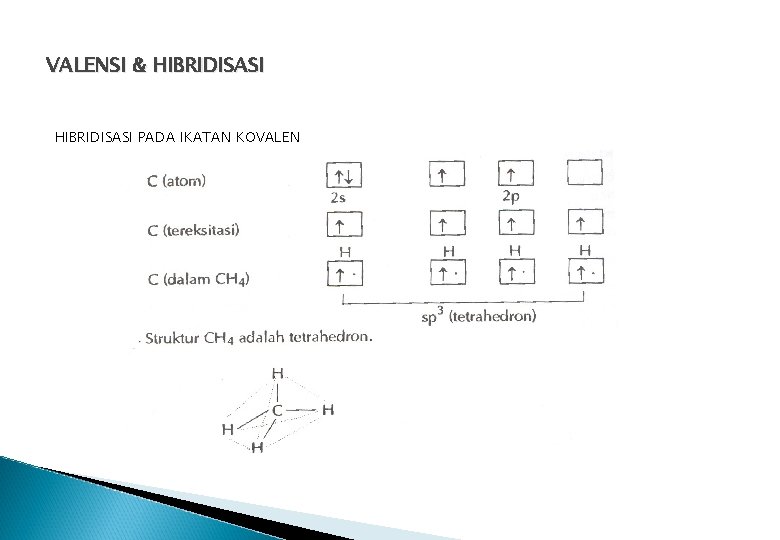
TEORI IKATAN VALENSI & KONSEP HIBRIDISASI Elektron yg terlibat hanya elektron valensi Ikatan terbentuk krn adanya overlap (tumpang tindih) orbital – orbital dari unsur – unsur yang berikatan Orbital yang saling tumpang tindih diisi oleh psgan elektron dng spin berlawanan Pada ikatan tunggal 1 tumpang tindih pd sumbu ikatan sigma (σ) Pada ikatan rangkap 2 tumpang tindih, yaitu : 1 tumpang tindih pd sumbu ikatan (ikatan σ) 1 tumpang tindih tegak lurus sumbu ikatan (ikatan pi / π) Pada pembentukan ikatan terjadi HIBRIDISASI Adalah penggabungan beberapa orbital dari atom – atom yg berikatan ditata ulang sehingga membentuk orbital baru dengan tingkat energi yg sama Jumlah orbital hybrid yang diperoleh sama dengan orbital –orbital atomiknya.


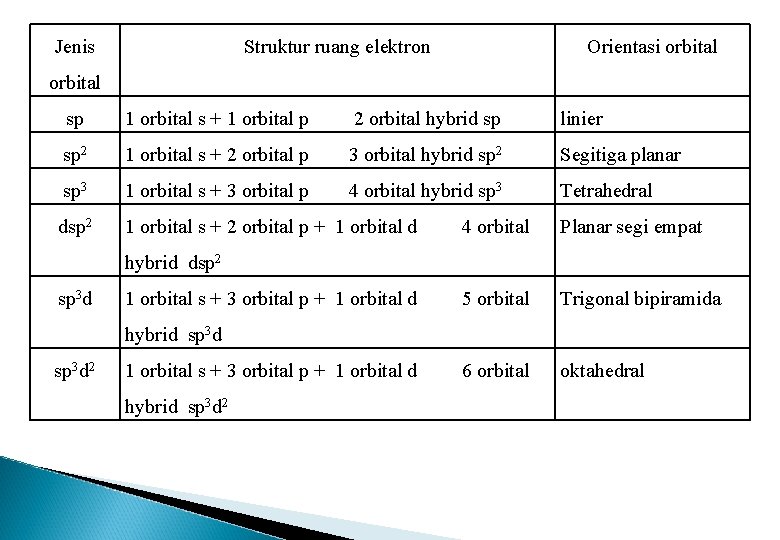
Jenis Struktur ruang elektron Orientasi orbital sp 1 orbital s + 1 orbital p 2 orbital hybrid sp linier sp 2 1 orbital s + 2 orbital p 3 orbital hybrid sp 2 Segitiga planar sp 3 1 orbital s + 3 orbital p 4 orbital hybrid sp 3 Tetrahedral dsp 2 1 orbital s + 2 orbital p + 1 orbital d 4 orbital Planar segi empat 5 orbital Trigonal bipiramida 6 orbital oktahedral hybrid dsp 2 sp 3 d 1 orbital s + 3 orbital p + 1 orbital d hybrid sp 3 d 2

VALENSI & HIBRIDISASI PADA IKATAN KOVALEN

VALENSI & HIBRIDISASI PADA IKATAN KOVALEN KOORDINASI

VALENSI & HIBRIDISASI Hibridisasi Pasangan elektron bebas Struktur molekul sp 0 Linier 0 Segitiga planar 1 Sudut 0 Tetrahedron 1 Segitiga 2 Sudut 0 Trigonal bipiramid 1 Piramid 2 Bentuk T 0 Oktahedral 1 Piramid 2 Bujur sangkar sp 2 sp 3 d 2 KETERBATASAN TEORI HIBRIDISASI Tidak dapat menjelaskan sifat kemagnetan


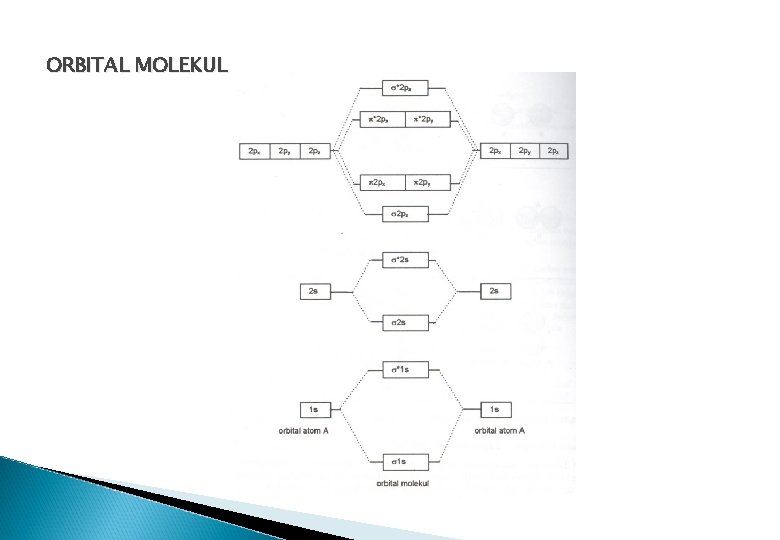
TEORI ORBITAL MOLEKUL (OM) Semua orbital atom bergabung membentuk orbital molekul Orbital molekul adalah daerah kebolehjadian (probabilitas) menemukan elektron di sekitar inti Yang akan dibahas dalam materi hanya molekul dwiatom yg sejenis, seperti F 2, O 2, dan H 2 Penggabungan dua atom menghasilkan orbital baru yg disebut orbital bonding (ikat) dan anti bonding (anti ikat) Orbital bonding adalah orbital yg terdapat antara kedua inti yang membuat kedua atom saling terikat Orbital anti bonding adalah orbital yg berada di belakang kedua inti dan saling berjauhan dilambangkan dengan tanda bintang (*)

ORBITAL MOLEKUL

ORBITAL MOLEKUL KONFIGURASI ELEKTRON MOLEKUL Contoh : 1. B 2 Jumlah elektron = 10 Konfigurasi elektron : (σ1 s)2 (σ1 s*)2 (σ2 s*)2 (σ2 px)2 2. N 2 Jumlah elektron = 14 Konfigurasi elektron : (σ1 s)2 (σ1 s*)2 (σ2 s*)2 (σ2 px)2 (π2 py)2 (π2 pz)2 ORDE IKATAN Orde Ikatan = Jml elektron orbital bonding – Jumlah elektron orbital anti bonding 2 Orde ikatan menggambarkan kekuatan ikatan yang terbentuk OI makin besar, ikatan makin kuat

ORBITAL MOLEKUL (OM) SIFAT KEMAGNETAN Ditentukan oleh ada tidaknya elektron yang tidak berpasangan (lone pair) Makin banyak elektron tak berpasangan makin paramagnetik Tidak ada elektron tak berpasangan diamagnetik Momen magnet = μ √ n (n+2) n = elektron tak berpasangan MOMEN DIPOL Dipol adalah jarak antara muatan positif dan negatif dalam molekul Momen dipol (μ) = produk perkalian antara muatan dan jarak muatan μ=qxd KEPOLARAN IKATAN dan MOLEKUL Jika terdapat perbedaan keelektronegatifan antara 2 atom yang berikatan, maka ikatan tersebut bersifat polar (momen dipol ≠ 0) Pada suatu molekul, jika jumlah momen dipol ikatan – katannya ≠ 0, maka molekul tersebut dinyatakan polar.