STEREOCHIMICA ORGANICA STEREOCHIMICA ORGANICA ffellugaunits it tel 040












- Slides: 39

STEREOCHIMICA ORGANICA

STEREOCHIMICA ORGANICA ffelluga@units. it, tel. 040 5583924 4 CFU, 32 ore POWER POINT ESAME: ORALE RICEVIMENTO: IN GENERALE SU APPUNTAMENTO PRESSO STUDIO N. 349; ADESSO PER EMAIL • Orario 2019/20: mercoledì 16 - 18; venerdì 11 -13 • • •

CORSO DI STEREOCHIMICA Programma del corso di Stereochimica Organica – 4 CFU – Prof. Fulvia Felluga • Ripasso (stereoisomeria, enantiomeria, diastereoisomeria, conformazioni) • Elementi e operazioni di simmetria. Gruppi puntuali chirali. • Polarimetria e CD • Unità stereogeniche e descrittori stereochimici: Chiralità centrale. Chiralità assiale. Descrittori, a. R, a. S, M e P. Chiralità planare. Descrittori p. R, p. S. Molecole con chiralità inerente. Descrittori Re, Si, pro-R, pro-S. Descrittori R*, S*. Scrittura tridimensionale corretta delle molecole. • Metodi di risoluzione di miscele raceme: risoluzione classica e cinetica. Risoluzione fisica e determinazione dell’eccesso enantiomerico. Risoluzione cinetica dinamica. • La selettività. Selettività rispetto al substrato e al prodotto. Stereospecificità e stereoselettività. Topicità. Gruppi e facce omotopici, diastereotopici, enantiotopici. Molecole prochirali. Enantioselettività e diastereoselettività, profili cinetici. Controllo della stereochimica relativa.

STEREOCHIMICA • • • Controllo della stereochimica relativa in reazioni diastereoselettive: Addizioni di nucleofili al carbonile di cicloalcanoni (controllo conformazionale) e di composti carbonilici lineari (controllo da un centro chirale adiacente). Modello di Felkin Ahn, anche per atomi elettronegativi adiacenti al C=O. Controllo per chelazione. Reazioni aldoliche. Addizioni coniugate. Controllo della stereochimica assoluta. Metodi di sintesi asimmetrica. Strategia dell’ausiliario chirale. Ossazolidinoni di Evans nelle alchilazioni di enolati e nelle reazioni aldoliche. Induzione asimmetrica da reagenti chirali e catalizzatori chirali. Riduzioni asimmetriche di chetoni prochirali. Idroborazioni-ossidazioni di alcheni. Ossidazioni di Sharpless. Strategia del Pool chirale

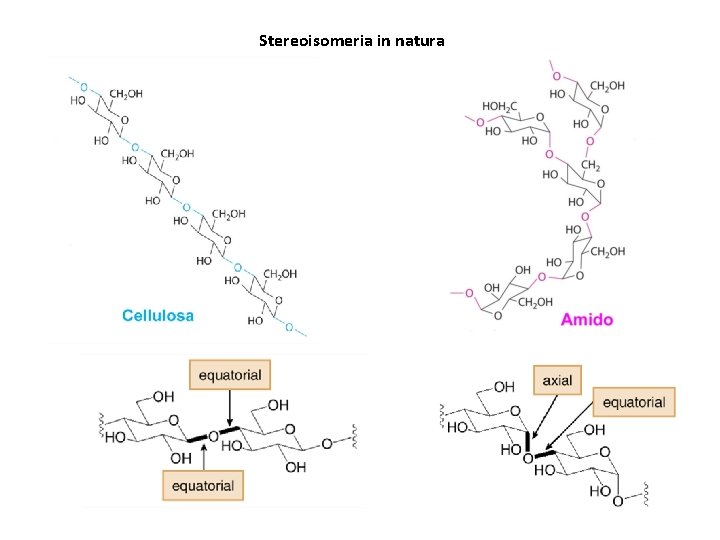
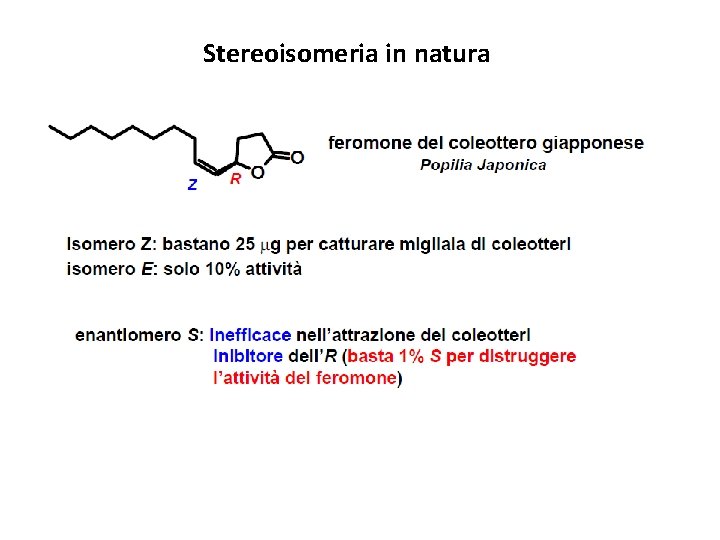
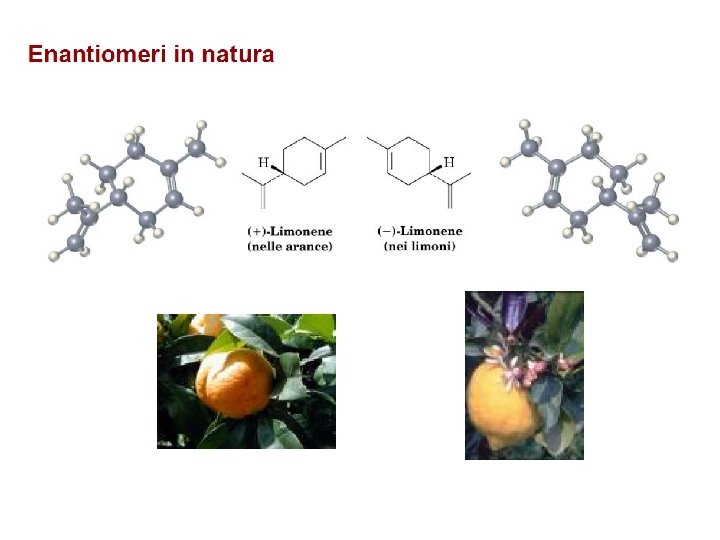
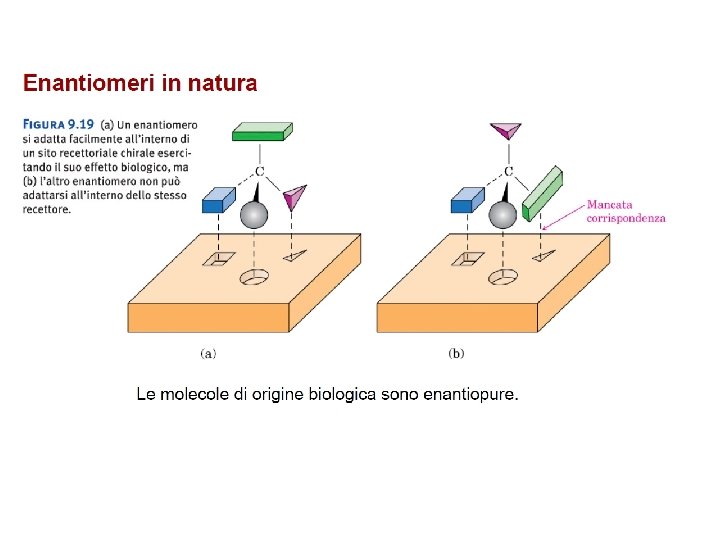
Stereoisomeria in natura

Stereoisomeria in natura




METODI DI OTTENIMENTO DI SINGOLI STEREOISOMERI: REAZIONI CHE PORTANO ALLA FORMAZIONE DI DIASTEREOISOMERI SINGOLI

RIPASSO


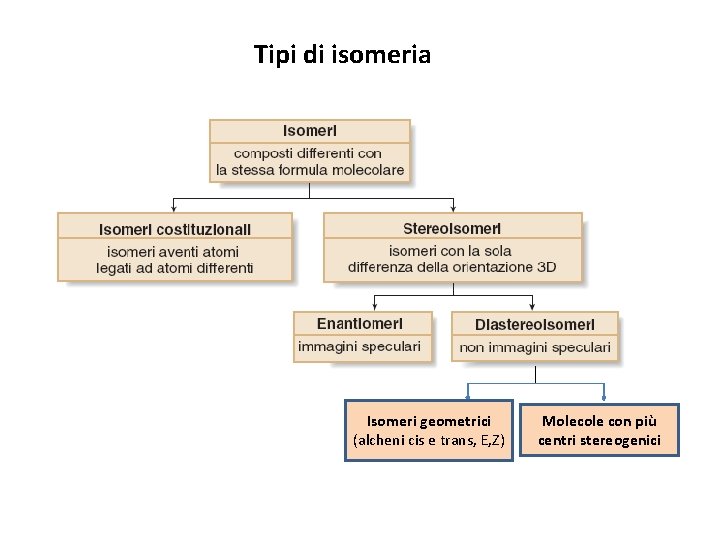
Tipi di isomeria Isomeri geometrici (alcheni cis e trans, E, Z) Molecole con più centri stereogenici

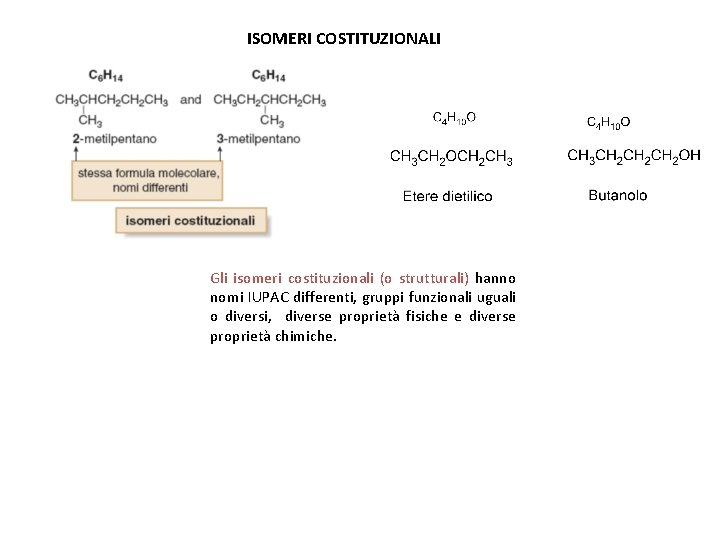
ISOMERI COSTITUZIONALI Gli isomeri costituzionali (o strutturali) hanno nomi IUPAC differenti, gruppi funzionali uguali o diversi, diverse proprietà fisiche e diverse proprietà chimiche.

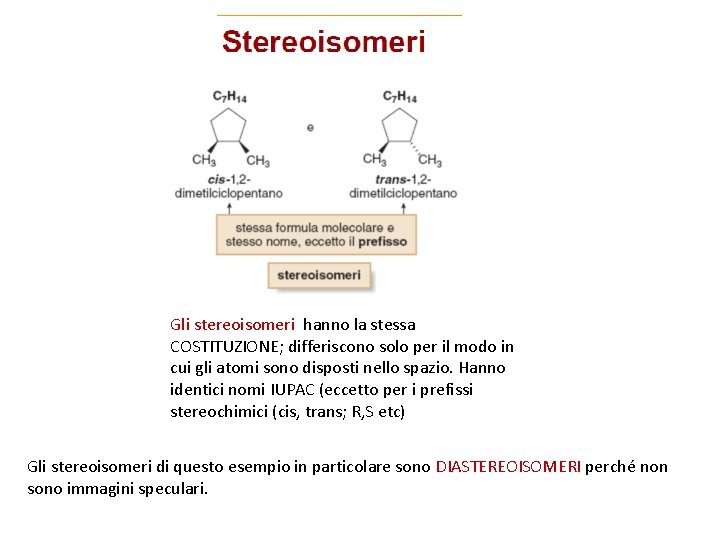
Gli stereoisomeri hanno la stessa COSTITUZIONE; differiscono solo per il modo in cui gli atomi sono disposti nello spazio. Hanno identici nomi IUPAC (eccetto per i prefissi stereochimici (cis, trans; R, S etc) Gli stereoisomeri di questo esempio in particolare sono DIASTEREOISOMERI perché non sono immagini speculari.

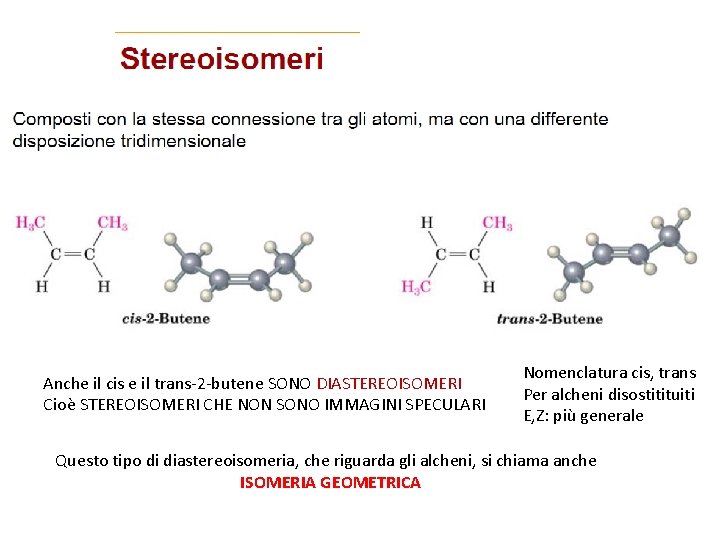
Anche il cis e il trans-2 -butene SONO DIASTEREOISOMERI Cioè STEREOISOMERI CHE NON SONO IMMAGINI SPECULARI Nomenclatura cis, trans Per alcheni disostitituiti E, Z: più generale Questo tipo di diastereoisomeria, che riguarda gli alcheni, si chiama anche ISOMERIA GEOMETRICA

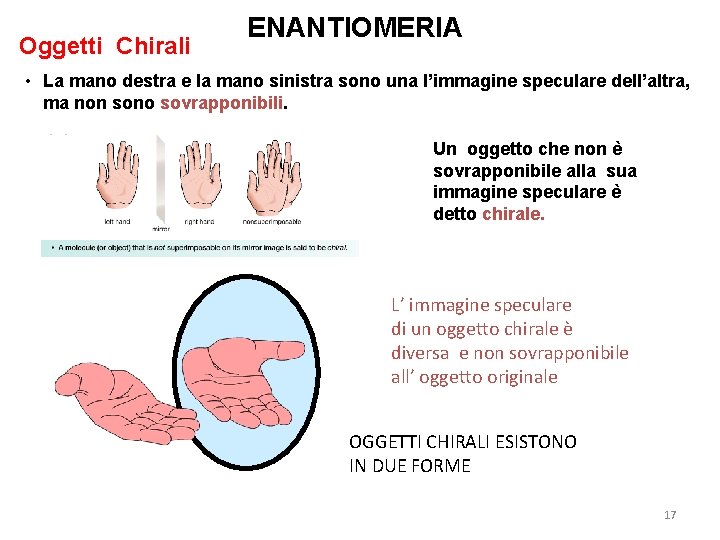
Oggetti Chirali ENANTIOMERIA • La mano destra e la mano sinistra sono una l’immagine speculare dell’altra, ma non sono sovrapponibili. Un oggetto che non è sovrapponibile alla sua immagine speculare è detto chirale. L’ immagine speculare di un oggetto chirale è diversa e non sovrapponibile all’ oggetto originale OGGETTI CHIRALI ESISTONO IN DUE FORME 17

Oggetti Achirali • Altre molecole sono come le calze. Due calze formano una coppia di immagini speculari che sono sovrapponibili. Una calza e la sua immagine speculare sono dunque identiche. • Una molecola o un oggetto che è sovrapponibile alla sua immagine speculare è detta achirale. • Gli oggetti achirali contengono un piano di simmetria, mentre quelle chirali no. • Un piano di simmetria è un piano che taglia l’oggetto a metà, in modo tale che una metà è il riflesso dell’altra. L’ immagine speculare di un oggetto achirale è identica e sovrapponibile all’ oggetto originale PIANO DI SIMMETRIA 18

Oggetti achirali hanno almeno un piano di simmetria Oggetti chirali non hanno elementi di simmetria

Molecole Chirali e Achirali • Consideriamo alcune molecole con 1 atomo centrale sp 3 per determinare se sono o non sono chirali. Molecole achirali Piano di simmetria 20

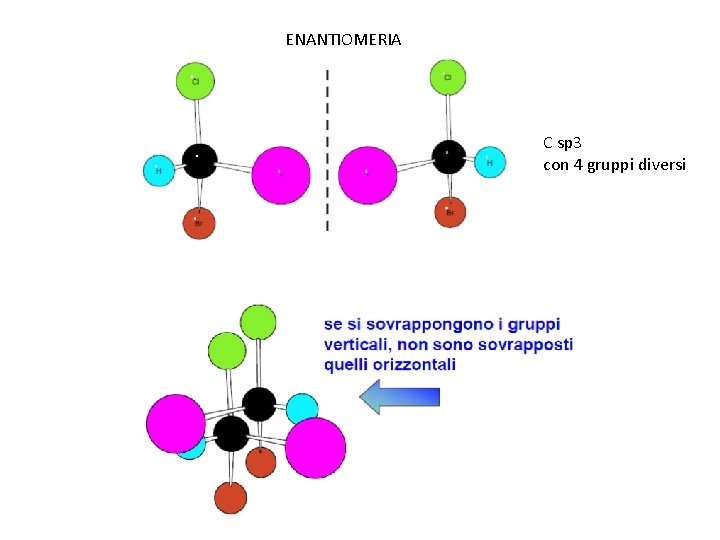
ENANTIOMERIA C sp 3 con 4 gruppi diversi

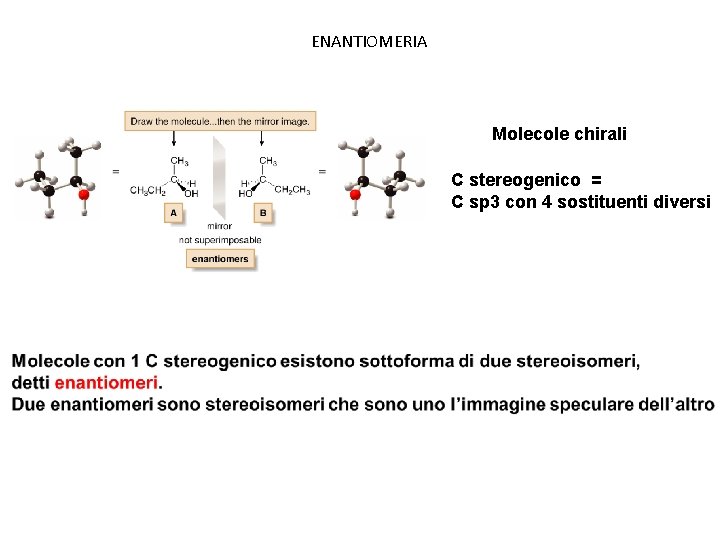
ENANTIOMERIA Molecole chirali C stereogenico = C sp 3 con 4 sostituenti diversi

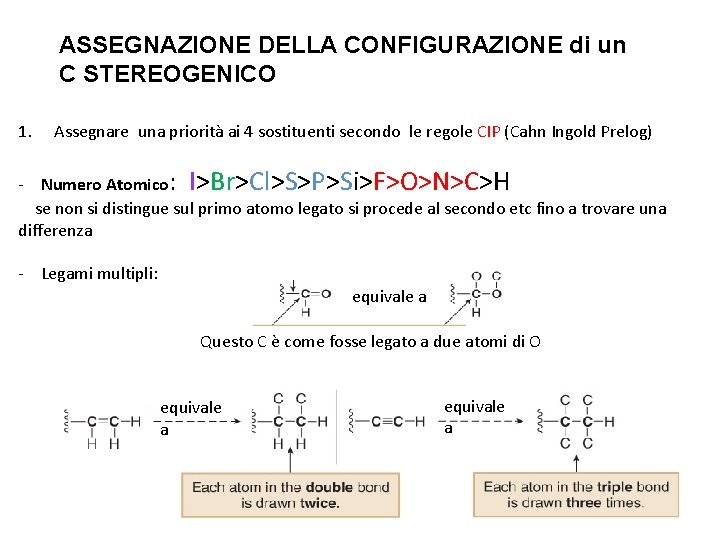
ASSEGNAZIONE DELLA CONFIGURAZIONE di un C STEREOGENICO 1. Assegnare una priorità ai 4 sostituenti secondo le regole CIP (Cahn Ingold Prelog) - Numero Atomico: I>Br>Cl>S>P>Si>F>O>N>C>H se non si distingue sul primo atomo legato si procede al secondo etc fino a trovare una differenza Equivale a - Legami multipli: equivale a Questo C è come fosse legato a due atomi di O equivale a

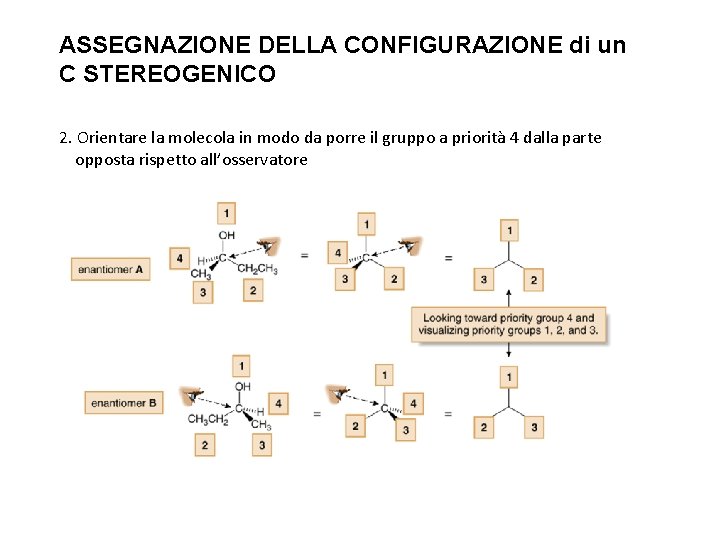
ASSEGNAZIONE DELLA CONFIGURAZIONE di un C STEREOGENICO 2. Orientare la molecola in modo da porre il gruppo a priorità 4 dalla parte opposta rispetto all’osservatore

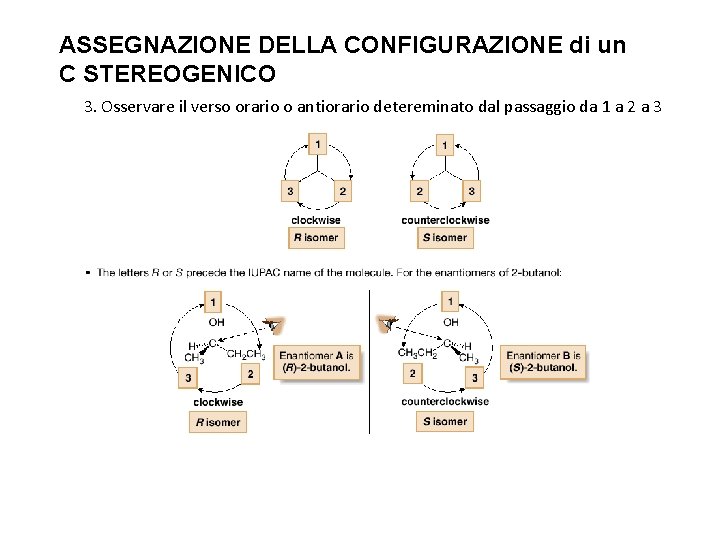
ASSEGNAZIONE DELLA CONFIGURAZIONE di un C STEREOGENICO 3. Osservare il verso orario o antiorario detereminato dal passaggio da 1 a 2 a 3

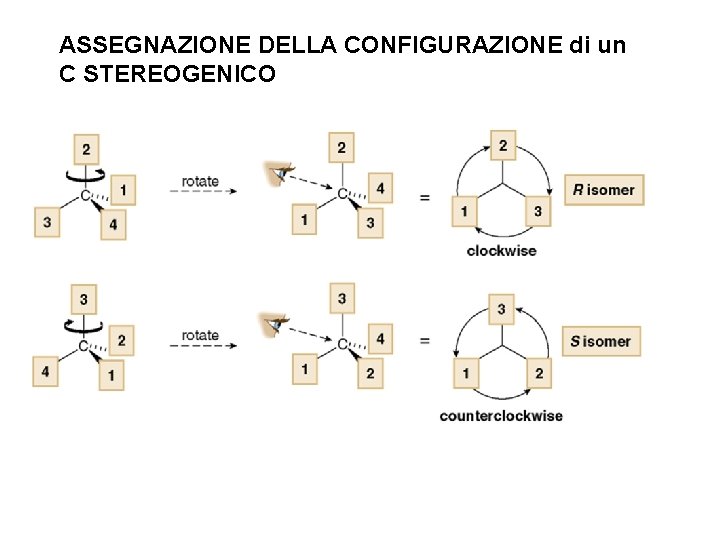
ASSEGNAZIONE DELLA CONFIGURAZIONE di un C STEREOGENICO

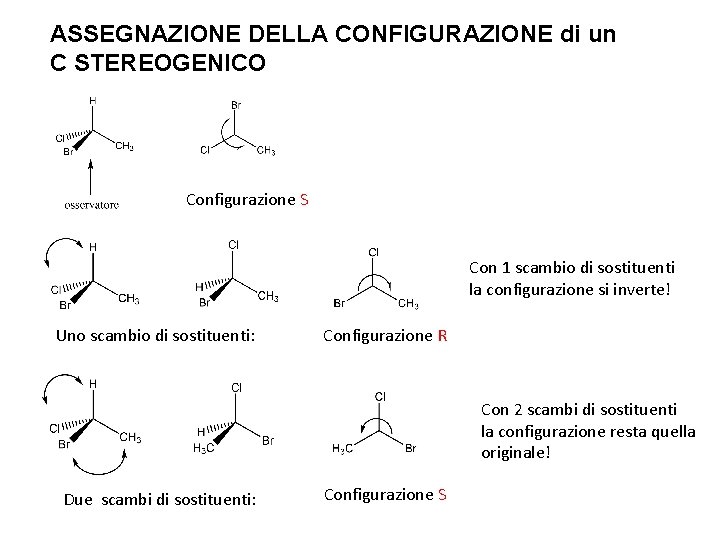
ASSEGNAZIONE DELLA CONFIGURAZIONE di un C STEREOGENICO Configurazione S Con 1 scambio di sostituenti la configurazione si inverte! Uno scambio di sostituenti: Configurazione R Con 2 scambi di sostituenti la configurazione resta quella originale! Due scambi di sostituenti: Configurazione S

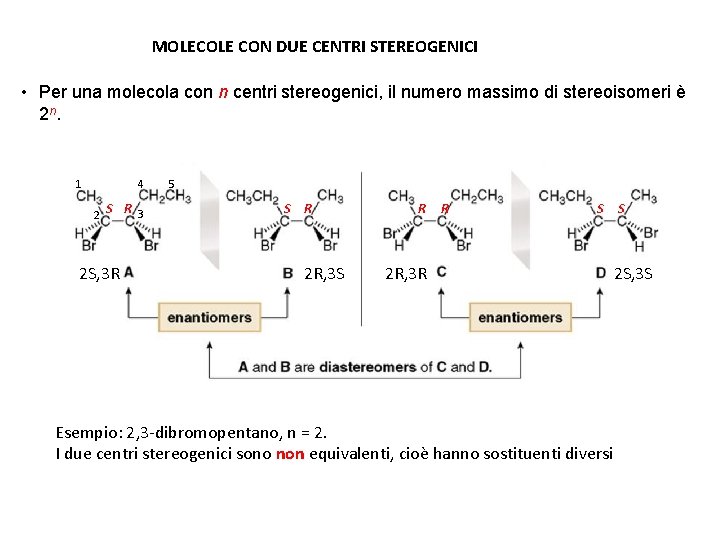
MOLECOLE CON DUE CENTRI STEREOGENICI • Per una molecola con n centri stereogenici, il numero massimo di stereoisomeri è 2 n. 4 1 2 S R 3 2 S, 3 R 5 S R 2 R, 3 S R R S 2 R, 3 R Esempio: 2, 3 -dibromopentano, n = 2. I due centri stereogenici sono non equivalenti, cioè hanno sostituenti diversi S 2 S, 3 S

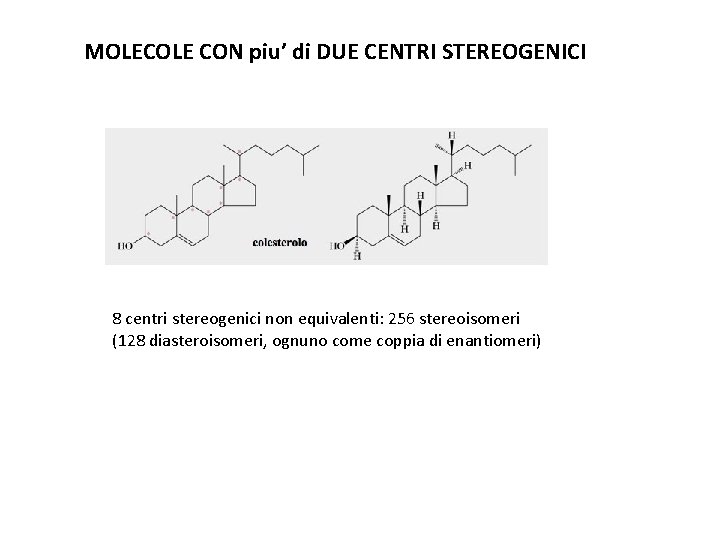
MOLECOLE CON piu’ di DUE CENTRI STEREOGENICI 8 centri stereogenici non equivalenti: 256 stereoisomeri (128 diasteroisomeri, ognuno come coppia di enantiomeri)

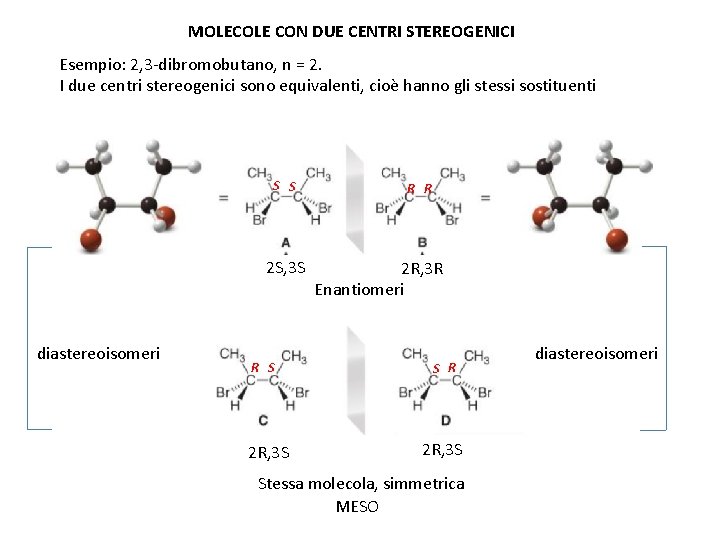
MOLECOLE CON DUE CENTRI STEREOGENICI Esempio: 2, 3 -dibromobutano, n = 2. I due centri stereogenici sono equivalenti, cioè hanno gli stessi sostituenti S S 2 S, 3 S diastereoisomeri R S 2 R, 3 S R R S 2 R, 3 R Enantiomeri S R 2 R, 3 S Stessa molecola, simmetrica MESO diastereoisomeri

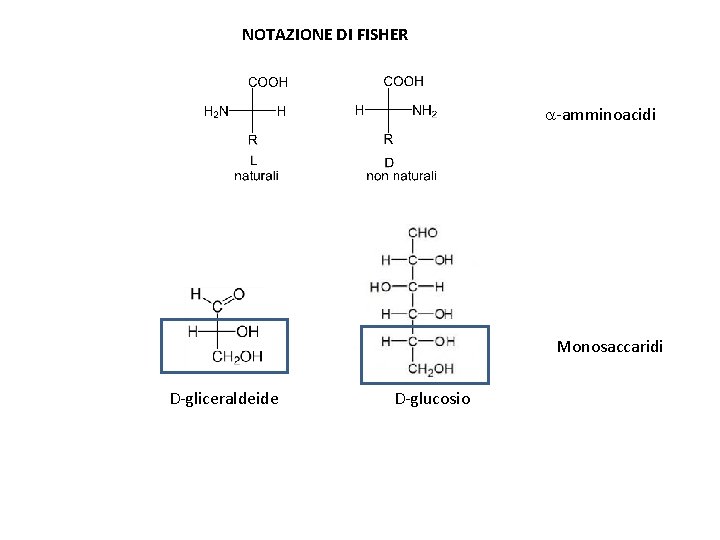
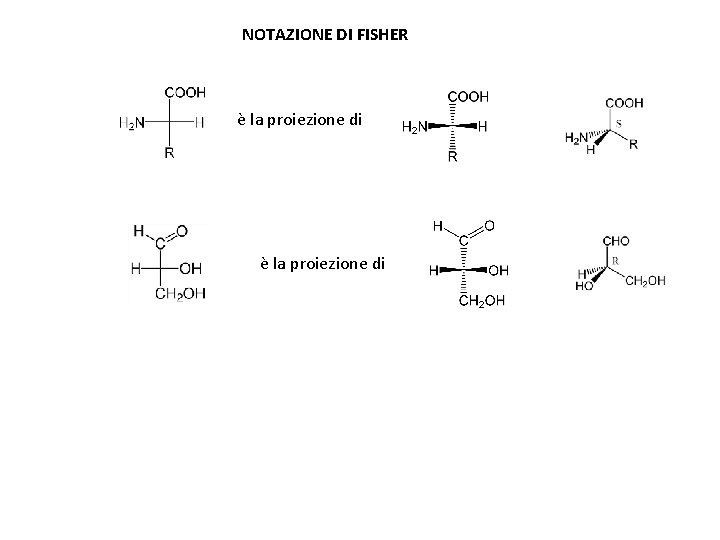
NOTAZIONE DI FISHER a-amminoacidi Monosaccaridi D-gliceraldeide D-glucosio

NOTAZIONE DI FISHER è la proiezione di

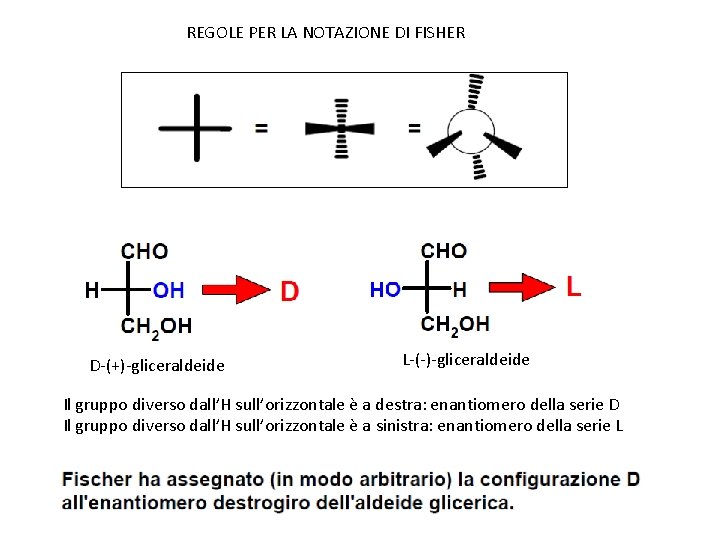
REGOLE PER LA NOTAZIONE DI FISHER D-(+)-gliceraldeide L-(-)-gliceraldeide Il gruppo diverso dall’H sull’orizzontale è a destra: enantiomero della serie D Il gruppo diverso dall’H sull’orizzontale è a sinistra: enantiomero della serie L

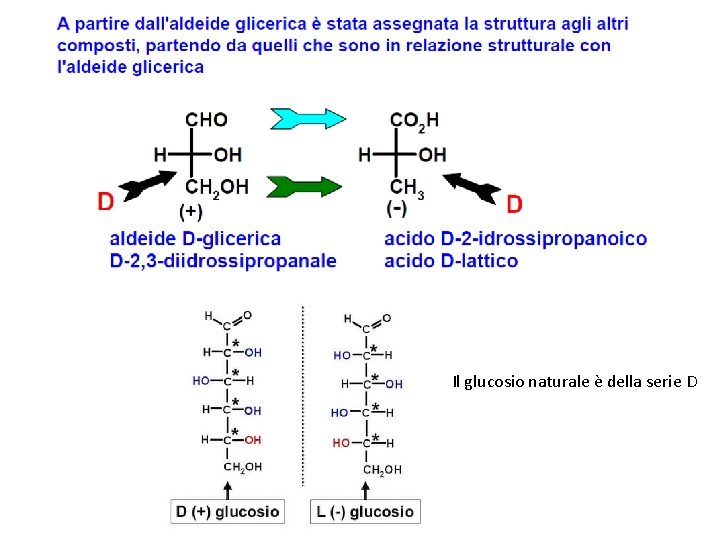
Il glucosio naturale è della serie D

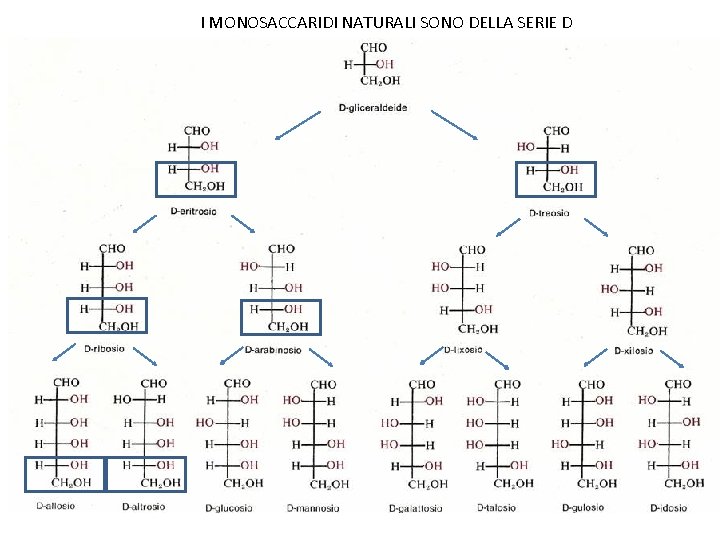
I MONOSACCARIDI NATURALI SONO DELLA SERIE D

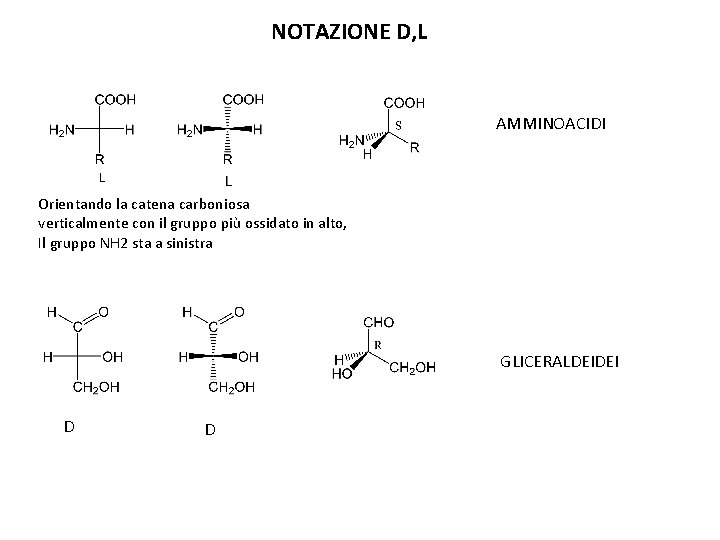
NOTAZIONE D, L AMMINOACIDI Orientando la catena carboniosa verticalmente con il gruppo più ossidato in alto, Il gruppo NH 2 sta a sinistra GLICERALDEIDEI D D

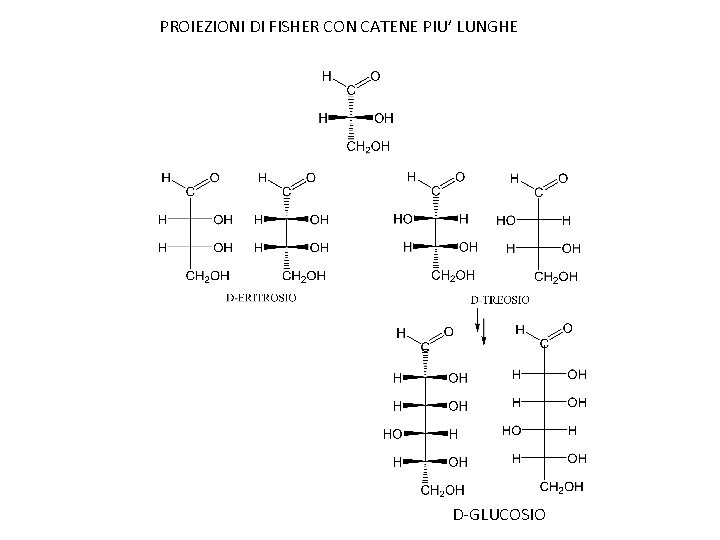
PROIEZIONI DI FISHER CON CATENE PIU’ LUNGHE D-GLUCOSIO

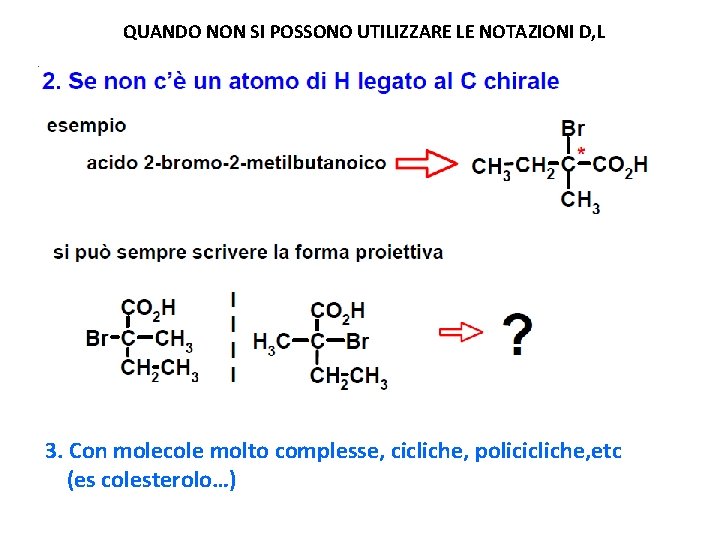
QUANDO NON SI POSSONO UTILIZZARE LE NOTAZIONI D, L

QUANDO NON SI POSSONO UTILIZZARE LE NOTAZIONI D, L 3. Con molecole molto complesse, cicliche, policicliche, etc (es colesterolo…)