Spinspin csatols Az NMR spektrumokat jellemz harmadik paramter



















- Slides: 62

Spin-spin csatolás • Az NMR spektrumokat jellemző harmadik paraméter a csatolási állandó. Az 1 H-NMR spektrumok szinte mindegyikében fellép a spin-spin csatolás, melynek jellemzője, a csatolási állandó a kémiai szerkezetmeghatározás szempontjából alapvető fontosságú. • A skaláris spin-spin csatolás eredménye jelfelhasadás, a spektrális finomszerkezet megjelenése. Csatolás felléphet minden NMR-aktív mag között, melyek kémiai kötéseken keresztül kapcsolódnak egymáshoz. J 0 J=0 I S • A jel felhasadása azt jelenti, hogy bizonyos magok átmenetei során nagyobb energiakülönbség észlelhető. Az ok a kötő elektronok mágneses momentumában keresendő. A magok mágneses momentuma az elektronok kismértékű polarizációját (elrendeződését) eredményezi, és az átlapoló molekulapályák ezt közvetítik a szomszédos, illetve közeli magok felé.

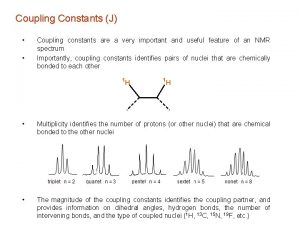
Spin-spin csatolás • Egy mag spinállapotait befolyásolhatja a szomszédos spinek energiaállapota, mely kölcsönös. Ez a jelenség a csatolás. A csatolás legtipikusabb esete a molekula elektronfelhőjének közvetítésével jön létre – a kötésen keresztül. 1 H 13 1 1 H H Három kötés C Egy kötés • Energiaszintek: Mindegyik spin nivóján további felhasadás észlelhető I J (Hz) b Ib S S a Ib S b Ia S S I a Ia S I Csatolási állandó, (J) tipusai milyen magok között jön létre? homonukleáris - heteronukleáris hány kötés távolságban vannak a csatoló partnerek? 1 J, 2 J, 3 J, 4 J…… S

Elsőrendű spinrendszerek • Kezdetnek vizsgáljuk meg a legegyszerűbb csatolt rendszert, amelyet bonyolult kvantummechanikai megközelítés nélkül is viszonylag egyszerűen értelmezhetünk • Nézzük meg mindezt az etil-klorid példáján!. Ebben a vegyületben az etil CH 3 jel ~ 1. 3 ppm, míg az etil CH 2 jel ~ 4. 2 ppm körül várható. A legtöbb mai spektrométer esetén ez a kémiai eltolódás különbség, Dn, sokkal nagyobb, mint a J csatolási állandó, mely esetünkben ~ 7 Hz. Ebben az esetben jogosan feltételezhetjük, hogy rendszerünk elsőrendű spinrendszer. • Ha a rendszert az egyszerű AX spinrendszerhez hasonló módszerrel közelítjük, belátható, hogy minden metilénproton 4 metilállapotot fog „érezni”, míg minden metilproton 3 lehetséges metilénállapotot. Ugyanakkor mind a 3 metilproton ekvivalens egymással, ugyanígy a két metilénproron is. Hogy ezt jobban be tudjuk látni, az etil-klorid molekulában minden egyes 1 H mag energiaállapot lehetőségét egy energiadiagramban ábrázoljuk aa ab ba bb CH 2 aaa aab aba baa abb bab bba bbb CH 3

Elsőrendű spinrendszerek • Általánosítva az előzőeket : ha egy A mag csatol n db azonos X ( 1/2) spinű maggal, az A jele a spektrumban n + 1 jelet fog mutatni. Ezért az Et. Cl molekula CH 2 jele 4 -s felhasadást mutat, azaz quartett lesz. Analóg módon, az Et. Cl CH 3 jele 3 -as jelcsoportot alkot, tehát triplett lesz • A multiplett vonalainak egymástól való távolsága egyenlő lesz a két különböző kémiai eltolódású mag (metil és metilén, A és X) közötti csatolási állandóval. (~ 7 Hz). • Az energiadiagramból nemcsak a multiplicitások, hanem az intenzitások is megállapíthatóak CH 3 CH 2 • Mivel a spinállapotok valószínűsége azonos és az adott sorok a diagramban azonos energiaállapotokat reprezentálnak, a metilcsoport jeleinek J (Hz) CH 3 intenzitás-aránya 1: 2: 1 lesz, míg a metiléncsoport jeleinél CH 2 ez az arány 1: 3: 3: 1 4. 2 ppm 1. 3 ppm

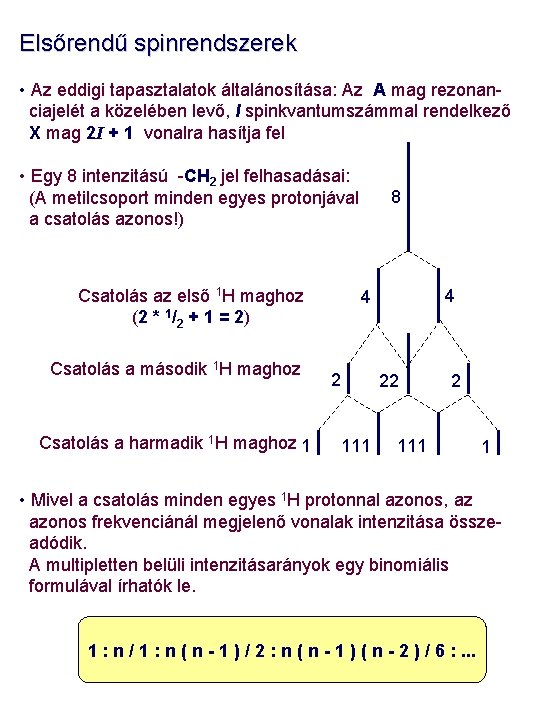
Elsőrendű spinrendszerek • Az eddigi tapasztalatok általánosítása: Az A mag rezonanciajelét a közelében levő, I spinkvantumszámmal rendelkező X mag 2 I + 1 vonalra hasítja fel • Egy 8 intenzitású -CH 2 jel felhasadásai: (A metilcsoport minden egyes protonjával a csatolás azonos!) Csatolás az első 1 H maghoz (2 * 1/2 + 1 = 2) Csatolás a második 1 H maghoz Csatolás a harmadik 1 H maghoz 1 8 4 4 2 111 22 2 111 1 • Mivel a csatolás minden egyes 1 H protonnal azonos, az azonos frekvenciánál megjelenő vonalak intenzitása összeadódik. A multipletten belüli intenzitásarányok egy binomiális formulával írhatók le. 1 : n / 1 : n ( n - 1 ) / 2 : n ( n - 1 ) ( n - 2 ) / 6 : . . .

Elsőrendű spinrendszerek • Amennyiben n db ekvivalens, 1/2 spinnel rendelkező maggal csatol a jel, multiplicitások és az ezen belüli intenzitásokat a Pascal háromszög írja le 1 1 2 1 1 3 3 1 1 4 6 4 1 • Ha egy spinrendszerben egy mag többféle maggal csatol és mindegyik csatolás elsőrendűnek tekinthető – a felhasadás és az intenzitásviszonyok leírása az eddigi szabályok továbbgondolásával lehetséges • Tekintsünk egy CH csoportot, (A) mely csatol egy CH 3 csoporttal (M), JAM =7 Hz csatolási állandóval és egy CH 2 csoporttal (X), JAX = 5 Hz csatolási állandóval. Lépésenként haladva, a nagyobb csatolás a jelet kvartetté hasítja: 7 Hz • Ezután a kisebb csatolás a kvartett minden egyes vonalát tripletté hasítja fel. 5 Hz

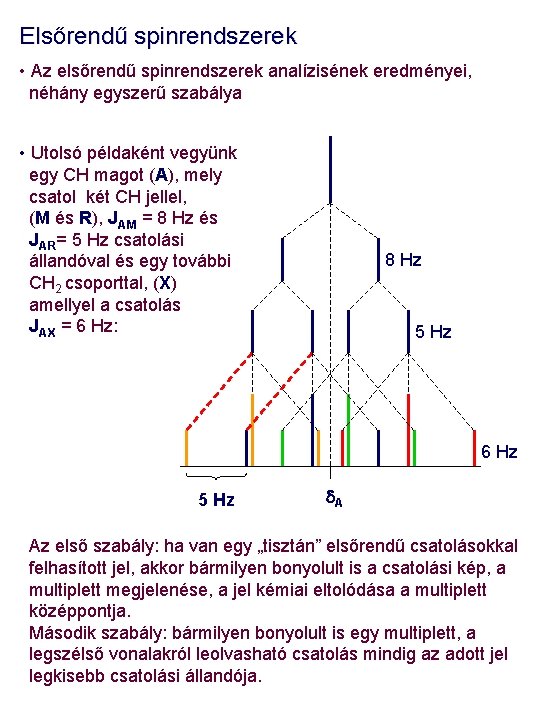
Elsőrendű spinrendszerek • Az elsőrendű spinrendszerek analízisének eredményei, néhány egyszerű szabálya • Utolsó példaként vegyünk egy CH magot (A), mely csatol két CH jellel, (M és R), JAM = 8 Hz és JAR= 5 Hz csatolási állandóval és egy további CH 2 csoporttal, (X) amellyel a csatolás JAX = 6 Hz: 8 Hz 5 Hz 6 Hz 5 Hz d. A Az első szabály: ha van egy „tisztán” elsőrendű csatolásokkal felhasított jel, akkor bármilyen bonyolult is a csatolási kép, a multiplett megjelenése, a jel kémiai eltolódása a multiplett középpontja. Második szabály: bármilyen bonyolult is egy multiplett, a legszélső vonalakról leolvasható csatolás mindig az adott jel legkisebb csatolási állandója.

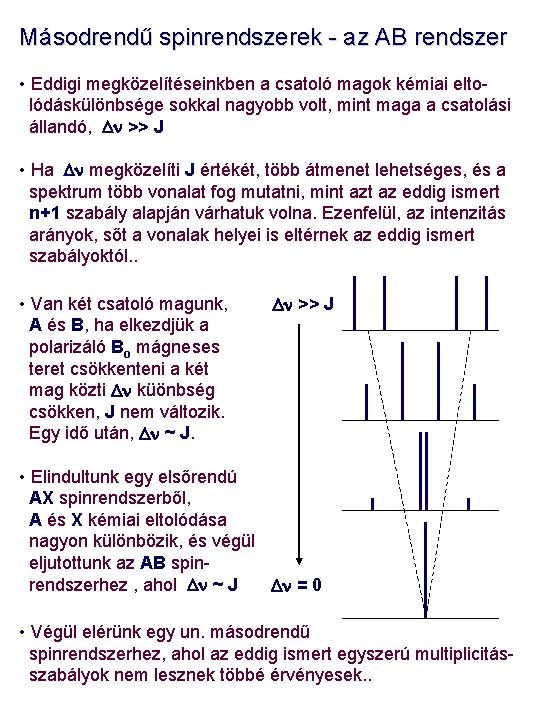
Másodrendű spinrendszerek - az AB rendszer • Eddigi megközelítéseinkben a csatoló magok kémiai eltolódáskülönbsége sokkal nagyobb volt, mint maga a csatolási állandó, Dn >> J • Ha Dn megközelíti J értékét, több átmenet lehetséges, és a spektrum több vonalat fog mutatni, mint az eddig ismert n+1 szabály alapján várhatuk volna. Ezenfelül, az intenzitás arányok, sőt a vonalak helyei is eltérnek az eddig ismert szabályoktól. . • Van két csatoló magunk, A és B, ha elkezdjük a polarizáló Bo mágneses teret csökkenteni a két mag közti Dn küönbség csökken, J nem változik. Egy idő után, Dn ~ J. Dn >> J • Elindultunk egy elsőrendú AX spinrendszerből, A és X kémiai eltolódása nagyon különbözik, és végül eljutottunk az AB spinrendszerhez , ahol Dn ~ J Dn = 0 • Végül elérünk egy un. másodrendű spinrendszerhez, ahol az eddig ismert egyszerú multiplicitásszabályok nem lesznek többé érvényesek. .

Az AB rendszer • Egy AB spinrendszer analízise (a kémiai eltolódások és csatolási állandók meghatározása) nem annyira egyszerű, mint az az AX spinrendszer esetén volt… A másodrendű spektrumok jellegzetes sajátossága a „háztető effektus”: ami egy AB rendszerben is megfigyelhető és a csatoló n. A n. Z n. B partner irányát mutatja. A B 1 2 3 4 Hasonlóan az AX spinrendszerhez a JAB | = | f 1 - f 2 | = | f 3 - f 4 | csatolási állandó is meghatározható, mint az 1 és 2, illetve 3 és 4 vonalak frelvenciakülönbsége: A és B magok kémiai eltolódásai nem lesznek a „dublettek” számtani középpontjai ! Helyük kiszámítható a következő formulákkal : Mivel Dn a n. A - n. B kémiai eltolódás különbség, n. A és n. B pontos kémiai eltolódása : • Hasonló módon számíthatók a jelintenzitások : Dn 2 = | ( f 1 - f 4 ) ( f 2 - f 3 ) | n. A = n. Z - Dn / 2 n. B = n. Z + Dn / 2 I 1 = I 3 I 4 = | f 1 - f 4 | | f 2 - f 3 |

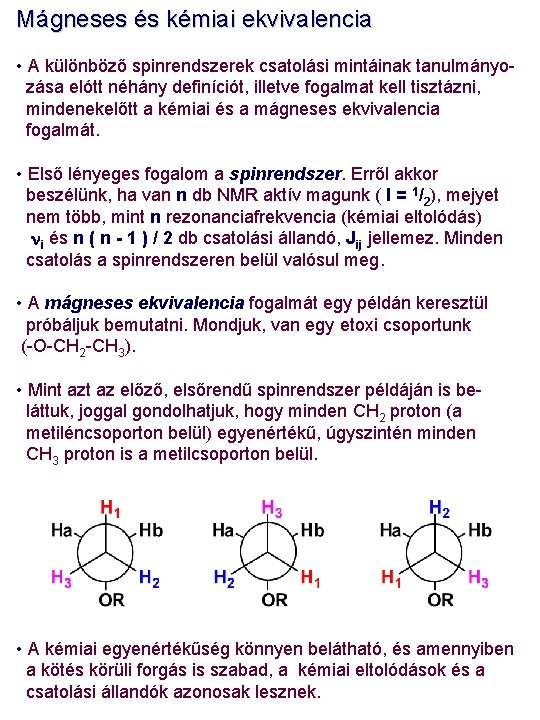
Mágneses és kémiai ekvivalencia • A különböző spinrendszerek csatolási mintáinak tanulmányozása elótt néhány definíciót, illetve fogalmat kell tisztázni, mindenekelőtt a kémiai és a mágneses ekvivalencia fogalmát. • Első lényeges fogalom a spinrendszer. Erről akkor beszélünk, ha van n db NMR aktív magunk ( I = 1/2), mejyet nem több, mint n rezonanciafrekvencia (kémiai eltolódás) ni és n ( n - 1 ) / 2 db csatolási állandó, Jij jellemez. Minden csatolás a spinrendszeren belül valósul meg. • A mágneses ekvivalencia fogalmát egy példán keresztül próbáljuk bemutatni. Mondjuk, van egy etoxi csoportunk (-O-CH 2 -CH 3). • Mint az előző, elsőrendű spinrendszer példáján is beláttuk, joggal gondolhatjuk, hogy minden CH 2 proton (a metiléncsoporton belül) egyenértékű, úgyszintén minden CH 3 proton is a metilcsoporton belül. • A kémiai egyenértékűség könnyen belátható, és amennyiben a kötés körüli forgás is szabad, a kémiai eltolódások és a csatolási állandók azonosak lesznek.

Mágneses ekvivalencia MIvel az egyes szénatomokhoz kapcsolódó protonok kémiai eltolódása ugyan változhat, a szabad forgás következtében csak egy átlagos kémiai eltolódást figyelhetünk meg. Ugyanez igaz a csatolási állandókra is. Az általunk megfigyelhető JHH csatolás is egy átlagérték, azaz a metiléncsoport bármely protonjának csatolása bármely metilprotonnal azonos. Az eddigi szimbólumrendszert kiterjesztve, és figyelembe véve, hogy d(CH 2) >> d(CH 3), egy un. A 2 X 3 spinrendszerünk lesz : Van 2 mágnesesen ekvivalens 1 H mag a CH 2, csoporton és 3 a CH 3 csoporton. A 2 JHH geminális csatolás (azonos szénatomokhoz kapcsolódó protonok között) esetünkben 0, mivel bármely mag energiaszintje a két (három) proton közül azonos állapotú. A CH 2 csoport protonjait A –val, míg a CH 3 csoport protonjait X -el jelöljük, mivel kémiai eltolódásuk különbsége sokszorosa a köztük fellépő csatolási állandónak. Általában a nagyobb eltolódású protont jelöljük A -val. Az ‘An. Xm’ tipusú spinrendszerre további példa a difluormetán: Ebben az esetben is a 1 H és 19 F magok ekvivalensek, de nem a szabad forgás, hanem a szimmetria eredményeként. Ez egy A 2 X 2 spinrendszer.

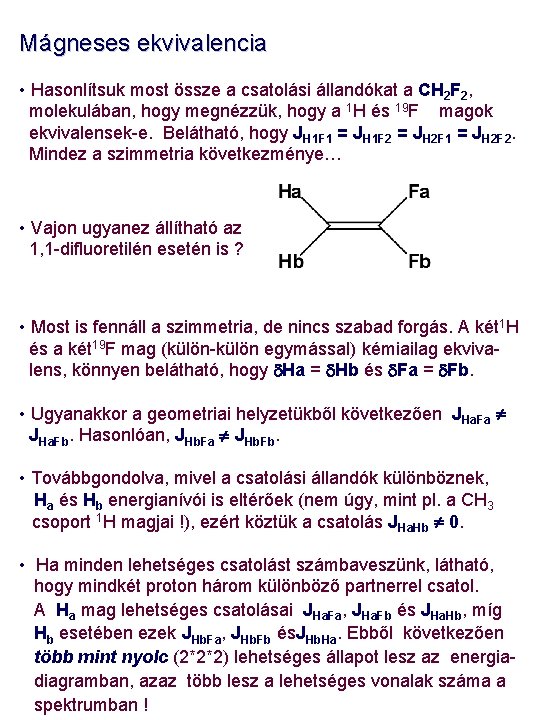
Mágneses ekvivalencia • Hasonlítsuk most össze a csatolási állandókat a CH 2 F 2, molekulában, hogy megnézzük, hogy a 1 H és 19 F magok ekvivalensek-e. Belátható, hogy JH 1 F 1 = JH 1 F 2 = JH 2 F 1 = JH 2 F 2. Mindez a szimmetria következménye… • Vajon ugyanez állítható az 1, 1 -difluoretilén esetén is ? • Most is fennáll a szimmetria, de nincs szabad forgás. A két 1 H és a két 19 F mag (külön-külön egymással) kémiailag ekvivalens, könnyen belátható, hogy d. Ha = d. Hb és d. Fa = d. Fb. • Ugyanakkor a geometriai helyzetükből következően JHa. Fa JHa. Fb. Hasonlóan, JHb. Fa JHb. Fb. • Továbbgondolva, mivel a csatolási állandók különböznek, Ha és Hb energianívói is eltérőek (nem úgy, mint pl. a CH 3 csoport 1 H magjai !), ezért köztük a csatolás JHa. Hb 0. • Ha minden lehetséges csatolást számbaveszünk, látható, hogy mindkét proton három különböző partnerrel csatol. A Ha mag lehetséges csatolásai JHa. Fa, JHa. Fb és JHa. Hb, míg Hb esetében ezek JHb. Fa, JHb. Fb és. JHb. Ha. Ebből következően több mint nyolc (2*2*2) lehetséges állapot lesz az energiadiagramban, azaz több lesz a lehetséges vonalak száma a spektrumban !

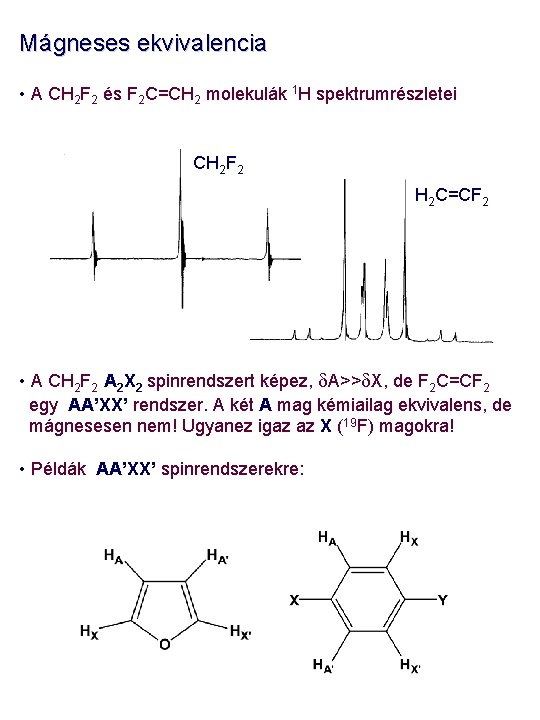
Mágneses ekvivalencia • A CH 2 F 2 és F 2 C=CH 2 molekulák 1 H spektrumrészletei CH 2 F 2 H 2 C=CF 2 • A CH 2 F 2 A 2 X 2 spinrendszert képez, d. A>>d. X, de F 2 C=CF 2 egy AA’XX’ rendszer. A két A mag kémiailag ekvivalens, de mágnesesen nem! Ugyanez igaz az X (19 F) magokra! • Példák AA’XX’ spinrendszerekre:

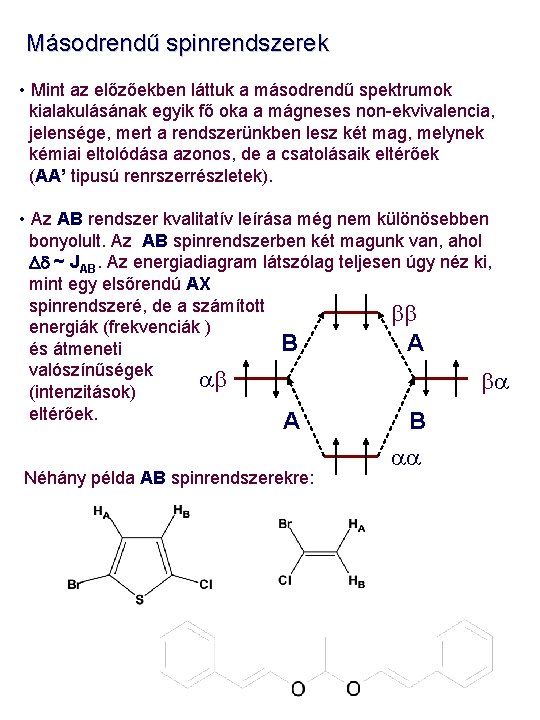
Másodrendű spinrendszerek • Mint az előzőekben láttuk a másodrendű spektrumok kialakulásának egyik fő oka a mágneses non-ekvivalencia, jelensége, mert a rendszerünkben lesz két mag, melynek kémiai eltolódása azonos, de a csatolásaik eltérőek (AA’ tipusú renrszerrészletek). • Az AB rendszer kvalitatív leírása még nem különösebben bonyolult. Az AB spinrendszerben két magunk van, ahol Dd ~ JAB. Az energiadiagram látszólag teljesen úgy néz ki, mint egy elsőrendú AX spinrendszeré, de a számított bb energiák (frekvenciák ) B A és átmeneti valószínűségek ab ba (intenzitások) eltérőek. A Néhány példa AB spinrendszerekre: B aa

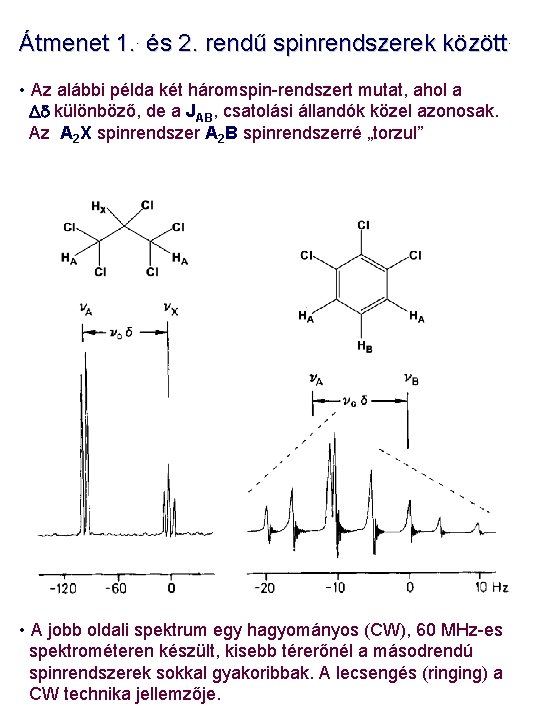
Átmenet 1. . és 2. rendű spinrendszerek között. • Az alábbi példa két háromspin-rendszert mutat, ahol a Dd különböző, de a JAB, csatolási állandók közel azonosak. Az A 2 X spinrendszer A 2 B spinrendszerré „torzul” • A jobb oldali spektrum egy hagyományos (CW), 60 MHz-es spektrométeren készült, kisebb térerőnél a másodrendú spinrendszerek sokkal gyakoribbak. A lecsengés (ringing) a CW technika jellemzője.

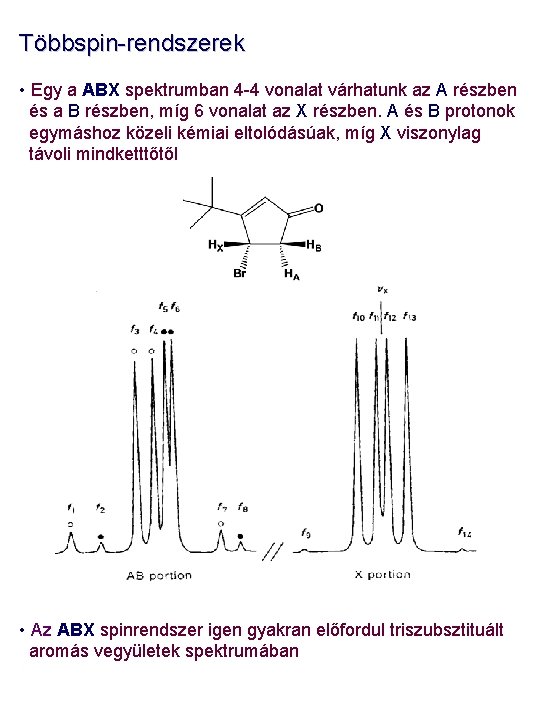
Többspin-rendszerek • Egy a ABX spektrumban 4 -4 vonalat várhatunk az A részben és a B részben, míg 6 vonalat az X részben. A és B protonok egymáshoz közeli kémiai eltolódásúak, míg X viszonylag távoli mindketttőtől • Az ABX spinrendszer igen gyakran előfordul triszubsztituált aromás vegyületek spektrumában

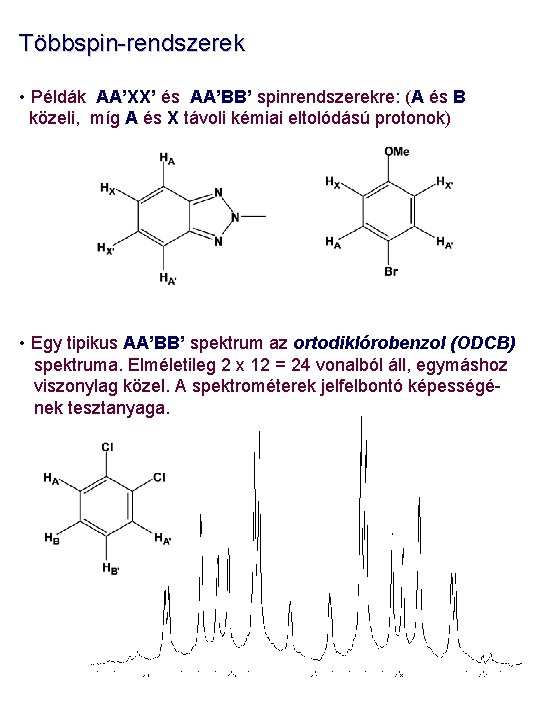
Többspin-rendszerek • Példák AA’XX’ és AA’BB’ spinrendszerekre: (A és B közeli, míg A és X távoli kémiai eltolódású protonok) • Egy tipikus AA’BB’ spektrum az ortodiklórobenzol (ODCB) spektruma. Elméletileg 2 x 12 = 24 vonalból áll, egymáshoz viszonylag közel. A spektrométerek jelfelbontó képességének tesztanyaga.

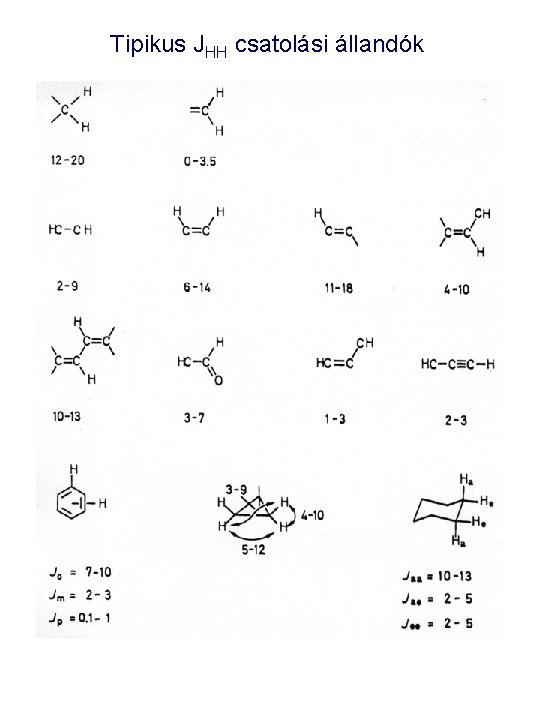
Tipikus JHH csatolási állandók

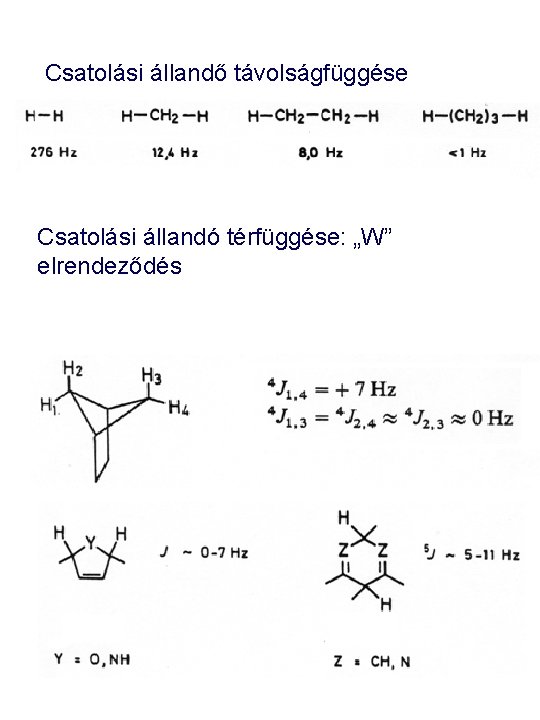
Csatolási állandő távolságfüggése Csatolási állandó térfüggése: „W” elrendeződés

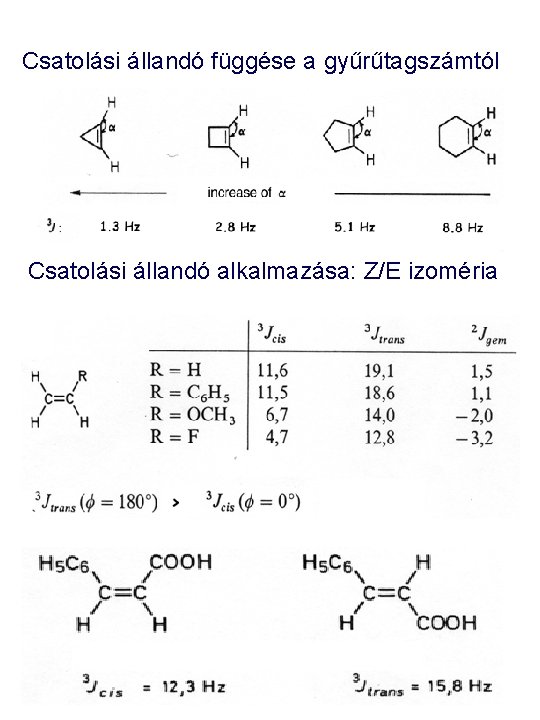
Csatolási állandó függése a gyűrűtagszámtól Csatolási állandó alkalmazása: Z/E izoméria

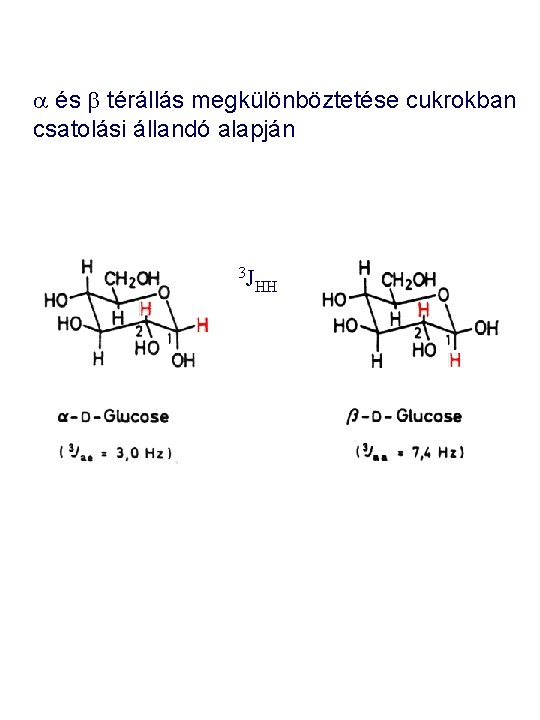
a és b térállás megkülönböztetése cukrokban csatolási állandó alapján 3 J HH

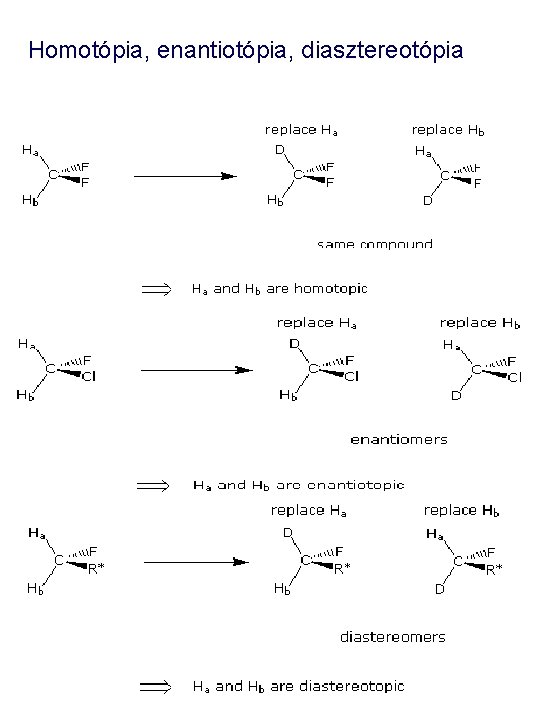
Homotópia, enantiotópia, diasztereotópia

B 0 polarizáló mágneses tér növelése Hatások : Véletlen izokrónia (jelátfedések)megszüntetése Magasabbrendű spinrendszerek egyszerűsödése Jel/zaj viszony növekedése, rövidebb mérési idő

Csatolás következménye : jelek felhasadása - multiplicitás Multiplicitás : NMR paraméter: mi van a szomszédban? (n+1)*(m+1) szabály egyszerűsödése : (n+1) szabály Feltétel: 3 J csatolási állandók azonossága 3 J ca. 7 Hz szabad rotáció esetén : nyilt szénlácú vegyületeknél gyakorlatilag mindig érvényes! Példa : Tiszta etanol „szuperszáraz állapot” Etanol + sav (OHhidrogének gyors cseréje) További egyszerűsítési lehetőség: D 2 O kezelés

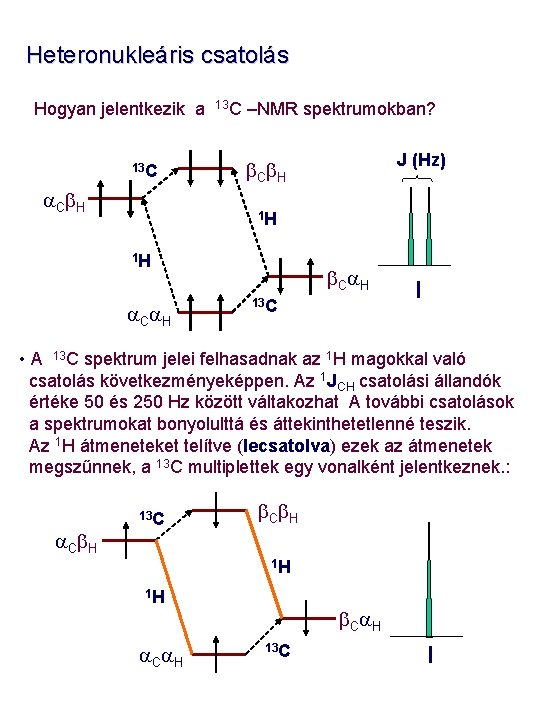
Heteronukleáris csatolás Hogyan jelentkezik a 13 C a. Cb. H 13 C –NMR spektrumokban? J (Hz) b. Cb. H 1 H 1 H a. Ca. H b. Ca. H 13 C I • A 13 C spektrum jelei felhasadnak az 1 H magokkal való csatolás következményeképpen. Az 1 JCH csatolási állandók értéke 50 és 250 Hz között váltakozhat A további csatolások a spektrumokat bonyolulttá és áttekinthetetlenné teszik. Az 1 H átmeneteket telítve (lecsatolva) ezek az átmenetek megszűnnek, a 13 C multiplettek egy vonalként jelentkeznek. : a. Cb. H 13 C b. Cb. H 1 H 1 H a. Ca. H b. Ca. H 13 C I

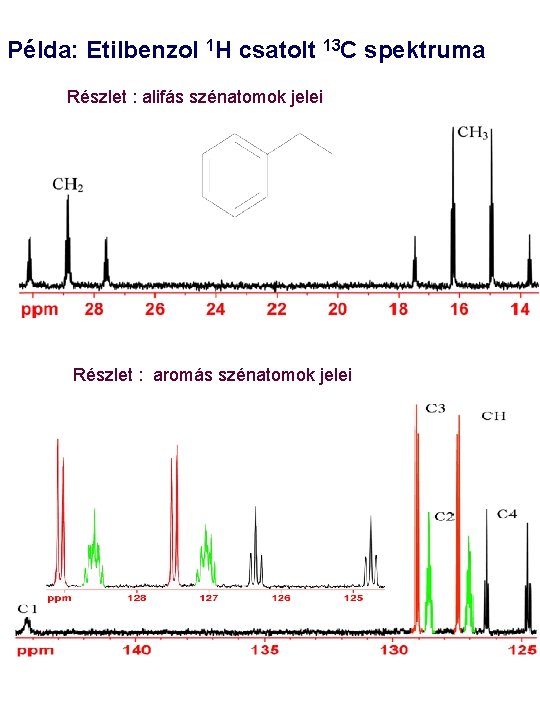
Példa: Etilbenzol 1 H csatolt 13 C spektruma Részlet : alifás szénatomok jelei Részlet : aromás szénatomok jelei

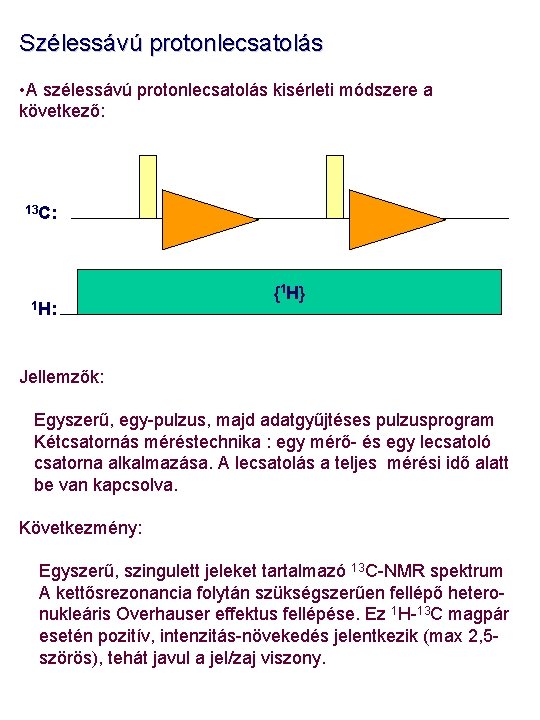
Szélessávú protonlecsatolás • A szélessávú protonlecsatolás kisérleti módszere a következő: 13 C: 1 H: {1 H} Jellemzők: Egyszerű, egy-pulzus, majd adatgyűjtéses pulzusprogram Kétcsatornás méréstechnika : egy mérő- és egy lecsatoló csatorna alkalmazása. A lecsatolás a teljes mérési idő alatt be van kapcsolva. Következmény: Egyszerű, szingulett jeleket tartalmazó 13 C-NMR spektrum A kettősrezonancia folytán szükségszerűen fellépő heteronukleáris Overhauser effektus fellépése. Ez 1 H-13 C magpár esetén pozitív, intenzitás-növekedés jelentkezik (max 2, 5 szörös), tehát javul a jel/zaj viszony.

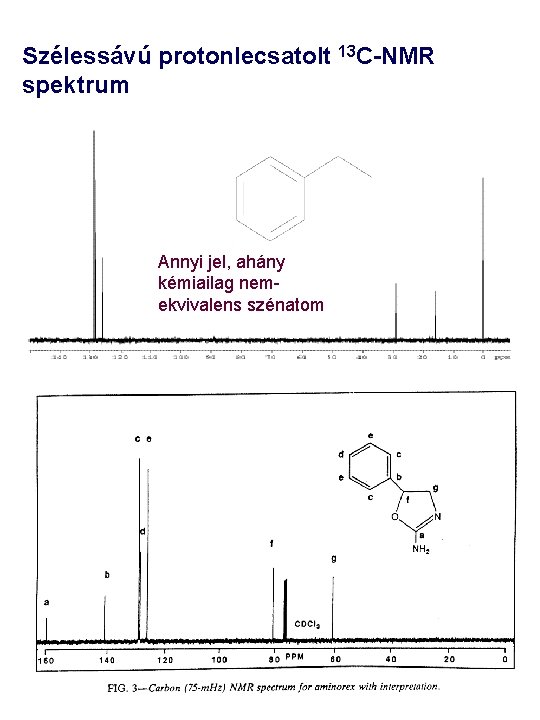
Szélessávú protonlecsatolt 13 C-NMR spektrum Annyi jel, ahány kémiailag nemekvivalens szénatom

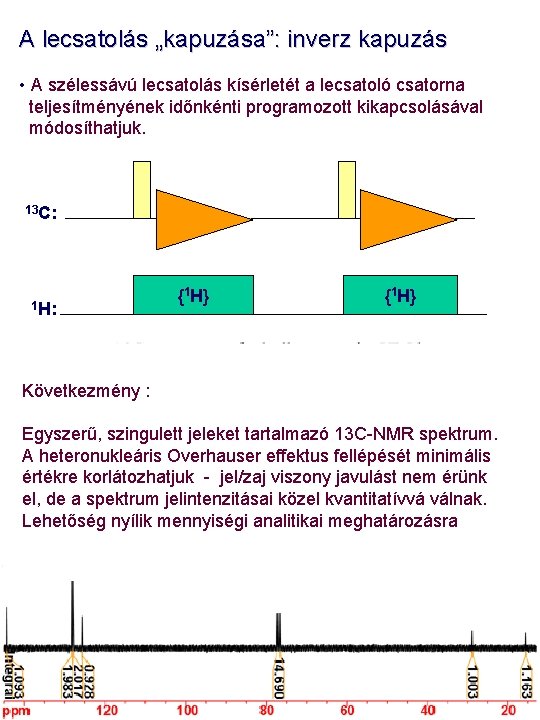
A lecsatolás „kapuzása”: inverz kapuzás • A szélessávú lecsatolás kísérletét a lecsatoló csatorna teljesítményének időnkénti programozott kikapcsolásával módosíthatjuk. 13 C: 1 H: {1 H} . Következmény : Egyszerű, szingulett jeleket tartalmazó 13 C-NMR spektrum. A heteronukleáris Overhauser effektus fellépését minimális értékre korlátozhatjuk - jel/zaj viszony javulást nem érünk el, de a spektrum jelintenzitásai közel kvantitatívvá válnak. Lehetőség nyílik mennyiségi analitikai meghatározásra

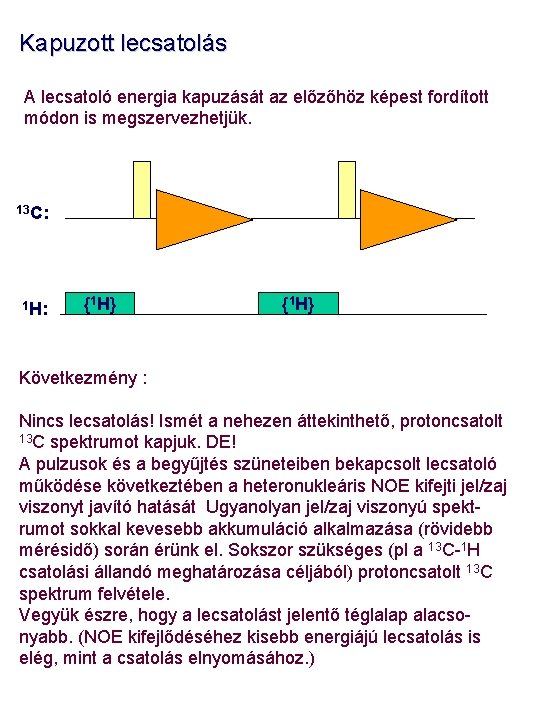
Kapuzott lecsatolás A lecsatoló energia kapuzását az előzőhöz képest fordított módon is megszervezhetjük. 13 C: 1 H: {1 H} Következmény : Nincs lecsatolás! Ismét a nehezen áttekinthető, protoncsatolt 13 C spektrumot kapjuk. DE! A pulzusok és a begyűjtés szüneteiben bekapcsolt lecsatoló működése következtében a heteronukleáris NOE kifejti jel/zaj viszonyt javító hatását Ugyanolyan jel/zaj viszonyú spektrumot sokkal kevesebb akkumuláció alkalmazása (rövidebb mérésidő) során érünk el. Sokszor szükséges (pl a 13 C-1 H csatolási állandó meghatározása céljából) protoncsatolt 13 C spektrum felvétele. Vegyük észre, hogy a lecsatolást jelentő téglalap alacsonyabb. (NOE kifejlődéséhez kisebb energiájú lecsatolás is elég, mint a csatolás elnyomásához. )

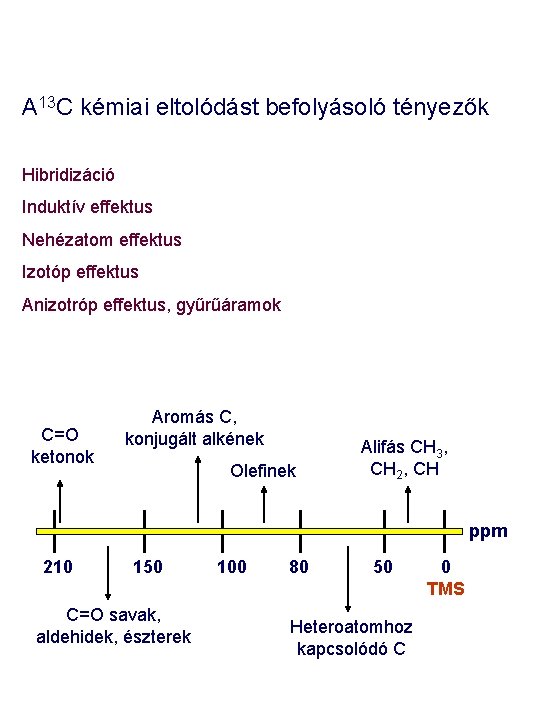
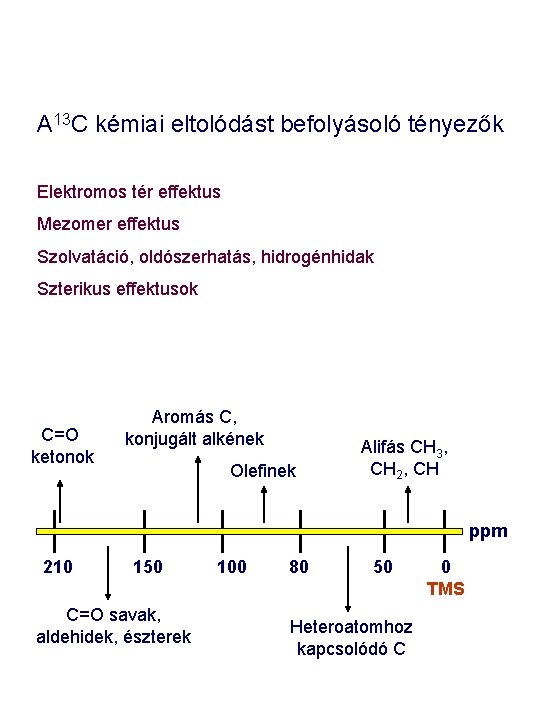
A 13 C kémiai eltolódást befolyásoló tényezők Hibridizáció Induktív effektus Nehézatom effektus Izotóp effektus Anizotróp effektus, gyűrűáramok C=O ketonok Aromás C, konjugált alkének Olefinek Alifás CH 3, CH 2, CH ppm 210 150 C=O savak, aldehidek, észterek 100 80 50 Heteroatomhoz kapcsolódó C 0 TMS

A 13 C kémiai eltolódást befolyásoló tényezők Elektromos tér effektus Mezomer effektus Szolvatáció, oldószerhatás, hidrogénhidak Szterikus effektusok C=O ketonok Aromás C, konjugált alkének Olefinek Alifás CH 3, CH 2, CH ppm 210 150 C=O savak, aldehidek, észterek 100 80 50 Heteroatomhoz kapcsolódó C 0 TMS

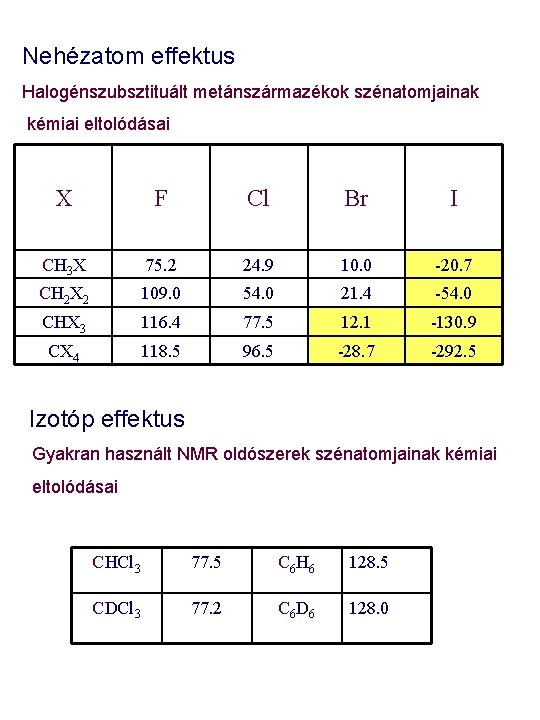
Nehézatom effektus Halogénszubsztituált metánszármazékok szénatomjainak kémiai eltolódásai X F Cl Br I CH 3 X 75. 2 24. 9 10. 0 -20. 7 CH 2 X 2 109. 0 54. 0 21. 4 -54. 0 CHX 3 116. 4 77. 5 12. 1 -130. 9 CX 4 118. 5 96. 5 -28. 7 -292. 5 Izotóp effektus Gyakran használt NMR oldószerek szénatomjainak kémiai eltolódásai CHCl 3 77. 5 C 6 H 6 128. 5 CDCl 3 77. 2 C 6 D 6 128. 0

Gyűrűáramok, mágneses anizotrópia

Elektromos tér effektus 13 C kémiai eltolódás karbokationokban d 13 C+ d 13 CH 3 (CH 3)3 C+ 328 47 (CH 3)2 CH+ 318 60 (CH 3)2 CC 2 H 5+ 332 43 (CH 3)2 CPh+ 254 CH 3 CPh 2+ 198 Ph 3 C+ 211

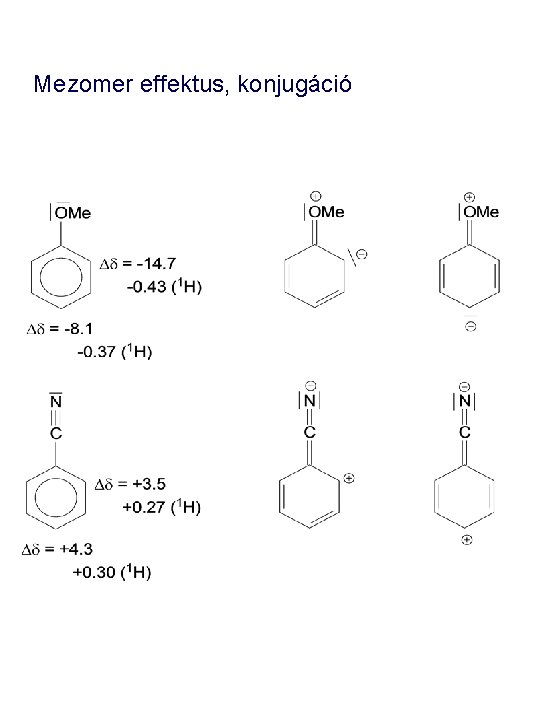
Mezomer effektus, konjugáció

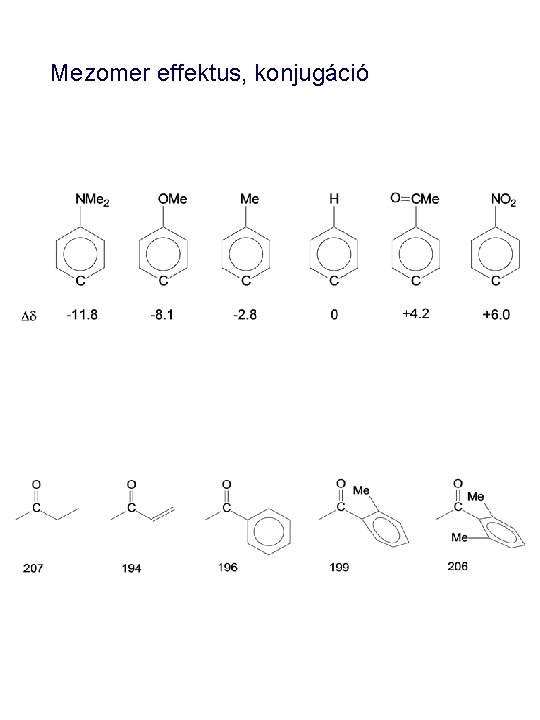
Mezomer effektus, konjugáció

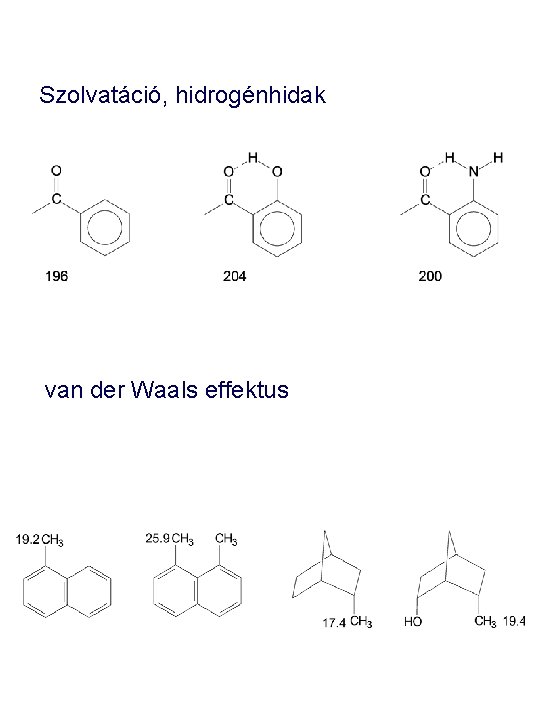
Szolvatáció, hidrogénhidak van der Waals effektus

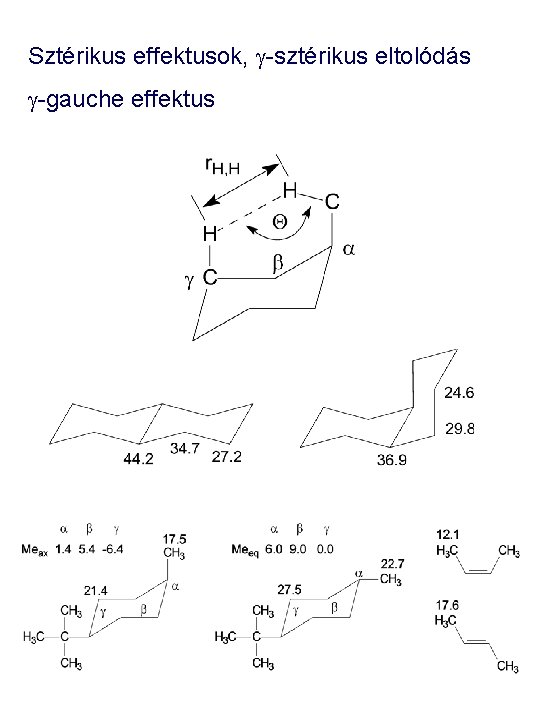
Sztérikus effektusok, g-sztérikus eltolódás g-gauche effektus

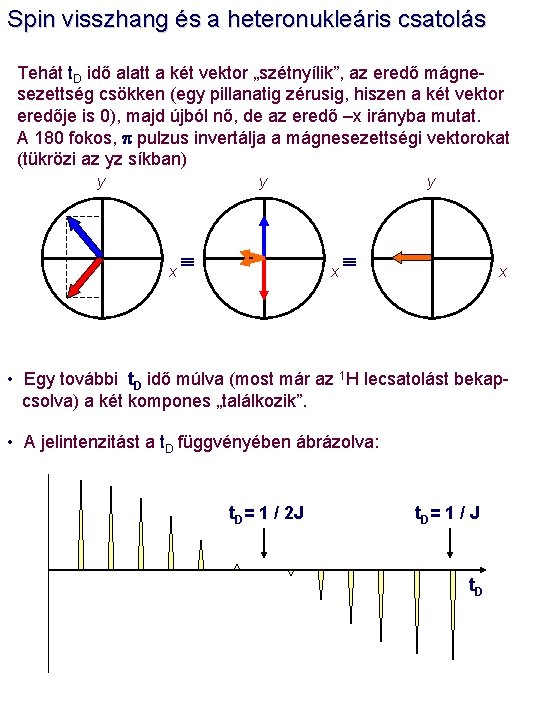
Spin visszhang és a heteronukleáris csatolás Amennyiben a következő pulzusprogramot alkalmazzuk: 90 y 180 y (or x) t. D 13 C: t. D {1 H} 1 H: • Vizsgáljuk meg ennek a pulzuskombinációnak a hatását a 13 C mágnesezettségi vektorra. Először tekintsük egy CH (a metin) szénatom példáját. A p / 2 pulzus után a 13 C mágnesezettségi vektor az xy síkbakerül. Az M xy vektor a J csatolás következtében két komponensre válik szét. z y y -J/2 (a) x t. D x y • A „szétválás” szöge leírható, mint f = p * t. D * J. f x (b) J/2

Spin visszhang és a heteronukleáris csatolás Tehát t. D idő alatt a két vektor „szétnyílik”, az eredő mágnesezettség csökken (egy pillanatig zérusig, hiszen a két vektor eredője is 0), majd újból nő, de az eredő –x irányba mutat. A 180 fokos, p pulzus invertálja a mágnesezettségi vektorokat (tükrözi az yz síkban) y y x x • Egy további t. D idő múlva (most már az 1 H lecsatolást bekapcsolva) a két kompones „találkozik”. • A jelintenzitást a t. D függvényében ábrázolva: t. D= 1 / 2 J t. D = 1 / J t. D

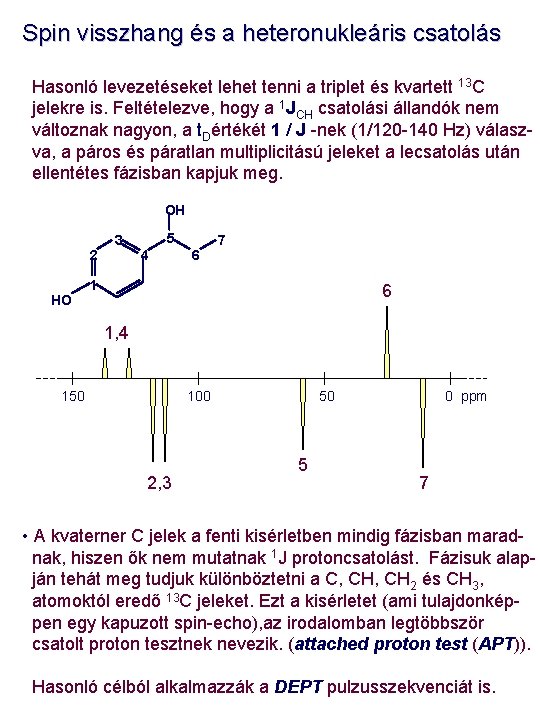
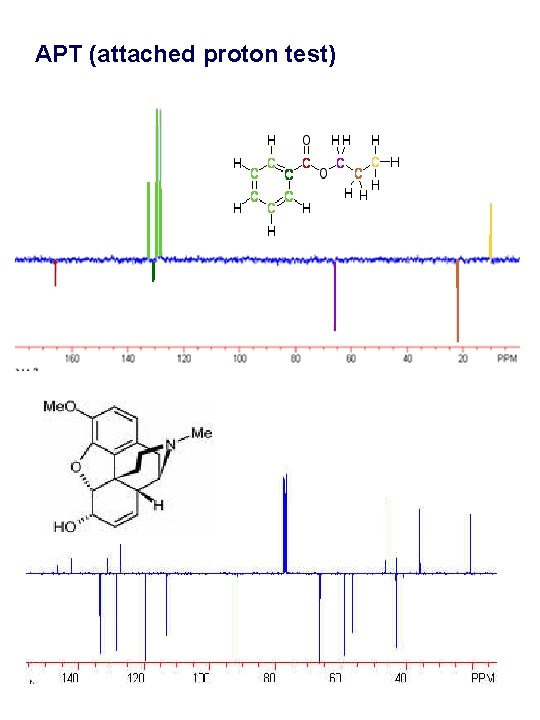
Spin visszhang és a heteronukleáris csatolás Hasonló levezetéseket lehet tenni a triplet és kvartett 13 C jelekre is. Feltételezve, hogy a 1 JCH csatolási állandók nem változnak nagyon, a t. Dértékét 1 / J -nek (1/120 -140 Hz) válaszva, a páros és páratlan multiplicitású jeleket a lecsatolás után ellentétes fázisban kapjuk meg. OH 2 HO 3 5 4 6 7 1 6 1, 4 150 100 2, 3 50 5 0 ppm 7 • A kvaterner C jelek a fenti kisérletben mindig fázisban maradnak, hiszen ők nem mutatnak 1 J protoncsatolást. Fázisuk alapján tehát meg tudjuk különböztetni a C, CH 2 és CH 3, atomoktól eredő 13 C jeleket. Ezt a kisérletet (ami tulajdonképpen egy kapuzott spin-echo), az irodalomban legtöbbször csatolt proton tesztnek nevezik. (attached proton test (APT)). Hasonló célból alkalmazzák a DEPT pulzusszekvenciát is.

APT (attached proton test)

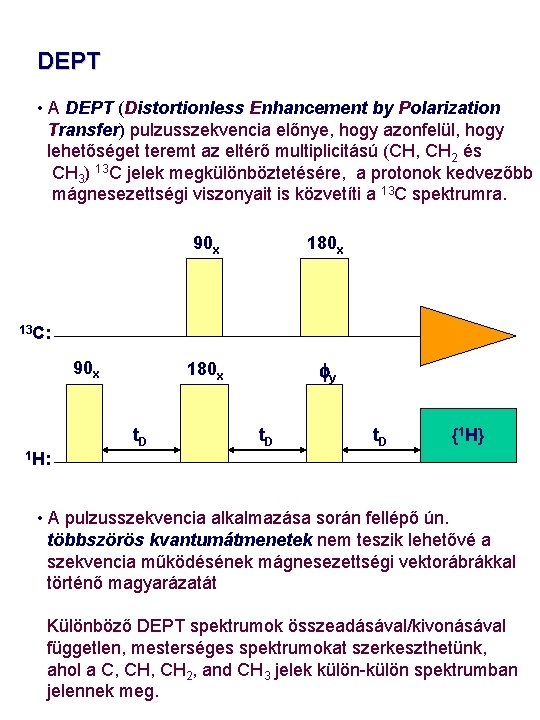
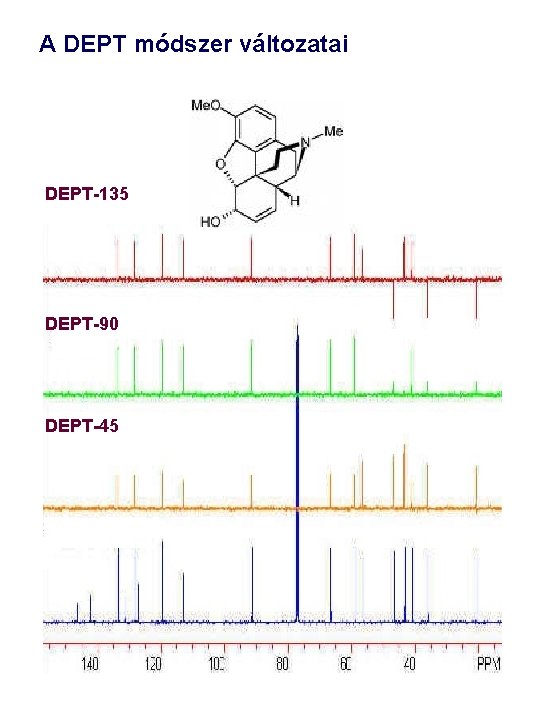
DEPT • A DEPT (Distortionless Enhancement by Polarization Transfer) pulzusszekvencia előnye, hogy azonfelül, hogy lehetőséget teremt az eltérő multiplicitású (CH, CH 2 és CH 3) 13 C jelek megkülönböztetésére, a protonok kedvezőbb mágnesezettségi viszonyait is közvetíti a 13 C spektrumra. 90 x 180 x fy 13 C: 90 x t. D {1 H} 1 H: • A pulzusszekvencia alkalmazása során fellépő ún. többszörös kvantumátmenetek nem teszik lehetővé a szekvencia működésének mágnesezettségi vektorábrákkal történő magyarázatát Különböző DEPT spektrumok összeadásával/kivonásával független, mesterséges spektrumokat szerkeszthetünk, ahol a C, CH 2, and CH 3 jelek külön-külön spektrumban jelennek meg.

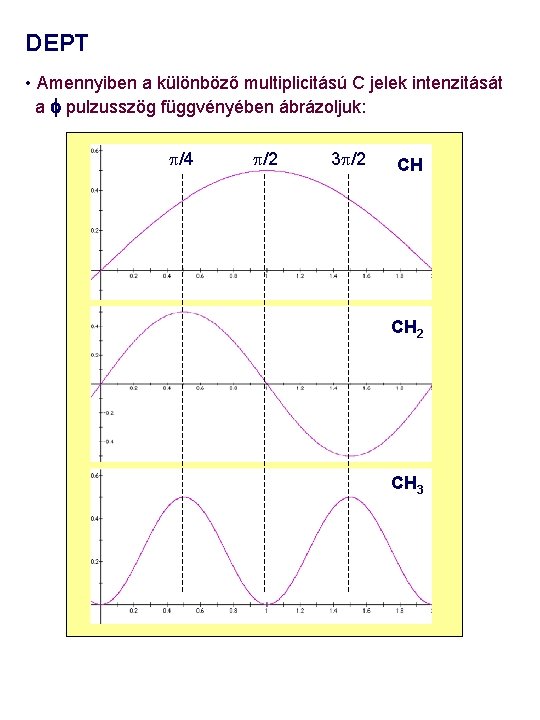
DEPT • Amennyiben a különböző multiplicitású C jelek intenzitását a f pulzusszög függvényében ábrázoljuk: p/4 p/2 3 p/2 CH CH 2 CH 3

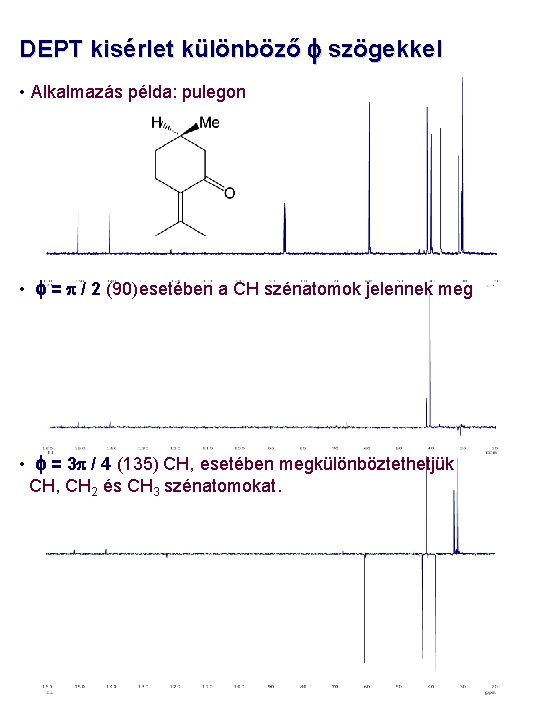
DEPT kisérlet különböző f szögekkel • Alkalmazás példa: pulegon • f = p / 2 (90)esetében a CH szénatomok jelennek meg • f = 3 p / 4 (135) CH, esetében megkülönböztethetjük CH, CH 2 és CH 3 szénatomokat.

A DEPT módszer változatai DEPT-135 DEPT-90 DEPT-45

APT és DEPT összehasonlítás APT DEPT spektrumszerkesztés

A 1 J 13 C-1 H csatolási állandót befolyásoló tényezők gyűrűfeszülés Csatolási állandók (Hz) térszerkezet

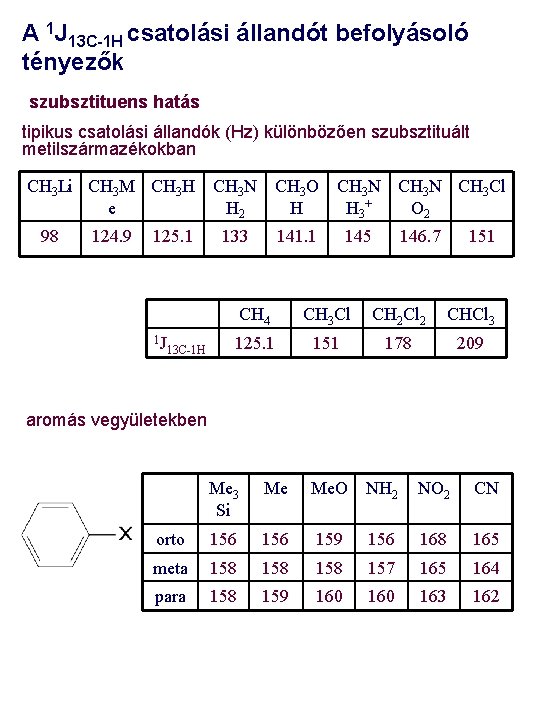
A 1 J 13 C-1 H csatolási állandót befolyásoló tényezők szubsztituens hatás tipikus csatolási állandók (Hz) különbözően szubsztituált metilszármazékokban CH 3 Li CH 3 M CH 3 H CH 3 N CH 3 O CH 3 N CH 3 Cl e H 2 H H 3 + O 2 98 124. 9 125. 1 1 J 13 C-1 H 133 141. 1 145 146. 7 151 CH 4 CH 3 Cl CH 2 Cl 2 CHCl 3 125. 1 151 178 209 aromás vegyületekben Me 3 Si Me Me. O NH 2 NO 2 CN orto 156 159 156 168 165 meta 158 158 157 165 164 para 158 159 160 163 162

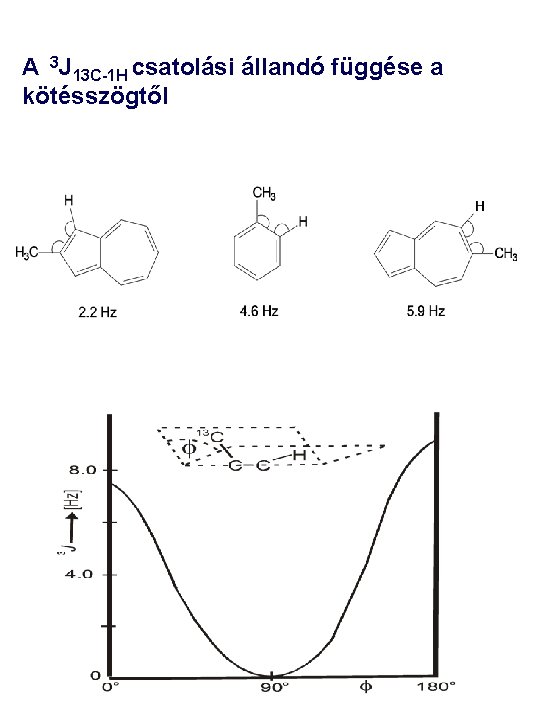
A 3 J 13 C-1 H csatolási állandó függése a kötésszögtől

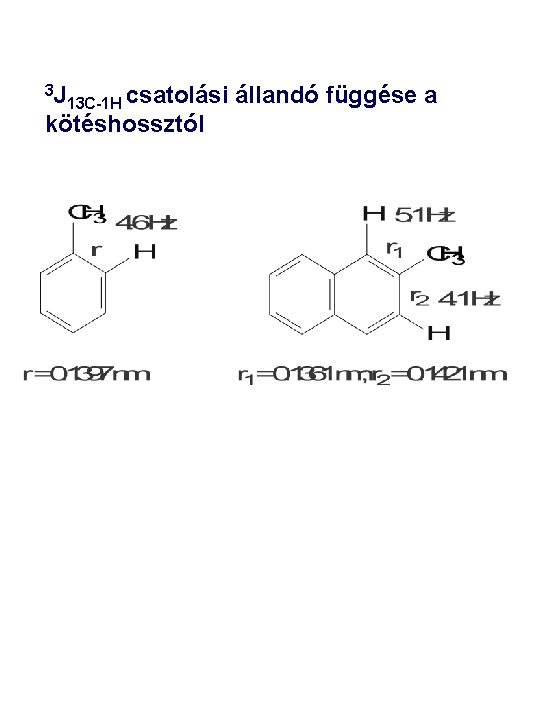
3 J 13 C-1 H csatolási kötéshossztól állandó függése a

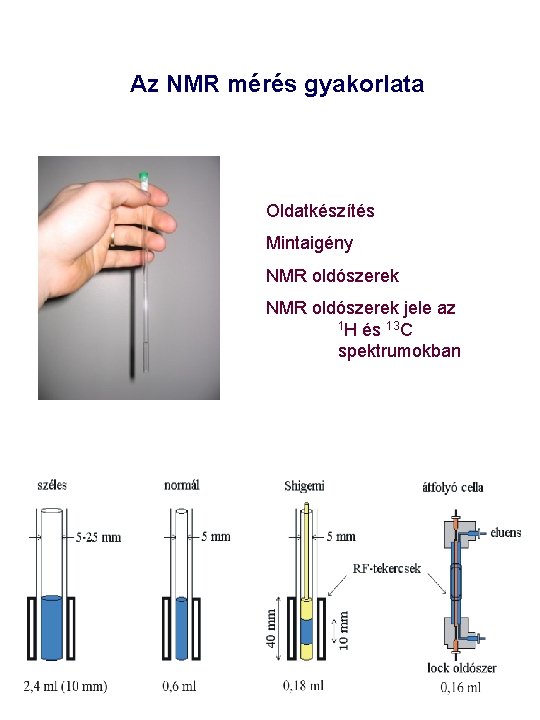
Az NMR mérés gyakorlata Oldatkészítés Mintaigény NMR oldószerek jele az 1 H és 13 C spektrumokban

NMR spektrométerek egykor és ma

NMR tomográfia (MRI) Peter Mansfield Paul Lauterbur

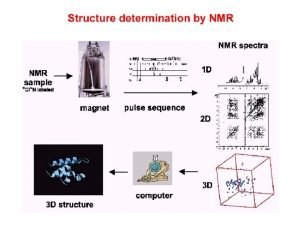
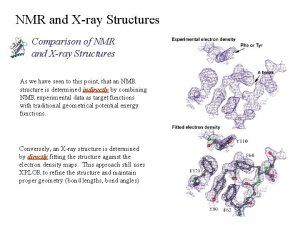
NMR a fehérjék szerkezetkutatásában Kurt Wüttrich


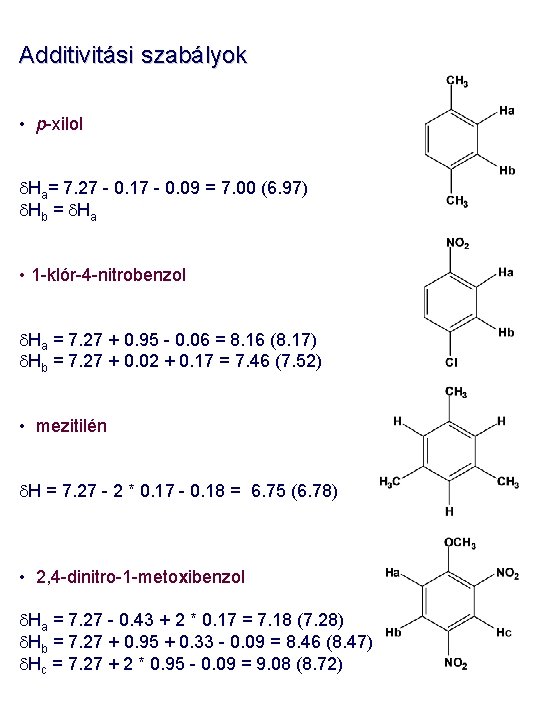
Additivitási szabályok • Aromás rendszerek (szubsztituált benzolok) esetében a benzol kémiai eltolódása (d =7, 27 ppm) a számítás kiindulási alapja. d = 7. 27 + Rorto + Rmeta + Rpara Szubsztituens dortho dmeta dpara -H 0. 0 -CH 3 -0. 17 -0. 09 -0. 18 -NO 2 0. 95 0. 17 0. 33 -COOH 0. 80 0. 14 0. 20 -OCH 3 -0. 43 -0. 09 -0. 37 -Cl 0. 02 -0. 06 -0. 04 -F -0. 30 -0. 02 -0. 22 -NH 2 -0. 75 -0. 24 -0. 63 -C 6 H 5 0. 18 0. 00 0. 08 -SCH 3 -0. 03 0. 00

Additivitási szabályok • p-xilol d. Ha= 7. 27 - 0. 17 - 0. 09 = 7. 00 (6. 97) d. Hb = d. Ha • 1 -klór-4 -nitrobenzol d. Ha = 7. 27 + 0. 95 - 0. 06 = 8. 16 (8. 17) d. Hb = 7. 27 + 0. 02 + 0. 17 = 7. 46 (7. 52) • mezitilén d. H = 7. 27 - 2 * 0. 17 - 0. 18 = 6. 75 (6. 78) • 2, 4 -dinitro-1 -metoxibenzol d. Ha = 7. 27 - 0. 43 + 2 * 0. 17 = 7. 18 (7. 28) d. Hb = 7. 27 + 0. 95 + 0. 33 - 0. 09 = 8. 46 (8. 47) d. Hc = 7. 27 + 2 * 0. 95 - 0. 09 = 9. 08 (8. 72)

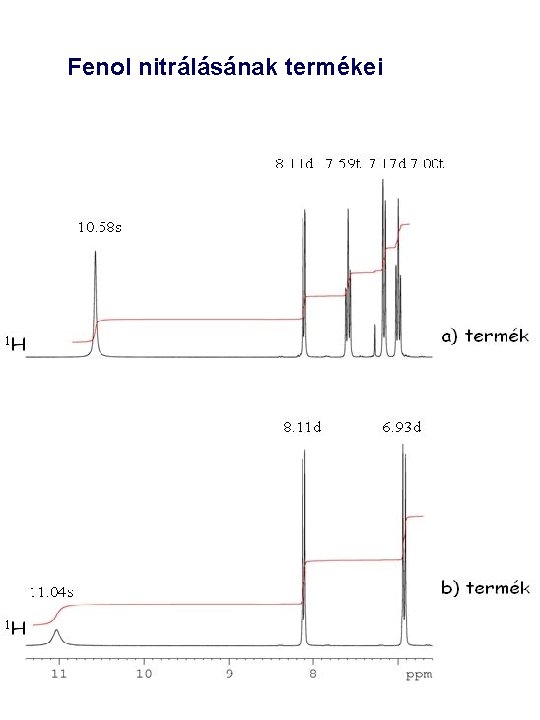
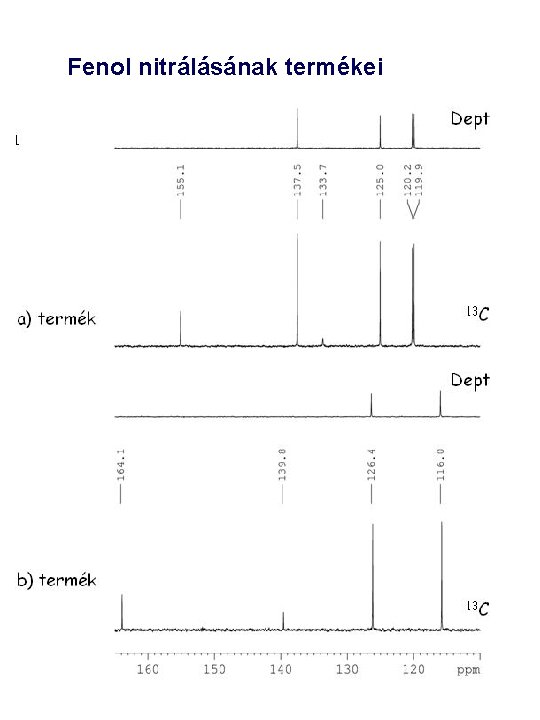
Fenol nitrálásának termékei

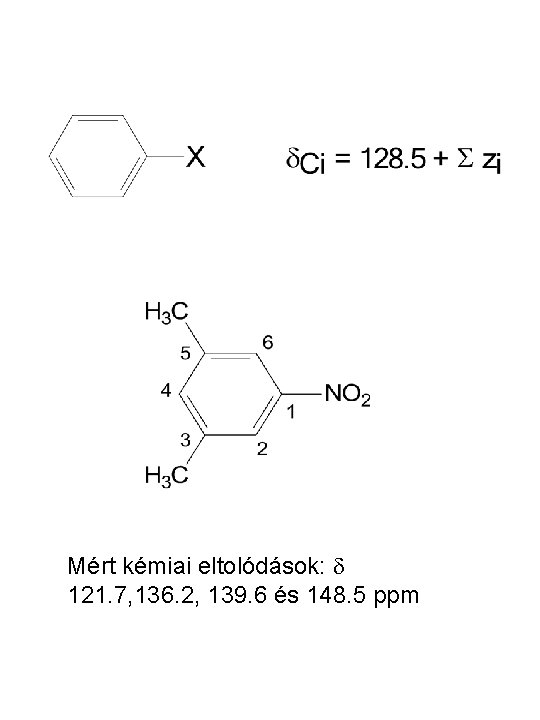
Mért kémiai eltolódások: d 121. 7, 136. 2, 139. 6 és 148. 5 ppm

Fenol nitrálásának termékei
 Verilog paramter
Verilog paramter Harmadik világ erősebb államai
Harmadik világ erősebb államai Harmadik világ erősebb államai
Harmadik világ erősebb államai Think 3 alakja
Think 3 alakja Przesunięcia chemiczne nmr tablice
Przesunięcia chemiczne nmr tablice Nmr kolena
Nmr kolena 13-c
13-c Evans method
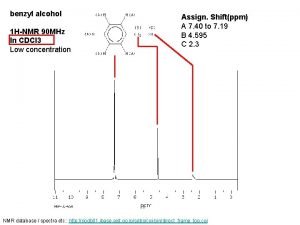
Evans method Benzyl alcohol h nmr
Benzyl alcohol h nmr Acetylferrocene ir spectrum labeled
Acetylferrocene ir spectrum labeled Spektra nmr
Spektra nmr 1 bromopropane nmr
1 bromopropane nmr Tabella chemical shift c13
Tabella chemical shift c13 Hlocal
Hlocal Ibmqx
Ibmqx Efekt dachowy nmr
Efekt dachowy nmr Hydrohalogenation mechanism
Hydrohalogenation mechanism Integration in nmr
Integration in nmr Konstantin ivanov nmr
Konstantin ivanov nmr Nmr singlet doublet triplet
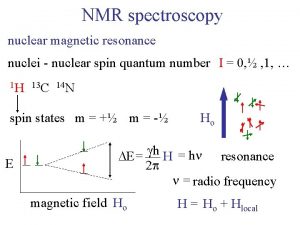
Nmr singlet doublet triplet Nmr spectroscopy
Nmr spectroscopy Bloch siegert shift
Bloch siegert shift Advantages of nmr spectroscopy
Advantages of nmr spectroscopy Pola splitting nmr
Pola splitting nmr Borrow heavily
Borrow heavily Acorn nmr
Acorn nmr Pure shift nmr
Pure shift nmr Tabel pergeseran kimia h nmr
Tabel pergeseran kimia h nmr 4 methylacetophenone nmr
4 methylacetophenone nmr Dept nmr spectroscopy
Dept nmr spectroscopy Benzyl acetate
Benzyl acetate Multipletowość nmr
Multipletowość nmr Nmr
Nmr Nmr sample requirements
Nmr sample requirements Nmr active and inactive nuclei
Nmr active and inactive nuclei Hexane 1h nmr
Hexane 1h nmr Spin-spin coupling examples
Spin-spin coupling examples 247remote
247remote Factors influencing chemical shift
Factors influencing chemical shift Diastereotopic protons
Diastereotopic protons Larmor frequency
Larmor frequency Application of nmr
Application of nmr Advantages and disadvantages of spectroscopy
Advantages and disadvantages of spectroscopy Nmr polymer
Nmr polymer Function of nmr
Function of nmr Nmr esr
Nmr esr Ch3ch2occh2ch3
Ch3ch2occh2ch3 Alkyne carbon nmr
Alkyne carbon nmr Gyromagnetic ratio
Gyromagnetic ratio Nmr singlet doublet triplet
Nmr singlet doublet triplet St olaf nmr
St olaf nmr Traº
Traº Haddock nmr
Haddock nmr Evans method
Evans method Ketone nmr
Ketone nmr H nmr
H nmr Nmr sample tube
Nmr sample tube Ppm formülü
Ppm formülü Nmr lipoprofile
Nmr lipoprofile Michael sattler nmr
Michael sattler nmr Nuts nmr software
Nuts nmr software Casper wu
Casper wu Nmr structure calculator
Nmr structure calculator