Spektroskopia w ultrafiolecie i w wietle widzialnym UVVIS
































- Slides: 39

Spektroskopia w ultrafiolecie i w świetle widzialnym (UV-VIS)

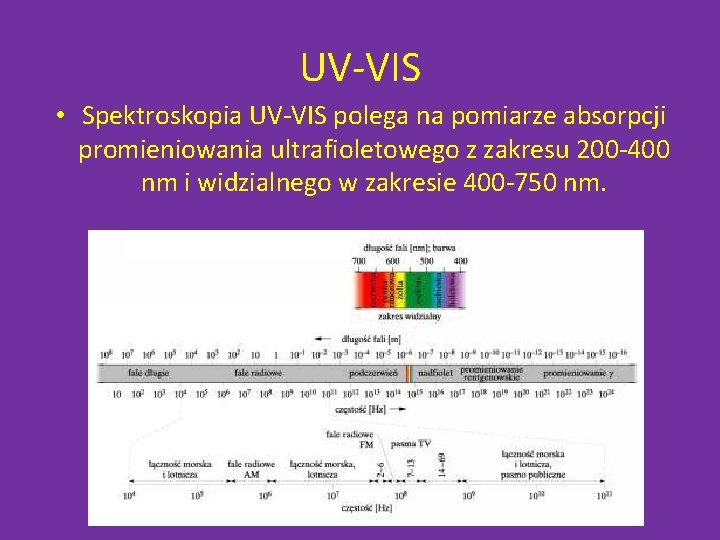
UV-VIS • Spektroskopia UV-VIS polega na pomiarze absorpcji promieniowania ultrafioletowego z zakresu 200 -400 nm i widzialnego w zakresie 400 -750 nm.

UV-VIS - podstawy Z równania Plancka wynika że: • E = hv = h*c/λ • h = 6, 626 069 57(29)· 10– 34 J·s • v - częstotliwość drgań źródła, które wysyła falę elektromagnetyczną • c - prędkość światła (3 * 10^8 m/s) • λ – długość fali

UV-VIS -podstawy Graniczne energie fotonów wyliczone na podstawie równania Plancka dla zakresu UV-VIS: 100 – 10000 k. J/mol mogą powodować przejście elektronów w cząsteczce ze stanu podstawowego do stanu wzbudzonego.

UV-VIS Zabsorbowana energia powoduje zmiany: • stanów elektronowych • energii oscylacyjnej • energii rotacyjnej przy czym: e. rotacyjna : e. oscylacyjna : e. elektronowa 1 10 1000

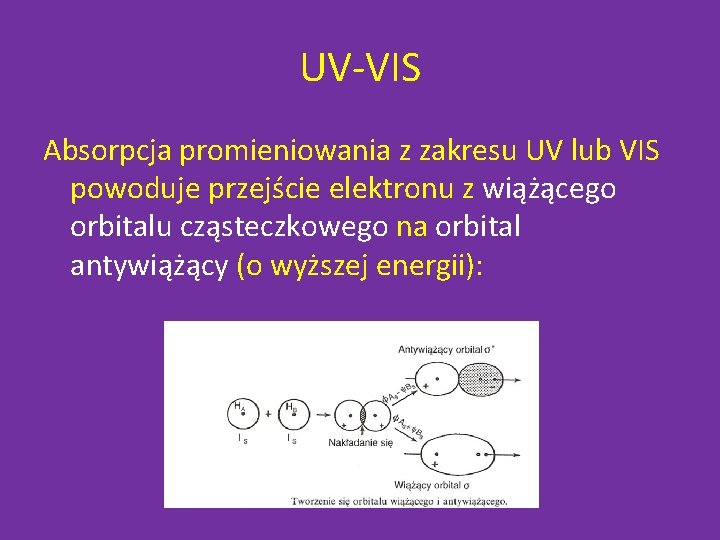
UV-VIS Absorpcja promieniowania z zakresu UV lub VIS powoduje przejście elektronu z wiążącego orbitalu cząsteczkowego na orbital antywiążący (o wyższej energii):

Orbitale cząsteczkowe podsumowanie • Orbital wiążący ma energię niższą niż energia stanu podstawowego atomów tworzących cząsteczkę. • W orbitalu wiążącym gęstość elektronowa pomiędzy jądrami jest duża, w orbitalu antywiążącym jest natomiast mała – co powoduje odpychanie między atomami doprowadzając do osłabienia lub nawet zerwania wiązania.

UV-VIS Warunkiem koniecznym absorpcji fotonu, powodującego przejście elektronu z orbitalu wiążącego na antywiążący jest dopasowanie wielkości fotonu do różnicy poziomów energetycznych orbitalu wiążącego i antywiążącego. Różnica ta jest równa: DE =hv

UV-VIS Elektrony walencyjne w cząsteczce związku organicznego podzielić można na 3 rodzaje: • elektrony s • elektrony p • elektrony n

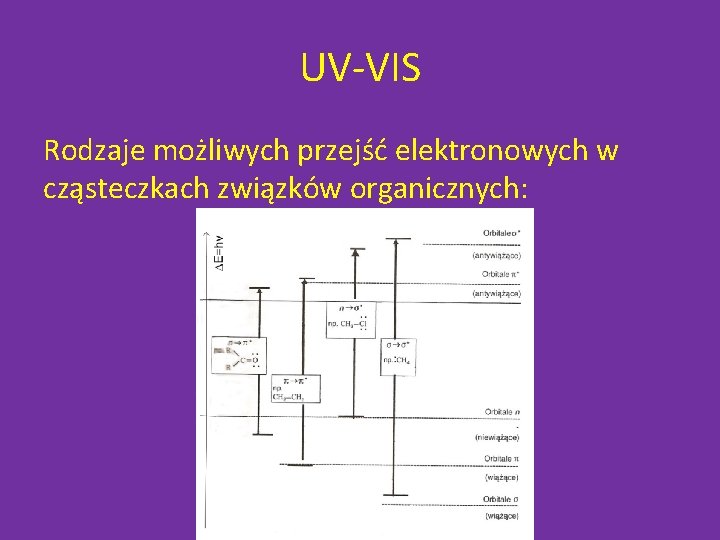
UV-VIS Rodzaje możliwych przejść elektronowych w cząsteczkach związków organicznych:

UV-VIS Analizując np. strukturę metanolu można stwierdzić że pasmo absorpcyjne związane z przejściem s -> s* nie będzie w widmie widoczne ponieważ wzbudzenie elektronów w wiązaniu kowalencyjnym C-H wymaga zbyt dużej energii (λ < 160 nm). Widoczne są natomiast pasma absorpcyjne związane z przejściami: p –> p*, n –> s* Oznacza to że chromoforami są grupy posiadające elektrony p lub n.

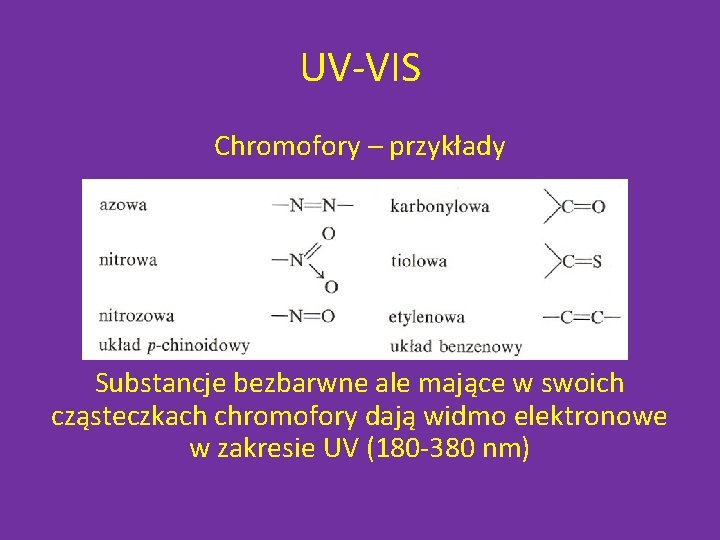
UV-VIS Chromofory – przykłady Substancje bezbarwne ale mające w swoich cząsteczkach chromofory dają widmo elektronowe w zakresie UV (180 -380 nm)

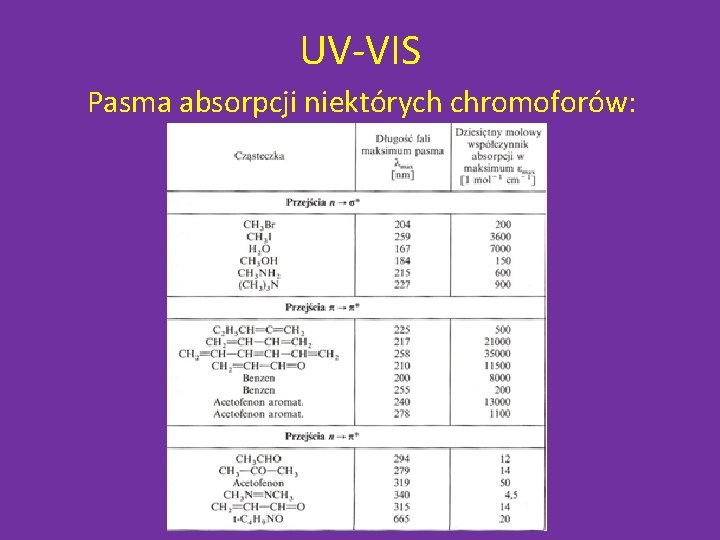
UV-VIS Pasma absorpcji niektórych chromoforów:

UV-VIS Widmo elektronowe zazwyczaj charakteryzuje się określając długość fali, przy której pojawia się maksimum absorpcji. Poniżej przedstawiono widmo elektronowe kwasu salicylowego w którym widoczne są 2 maksima absorpcji:

UV-VIS Czynnikiem decydującym o wielkości absorpcji jest charakter grup chromoforowych w cząsteczkach. Większa ich ilość powoduje silniejszą absorpcję ale również przesunięcie maksimum absorpcji w kierunku fal dłuższych. Takie przesunięcie nazywa się przesunięciem batochromowym i może być wywołane obecnością kilku sprzężonych ze sobą wiązań podwójnych lub wprowadzeniu do cząsteczki grup auksochromowych (np. –OH lub -NH 2). Grupy te nie wywołują barwy ale oddziałują na chromofory. Ich wpływ na przesunięcie maksimum absorpcji rośnie w szeregu: -CH 3 < -OH < -O-CH 3 < -NH 2 < -NH-CH 3 < N(CH 3)2

UV-VIS Prawa absorpcji: • Prawo Lamberta – Beera: gdzie: e – molowy współczynnik absorpcji c – stężenie substancji absorbującej l – grubość warstwy substancji absorbującej

UV-VIS Molowy współczynnik absorpcji e jest ważnym parametrem charakteryzującym widmo elektronowe, świadczącym o intensywności absorpcji promieniowania. Ma on również duże znaczenie przy oznaczeniach ilościowych: jego duża wartość (powyżej 10000) pozwala na oznaczanie bardzo małej ilości substancji (zwiększa się czułość oznaczenia). Metody dla których e jest mniejszy od 1000 uznaje się za mało czułe.

UV-VIS Prawa absorpcji: • Prawo addytywności absorbancji: jeżeli w roztworze znajdują się dwie lub więcej substancji absorbujących promieniowanie UVVIS, to całkowita absorbancja roztworu (A) jest równa sumie absorbancji poszczególnych składników:

UV-VIS Przyczyny odchyleń od praw absorpcji: Odstępstwa od praw absorpcji mogą być wywołane czynnikami: • podstawowe ograniczenia praw (np. za duże stężenia, niepożądana luminescencja) • chemicznymi (np. zmiana p. H lub stężenia roztworu wpływa na dysocjację, solwatację, kompleksowanie…) • aparaturowymi (brak monochromatyczności promieniowania)

Aparatura stosowana w spektrofotometrii UV-VIS

Aparatura stosowana w spektrofotometrii UV-VIS Spektrofotometr Lambda

UV-VIS Analiza ilościowa: • wybór analitycznej długości fali • metoda krzywej kalibracyjnej

UV-VIS Analiza ilościowa - układy 2 (i więcej) składnikowe. Możliwe jest ilościowe spektrofotometryczne oznaczenie kilku składników mieszanie nawet jeśli widma tych składników nakładają się na siebie. Konieczna jest jednak w tym przypadku znajomość molowych współczynników absorbcji wszystkich składników przy ich analitycznych długościach fal a poszukiwane stężenia składników uzyskuje się rozwiązując odpowiednie układy równań.

UV-VIS Zastosowanie spektrofotometrii UV-VIS do identyfikacji substancji organicznych. Widma UV-VIS dają mniej informacji o strukturze cząsteczkowej niż widma w podczerwieni lub NMR. Wynika to z faktu iż wiele związków nie absorbuje promieniowania powyżej 200 nm, np. węglowodory nasycone albo położenie pasm absorpcji zależy tylko w niewielkim stopniu od budowy cząsteczki. Energie potrzebne do przeniesienia elektronów na wyższe poziomy energetyczne można uszeregować następująco:

Spektroskopia fluorescencyjna cząsteczkowa Luminescencja: emisja promieniowania elektromagnetycznego w czasie nie krótszym niż 10 -10 s od momentu zaabsorbowania energii przez atomy lub cząsteczki danej substancji. Rodzaje luminescencji: • fotoluminescencja • chemiluminescencja • bioluminescencja • elektroluminescencja

Spektroskopia fluorescencyjna cząsteczkowa W analizie chemicznej wykorzystuje się głównie zjawisko fotoluminescencji: • w przypadku fluorescencji samorzutna emisja promieniowania ustaje natychmiast po wyłączeniu źródła promieniowania wzbudzającego. • Fosforescencja jest procesem o długim czasie zaniku promieniowania (trwa kilka sekund a czasami minut).

Spektroskopia fluorescencyjna cząsteczkowa Proces fotoluminescencji można przedstawić ogólnym schematem: Czas oddawania energii hv przez wzbudzoną cząsteczkę X* jest rzędu 10 -9 – 10 -7 s. Ponieważ emisji promieniowania towarzyszy wydzielenie ciepła dlatego długość fali promieniowania emitowanego (mniejsza energia) jest większa niż promieniowania wzbudzanego.

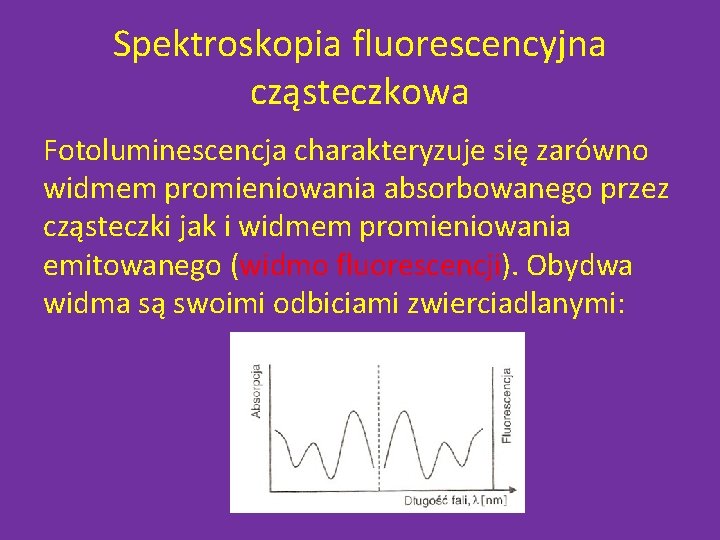
Spektroskopia fluorescencyjna cząsteczkowa Fotoluminescencja charakteryzuje się zarówno widmem promieniowania absorbowanego przez cząsteczki jak i widmem promieniowania emitowanego (widmo fluorescencji). Obydwa widma są swoimi odbiciami zwierciadlanymi:

Spektroskopia fluorescencyjna cząsteczkowa Diagram Jabłońskiego ilustruje kolejne etapy prowadzące do fluorescencji i fosforescencji: S 0, S 1 – podstawowe stany energetyczne cząsteczki T 1 - energetyczny poziom elektronowy o charakterze metastabilnym

Spektroskopia fluorescencyjna cząsteczkowa Zastosowanie fluorymetrii i spektrofluorymetrii w analizie ilościowej. Dla roztworów rozcieńczonych (stężenia na poziomie 1 -100 ng substancji rozpuszczonej w 1 ml roztworu) prawdziwa jest zależność: IF=KI 0 kcl gdzie: IF – natężenie pr. Fluorescencyjnego K - stała proporcjonalności I 0 – natężenie pr. wzbudzającego k – współczynnik absorpcji promieniowania c – stężenie substancji oznaczanej l - grubość warstwy

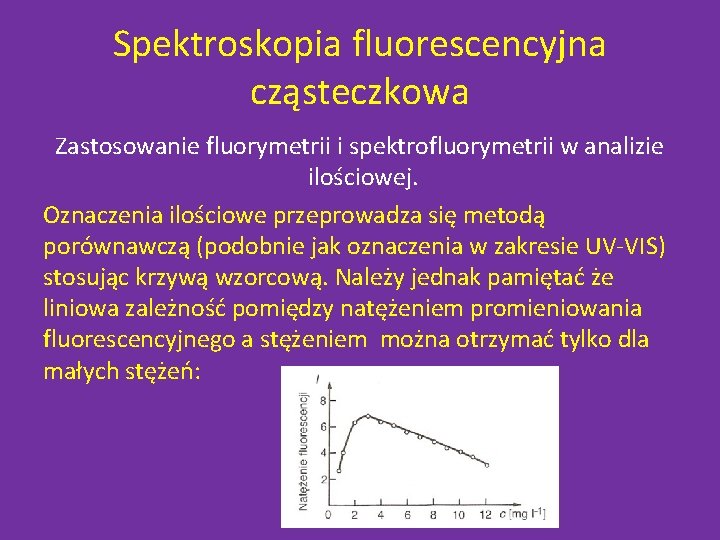
Spektroskopia fluorescencyjna cząsteczkowa Zastosowanie fluorymetrii i spektrofluorymetrii w analizie ilościowej. Oznaczenia ilościowe przeprowadza się metodą porównawczą (podobnie jak oznaczenia w zakresie UV-VIS) stosując krzywą wzorcową. Należy jednak pamiętać że liniowa zależność pomiędzy natężeniem promieniowania fluorescencyjnego a stężeniem można otrzymać tylko dla małych stężeń:

Spektroskopia fluorescencyjna cząsteczkowa Fluorymetria i spektrofluorymetria znajduje szerokie zastosowanie w analizie: • środków biologicznie czynnych (np. witaminy) • Środków farmaceutycznych (antybiotyki, barbiturany) • Substancji zagrażających środowisku (np. wielkopierścieniowe węglowodory aromatyczne) • Jonów metali (np. Al, Be, Ge) które z odczynnikami organicznymi (np. moryna) tworzą kompleksy chelatowe

Metody emisyjne Atomowa spektrometria emisyjna – jedna z najstarszych metod instrumentalnych stosowanych w analizie elementarnej. Jej początki sięgają pierwszych lat XIX wieku (Brewster, Herschel – wpływ różnych soli na zabarwienie płomienia palnika spirytusowego). Pod koniec XIX wieku Bunsen i Kirchhoff w oparciu o wcześniejsze wyniki badań m. in. Brewstera i Herschel’a stworzyli podstawy współczesnej atomowej spektroskopii emisyjnej.

Techniki emisyjne – fotometria płomieniowa Silnie rozgrzane ciała stałe (np. metale) emitują promieniowanie elektromagnetyczne o charakterze ciągłym. Cząsteczki związków chemicznych są źródłem promieniowania o charakterze pasmowym. Atomy poddane wzbudzeniu emitują widmo liniowe. Oznacza to że emitowane są tylko pewne wybrane długości fal promieniowania elektromagnetycznego. Wynika to z faktu że elektrony w atomie nie mogą mieć dowolnej energii lecz tylko energię o ściśle określonych wartościach, wynikających z liczb kwantowych

Techniki emisyjne – fotometria płomieniowa Emisja promieniowania następuje przy przejściu z wyższego stanu energetycznego na niższy. W atomie istnieje wiele poziomów energetycznych (tzw. termów) na które może zostać przeniesiony elektron w procesie wzbudzenia. Powrót elektronu na stan podstawowy nie musi odbywać się jednoetapowo. W efekcie emitowanych jest kilka kwantów promieniowania o energiach równych różnicom poszczególnych termów. hv = EM – EK EM – energia termu o wyższej energii EK – energia termu o wyższej energii

Techniki emisyjne – fotometria płomieniowa Pomimo ograniczeń powodujących że nie wszystkie przejścia energetyczne pomiędzy termami są realizowane daje to duże ilości linii spektralnych w widmie (np. Al ma ich 118 a Al 1+ posiada dodatkowo 318 linii spektralnych w zakresie 160 -1000 nm) – szczególnie przy wzbudzaniu wysokoenergetycznym (np. iskra elektryczna). Źródła wzbudzania typu płomień powodują powstawanie widm znacznie uboższych w linie. Intensywność linii spektralnej zależy przede wszystkim od stężenia atomów emitujących promieniowanie.

Techniki emisyjne – fotometria płomieniowa Do celów analizy ilościowej najbardziej przydatne są linie związane z przejściem do stanu podstawowego (linie rezonansowe). Są one najbardziej intensywne. Zdolność pierwiastków do wzbudzania (kolejność malejąca): • Litowce (1. 4 – 3. 0 e. V) • metale przejściowe (3. 0 -10 e. V) • metale ciężkie (powyżej 10 e. V)

Techniki emisyjne – fotometria płomieniowa - jest najprostszą metodą z atomowych metod emisyjnych. Do atomizacji próbki używa się płomienia który ma dostarczyć wytworzonym atomom energii potrzebnej do ich wzbudzenia. Aparatura stosowana w fotometrii płomieniowej

Techniki emisyjne – fotometria płomieniowa Zastosowanie fotometrii płomieniowej: • - seryjne oznaczenia jonów sodu, potasu, wapnia w wodach mineralnych • - analiza zawartości tych jonów w płynach ustrojowych, ekstraktach roślinnych Ponieważ kationy sodu i potasu są odpowiedzialne za tzw. równowagę jonową w organizmie ludzkim dlatego fotometria płomieniowa stosowana jest w prawie każdym laboratorium szpitalnym.

























