Soojustehnika teoreetilised alused MSJ 0310 6 loeng Vanemteadur

















- Slides: 20


Soojustehnika teoreetilised alused - MSJ 0310 6. loeng Vanemteadur Alar Konist Soojustehnika instituut Hoone U 06, kabinet 136 Ehitajate tee 5, Tallinn, 19086 +372 620 3907 alar. konist@ttu. ee http: //staff. ttu. ee/~akonist/sti/Oppetoo. html

Termodünaamilised põhiprotsessid Termodünaamiliste protsesside uurimise eesmärk on kindlaks määrata termiliste parameetrite vaheline seos, protsessis sooritatav töö ja protsessist osavõttev soojushulk. • Ringprotsessid on keerulised ning nende uurimisel saame jaotada üksikuteks põhiprotsessideks • Igasuguses termodünaamilises süsteemis võib toimuda kolm järgimist protsessi: • isotermiline (T=konst. ), • adiabaatiline (dq=0) • polütroopiline (c=konst. ). • Süsteemis, millele mõjuvad ainult mehaanilised jõud, lisandub kolmele loetletud protsessile veel kaks järgmist võimalikku protsessi: • isohooriline (v=konst. ) • isobaariline (p=konst. ) Toodud viis protsessi ongi termodünaamilise põhiprotsessid. •

• Termiliste olekuparameetrite p, v ja T omavahelist seost vaadeldavas termodünaamilises protsessis nimetatakse protsess võrrandiks • Isohoorilise, isobaarilise ja isotermilise protsessi võrrandid on otseselt järeldatavad termodünaamilise süsteemi termilisest olekuvõrrandist, sest olekuvõrrand juba ise sisaldab protsessi tunnusparameetri. • Adiabaatilise ja polütroopilise protsessi võrrand ei ole termilisest olekuvõrrandist otseselt tuletatav, sest ta ei sisalda soojushulka ega ka erisoojust. Seetõttu on adiabaadi ja polütroobi võrrandite tuletamiseks vaja termilise olekuvõrrandi kõrval teada ka süsteemi soojuslikku võrrandit

Isohooriline protsess Isohooriliseks nimetatakse sellist termodünaamilist protsessi, kus termodünaamilise süsteemi soojuslikul mõjutamisel (soojuse protsessi juhtimisel või eemaldamisel) tema maht ei muutu (v=konst. ja dv =0). Mehaaniline töö on arvutatav kui dl=pdv et dv=0, siis süsteemis mehaanilist tööd ei tehta.

• Süsteemi üleminekul olekust 1(algolek) olekusse 2 (lõppolek) termodünaamilisele kehale siirduv soojushulk on leitav kui q=∆u=u 2 -u 1 • Isohoorilises protsessis termodünaamilisele süsteemile juurde või ärajuhitav soojushulk on võrdne protsessis esineva siseenergia muutusega. nii tagastatava kui ka tagastamatu protsessi korral. Ishooriline protsess pv-diagrammil: Positiivse soojuse q korral kulgeb joon alt üles Tehniline töö avaldub võrrandina lt=-v(p 2 -p 1) ja joonisel viirutatud pindalana.

• Isohoorilise protsessi tehniline töö avaldub sisenemis(vp 1 ) ja väljumistöö (vp 2 ) vahena. Isohoorilise protsessi tehnilise töö mõiste selgitamine liikuva kolviga silindris Termodünaamilise keha suundumisel silindrisse tehakse välisjõudude poolt sisenemistöö vp 1. Järgnevalt juhitakse protsessi soojushulk q=∆u olukorras, kus kolb ei liigu (positiivse q korral süsteemi rõhk suureneb). Keha väljumisel silindrist teevad sisejõud väljumistöö vp 2. ehk: lt=ls+l+lv=vp 1 -vp 2 et q=∆u siis lt=∆u-∆h (∆h on etnalpia muutus protsessis. Edasine analüüsi teeme eeldusel, et termodünaamiline keha on ideaalne gaas.

Siis Clapeyroni võrrandi alusel: ehk isohoorilises termodünaamilises protsessis gaasi rõhk võrdeline tema absoluutse temperatuuriga: Protsessist osavõttev soojushulk (cv=konst): q=cv(T 2 -T 1)

Entroopia mõiste selgitamisel oli meil võrrand: ehk ishoorilisel protsessil saab entroopia muutust avaldada: Kui loeme, et entroopia on absoluutse nulli juures (Kelvini kraadi) võrdne nulliga, siis saame entroopia väärtuse mingil temperatuuril T arvutada võrrandiga (ideaalse gaasi isohoorjoone võrrand) :

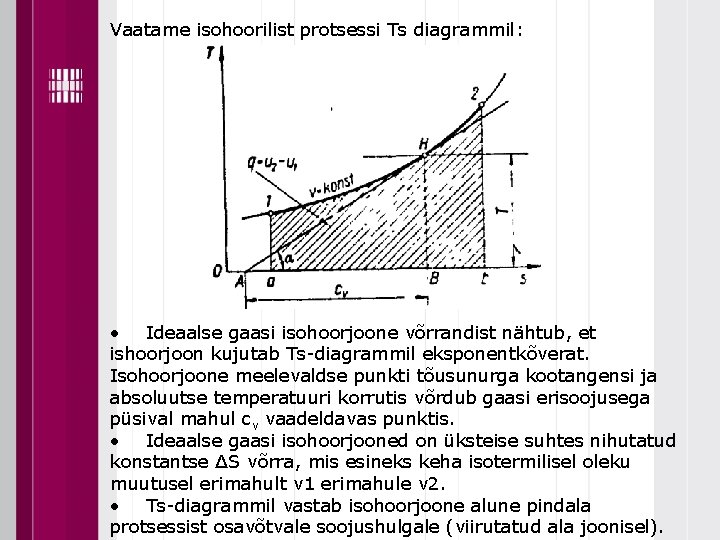
Vaatame isohoorilist protsessi Ts diagrammil: • Ideaalse gaasi isohoorjoone võrrandist nähtub, et ishoorjoon kujutab Ts-diagrammil eksponentkõverat. Isohoorjoone meelevaldse punkti tõusunurga kootangensi ja absoluutse temperatuuri korrutis võrdub gaasi erisoojusega püsival mahul cv vaadeldavas punktis. • Ideaalse gaasi isohoorjooned on üksteise suhtes nihutatud konstantse ∆S võrra, mis esineks keha isotermilisel oleku muutusel erimahult v 1 erimahule v 2. • Ts-diagrammil vastab isohoorjoone alune pindala protsessist osavõtvale soojushulgale (viirutatud ala joonisel).

Isobaariline protsess • Isobaariliseks nimetatakse sellist termodünaamilist protsessi, mis toimub püsival rõhul (p=konst. ja dp=0). • Kuna dp=0, siis termodünaamilises süsteemis tehnilist tööd (lt=-vdp) ei tehta • Isobaarilises protsessis termodünaamilise keha üleminekuks olekust 1 olekusse 2 vajalik soojushulk on arvutav: q=h 1 -h 2 ehk isobaarilises termodünaamilises protsessis keha poolt juurdesaadav või äraantav soojushulk võrdne protsessis esineva entalpia muutusega nii tagastatava kui ka tagastamatu protsessis

• pv diagrammil isobaariline protsess: p=konst. protsess väljendub pv-diagrammil horisontaalse sirglõiguna Soojuse juurdeviimisel protsessi kulgeb joon vasakult paremale, soojuse eemaldamisel aga paremalt vasakule. • Et mehaanilise töö on arvutata l=p(v 2 -v 1), siis viirutad ala joonisel vastab mehaanilisele tööle.

Edasise analüüsi teostame ideaalsele gaasile: • Vastavalt Clapeyroni võrrandile: ehk gaasi üleminekul ühest olekust teise: ehk: • Isobaarilises protsessis on ideaalse gaasi maht võrdeline absoluutse temperatuuriga. Paisumisel gaasi temperatuur tõuseb, komprimeerimisel alaneb. • Konstantse cp korral protsessist osavõttev soojushulk arvutav: q=cp(T 2 -T 1)

• Siseenergia muutus ∆u=cv(T 2 -T 1) (eeldus cv=konst. ) • Ideaalne gaasi poolt tehtav mehaaniline töö isobaarilises protsessis on arvutatav l=R(T 2 -T 1) sest pv 1=RT 1 ja pv 2=RT 2 • Analoogiliselt ishoorilise protsessi analüüsiga tuletame entroopia muutuse isobaarilises protsessis.

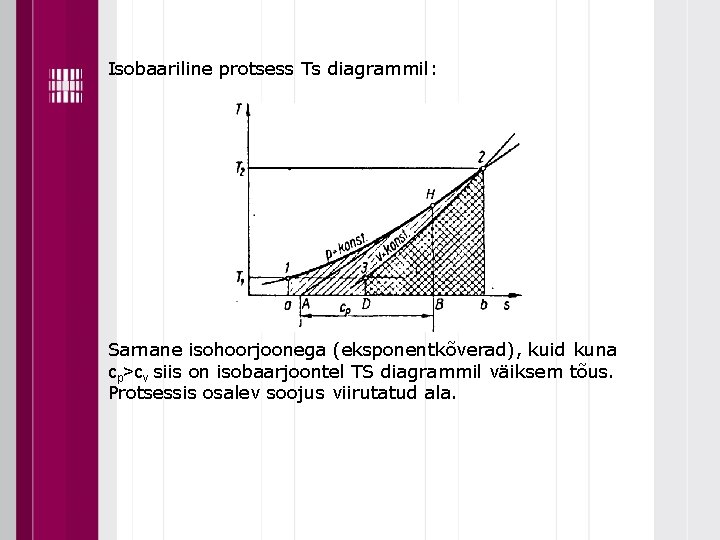
Isobaariline protsess Ts diagrammil: Sarnane isohoorjoonega (eksponentkõverad), kuid kuna cp>cv siis on isobaarjoontel TS diagrammil väiksem tõus. Protsessis osalev soojus viirutatud ala.

Isotermiline protsess • Isotermiliseks nimetatakse sellist termodünaamilist protsessi, mis toimub püsival temperatuuril (T=konst. ja d. T=0). • Et d. T=0 ja du=0=dh ehk u=konst. ja h=konst. , siis isotermiline protsess toimub termodünaamilise keha siseenergia ja entalpia püsivatel väärtusel. • Isotermiline erisoojus c=d. T/dq=±lõpmatus • Rakendame termodünaamika esimest seadust protsessile kus T=konst. : dq=dl=pdv ehk dq=dlt=-vpdp Järeldused: • isotermilisse protsessi antud soojus muundub mehaaniliseks (tehniliseks) tööks

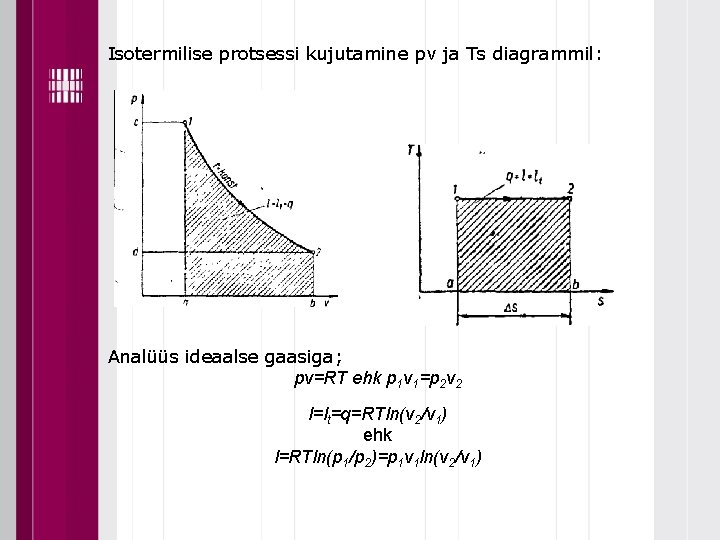
Isotermilise protsessi kujutamine pv ja Ts diagrammil: Analüüs ideaalse gaasiga; pv=RT ehk p 1 v 1=p 2 v 2 l=lt=q=RTln(v 2/v 1) ehk l=RTln(p 1/p 2)=p 1 v 1 ln(v 2/v 1)

Entroopia muutus on arvutatav Δs=Rln(v 2/v 1) või Δs=Rln(p 1/p 2) ja protsessist osavõttev soojus: q= Δs. T

Tänan tähelepanu eest!




























