Soojustehnika teoreetilised alused MSJ 0310 4 loeng Vanemteadur

















- Slides: 19


Soojustehnika teoreetilised alused MSJ 0310 4. loeng Vanemteadur Alar Konist Soojustehnika instituut Hoone U 06, kabinet 136 Ehitajate tee 5, Tallinn, 19086 +372 620 3907 alar. konist@ttu. ee http: //staff. ttu. ee/~akonist/sti/Oppetoo. html

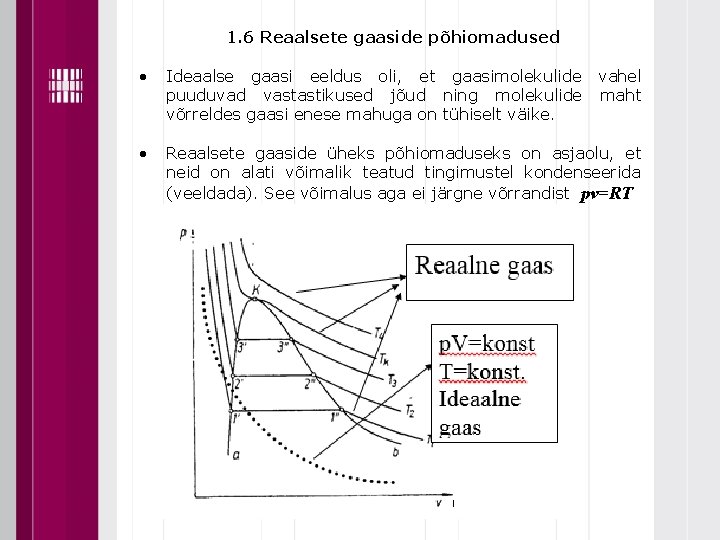
1. 6 Reaalsete gaaside põhiomadused Ideaalse gaasi eeldus oli, et gaasimolekulide vahel puuduvad vastastikused jõud ning molekulide maht võrreldes gaasi enese mahuga on tühiselt väike. Reaalsete gaaside üheks põhiomaduseks on asjaolu, et neid on alati võimalik teatud tingimustel kondenseerida (veeldada). See võimalus aga ei järgne võrrandist pv=RT

Diagrammil komprimeerime gaasi püsitemperatuuridel, kus T 1<T 2<…. Tk 1" 1' …… 3" 3' vahel on nii gaasiline kui vedel olek niiske aur 1" st paremal on aine gaasilises faasis 1' st vasakul esineb aine ainult vedelas olekus b……kuni punktini K ülemine piirkõver a kuni punktini K alumine piirkõver punkt K aine kriitiline punkt, seda läbib kriitiline isoterm Aine Kriitiline temperatuur 0 C rõhk MPa Vesi Heelium N 2 O 2 374, 15 267, 9 147, 1 118, 8 22, 129 0, 229 3, 394 5, 036 erimaht m 3/kg 3, 26 14, 43 3, 21 2, 44

Käänupunkti võrrand: Puutuja võrrand: ehk: Kriitiline isoterm omab punktis K käänupunkti ning seda läbiv puutuja on horisontaalne.

Reaalsete gaaside kirjeldamine Reaalsete gaaside iseloomustamiseks on sobiv käsutada kokkusurutavustegurit, mis on määratletud kui ideaal ja reaalgaasi mahu suhtarv: Võrrandist nähtub, et ideaalgaasi kriteerium on z = 1; sellele peaks vastama reaalgaas, juhul kui tema mahu arvutamisel on olekufunktsioonina kasutatud ideaalgaasi võrrandit

Näited kokkusurutavustegurist:

Esitame üldistatud zp diagrammi, kuhu on kantud T=konst. jooned (isotermid) Temperatuuridel T<TB on isotermjoontel zp-diagrammil miinimum. Seejuures miinimumpunktile vastav rõhk temperatuuri tõusmisel algul suureneb, hiljem väheneb. Kirjeldatud isotermjoonte miinimumpunkte nimetatakse Boyle'i punktideks ning neid ühendavat joont Boyle'i jooneks. Temperatuuri, mille juures isotermjoone miinimumpunkt asub z-teljel (p=0), kannab Boyle'i temperatuuri nime (tähistame TB).

• Reaalsete gaaside kõrvalekaldumine ideaalse gaasi omadustest on tingitud reaalse gaasi molekulidevahelistest jõududest ja molekulide lõplikust mahust. Molekulidevahelise potentsiaalse energia E sõltuvuse iseloom molekulide vahekaugustest h; on kujutatud joonisel: Madalatel rõhkudel (molekulide vahekaugused on suured) on molekulidevahelised tõmbejõud väiksed ning molekulide maht võrreldes gaasi mahuga on samuti väike. Selline gaasi olek vastab esimeses lähenduses ideaalse gaasi olekule.

Sellest tulenevalt alluvad reaalsed gaasid madalatel rõhkudel (zp diagrammil ala p=0 ümbruses) küllalt hästi ideaalse gaasi oleku võrrandile pv=RT. • Molekulidevaheliste kauguste vähenemisel gaasi rõhk kasvab ja molekulidevahelised tõmbejõud suurenevad (kuni punktini m joonisel ). Selles olekupiirkonnas ületab ideaalse gaasi maht reaalse gaasi mahu. zp diagrammil vastab see ala piirkonnale z=1 kuni Boyle'i punktini. • Molekulide edasisel üksteisele lähenemisel hakkavad ülekaalu omandama tõukejõud (punktis n on tõmbejõud võrdsed tõukejõududega), takistades mahu edasist vähenemist. • Molekulide vahekauguste piirkonnas h<ho suurenevad tõukejõud h vähenemisel väga järsult. Seetõttu lähenevad isotermjooned zp diagrammil Boyle'i punktist paremal uuesti ideaalse gaasi isotermile (z= 1) ning pärast viimasega lõikumist on reaalse gaasi maht juba ideaalse gaasi mahust suurem.

1. 7 Reaalse gaasi olekuvõrrandid • • • Meeldetuletus: Olekuvõrrand seob omavahel p, v ja T. On tuntud ligikaudu 200 300 võrrandit. Üheks klassikaliseks reaalsete gaaside termiliseks olekuvõrrandiks on 1873. a. J. D. van der Waalsi poolt esitatud võrrand. • Van der Waalsi võrrandi tuletamise aluseks on molekulidevaheliste jõudude lihtsustatud skeem (punktiirjoon cd-a eelmisel joonisel ). Toodud skeem võimaldab vaadelda tõmbe ja tõukejõudude mõju teineteisest sõltumatutena. Tõukejõudude sõltumatust molekulide vahekaugustest (joon ad) väljendab vahe v vef=b, kus v tähistab süsteemi kogu mahtu (erimaht) ja konstant b minimaalset mahtu, mille süsteem võib saavutada lõpmata suurel rõhul. b sõltub aine omadustest. • Molekulidevahelisi tõmbejõude (joon d-c) arvestatakse rõhu vähenemise teel suuruse Δp=p'-p võrra. Siinjuures on p gaasi piirdepindadele mõjuv rõhk ning p' sama suurus juhul, kui puu duks molekulidevaheline tõmbejõud. Rõhkude vahe Δp kujutab gaasi siserõhku. Esimeses lähenduses võib siserõhu lugeda proport sionaalseks tiheduse ruuduga, s. t Δp~ (a/v 2 ) kus a tähistab ainest sõltuvat tegurit. Eelneva põhjal saame, et:

Saame anda võrrandile kujusid: (p+ Δp)vef=RT ehk Viimane ongi Van der Waalsi võrrand. Ka kujul: Graafiline esitus:

On tuletatav kriitilised parameetrid ja arvutada konstandid a ja b. , v=3 b,

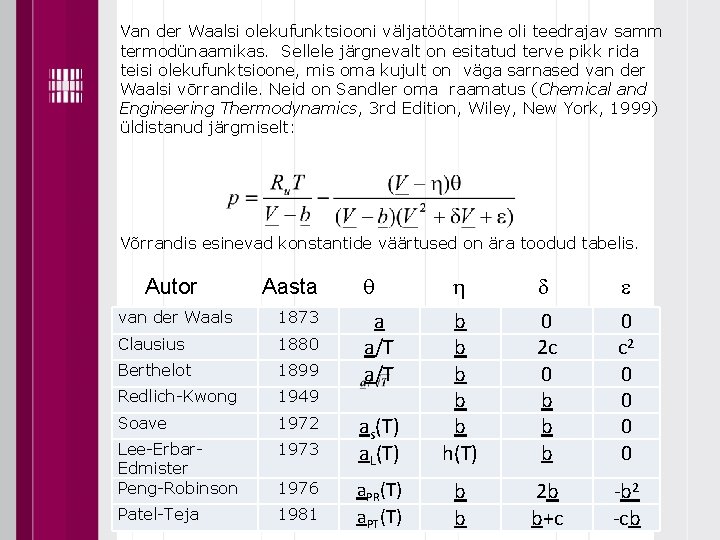
Van der Waalsi olekufunktsiooni väljatöötamine oli teedrajav samm termodünaamikas. Sellele järgnevalt on esitatud terve pikk rida teisi olekufunktsioone, mis oma kujult on väga sarnased van der Waalsi vōrrandile. Neid on Sandler oma raamatus (Chemical and Engineering Thermodynamics, 3 rd Edition, Wiley, New York, 1999) üldistanud järgmiselt: Võrrandis esinevad konstantide väärtused on ära toodud tabelis. Autor Aasta van der Waals 1873 Clausius 1880 Berthelot 1899 Redlich Kwong 1949 Soave 1972 Lee Erbar Edmister Peng Robinson 1973 Patel Teja 1981 1976 q h d e as(T) a. L(T) b b b h(T) 0 2 c 0 b b b 0 c 2 0 0 a. PR(T) a. PT(T) b b 2 b b+c -b 2 -cb a a/T

Samal ajal kui töötati välja olekufunktsioone molekulaarfüüsika arusaamade kohaselt, on ka avaldatud olekufunktsioone, mis põhinevad puhtalt empiirikal nn. viriaal olekufunktsioone Sõna viriaal pärineb ladina keelest ja tähendab “jõud”, mis selgelt vihjab selle olekufunktsiooni seosele molekulidevahelise jõuga. Puhtempiirilistest olekufunktsioonidest on üks tähtsaim viie konstandiga Beattie Bridgeman’i olekufunktsioon (aastast 1928). See olekufunktsioon kirjutatakse tavaliselt: Seda võrrandit soovitatakse kasutada ainult väikese gaasitiheduse korral, mis küünib kuni 80% ni aine kriitilisest tihedusest.

2. Termodünaamika põhimõisted ja põhiseadused 2. 1 Termodünaamilised protsessid • Termodünaamilised arvutused on seotud oleku muutustega süsteemis. Neid muutusi on mitmesuguseid ja tihti on need mitmeastmelised ja väga keerulised • Neid muutusi kirjeldab vastavanimeline termodünaamiline protsess: 1. Adiabaatne Protsessis ei toimu soojusvahetust süsteemi ja väliskeskkonna vahel 2. Isotermne Süsteemi temperatuur protsessis ei muutu 3. Isobaarne Süsteemi rõhk protsessis ei muutu 4. Isohoorne Süsteemi maht protsessis ei muutu 5. Isoentroopne Entroopia protsessis ei muutu 6. Isoentalpne Süsteemi entalpia protsessis ei muutu 7. Polütroopne Gaasiga toimuva protsessi puhul pvn on konstantne

• Ringprotsessid on need protsessid, milles süsteemi algolek taastub pärast seda kui süsteem on läbinud järjestikku mitu erinevat termodünaamilist vaheolekut. Ringprotsessi tähtis eesmärk on soojuse muundamine tööks, mis ongi tehnilise termodünaamika peamine eesmärk. Näide: • Termodünaamilist protsessi, mille käigus igal ajamomendil on olemas termodünaamiline tasakaalule lähedane olek nimetatakse kvaasistaatiliseks protsessiks

Tänan tähelepanu eest!



























