SOLUCIONES Practicas de Bioqumica y Biologa MolecularPrctica 1

SOLUCIONES

Practicas de Bioquímica y Biología Molecular-Práctica 1 PREPARACION DE SOLUCIONES UNIDADES DE CONCENTRACION

Definición de Solución o Disolución Se denomina solución o disolución al resultado de interponer totalmente las moléculas de un sólido en un líquido o de un líquido en otro líquido.

Componentes de una solución o disolución El componente más abundante se llama solvente o disolvente y el minoritario se conoce como soluto.

Las disoluciones en Bioquímica En el laboratorio tienen una gran importancia la correcta preparación y el conocimiento de las propiedades fisico-químicas de soluciones: - Todas las reacciones bioquímicas se producen en medio acuoso. - Los líquidos biológicos son soluciones acuosas de metabolitos y sales minerales. - La inmensa mayoría de los reactivos que se emplean en el laboratorio de análisis son soluciones. - La preparación de soluciones requiere cálculos matemáticos para conocer la concentración del soluto o la proporción soluto/solvente - La expresión de resultados analíticos en Bioquímica Clínica casi siempre requiere el cálculo de la concentración de moléculas biológicas (metabolitos o analitos) - En muchos casos, la determinación de la concentración de un analito requiere la preparación previa de una solución de referencia de concentración exactamente definida.

Expresión de la concentración de disoluciones La concentración de una solución, es decir, la cantidad de soluto que hay en ella por unidad de volumen, puede expresarse de diversas formas, siendo las más usuales en el laboratorio: - Molaridad - Normalidad - Relación Peso / Volumen - Relación Volumen / Volumen

MOLARIDAD Molaridad (M): es igual al número de moles de soluto por litro de solución final. Un mol es el peso molecular (PM) del soluto expresado en gramos. Así una solución 1 M de cloruro sódico (Cl. Na, PM=58. 5) es la que tiene 58. 5 g/l de solución. Moles = gramos / Peso Molecular Molaridad = n° moles/litro = g / PM / volumen

MOLARIDAD Cuando se consideran concentraciones pequeñas, como las que suelen presentar los metabolitos en los seres vivos, se emplean submúltiplos de esta unidad: UNIDAD CONCENTRACION EQUIVALENCIA mmol m. M 0. 001 Molar (10 -3 M) µmol µM 0. 001 m. Molar (10 -6 M) nmol n. M 0. 001 µMolar (10 -9 M) pmol p. M 0. 001 n. Molar (10 -12 M)

EJEMPLOS SIMPLES DE PREPARACION DE SOLUCIONES - Calcular el peso p de soluto para preparar un volumen v de solución n M de un soluto de peso molecular w - p = n x w (en gramos) x v (en litros) - Añadir disolvente hasta llegar al volumen v - Calcular la molaridad m de solución que contiene un peso p de un soluto de peso molecular w en un volumen v de disolución - Moles de soluto: p (en gramos) / w - m = [p/w] / v

NORMALIDAD Normalidad (N): es igual al número de equivalentes (Eq) de soluto por litro de solución final. El peso equivalente de una sustancia es igual al peso molecular dividido por su valencia.

NORMALIDAD Por ejemplo, 1 Eq de ácido sulfúrico (SO 4 H 2; PM = 98) es 98/2 (dos H+ cedidos por el ácido) = 49. Sin embargo 1 Eq de ácido clorhídrico (C 1 H, PM=36) es 36/1 = 36. No se suelen utilizar submúltiplos de N, indicándose con decimales (0. 1 N, 10 -5 N, etc). Por el contrario, se emplea mucho el término m. Eq (= 0. 001 Eq).

EJEMPLOS SIMPLES DE PREPARACION DE SOLUCIONES - Calcular el peso p de soluto para preparar un volumen v de solución n N de un soluto de peso molecular w y valencia a - p = [n x w /a (en gramos)] x v (en litros) - Añadir disolvente hasta llegar al volumen v - Calcular la normalidad n de solución que contiene un peso p de un soluto de peso molecular w y valencia a en un volumen v de disolución - Equivalentes de soluto: [p (en gramos) x a ] / w - n = [p x a / w] / v

RELACION PESO / VOLUMEN Peso/volumen (p/v): se expresa el peso del soluto (en gramos o submúltiplos) por unidad de volumen (litro o submúltiplos). Las unidades más frecuentemente empleadas son: - g/L - mg/m. L - mg/cm 3 - g/d. L - % p/v (= gramos / 100 m. L de solución) Este tipo de unidades se utiliza con mucha frecuencia en la Bioquímica Clínica. Sin embargo, la tendencia actual es la de expresar los resultados analíticos en unidades de Molaridad.

RELACION VOLUMEN / VOLUMEN Volumen / volumen (v/v): se emplea cuando son dos líquidos los que se mezclan. Las unidades que se emplean más frecuentemente son: - mililitros/litro (m. L/L) - % v/v (Porcentaje de líquido minoritario en el total de la disolución) - P/P (Partes de líquido minoritario en partes totales de disolución) - P : P (Partes de líquido A + partes de líquido B)
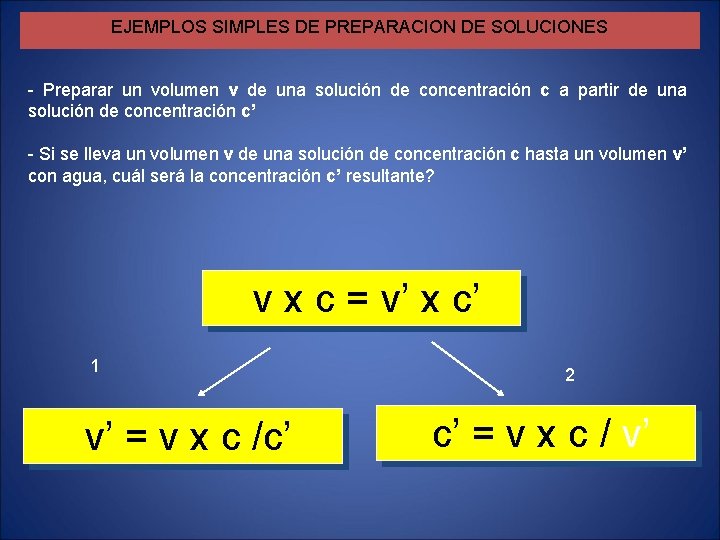
EJEMPLOS SIMPLES DE PREPARACION DE SOLUCIONES - Preparar un volumen v de una solución de concentración c a partir de una solución de concentración c’ - Si se lleva un volumen v de una solución de concentración c hasta un volumen v’ con agua, cuál será la concentración c’ resultante? v x c = v’ x c’ 1 v’ = v x c /c’ 2 c’ = v x c / v’

EJEMPLOS SIMPLES DE RELACION VOLUMEN / VOLUMEN - mililitros/litro: 25 m. L líquido A / L de disolución - Mezclar 25 m. L de líquido A y 975 m. L de agua - % v/v: Solución de A al 3 % v/v - Mezclar 30 m. L de A y 970 m. L de agua - P/P: Solución 3/5 de líquido A en agua - Mezclar 600 m. L de líquido A y 400 m. L de agua - P: P : Solución 3: 5 de líquido A en agua - Mezclar 600 m. L de líquido A y 500 m. L de agua

Soluciones Mezclas homogéneas de dos o más componentes. Componentes Mayor proporción solvente Menor proporción soluto Concentración: indica la cantidad de soluto presente en una dada cantidad de solvente o una dada cantidad de solución. Solución saturada: es una solución que no puede disolver mayores cantidades de soluto. Una solución saturada está en equilibrio con el soluto sólido. Solubilidad: concentración de soluto de la solución saturada.

Unidades de concentración % p/p o % en masa: g de soluto en 100 g de solución. msto= g de soluto presentes en msoln g de solución. Partes por millón: g de soluto en 106 g de solución. msto= g de soluto presentes en mslon g de solución.

Molaridad: moles de soluto en 1 litro de solución. nsto= Nro de moles de soluto presentes en nlsoln litros de solución. Formaridad: peso formula g de soluto en 1 litro de solución. Molalidad: moles de soluto en 1 kg de solvente.
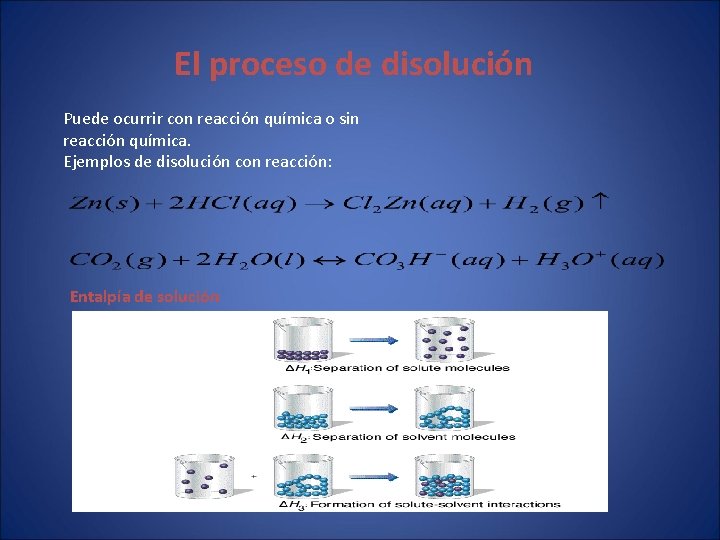
El proceso de disolución Puede ocurrir con reacción química o sin reacción química. Ejemplos de disolución con reacción: Entalpía de solución
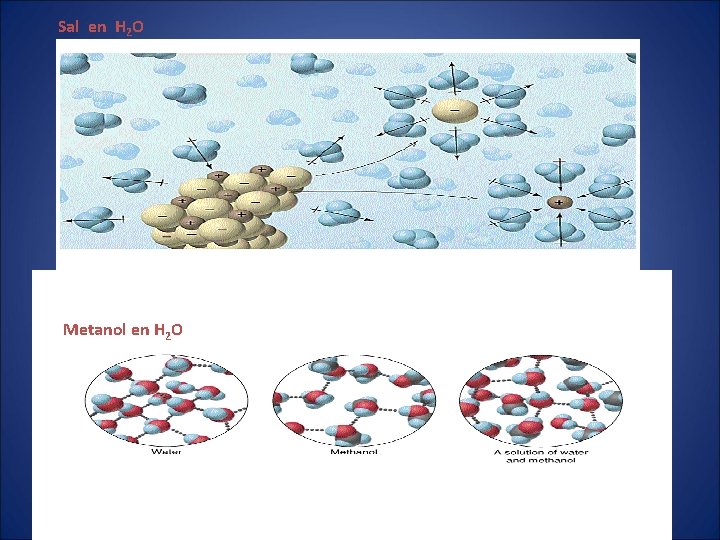
Sal en H 2 O Metanol en H 2 O
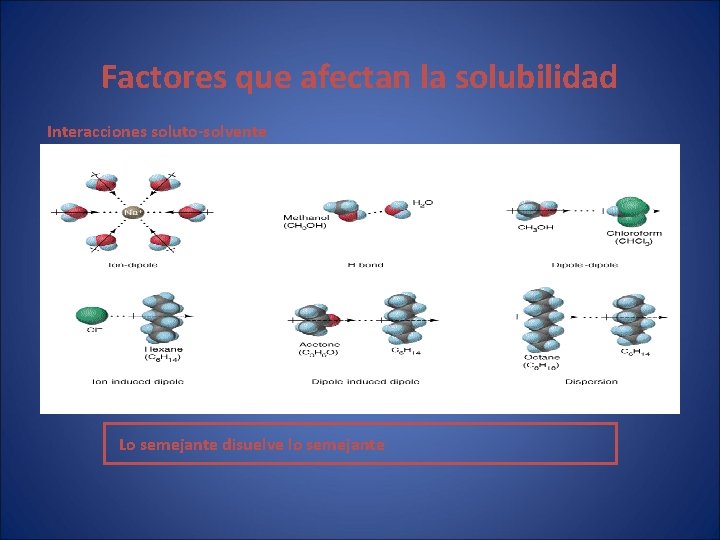
Factores que afectan la solubilidad Interacciones soluto-solvente Lo semejante disuelve lo semejante
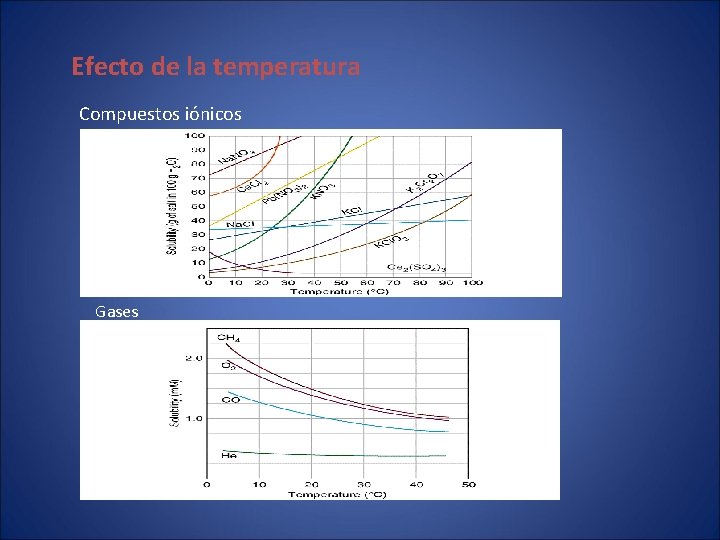
Efecto de la temperatura Compuestos iónicos Gases
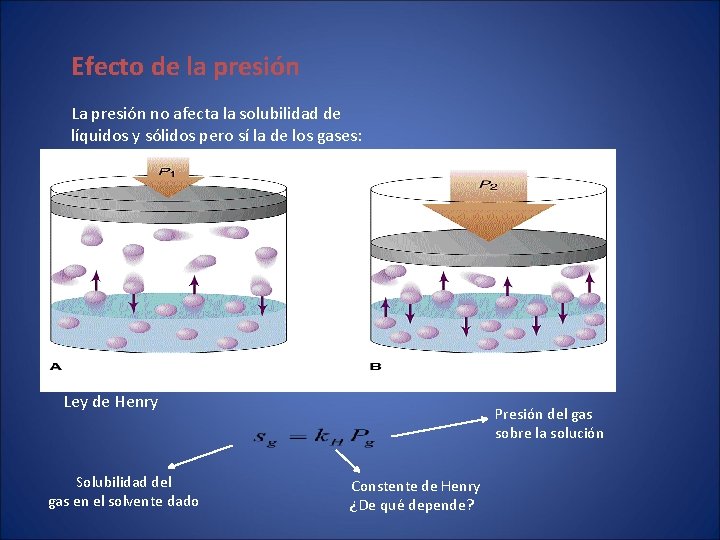
Efecto de la presión La presión no afecta la solubilidad de líquidos y sólidos pero sí la de los gases: Ley de Henry Solubilidad del gas en el solvente dado Presión del gas sobre la solución Constente de Henry ¿De qué depende?

Disoluciones Una disolución es una mezcla homogénea de dos o mas sustancias. • El soluto es la sustancia presente en menor cantidad • el disolvente es la sustancia que esta en mayor cantidad.

Disolución. Vs. Coloide • Solución: no se observa ningún asentamiento de soluto a lo largo del tiempo. • Suspensión: El “soluto” se asienta (polvo en agua) • Coloide o dispersión: estado intermedio entre una solución y una suspensión: Moléculas de gran tamaño como almidón, gelatina, albúmina.

COLOIDES • Partículas dispersas de masa molar alta. • Relativamente grandes (1000 nm de diámetro) • Presentan el efecto Tyndall (dispersión de la luz que les dá apariencia opaca). • Partículas coloidales no se asientan.

Una disolución puede ser: • gaseosa como el aire, • sólida como una aleación • ó líquida como el agua de mar.
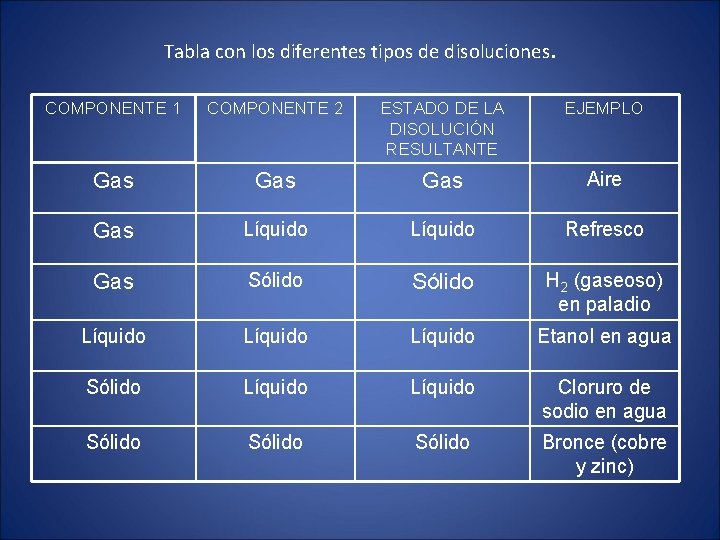
Tabla con los diferentes tipos de disoluciones. COMPONENTE 1 COMPONENTE 2 ESTADO DE LA DISOLUCIÓN RESULTANTE EJEMPLO Gas Gas Aire Gas Líquido Refresco Gas Sólido H 2 (gaseoso) en paladio Líquido Etanol en agua Sólido Líquido Cloruro de sodio en agua Sólido Bronce (cobre y zinc)

Tipos • No saturada: Contiene menos cantidad de soluto que la que el disolvente puede disolver. • Saturada: Contiene la máxima cantidad de un soluto que se disuelve en un disolvente en particular, a una temperatura específica. • Sobresaturada: Contiene mas soluto del que puede haber en una disolución saturada.

Cálculo de Concentración de Disoluciones
![• Porcentaje en masa 100%=masa de soluto + masa de solvente %=[(m)soluto/ (m)total]100 • Porcentaje en masa 100%=masa de soluto + masa de solvente %=[(m)soluto/ (m)total]100](http://slidetodoc.com/presentation_image_h/11c7b4396ae17d5b131fe048a9464b72/image-32.jpg)
• Porcentaje en masa 100%=masa de soluto + masa de solvente %=[(m)soluto/ (m)total]100 • Porcentaje en volumen 100%=volumen de soluto + volumen de solvente %=[(v)soluto/(v)total]100 • Partes por millon Ppm=(soluto/total)1000000 • w = V*r V = volumen (ml) r = densidad (g/ml)
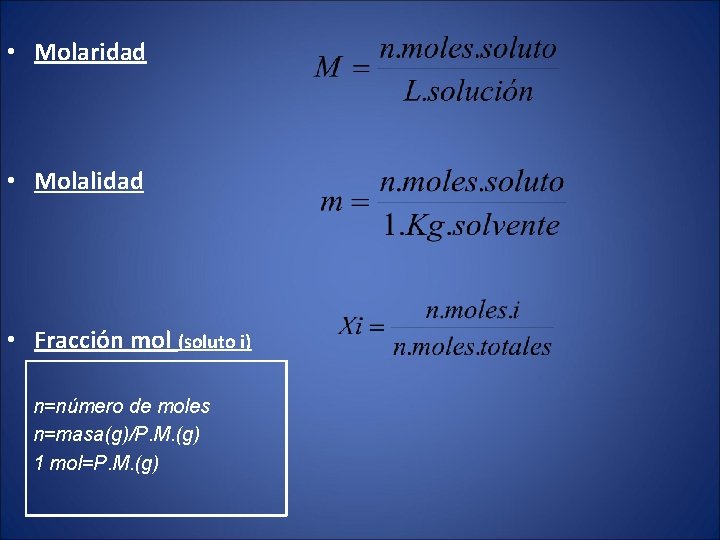
• Molaridad • Molalidad • Fracción mol (soluto i) n=número de moles n=masa(g)/P. M. (g) 1 mol=P. M. (g)

UNIDADES DE CONCENTRACION • %(v/v) • %(m/m) • Ppm • Solns líquido/líquido (bebidas alcóholicas) • Común en los productos de consumo • Solns extremadamente diluídas (química ambiental) • Molaridad • Reacciones químicas (estequiometría) • molalidad • Cambios de temperatura (propiedades coligativas
- Slides: 34