SOLI SOLI velmi poetn skupina anorganickch ltek chemick







































- Slides: 51

SOLI

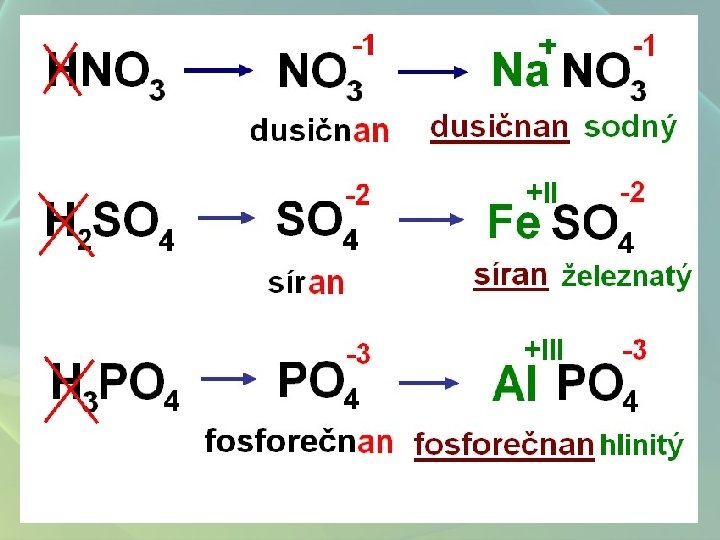
SOLI • velmi početná skupina anorganických látek • chemické sloučeniny, které tvoří kationt kovu a aniont kyseliny Názvosloví solí K NO 3 dusičnan draselný odvozeno od názvu kyseliny odvozeno od názvu kationtu

1. Soli bezkyslíkatých kyselin

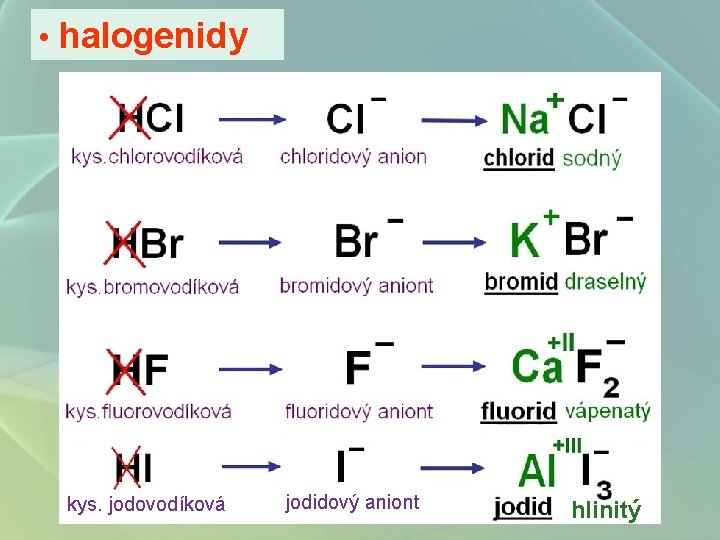
• halogenidy kys. jodovodíková jodidový aniont hlinitý

Bolívie, těžba soli na jezeře Salar de Uyuni


• sulfidy

2. Soli kyslíkatých kyselin Cu. SO 4



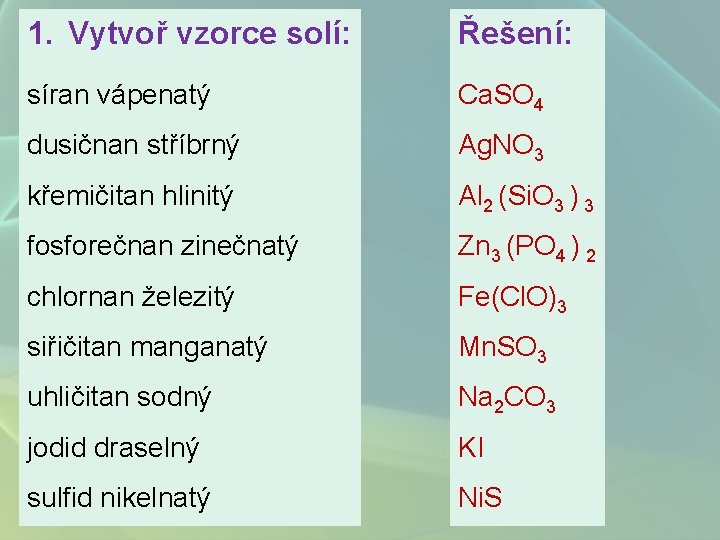
1. Vytvoř vzorce solí: Řešení: síran vápenatý Ca. SO 4 dusičnan stříbrný Ag. NO 3 křemičitan hlinitý Al 2 (Si. O 3 ) 3 fosforečnan zinečnatý Zn 3 (PO 4 ) 2 chlornan železitý Fe(Cl. O)3 siřičitan manganatý Mn. SO 3 uhličitan sodný Na 2 CO 3 jodid draselný KI sulfid nikelnatý Ni. S

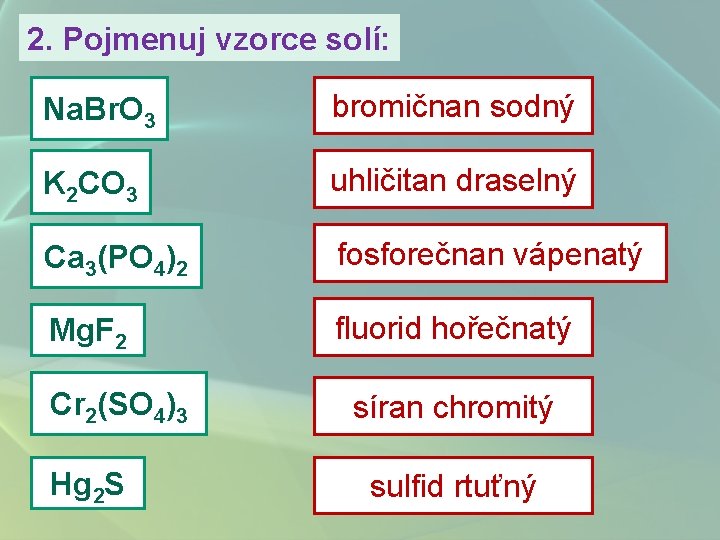
2. Pojmenuj vzorce solí: Na. Br. O 3 bromičnan sodný K 2 CO 3 uhličitan draselný Ca 3(PO 4)2 fosforečnan vápenatý Mg. F 2 fluorid hořečnatý Cr 2(SO 4)3 Hg 2 S síran chromitý sulfid rtuťný

VLASTNOSTI SOLÍ • v přírodě jako krystaly • velmi pevné vazby (iontové) velmi pevné vazby • vysoké body tání a varu • v roztoku nebo tavenině vedou elektrický proud

VLASTNOSTI 1. Proč mají soli vysoké body tání a varu, vysvětli! 2. Proč nevedou elektrický proud v krystalech?

VLASTNOSTI 1. Proč mají soli vysoké body tání a varu, vysvětli! má v krystalech iontové vatby, což je příčinou velké teploty tání a teploty varu 2. Proč nevedou elektrický proud v krystalech? v pevném stavu nevede elektrický proud, avšak její vodný roztok nebo tavenina elektrický proud vedou (vedení elektrického proudu umožňují volně se pohybující ionty v tavenině či roztoku)

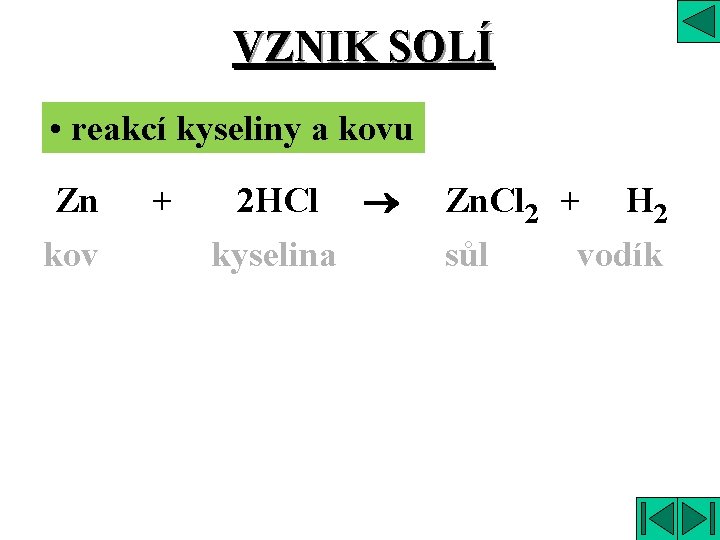
VZNIK SOLÍ âslučování kovu a nekovu âneutralizací âreakcí kyselinotvorného oxidu a hydroxidu âreakcí hydroxidotvorného oxidu a kyseliny âreakcí kyseliny a kovu

VZNIK SOLÍ • reakcí kyseliny a kovu Zn kov + 2 HCl kyselina Zn. Cl 2 + H 2 sůl vodík

VZNIK SOLÍ • reakcí kyselinotvorného oxidu a hydroxidu 2 Na. NO 3 + H 2 O voda hydroxid sůl N 2 O 5 + 2 Na. OH oxid • reakcí hydroxidotvorného oxidu a kyseliny Na 2 O + 2 HCl 2 Na. Cl + H 2 O voda oxid kyselina sůl

VZNIK SOLÍ • slučování kovu a nekovu 2 K kov + Cl 2 2 KCl sůl Ag. Cl + nekov • neutralizací Ag. OH hydroxid + HCl kyselina sůl H 2 O voda

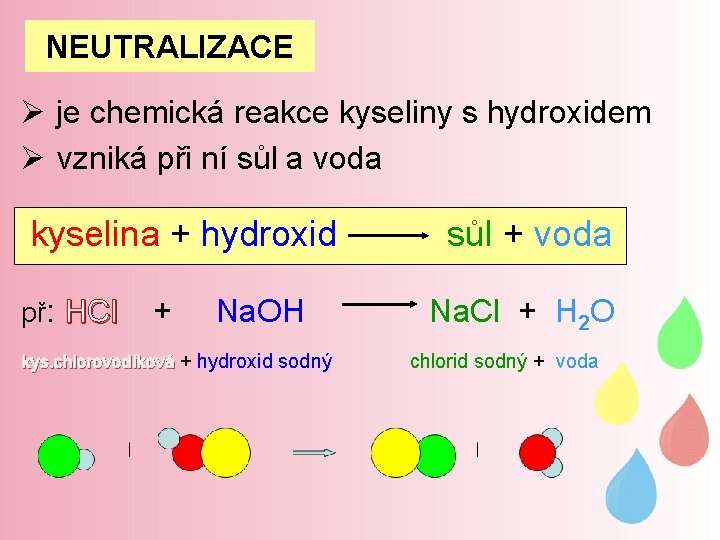
NEUTRALIZACE

NEUTRALIZACE Ø je chemická reakce kyseliny s hydroxidem Ø vzniká při ní sůl a voda kyselina + hydroxid př: HCl + Na. OH kys. chlorovodíková + hydroxid sodný sůl + voda Na. Cl + H 2 O chlorid sodný + voda

Vznik solí neutralizací

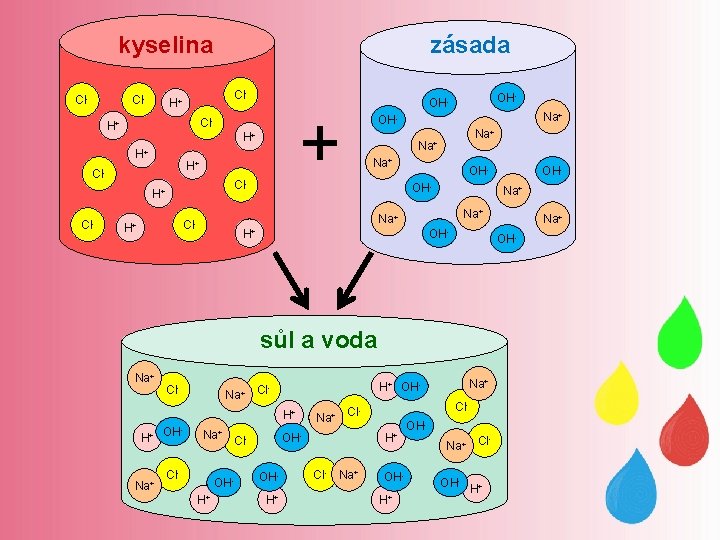
kyselina Cl- Cl- H+ H+ Na+ OHNa+ Na+ OHOHNa+ H+ OH- Cl- H+ H+ Na+ OH- Na+ Cl- OHH+ Na+ H+ Cl- Cl. H+ OHOH- Na+ H+ OH- Na+ Cl Cl- Na+ OHH+ Na+ OH- sůl a voda Na+ OHNa+ Cl- OH- + Cl- H+ Cl- zásada OHNa+ Cl OH- H+

• podstatou neutralizace je chemická reakce vodíkových kationtů s hydroxidovými anionty • v neutrálním roztoku je stejný počet kationtů H+ a aniontů OH • neutralizace je doprovázena změnou p. H původních látek, někdy bývá doprovázena i barevnými změnami • vzniklé produkty mají p. H neutrální

Využití neutralizace v praxi • příprava některých solí • poskytnutí první pomoci při poleptání kyselinou nebo hydroxidem • při úpravě odpadních vod nebo ekologických haváriích

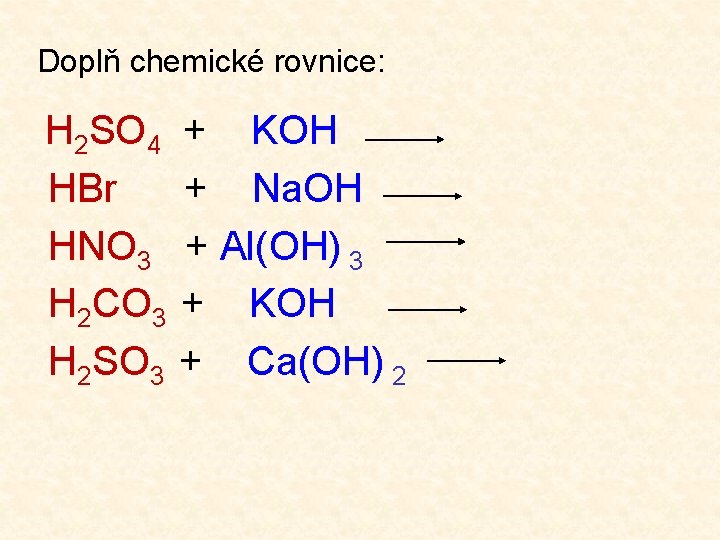
Doplň chemické rovnice: H 2 SO 4 HBr HNO 3 H 2 CO 3 H 2 SO 3 + KOH + Na. OH + Al(OH) 3 + KOH + Ca(OH) 2

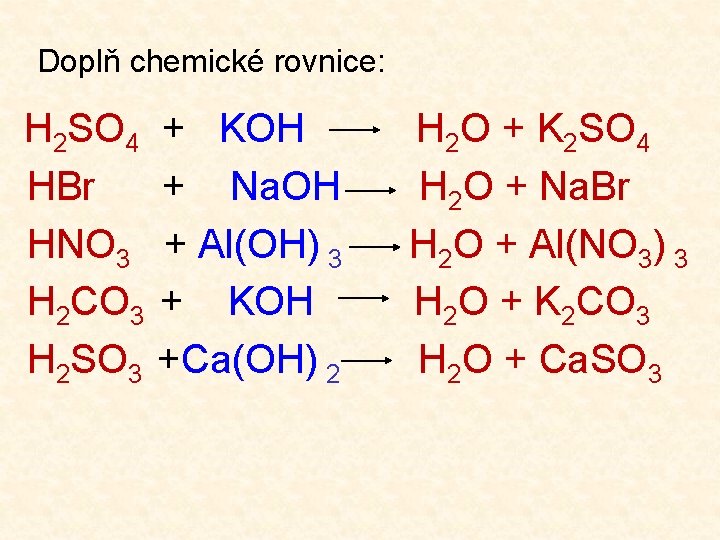
Doplň chemické rovnice: H 2 SO 4 HBr HNO 3 H 2 CO 3 H 2 SO 3 + KOH + Na. OH + Al(OH) 3 + KOH +Ca(OH) 2 H 2 O + K 2 SO 4 H 2 O + Na. Br H 2 O + Al(NO 3) 3 H 2 O + K 2 CO 3 H 2 O + Ca. SO 3

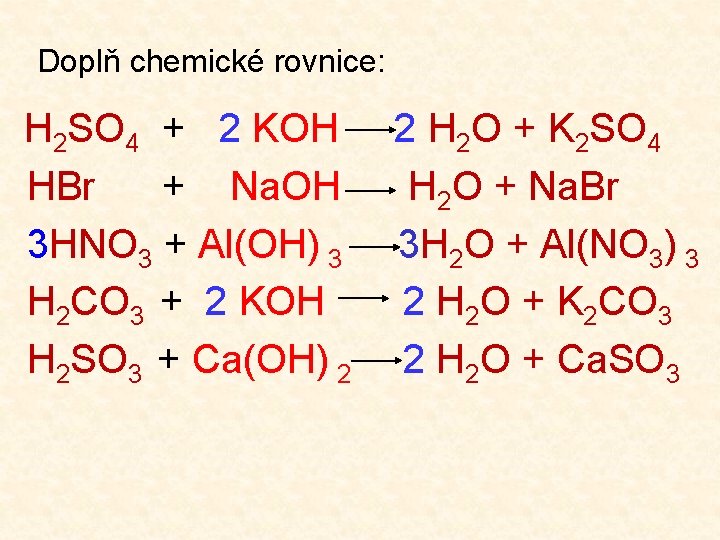
Doplň chemické rovnice: H 2 SO 4 + 2 KOH HBr + Na. OH 3 HNO 3 + Al(OH) 3 H 2 CO 3 + 2 KOH H 2 SO 3 + Ca(OH) 2 2 H 2 O + K 2 SO 4 H 2 O + Na. Br 3 H 2 O + Al(NO 3) 3 2 H 2 O + K 2 CO 3 2 H 2 O + Ca. SO 3

Víte, že … Včelí žihadlo obsahuje kyselinu. Ta může být neutralizována mýdlem, které patří mezi zásady. Zubní pasta je zásada, která neutralizuje kyseliny vznikající v ústech. Při bodnutí vosy je do těla oběti vypuštěna zásada. Můžete bodnutí neutralizovat octem.

ZÁSTUPCI • podle koncovky do skupin • dusičnany • fosforečnany • sírany • uhličitany • křemičitany

ZÁSTUPCI dusičnany 1. Dusičnan sodný– Na. NO 3 Čilský ledek, přírodní naleziště v Chile - hnojivo 2. Dusičnan draselný – KNO 3 Salnytr nebo sanytr (ledek draselný) - hnojivo, přísada do střelného prachu, do uzenin (červené maso)

ZÁSTUPCI dusičnany 3. Dusičnan amonný– NH 4 NO 3 (ledek amonný) - hnojivo 4. Dusičnan stříbrný – Ag. NO 3 Lápis - v kožním lékařství, výroba fotografických filmů a papírů Prášková forma

ZÁSTUPCI Fosforečnany (fosfáty) • Všechny základní se užívají jako fosforečná hnojiva Fosforečnan vápenatý

Minerály fosfáty Apatit Pyromorfit Tyrkys jiné fosfáty. . . vanadáty a arsenáty. . .

ZÁSTUPCI sírany 1. síran měďnatý – modrá skalice = pentahydrát síranu měďnatého Cu. SO 4. 5 H 2 O - k likvidaci plísní (postřiky) - do bazénů proti řasám

ZÁSTUPCI sírany 2. síran sodný, draselný - hnojiva

ZÁSTUPCI sírany 3. sádra Ca. SO 4. H 2 O - vzniká ze sádrovce Ca. SO 4. 2 H 2 O - pálením se sádrovec zbavuje vody - Sádra tvrdne působením vody (přijímá ji)!!! - Vždy se sype sádra do vody - Umíchá se řidší kašička - Užití = pojivo, výtvarný materiál

ZÁSTUPCI uhličitany 1. Uhličitan sodný – Na 2 CO 3 - soda, vyráběná v historii z popela - Ke změkčování vody, při výrobě skla

ZÁSTUPCI uhličitany 2. Hydrogenuhličitan sodný – Na. HCO 3 - Jedlá soda - K pečení perníků, v kuchyni

ZÁSTUPCI uhličitany 3. Uhličitan draselný – K 2 CO 3 - potaš - při výrobě skla 4. Uhličitan vápenatý – Ca. CO 3 - Vápenec - K výrobě páleného a hašeného vápna

ZÁSTUPCI uhličitany Výroba vápna: 1. Vápenec se zahřeje na vysokou teplotu 2. Rozloží se na Ca. O = pálené vápno a CO 2 = oxid uhličitý 3. Přidáním vody vzniká Ca(OH)2 = hašené vápno 4. Vápno + písek = malta Ca(OH)2 + CO 2 Ca. CO 3 + H 2 O

ZÁSTUPCI křemičitany • Obsažené v kaolínu, v hlíně a písku • Užívané pro výrobu keramiky a porcelánu

ZÁSTUPCI Chloridy Na. Cl – chlorid sodný – výroba hydroxidu sodného, potravinářský průmysl KCl – chlorid draselný – výroba hydroxidu draselného, draselné hnojivo NH 4 Cl – chlorid amonný – salmiak – náplň suchých článků – baterií, čištění povrchu kovů při pájení

TEST – otázka č. 1 která sůl se používá jako prostředek proti tzv. pálení žáhy (při překyselení žaludeční šťávy) a ke zmírnění bolestí při žaludečních vředech – zapiš správný chemický název a vzorec

odpověď – otázka č. 1 Na. HCO 3 – hydrogenuhličitan sodný – „užívací soda“ – součást prášků do pečiva, šumivých prášků pro přípravu nápojů

otázka č. 2 - Která sůl se používá ve stavebnictví k výrobě páleného vápna? - Napiš správný chemický název a vzorec, uveď také mineralogický název

odpověď – otázka č. 2 Uhličitan vápenatý Ca. CO 3 – v přírodě minerál vápenec (kalcit) a aragonit

otázka č. 3 Uveď název a vzorec soli zvané salmiak. K čemu se tato sůl používá?

odpověď – otázka č. 3 NH 4 Cl – chlorid amonný – salmiak – náplň suchých článků – baterií, čištění povrchu kovů při pájení

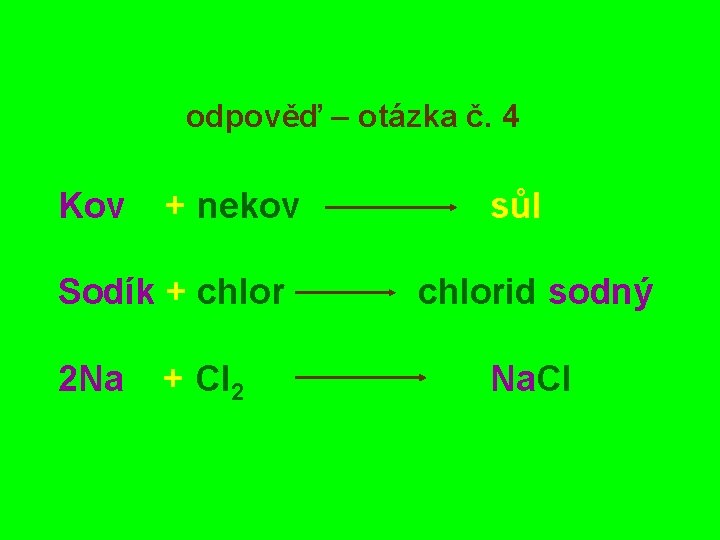
otázka č. 4 Zapiš chemickou rovnicí vznik choridu sodného přímým slučováním prvků - reakcí kovu s nekovem

odpověď – otázka č. 4 Kov + nekov Sodík + chlor 2 Na + Cl 2 sůl chlorid sodný Na. Cl