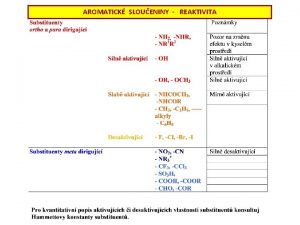
Soli Soli jsou iontov sloueniny vznikl neutralizan reakc



![Pufrační účinek • Nejvyšší pufrační kapacita dosažena v případě [kyselina] = [zásada], p. H Pufrační účinek • Nejvyšší pufrační kapacita dosažena v případě [kyselina] = [zásada], p. H](https://slidetodoc.com/presentation_image_h/7a25f17c7fa8e52e61ca26034713c1f2/image-5.jpg)






![Rozpouštěcí rovnováhy Ag. Cl (s) Ksp = [Ag+][Cl-] Mg. F 2 (s) Ag 2 Rozpouštěcí rovnováhy Ag. Cl (s) Ksp = [Ag+][Cl-] Mg. F 2 (s) Ag 2](https://slidetodoc.com/presentation_image_h/7a25f17c7fa8e52e61ca26034713c1f2/image-17.jpg)



- Slides: 21

Soli • Soli jsou iontové sloučeniny vzniklé neutralizační reakcí. – Např. Na. Cl je sůl vzniklá reakcí kyseliny HCl a zásady Na. OH. • Př. : Napište neutralizační reakce jejichž produktem jsou CH 3 COONa, Na. CN, NH 4 Cl, (NH 4)2 CO 3. • Soli jsou vzhledem k iontovému charakteru vazby často rozpustné ve vodě. • Vlastnosti soli závisí na síle kyseliny a zásady ze které sůl vznikla. - Např. některé rozpuštěné soli ovlivňují p. H roztoku.

p. H roztoků solí - hydrolýza • Soli silných kyselin a silných zásad p. H roztoku neovlivňují (např. Na. Cl, KCl, Li. Cl. O 4…) • Roztoky solí slabé kyseliny a silná zásady jsou (mírně) zásadité, roztoky solí silné kyseliny a slabé zásady jsou (mírně) kyselé. • Příčina: ionty slabé kyseliny/zásady podléhají hydrolýze A (aq) + H 2 O(l) HA(aq) + OH (aq) B+(aq) + H 2 O(l) BOH(aq) + H 3 O+(aq) • Př. : Odhadněte p. H roztoků CH 3 COONa, Na. CN, NH 4 Cl, N 2 H 5 Br. • U solí slabých kyselin a slabých zásad rozhoduje velikost Ka a Kb kyselé a zásadité části soli. • Př. : Odhadněte zda je roztok NH 4 CN spíše kyselý nebo zásaditý. Ka(HCN) = 4. 9 x 10 10, Kb(NH 4 OH) = 1. 8 x 10 5.

Efekt společného iontu • Rovnováhu v roztoku ovlivní přídavek některého z iontů, které se na rovnováze podílejí. • Př. : Na. Cl. O do roztoku HCl. O; do roztoku NH 3. • Ovlivnění plyne ze vztahu pro rovnovážnou konstantu: např. přídavkem Na. Cl. O do roztoku HCl. O dojde k potlačení disociace kyseliny a roztok bude méně kyselý než před přídavkem soli. HCl. O+ H 2 O H 3 O+ + Cl. O Na+ + Cl. O

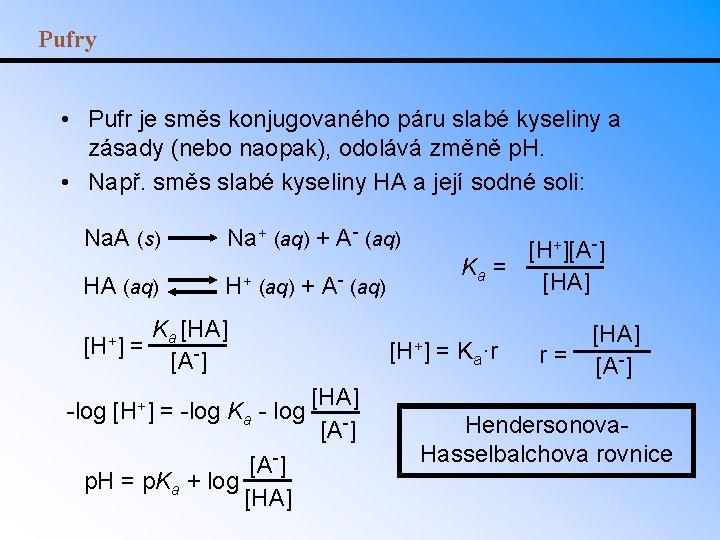
Pufry • Pufr je směs konjugovaného páru slabé kyseliny a zásady (nebo naopak), odolává změně p. H. • Např. směs slabé kyseliny HA a její sodné soli: Na. A (s) Na+ (aq) + A- (aq) HA (aq) H+ (aq) + A- (aq) [H+] Ka [HA] = [A-] -log [H+] = -log Ka - log [A-] p. H = p. Ka + log [HA] [H+][A-] Ka = [HA] [H+] [HA] [A-] = Ka·r r= [HA] [A-] Hendersonova. Hasselbalchova rovnice
![Pufrační účinek Nejvyšší pufrační kapacita dosažena v případě kyselina zásada p H Pufrační účinek • Nejvyšší pufrační kapacita dosažena v případě [kyselina] = [zásada], p. H](https://slidetodoc.com/presentation_image_h/7a25f17c7fa8e52e61ca26034713c1f2/image-5.jpg)
Pufrační účinek • Nejvyšší pufrační kapacita dosažena v případě [kyselina] = [zásada], p. H = p. Ka. • p. H v pufrační oblasti je úměrné podílu koncentrací konjugované kyseliny a zásady. • Jde o příklad efektu společného iontu (aniont soli potlačuje disociaci kyseliny). • Př. : ekvimolární směs CH 3 COOH a CH 3 COONa. Po přídavku silné kyseliny: H+ (aq) + CH 3 COO- (aq) CH 3 COOH (aq) Po přídavku silné zásady: OH- (aq) + CH 3 COOH (aq) CH 3 COO- (aq) + H 2 O (l)

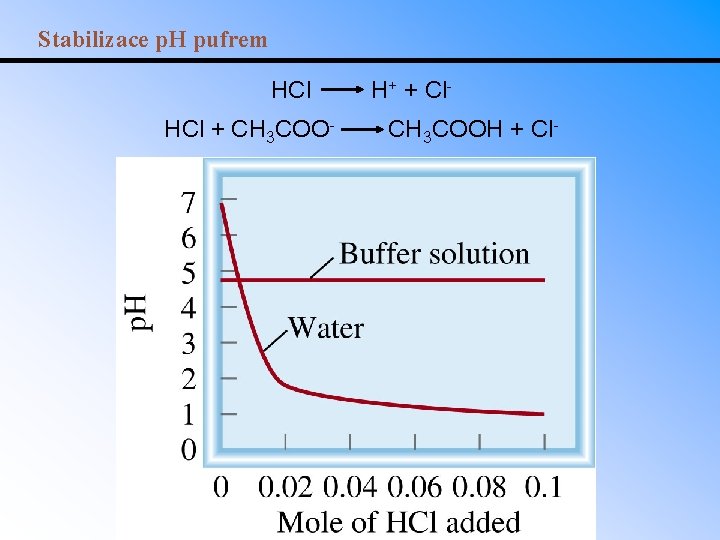
Stabilizace p. H pufrem HCl + CH 3 COO- H+ + Cl. CH 3 COOH + Cl-

Výpočty p. H v pufrech • Př. : Vypočítejte p. H roztoku který obsahuje Na 2 HPO 4 o koncentraci 0. 040 M a KH 2 PO 4 o koncentraci 0. 080 M. p. Ka 2=7. 20. • Př. : Určete podíl koncentrací kyseliny a její konjugované zásady v roztoku o p. H = 5. 45 a p. Ka = 5. 75. • Př. : Vypočítejte p. H roztoku, který obsahuje NH 3 o koncentraci 0. 100 M a NH 4 Cl o koncentraci 0. 150 M. • Př. : Určete p. H směsi vzniklé z 5. 00 ml 0. 100 M Na. OH a 10. 00 ml 0. 100 M HCl. O, je-li Ka = 3. 5 x 10 8. • Př. : Vypočítejte p. H 50. 00 ml fosfátového pufru, který obsahuje ekvimolární koncentrace (0. 200 M) kyseliny a soli, po přídavku 10. 00 ml 0. 100 M Na. OH nebo 10. 00 ml 0. 100 M HCl. p. Ka 2 = 7. 20

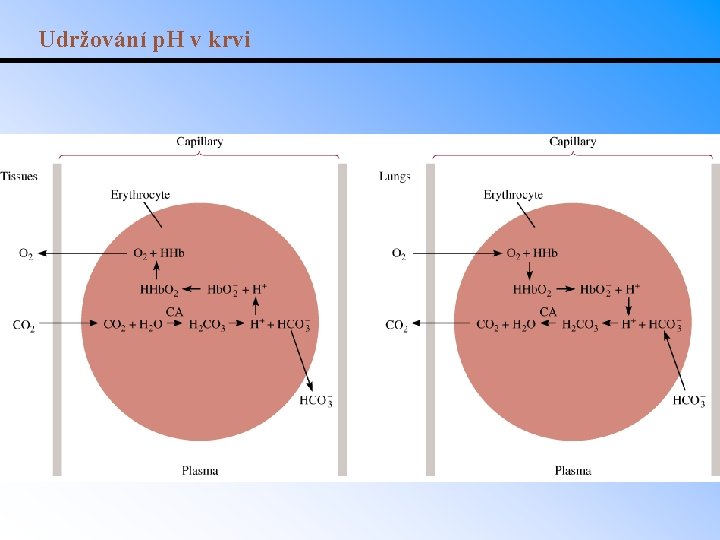
Udržování p. H v krvi

Neutralizace • • • Neutralizační reakce je reakce kyseliny a zásady za vzniku soli a vody. Rozsah neutralizační reakce je téměř kvantitativní, výjimka může nastat u neutralizace slabé kyseliny slabou zásadou. Př. : slabá kyselina se silnou zásadou: HCl. O + Na. OH Na. Cl. O + H 2 O K=? • Př. : slabá kyselina se slabou zásadou: • Př. : Určete rozsah neutralizační reakce dimethylaminu (Kb = 5. 4 x 10 4) s HF (Ka = 3. 5 x 10 4) nebo s HCl. O (Ka = 3. 5 x 10 8).

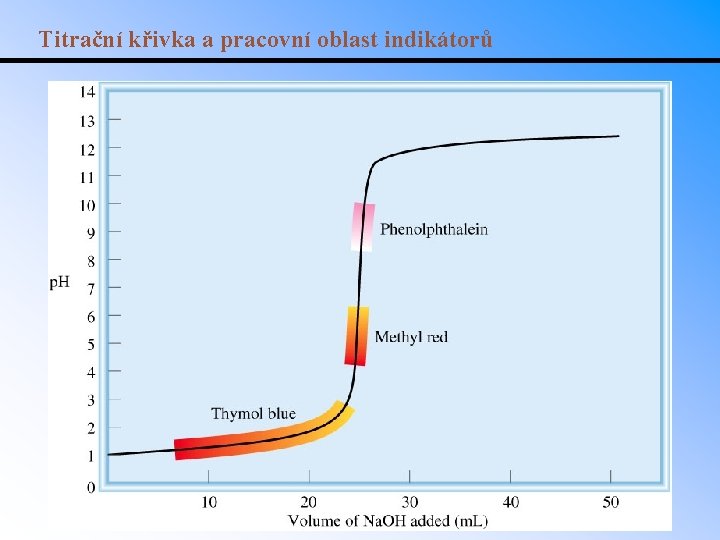
Titrace • Titrace je proces, využívající reakce spojené se změnou barvy nebo jiné veličiny k určení koncentrace jednoho z reaktantů. • Titrační křivka neutralizační titrace udává p. H jako funkci přidaného objemu kyseliny/zásady o známé koncentraci. • K prudké změně p. H dojde v okolí bodu ekvivalence. • Stanovením bodu ekvivalence lze zjistit koncentraci titrantu. • Př. : bod ekvivalence v 15. 00 ml roztoku kyseliny nastal po přídavku 25. 00 ml 0. 075 M Na. OH. Jaká je koncentrace (jednosytné) kyseliny?

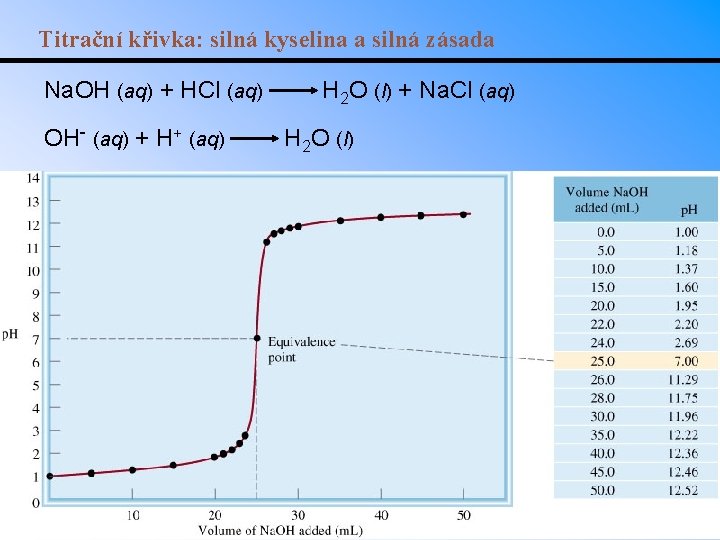
Titrační křivka: silná kyselina a silná zásada Na. OH (aq) + HCl (aq) OH- (aq) + H+ (aq) H 2 O (l) + Na. Cl (aq) H 2 O (l)

Titrace silné kyseliny silnou zásadou • Zásada postupně neutralizuje kyselinu a p. H se zvyšuje. nb = moly přidané zásady na, r = moly zbývající kyseliny, n. H 3 O+ = na, r = na nb = Ca. Va Cb. Vb • Platí až do bodu ekvivalence, který je v tomto případě kolem p. H = 7. • Za bodem ekvivalence je p. H určeno pouze přebytečným množstvím zásady. • Př. : Určete p. H roztoku 10. 0 ml 0. 100 M HCl po přídavku 5. 00, 10. 0 a 15. 0 ml 0. 100 M Na. OH.

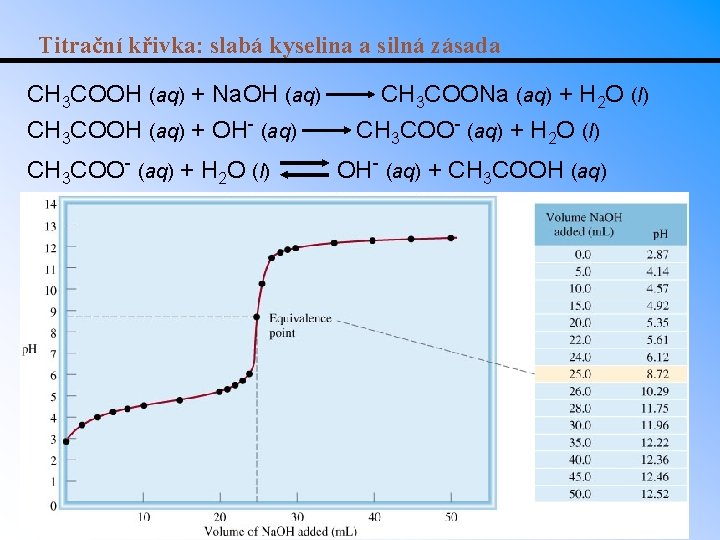
Titrace slabé kyseliny silnou zásadou • Zásada postupně neutralizuje kyselinu a p. H se zvyšuje. nb = moly přidané zásady n. HA = moly zbývající kyseliny n. HA = CHAVHA Cb. Vb n. A = nb = Cb. Vb • Platí do bodu ekvivalence, kterým je p. H soli slabé kyseliny se silnou zásadou. • Za bodem ekvivalence je p. H určeno pouze přebytečným množstvím zásady. • Př. : Určete p. H roztoku 10. 0 ml 0. 100 M kyseliny octové po přídavku 5. 00, 10. 0 a 15. 0 ml 0. 100 M Na. OH. Ka = 1. 75 x 10 5.

Titrační křivka: slabá kyselina a silná zásada CH 3 COOH (aq) + Na. OH (aq) CH 3 COOH (aq) + OH- (aq) CH 3 COO- (aq) + H 2 O (l) CH 3 COONa (aq) + H 2 O (l) CH 3 COO- (aq) + H 2 O (l) OH- (aq) + CH 3 COOH (aq)

Výběr vhodného indikátoru Př. : Jaký indikátor je vhodný k titraci HNO 2 odměrným roztokem KOH? - Slabá kyselina titrovaná silnou zásadou. - V bodě ekvivalence bude konjugovaná báze slabé kyseliny, očekávané p. H > 7.

Titrační křivka a pracovní oblast indikátorů
![Rozpouštěcí rovnováhy Ag Cl s Ksp AgCl Mg F 2 s Ag 2 Rozpouštěcí rovnováhy Ag. Cl (s) Ksp = [Ag+][Cl-] Mg. F 2 (s) Ag 2](https://slidetodoc.com/presentation_image_h/7a25f17c7fa8e52e61ca26034713c1f2/image-17.jpg)
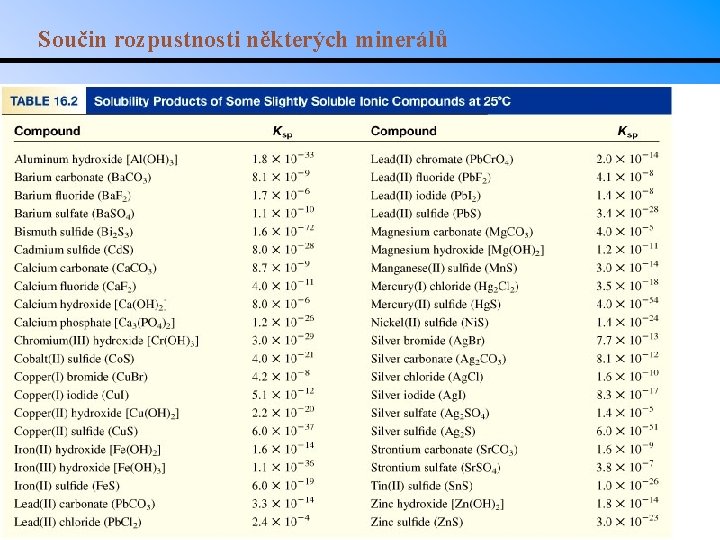
Rozpouštěcí rovnováhy Ag. Cl (s) Ksp = [Ag+][Cl-] Mg. F 2 (s) Ag 2 CO 3 (s) Ca 3(PO 4)2 (s) Ag+ (aq) + Cl- (aq) Ksp je součin rozpustnosti Mg 2+ (aq) + 2 F- (aq) 2 Ag+ (aq) + CO 32 - (aq) 3 Ca 2+ (aq) + 2 PO 43 - (aq) Rozpouštění iontových látek ve vodě: Q < Ksp Nenasycený roztok Q = Ksp Nasycený roztok Q > Ksp Přesycený roztok Ksp = [Mg 2+][F-]2 Ksp = [Ag+]2[CO 32 -] Ksp = [Ca 2+]3[PO 43 -]2

Součin rozpustnosti některých minerálů

Výpočet rozpustnosti Př. : Jaká je rozpustnost Ag. Cl v g/l ? Ag. Cl (s) počátek (M) rovnováha (M) Ag+ (aq) + Cl- (aq) 0. 00 s [Ag+] = 1. 3 x 10 -5 M 0. 00 Ksp = 1. 6 x 10 -10 Ksp = [Ag+][Cl-] = s 2 s s = Ksp = 1. 3 x 10 -5 [Cl-] = 1. 3 x 10 -5 M 1. 3 x 10 -5 mol Ag. Cl 143. 35 g Ag. Cl rozpustnost Ag. Cl = x = 1. 9 x 10 -3 g/L 1 mol Ag. Cl 1 l roztoku

Vliv společného iontu na rozpustnost • Přídavek společného iontu snižuje rozpustnost soli. • Př. : Jaká je molární rozpustnost Ag. Br (a) v čisté vodě; (b) v 0. 0010 M roztoku Na. Br? Na. Br (s) Na+ (aq) + Br- (aq) Ag. Br (s) Ag+ (aq) + Br- (aq) [Br-] = 0. 0010 M Ksp = 7. 7 x 10 -13 Ag. Br (s) Ag+ (aq) + Br- (aq) s 2 = Ksp [Ag+] = s s = 8. 8 x 10 -7 [Br-] = 0. 0010 + s 0. 0010 Ksp = 0. 0010 x s s = 7. 7 x 10 -10

Tvorba vaječné skořápky CO 2 (g) + H 2 O (l) H 2 CO 3 (aq) H+ (aq) + HCO 3 - (aq) H+ (aq) + CO 32 - (aq) Ca 2+ (aq) + CO 32 - (aq) Ca. CO 3 (s)
 Reakc
Reakc Co jsou to soli
Co jsou to soli Poetismus literatura
Poetismus literatura Jak vznikl název krásnoočko
Jak vznikl název krásnoočko Zaključak kristalizacije soli
Zaključak kristalizacije soli Vzorce kyselin
Vzorce kyselin Co jsou halogenidy
Co jsou halogenidy Jakou látkou jsou obaleny spojovací vodiče
Jakou látkou jsou obaleny spojovací vodiče Dvojslabičné předložky
Dvojslabičné předložky 1
1 Cukerná jednotka
Cukerná jednotka Co jsou to alkany
Co jsou to alkany Dokonavá slovesa
Dokonavá slovesa Nerosty jsou neústrojné stejnorodé horniny
Nerosty jsou neústrojné stejnorodé horniny Nabodeníčko krátké a dlouhé
Nabodeníčko krátké a dlouhé Klatovy jsou proslulé pěstování růží
Klatovy jsou proslulé pěstování růží Vid dokonavý a nedokonavý prezentace
Vid dokonavý a nedokonavý prezentace Inovace jsou in testy
Inovace jsou in testy Sousední strany čtverce
Sousední strany čtverce Co jsou to sulfidy
Co jsou to sulfidy Podobnost trojúhelníků
Podobnost trojúhelníků Příslovečná spřežka
Příslovečná spřežka