Soli Nzvoslov vznik a pouit sol hydrogensoli a


























- Slides: 29

Soli Názvosloví, vznik a použití solí, hydrogensoli a hydráty solí, hnojiva, použití solí ve stavebnictví Dostupné z Metodického portálu www. rvp. cz, ISSN: 1802 -4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze.

Definice solí n Sůl je sloučenina, složená z kationtu kovu, + případně kationtu amonného NH 4 a aniontu kyseliny.

Příklady solí Chlorid sodný – kuchyňská sůl Na. Cl n Dusičnan sodný - Chilský ledek Na. NO 3 n Pentahydrát síranu měďnatého – skalice modrá Cu. SO 4. 5 H 2 O n Hydrogenuhličitan sodný – jedlá soda Na. HCO 3 n

Rozdělení solí Soli můžeme dělit podle různých hledisek, např. : Podle rozpustnosti ve vodě n Podle kyseliny, od které se odvozují n Podle jiných hledisek n

Rozdělení solí podle rozpustnosti ve vodě Soli rozpustné ve vodě – např. halogenidy, většina ostatních solí n Soli nerozpustné ve vodě – např. uhličitan vápenatý, barnaté soli, dusičnan stříbrný n

Rozdělení solí podle kyselin, od kterých jsou odvozeny Halogenidy – fluoridy, chloridy, bromidy, jodidy (soli kyseliny fluorovodíkové…) n Sulfidy (soli kyseliny sirovodíkové) n Sírany (soli kyseliny sírové) n Siřičitany (soli kyseliny siřičité) n Uhličitany (soli kyseliny uhličité) n Dusičnany (soli kyseliny dusičné) n …………. . n

Jiné rozdělení solí – např. : Normální soli n Kyselé soli - hydrogensoli n Hydráty solí n Podle použití: n soli používané ve stavebnictví n v potravinářství n v zemědělství – hnojiva

Názvosloví solí bezkyslíkatých kyselin – jako názvosloví dvouprvkových sloučenin n Podstatné jméno Odvozeno od názvu prvku na druhém místě ve vzorci + koncovka –id n Přídavné jméno Název kationtu s koncovkou podle oxidačního čísla I Např. : -I K Cl Cl sůl kys. chlorovodíkové - chlorid -I chlorid draselný

Názvosloví solí kyslíkatých kyselin n Podstatné jméno Odvozeno od názvu kyseliny (aniontu) + koncovka –an n Přídavné jméno Název kationtu s koncovkou podle oxidačního čísla Např. : I V KN O -II -I 3 V N sůl kyseliny dusičné – dusičnan V N O -II –I 3 dusičnan draselný dusičnanový anion

Názvosloví hydrogensolí Tvoří se zařazením slova hydrogen- před podstatné jméno názvu soli n Počet atomů vodíku vázaných v aniontu hydrogensoli označujeme číslovkou: mono (pro 1 – zpravidla se neuvádí), di (2), tri (3) … V n Např. : Na. H 2 P O 4 dihydrogenfosforečnan sodný n

Hydráty solí n n n Některé soli vytvářejí krystaly, ve kterých jsou vázány molekuly vody. Takové soli se nazývají hydráty. Počet molekul vody v hydrátu se vyznačuje číslovkou. Např. : dihydrát síranu vápenatého Ca. SO 4. 2 H 2 O 1 – mono 6 - hexa 2 – di 7 - hepta 3 – tri 8 - okta 4 – tetra 9 - nona 5 – penta 10 - deka

Vznik solí Soli mohou vznikat různými chemickými reakcemi, např. : n Neutralizací n Reakcí kovu s nekovem n Reakcí kovu s kyselinou n Reakcí kyselinotvorného oxidu s hydroxidem n Reakcí hydroxidotvorného oxidu s kyselinou n Srážecí reakcí n …………

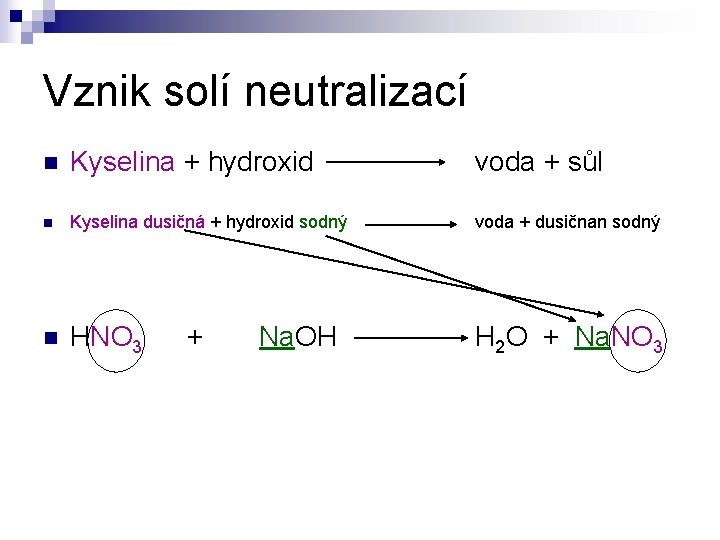
Vznik solí neutralizací n Kyselina + hydroxid voda + sůl n Kyselina dusičná + hydroxid sodný voda + dusičnan sodný n HNO 3 H 2 O + Na. NO 3 + Na. OH

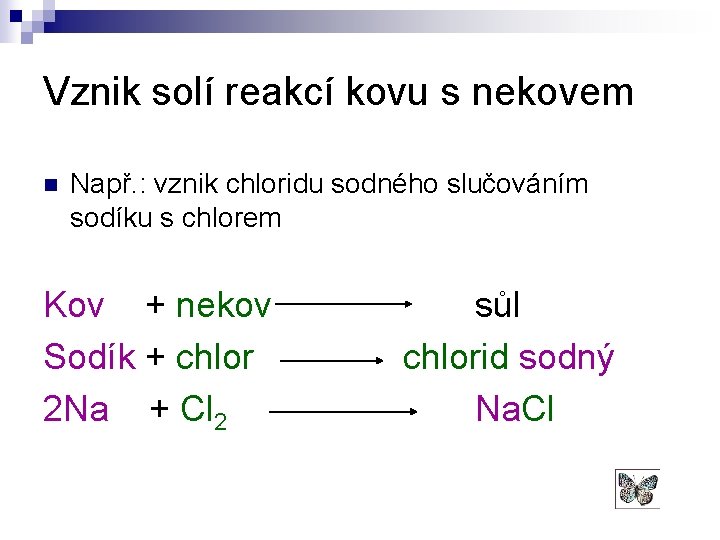
Vznik solí reakcí kovu s nekovem n Např. : vznik chloridu sodného slučováním sodíku s chlorem Kov + nekov Sodík + chlor 2 Na + Cl 2 sůl chlorid sodný Na. Cl

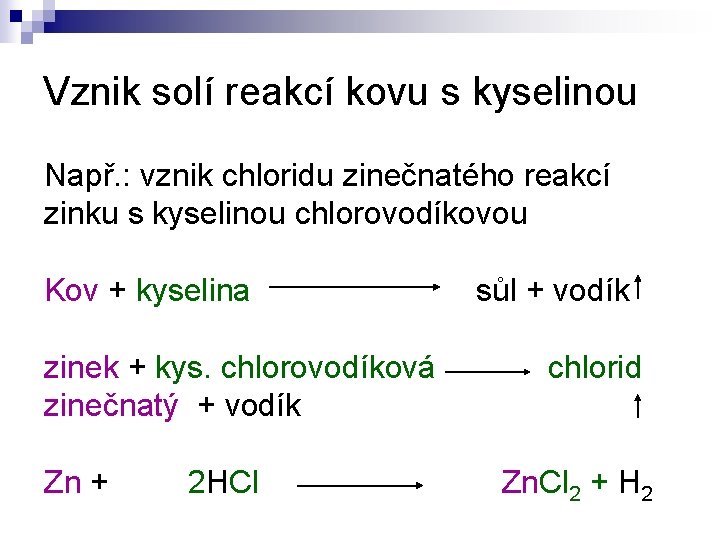
Vznik solí reakcí kovu s kyselinou Např. : vznik chloridu zinečnatého reakcí zinku s kyselinou chlorovodíkovou Kov + kyselina zinek + kys. chlorovodíková zinečnatý + vodík Zn + 2 HCl sůl + vodík chlorid Zn. Cl 2 + H 2

Použití solí V zemědělství – dusičnany, draselné soli a fosforečnany n Ve stavebnictví, sochařství – vápenaté soli n Výroba keramiky a porcelánu n Výroba pracích a čistících prostředků n V potravinářském průmyslu n Výroba chemických látek n

Dusičnany n n n Průmyslová hnojiva: Na. NO 3 dusičnan sodný (ledek sodný, chilský ledek) KNO 3 dusičnan draselný (ledek draselný) NH 4 NO 3 dusičnan amonný (ledek amonný) Lápis - Ag. NO 3 (dusičnan stříbrný) v kožním lékařství, výroba fotografických filmů a papírů

Sírany Síran vápenatý - nerost anhydrid (Ca. SO 4) a sádrovec (Ca. SO 4. 2 H 2 O) - výroba sádry (Ca. SO 4. 1/2 H 2 O) pro stavebnictví, sochařství a štukatérství n Skalice modrá – pentahydrát síranu měďnatého (Cu. SO 4. 5 H 2 O) – poměďování, k impregnaci dřeva proti hnilobě a k postřikům rostlin proti houbám a jiným škůdcům n

Uhličitany Uhličitan vápenatý Ca. CO 3 – v přírodě minerál vápenec (kalcit) a aragonit. Použití: n výroba páleného vápna, n stavební a sochařský kámen, n ozdobný kámen k obkladům budov (leštěný - mramor), n přísada při výrobě železa a cementu, n vápenaté průmyslové hnojivo n

Uhličitany Na 2 CO 3 – uhličitan sodný - výroba skla, mýdla, změkčování vody v prádelnách, papírnách, domácnostech (soda, krystalová soda Na 2 CO 3. 10 H 2 O) n K 2 CO 3 – uhličitan draselný - výroba skla a mazlavých mýdel n Na. HCO 3 – hydrogenuhličitan sodný – „užívací soda“ – součást prášků do pečiva, šumivých prášků pro přípravu nápojů n

Chloridy Na. Cl – chlorid sodný – výroba hydroxidu sodného, potravinářský průmysl n KCl – chlorid draselný – výroba hydroxidu draselného, draselné hnojivo n NH 4 Cl – chlorid amonný – salmiak – náplň suchých článků – baterií, čištění povrchu kovů při pájení n

Fosforečnany a křemičitany n Fosforečnany – fosforečná hnojiva (např. superfosfát), výroba fosforu a jeho sloučenin n Křemičitany - horninotvorné látky, např. živce, slídy – výroba stavebních materiálů a keramiky

Test na závěr Připravte se n Odpovídejte na následující otázky n

TEST – otázka č. 1 n která sůl se používá jako prostředek proti tzv. pálení žáhy (při překyselení žaludeční šťávy) a ke zmírnění bolestí při žaludečních vředech – zapiš správný chemický název a vzorec n odpověď

TEST – otázka č. 2 Která sůl se používá ve stavebnictví k výrobě páleného vápna? n Napiš správný chemický název a vzorec, uveď také mineralogický název n n odpověď

TEST – otázka č. 3 n Uveď název a vzorec soli zvané salmiak. K čemu se tato sůl používá? n odpověď

TEST – otázka č. 4 n Zapiš chemickou rovnicí vznik choridu sodného přímým slučováním prvků reakcí kovu s nekovem n odpověď

Hodnocení testu 1 za všechny odpovědi správně n 2 za jednu chybnou odpověď n 3 za dvě chybné odpovědi n 4 za tři chybné odpovědi n 5 pokud jsi žádnou z otázek nezodpověděl správně n

Použité zdroje: Čerpáno z: n Beneš, P. – Pumpr, V. – Banýr, J. : Základy chemie 1. díl pro 2. stupeň základní školy, nižší ročníky víceletých gymnázií a střední školy. 2. vydání. Nakladatelství Fortuna, 1996. ISBN 80 -7168 -234 -8. n www. wikipedia. cz
 Kristalizacija
Kristalizacija Hydrogensolí procvičování
Hydrogensolí procvičování Hydrogensoli priklady
Hydrogensoli priklady Contoh koloid liofil
Contoh koloid liofil Vznik poloacetalu
Vznik poloacetalu Vznik uhlí
Vznik uhlí Vznik krápníků rovnice
Vznik krápníků rovnice Vznik manufaktur
Vznik manufaktur Gotika vznik
Gotika vznik Vznik futbalu
Vznik futbalu Franská ríša mapa
Franská ríša mapa Naturalismus vznik
Naturalismus vznik Tvorenie slov skracovaním
Tvorenie slov skracovaním Vznik hor
Vznik hor Formy penazi
Formy penazi Alžbetínske divadlo znaky
Alžbetínske divadlo znaky Nacismus vznik
Nacismus vznik Odvodzovaním
Odvodzovaním Vznik jazzu
Vznik jazzu Vznik jednosmerneho prudu
Vznik jednosmerneho prudu Hinduizmus vznik
Hinduizmus vznik Csr vznik
Csr vznik Hinduizmus symboly
Hinduizmus symboly Volejbal vznik
Volejbal vznik Vznik uhlí
Vznik uhlí Scénické poznámky
Scénické poznámky Amoniak vzorec
Amoniak vzorec Vznik eu
Vznik eu Rysy klasicismu
Rysy klasicismu Judaismus vznik
Judaismus vznik