Sminaire sur les Politiques Pharmaceutiques OMS Genve 09






























- Slides: 33

Séminaire sur les Politiques Pharmaceutiques OMS, Genève, 09 au 13 mai 2016 Harmonisation des réglementations pharmaceutiques et cas particulier de l’harmonisation en Afrique Sub-saharienne Jean-Baptiste Nikiéma, OMS/AFRO

Glossaire l AMM : Autorisation de mise sur le marché l ANRP : Autorité nationale de réglementation pharmaceutique (en charge de l'application de la réglementation pharmaceutique) l BPF : Bonnes pratiques de fabrication l CTD : Dossier technique commun (Format commun de présentation des données en vue de l'obtention de l'AMM) l ICH : Conférence Internationale sur l'harmonisation l OMS : Organisation mondiale de la Santé 2| Harmonisation , TBS 2016

Pourquoi réglementer les médicaments ? 1 • Les consommateurs ne sont pas en mesure de décider de quand utiliser un médicament, quel médicament utiliser, comment l’utiliser, peser les avantages potentiels/aux risques • Même les professionnels de santé (médecins, pharmaciens) ont parfois des difficultés à prendre des décisions éclairées, sauf s’ils ont reçu une formation spécialisée “…médicaments sont des biens publics et pas simplement des produits quelconques: d'abord pour leur valeur sociale élevée, et ensuite parce que les consommateurs et les prescripteurs sont incapables d'évaluer leur qualité, sécurité et efficacité. ” Dr Gro Harlem Brundtland, Ancienne Directrice Générale de l’OMS 3| Harmonisation , TBS 2016

Pourquoi réglementer les médicaments ? 2 • Leur production, distribution et dispensation nécessitent des connaissances et des compétences particulières • La formation de base des médecins et des pharmaciens est insuffisante pour évaluer la qualité, la sécurité et l'efficacité des médicaments • L'utilisation de médicaments inefficaces ou de mauvaise qualité peut entraîner un échec thérapeutique, l'exacerbation de la maladie, la résistance aux traitements voir la mort; ce qui sape la confiance dans les systèmes de santé en général et les professionnels de la santé en particulier 4| Harmonisation , TBS 2016

5| Harmonisation , TBS 2016

Comment assurer la qualité, la sécurité et l’efficacité des médicaments en toute circonstance ? 6| - Harmonisation , TBS 2016 6

Introduction sur l'harmonisation L'harmonisation au sens large peut se traduire par l'harmonisation des exigences techniques dans le cadre de l'application de la réglementation pharmaceutique, i. e. , législation, réglementation, lignes directrices, procédures, etc. Ces exigences peuvent se décliner en fonction des domaines envisagées. On parle d'exigences relatives à la qualité, la sécurité et l'efficacité dans le cadre de l'homologation d'un produit pharmaceutique. Ces exigences peuvent différées dans leurs complexités en fonction du type de produit ou du type d'établissement (ex: homologation d'un médicament innovant vs. médicament multisource). Traduction de WHO Drug Information Vol 22, No. 3, 2008 7| Harmonisation , TBS 2016

Introduction sur l'harmonisation l Objectifs intermédiaires – Exigences communes => Robustesse des "Intrants" (Exigences) • Communauté de langage et échanges d'informations facilités – Pratiques communes => Robustesse des procédés • Procédures opérationnelles standardisées • Compétences nécessaires fournies et mises à jour Si les intrants sont identiques et les procédés équivalents, on peut envisager que les Données de sortie seront équivalentes, ce qui permet d'évoluer vers les objectifs primaires l Objectifs primaires – Reconnaissance des "Résultats" des processus réglementaires • Reconnaissance des rapports d'inspection, d'évaluation ou de vigilance • Reconnaissance des décisions d'AMM, d'autorisation des établissements de fabrication ou de centre de recherche clinique 8| Harmonisation , TBS 2016

Introduction sur l'harmonisation l En théorie, il s'agit donc d'harmoniser les cadres suivants: – Cadre légal définissant les grandes obligations et les interdictions: la détention d'une AMM, l'obligation d'informer l'autorité de ses modifications, les pouvoirs de suspension et de retrait, les sanctions • Y compris le cadre dérogatoire (les exceptions qui dérogent à la règle…. ) – Cadre réglementaire définissant les modalités pratiques (la nécessité de déposer un dossier, le passage en commission, la procédure à suivre, …) – Cadre technique : lignes directrices applicables (ex: stabilité) déclinant les obligations – Cadre administratif : procédure à suivre (nombre d'exemplaire, présentations des données, délais…) 9| Harmonisation , TBS 2016

Introduction sur l'harmonisation l En pratique, l'harmonisation recouvre des domaines plus nombreux et souvent bien moins maîtrisés tels que – L'application ou la mise en œuvre de ces exigences • Les procédures opérationnelles nécessaires sont rarement mises en place au sein des autorités et/ou leur application peut s'avérer variable. – L'interprétation de ses exigences est souvent variable • En fonction des compétences et de l'expérience des personnes travaillant au sein de l'autorité • En raison une absence de mode de gestion de la "doctrine" au sein des autorités. La doctrine étant considéré comme l'ensemble des microdécisions d'interprétation de l'ANRP prise au niveau individuel ou parfois institutionnel. 10 | Harmonisation , TBS 2016

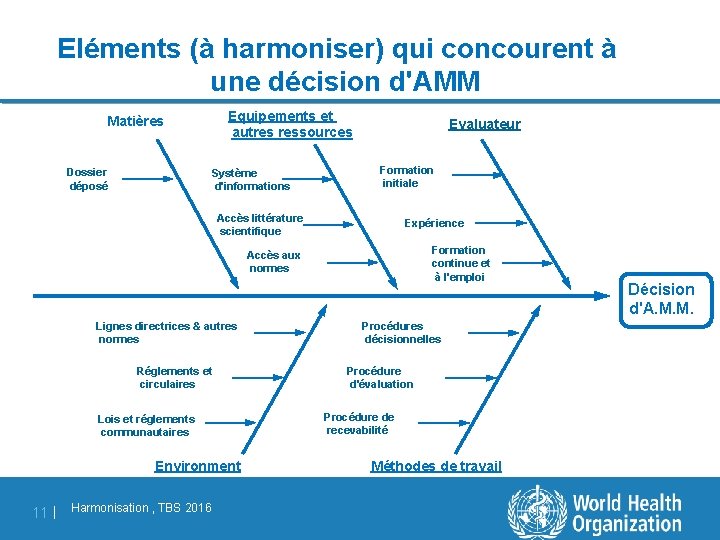
Eléments (à harmoniser) qui concourent à une décision d'AMM Equipements et autres ressources Matières Dossier déposé Système d'informations Evaluateur Formation initiale Accès littérature scientifique Expérience Formation continue et à l'emploi Accès aux normes Lignes directrices & autres normes Réglements et circulaires Lois et réglements communautaires Environment 11 | Harmonisation , TBS 2016 Procédures décisionnelles Procédure d'évaluation Procédure de recevabilité Méthodes de travail Décision d'A. M. M.

Introduction sur l'harmonisation l Résultats obtenus – Limiter la duplication des activités (études cliniques, études sur animaux (toxico), inspections, … – Gain de temps (industrie et autorité) – Gain d'argent – Accélération des processus décisionnel par la reconnaissance mutuelle – Décision plus rapide notamment des autorisations de mise sur le marché (AMM) – Accès amélioré pour les patients aux avancées thérapeutiques 12 | Harmonisation , TBS 2016

Initiatives d'harmonisation l Internationale / Globale / Supra-régionale – Organisation Mondiale de la Santé – Conférence Internationale d'Harmonisation - ICH – Schéma de Coopération des Inspections pharmaceutiques (Pl. C/S) – Conseil des organisations internationale en sciences médicales (CIOMS) l Régionale (au sens OMS) / Continentale – Pan American Drug Harmonization (Harmonisation pan-américaine) – Nouveau Partenariat Développement en Afrique (NEPAD) l Sous-régionales (UEMOA, CEMAC, …) l Bilatérales 13 | Harmonisation , TBS 2016

Initiatives d'harmonisation globale l Organisation Mondiale de la Santé (comité et pharmacopée) – Légitimité internationale – Représentation très large des Etats – Domaine d'intervention très varié • Législation, Organisation • Homologation • Pharmacovigilance • Fabrication et Distribution • Contrôle de la qualité (Organisation et 14 | monographies) – > 90 publications durant les 18 dernières années Harmonisation , TBS 2016

Initiatives d'harmonisation globale l ICH – Légitimité ? ? – Représentation limitée (USA, UE et Japon + Obs. ) – Domaine d'intervention restrient • Homologation (Format et contenu technique) • Pharmacovigilance (organisation) – Plus de 50 lignes directrices sur les exigences techniques (Qualité, sécurité et efficacité) – Au début nouvelle entité > générique 15 | Harmonisation , TBS 2016

Initiatives d'harmonisation globale l PICS – Représentation large (+/- OCDE) – Domaine d'intervention spécialisé • BPF (médicament humain, sang) et bientôt BPD ? • Dossier etablissement • Référentiel et guide d'inspection • Organisation des systèmes d'inspection 16 | Harmonisation , TBS 2016

Initiatives d'harmonisation globale l CIOMS – Représentation large des sociétés savantes int. – Domaine d'intervention spécialisé • Ethique et investigations sur l'homme • Pharmacovigilance • Nomenclature internationale des maladies 17 | Harmonisation , TBS 2016

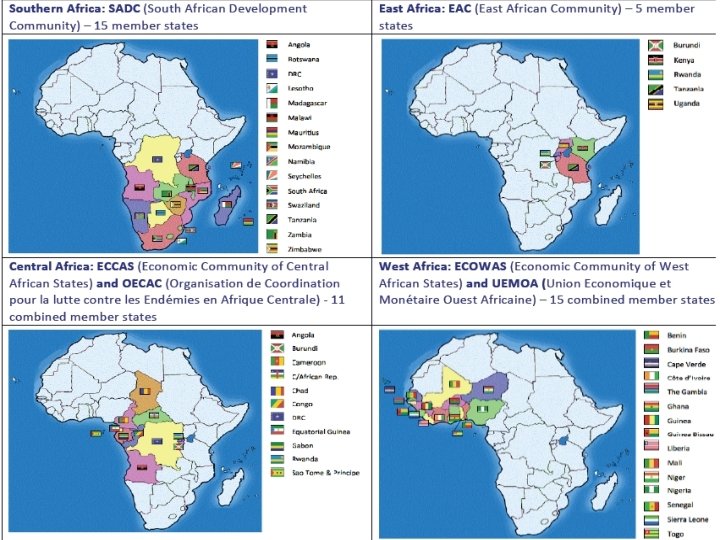
Initiatives d'harmonisation Sous-Régionales l Quelques exemples – Afrique • CEDEAO / UEMOA • ECCAS / CEMAC-OCEAC • SADC • EAC – Asie : ASEAN – Europe : UE, EDQM – Amérique • ANDEAN, • MERCOSUR 18 | Harmonisation , TBS 2016

Initiatives d'harmonisation Sous-Régionales l Légitimité : base d'accord économique, monétaire ou de libre échange l Représentation limitée aux pays membres l Domaine d'intervention large – Toutes les fonctions de réglementation – Pas spécifique du médicament humain l Nombre de publication varié / fonction des moyens des blocs 19 | Harmonisation , TBS 2016

Résumé : Initiatives d'harmonisation l Processus d'harmonisation de type "Fournisseur" – Acteurs globaux (ICH, OMS, …) – Domaine spécialisé (scientifique, technique) – Intégrant continuellement l'évolution l'état de l'art Nécessité d'un processus d'appropriation l Processus d'harmonisation de type "Utilisateur" – Acteurs sous-régionaux (Blocs sous-régionaux) – Domaine + large (réglementaire, organisationnel, …) – Adaptant (si nécessaire) les normes globales 20 | Harmonisation , TBS 2016

La situation en Afrique l Continent l Nombreux pays l Langues différentes l Cultures diverses 21 | Harmonisation , TBS 2016

22 | Harmonisation , TBS 2016

Les processus d'harmonisation des CER Africaines REC UEMOA Documents de politique Législation et réglementation Règlement relatif a l'harmonisation de la réglementation pharmaceutique dans les états membres de l'UEMOA Règlement relatif aux procédures d’homologation des médicaments à usage humain dans les Etats membres de l’UEMOA Décisions portant adoption du Guide de Bonnes Pratiques de fabrication, de distribution et d’importation des produits pharmaceutiques à usage humain dans les Etats membres de l’UEMOA Décision portant adoption de lignes directives pour le contrôle de la publicité et de l’information sur les médicaments 23 | Harmonisation , TBS 2016 Lignes directrices

Les processus d'harmonisation des CER Africaines REC Documents de politique Législation et réglementation OCEAC Politique pharmaceutique commune Référentiel d'Harmonisation des Procédures d'Homologation des Médicaments à usage humain Lignes directrices sur l'approvisionnement en médicament essentiels Lignes directrices sur la pharmacovigilance Manuel de procédures d'inspection pharmaceutique 24 | Harmonisation , TBS 2016 Lignes directrices

Les processus d'harmonisation des CER Africaines REC Documents de politique SADC Plan stratégique de développement 25 | Harmonisation , TBS 2016 Législation et réglementation Lignes directrices • Format et procédure des demandes • Stabilité • Bioéquivalence (BA/BE) • BPF • Essais Cliniques sur humain • Autorisations Export/Import • Validation (Analytique and Procédés) • Promotion et Publicité • Donations • Autorisations des Pharmacies et des distributeurs • Surveillance du marché • Rappels et retraits

Les processus d'harmonisation des CER Africaines REC Documents de politique EAC 26 | Harmonisation , TBS 2016 Législation et réglementation Lignes directrices Draft Protocol on the establishment of the East African Medicines and Food Safety Commission (EAMFSC) (voir diapositive suivante)

Les processus d'harmonisation des CER Africaines REC EAC Domaine Homologation Lignes directrices Dossier de demande de mise sur le marché Information sur le produit (étiquetage, notice, Résumé des caractéristiques du produit) Interchangeabilité (BE/BA), choix du comparateur, Essai de dissolution comparative, Liste des produits de référence Stabilité EAC Bonnes Pratiques de fabrication BPF + annexes (validation, stérilisation) EAC Système qualité Exigences pour les systèmes qualités des ANRP Guide d'application des exigences qualité Manuel qualité (standardisé) Procédures générales harmonisées (maitrise de la documentation, non -conformités, audit, CAPA) EAC 27 | Systèmes informatiques Harmonisation , TBS 2016 Etude de besoins

Résumé : Etude de l'existant l Le choix du mécanisme d'harmonisation est différent selon les blocs régionaux au regard de leur culture réglementaire respective parfois en lien avec l'héritage du colonialisme – Haut vers Bas – par le droit / la règle • ex. Les règlements, – Bas vers le haut – par la technique / l'outil • ex. Les lignes directrices, … l Pas de volonté de délégation des pouvoirs nationaux au niveau régional / supranational Vers une autorité continentale (AMA) 28 | Harmonisation , TBS 2016

Les initiatives de l'OMS l L'OMS – Renforce les capacités des ANRP nationales et donc indirectement les capacités des communautés économiques régionales – Soutien activement les processus d'harmonisation des communautés économiques régionales • Participe aux réunions des experts • Soutien technique sur les textes législatifs et réglementaires • Soutien technique dans l'adaptation des normes internationalement reconnues (OMS et/ou ICH et/ou PICS) – Promeut l'utilisation des normes et standards développés par l'Organisation (qui sont en eux-mêmes un mécanisme d'harmonisation car les experts de tous les pays participent) – Facilite les échanges d'informations par l'organisation de Forums (Conférence internationale des ARP) 29 | Harmonisation , TBS 2016

Les facteurs du succès l Rôles et responsabilités bien établis l Gestion et administration effective à travers un secretariat et un comité directeur ou de suivi l Participation active de tous les intervenants (ARP et industrie) disposant du mandat l Basé sur l'état de l'art et la recherche du consensus l Réunion fréquente axées sur la production l Des schémas décisionnels et des procédures bien définies 30 | Harmonisation , TBS 2016 30

Les facteurs du succès l Engagement de toutes les parties pour mettre en œuvre les documents développés et son suivi l Ressources humaines et financières adéquates l Transparence et communication effective l Développer des formations communes l Organiser des activités conjointes (inspections, évaluations de dossier) l Consolider la doctrine commune 31 | Harmonisation , TBS 2016 31

Conclusions L'harmonisation doit suivre l'évolution continuelle de l'état de l'art et donc des exigences. Mais doit-on continuer à suivre cette évolution alors que les exigences minimales ne sont toujours pas satisfaites ? 1978 Années ‘’Obscures’’ 32 | BPF : Prin. Généraux Harmonisation , TBS 2016 Qualité de la conception 2000 Système Qualité Développement pharmaceutique 1990 Gestion du risque Validation des 1980 Systèmes Informatisés Validations Ex. L'évolution des BPFs

Conclusions l L'harmonisation "va toujours de l'avant" mais attention aux conséquences notamment pour l'industrie locale et à veiller à l'intérêt pour la santé des populations l L'harmonisation ne veut pas dire uniformisation, il faut savoir montrer sa différence quand cela est justifié l L'harmonisation est un outil / un moyen pour atteindre un objectif déterminé et commun – Il ne doit pas être utilisé comme un moyen de maintenir ou d'acquérir une position dominante 33 | Harmonisation , TBS 2016
 Allez vous en sur les places
Allez vous en sur les places Pharmaceutiques
Pharmaceutiques Pharmaceutiques
Pharmaceutiques Pharmaceutiques
Pharmaceutiques Approche gar
Approche gar Politique de distribution marketing
Politique de distribution marketing Distribution intensive
Distribution intensive Structure des opportunités politiques
Structure des opportunités politiques Texte argumentatif sur les accidents de la route
Texte argumentatif sur les accidents de la route Introduction sur les capteurs
Introduction sur les capteurs Annotations sur les copies
Annotations sur les copies Le panda exposé
Le panda exposé Capitaliser sur les acquis
Capitaliser sur les acquis Introduction sur les tice
Introduction sur les tice Victor hugo les femmes sont sur la terre
Victor hugo les femmes sont sur la terre Action de la soude sur les métaux
Action de la soude sur les métaux Production écrite sur les nouvelles technologies
Production écrite sur les nouvelles technologies Conclusion de milieu de culture
Conclusion de milieu de culture Introduction sur les matériaux de construction
Introduction sur les matériaux de construction Tigran becker
Tigran becker Exposé sur les lions
Exposé sur les lions évaluation volcans
évaluation volcans Ouvre mes yeux, seigneur, fais que je vois pdf
Ouvre mes yeux, seigneur, fais que je vois pdf Introduction sur les biocapteurs
Introduction sur les biocapteurs Victor hugo léopoldine poème
Victor hugo léopoldine poème Les harpies mythologie grecque
Les harpies mythologie grecque Informations sur les chats
Informations sur les chats Exposé sur les dauphins cm1
Exposé sur les dauphins cm1 Sujet sur les vacances
Sujet sur les vacances Exposé pompier
Exposé pompier Exposé sur les logiciels
Exposé sur les logiciels Quel beau nom paroles
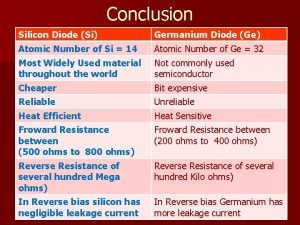
Quel beau nom paroles Germanium diode characteristics
Germanium diode characteristics Question sur les vacances
Question sur les vacances