slo projektu Nzev sady materil Nzev materilu Autor











- Slides: 15

Číslo projektu Název sady materiálů Název materiálu Autor CZ. 1. 07/1. 4. 00/21. 1405 Chemie 9. roč. VY_32_INOVACE_01_19 Neutralizace Melicharová Jana

Neutralizace Jana Melicharová, 2. ZŠ Dobříš

Co je to neutralizace? ¥ Neutralizace je reakce kyseliny s hydroxidem. ¥ Produkty neutralizace jsou voda a sůl příslušné kyseliny. ¥ Voda vzniká reakcí vodíkových kationtů H+ s hydroxidovými anionty OH-. ¥ Zbylé části molekul kyseliny (anionty) a hydroxidu (kationty) vzájemně reagují za vzniku soli.

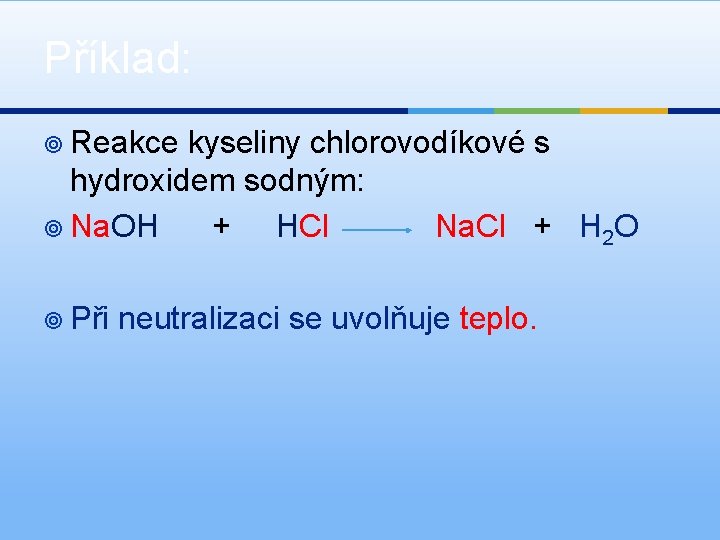
Příklad: ¥ Reakce kyseliny chlorovodíkové s hydroxidem sodným: ¥ Na. OH + HCl Na. Cl + H 2 O ¥ Při neutralizaci se uvolňuje teplo.

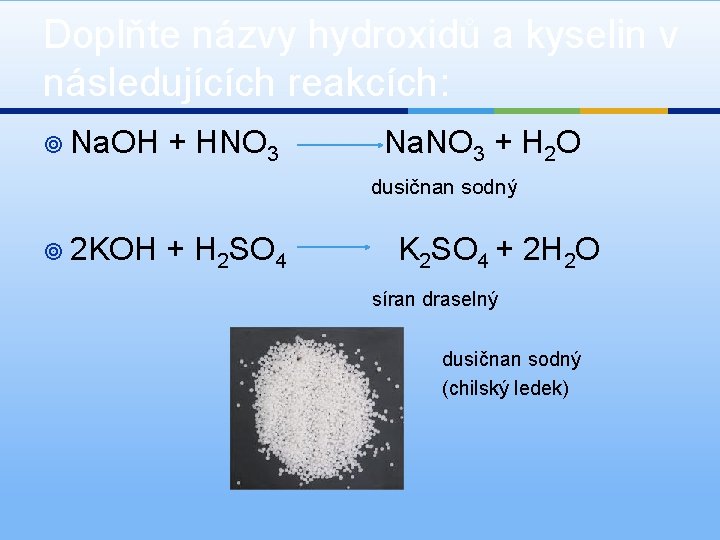
Doplňte názvy hydroxidů a kyselin v následujících reakcích: ¥ Na. OH + HNO 3 Na. NO 3 + H 2 O dusičnan sodný ¥ 2 KOH + H 2 SO 4 K 2 SO 4 + 2 H 2 O síran draselný dusičnan sodný (chilský ledek)

Řešení ¥ Hydroxid sodný + kyselina dusičná ¥ Hydroxid draselný + kyselina sírová

Vznik solí: ¥ Soli mohou vznikat různými chemickými reakcemi. ¥ Způsoby vzniku solí: ¥ 1) neutralizace, ¥ 2) reakce kovu s kyselinou, ¥ 3) reakce kovu s nekovem, ¥ 4) srážecí reakce

Reakce kovu s kyselinou: ¥S kyselinami snadno reagují pouze neušlechtilé kovy (např. Zn, Mg, Na, K, Al, Fe) ¥ Neušlechtilé kovy s kyselinami reagují za vzniku vodíku a soli: ¥ Př. : ¥ Mg +2 HCl Mg. Cl 2 + H 2 chlorid hořečnatý vodík

Reakce kovu s nekovem (slučování): ¥ Např. : ¥ 2 Na ¥ Jak + Cl 2 2 Na. Cl se nazývá produkt, který vznikl? ¥ Zapiš chemickou rovnicí reakci práškové síry a zinku:

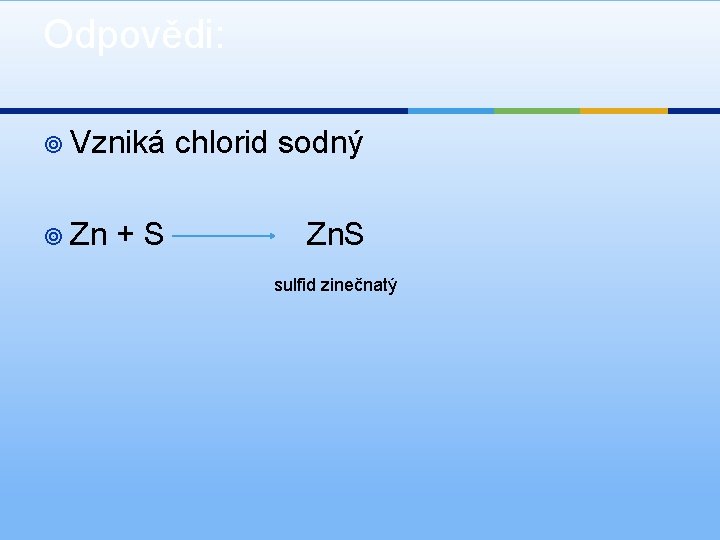
Odpovědi: ¥ Vzniká ¥ Zn +S chlorid sodný Zn. S sulfid zinečnatý

Srážecí reakce: ¥ Jsou reakce dvou roztoků solí. ¥ Při těchto reakcích vzniká sraženina – nerozpustná pevná látka, která se během reakce vylučuje z roztoku. ¥ př. : ¥ Ag. NO 3 + Na. Cl Ag. Cl + Na. NO 3 Dusičnan stříbrný sraženina chloridu stříbrného

Rozdělení solí: ¥ 1) Soli bezkyslíkatých kyselin – dvouprvkové sloučeniny, v molekule neobsahují kyslík ¥ 2) Soli kyslíkatých kyselin – tříprvkové sloučeniny, obsahují v molekule atomy kyslíku, patří sem i hydrogensoli

Procvičování: ¥ 1) Zapiš chemické rovnice uvedených reakcí a pojmenuj produkty: ¥ a) reakce zinku a kyseliny chlorovodíkové ¥ b) reakce hliníku a kyseliny chlorovodíkové ¥ c) reakce hořčíku a kyseliny dusičné ¥ 2) Co reaguje a co vzniká při srážecí reakci?

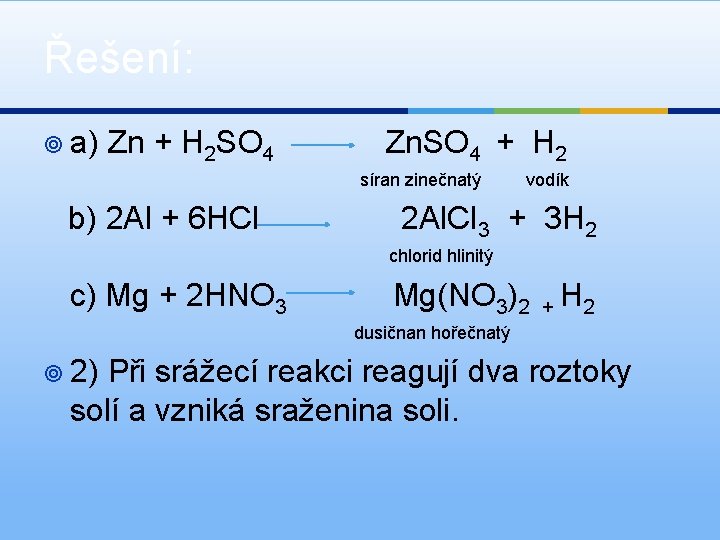
Řešení: ¥ a) Zn + H 2 SO 4 Zn. SO 4 + H 2 síran zinečnatý b) 2 Al + 6 HCl vodík 2 Al. Cl 3 + 3 H 2 chlorid hlinitý c) Mg + 2 HNO 3 Mg(NO 3)2 + H 2 dusičnan hořečnatý ¥ 2) Při srážecí reakci reagují dva roztoky solí a vzniká sraženina soli.

Zdroje: ¥ http: //www. klematcz. cz/cz/2 ---- prumyslova-chemie/14 -produkty/3 -vyrobahnojiv. html ¥ Josef Mach, Irena Plucková, Jiří Šibor: Chemie (Úvod do obecné a anorganické chemie), naklad. Nová škola



























