slo projektu CZ 1 071 5 0034 0029








- Slides: 11

Číslo projektu CZ. 1. 07/1. 5. 00/34. 0029 Číslo materiálu VY_32_INOVACE_04 -18 Název školy Střední průmyslová škola stavební, Resslova 2, České Budějovice Autor Ing. Věra Čechová Tematický celek Chemie Ročník 1. Datum tvorby 17. 7. 2012 Anotace Opakování a navazující výklad názvosloví solí Metodický pokyn Výklad nové látky s následným procvičením, možno využít i k samostudiu Pokud není uvedeno jinak, použitý materiál je z vlastních zdrojů autora

NÁZVOSLOVÍ 3 anorganických sloučenin – soli

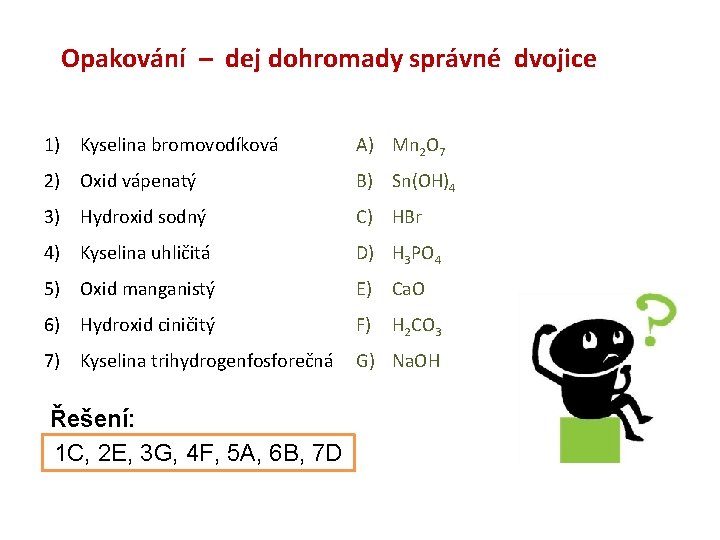
Opakování – dej dohromady správné dvojice 1) Kyselina bromovodíková A) Mn 2 O 7 2) Oxid vápenatý B) Sn(OH)4 3) Hydroxid sodný C) HBr 4) Kyselina uhličitá D) H 3 PO 4 5) Oxid manganistý E) Ca. O 6) Hydroxid ciničitý F) H 2 CO 3 7) Kyselina trihydrogenfosforečná G) Na. OH Řešení: 1 C, 2 E, 3 G, 4 F, 5 A, 6 B, 7 D

SOLI - vznik: reakcí kyseliny a hydroxidu (neutralizací), vzniká voda a sůl HCl + Na. OH → Na. Cl + H 2 O - chem. sloučeniny složené z kationtu kovu a aniontu kyseliny (odštěpením vodíkových kationtů z molekuly kyseliny), přičemž celkový náboj kationtů je roven celkovému náboji aniontů Názvy: - dvouslovné, podst. jméno odvozené od aniontu kyseliny a z přídavného jména označujícího kation a určující oxid. č. daného prvku. Podst. jméno v názvu solí bezkyslíkatých kyselin má zakončení –id (chlorid, sulfid) u kyslíkatých kyselin má zakončení -an, slovní základ odpovídá oxid. č. atomu kyselinotvorného prvku (dusitan, síran, manganistan). U ox. č. VI používáme podst. jm. vzniklé zkrácením, tedy síran a ne sírovan Tvorba vzorce: - nejprve kation, pak anion (v závorce) a upravit počet iontů, aby byl počet nábojů roven 0. (př. KCl – chlorid draselný, Na 2 SO 4 – síran sodný)

Soli bezkyslíkatých kyselin a) halogenidy (Al. Cl 3) - dvouprvkové sloučeniny halogenu a vodíku, všechny halogeny mají ox. č. – I - jako všechny dvouprvkové sloučeniny mají zakončení – id b) sulfidy (Al 2 S 3) - dvouprvkové sloučeniny síry s kovovým prvkem, ve kterých mají atomy síry oxid. č. - II - pro tvorbu názvů a vzorců platí stejné pravidla jako pro oxidy - sulfidy = sirníky (postaru), jako oxidy - kysličníky l. II -I Al Cl 3 l. II Al 2 -II S 3

Soli kyslíkatých kyselin - tvorba vzorců - dusičnany, dusitany, uhličitany, … - místo kationtu může být vázána i amonná skupina - NH 4 NO 3 – dusičnan amonný příklad postupu: uhličitan železitý 1) název kyseliny: - kyselina uhličitá 2) vzorec kyseliny: H 2 CO 3 3) vzorec aniontu: (CO 3)-II 4) vzorec kationtu: Fe+III 5) vzorec soli (celk. náboj kationtů= celk. náboji aniontů) Fe 2(CO 3)3

Soli kyslíkatých kyselin - tvorba názvů příklad postupu: vzorec Na 2 SO 4 1) kation: Na. I (v 1. skupině – max. oxid. č. I) 2) název kationtu (= přídavné jméno názvu soli): - sodný 3) anion: (SO 4)-II 4) oxid. č. síry (x – 8) = -2 → x = 6 5) název aniontu: - síran (ne sírovan) 6) název soli: síran sodný

Specielní typy solí Hydrogensoli – obsahují anionty kyselin, ve kterých zůstává jeden nebo více odštěpitelných kationů vodíku př. dihydrogenfosforečnan sodný Na. H 2 PO 4 Podvojné soli – mají více kationtů či aniontů př. – více kationtů: síran amonno – železnatý (NH 4)2 SO 4 + Fe. SO 4 = (NH 4)2 Fe(SO 4)2 fluorid draselno-hořečnatý KMg. F 3 - více aniontů: chlorid - fluorid olovnatý Pb. Cl. F Koordinační sloučeniny – komplexy: - k centrálnímu atomu M jsou vázány další atomy tak, že jejich počet převyšuje oxidační číslo atomu M př. hexakyanoželezitan (tri)draselný K 3[Fe(CN)6] Hydráty solí Některé soli vytvářejí krystaly, ve kterých jsou vázány molekuly vody. Počet molekul vody v molekule hydrátu se vyjadřuje číslovkou (řeckou) připojenou před slovo hydrát – monohydrát, dihydrát, tri… Ve vzorcích se značí číslicí, kterou oddělujeme spolu se vzorcem vody od vzorce soli tečkou př. modrá skalice Cu. SO 4. 5 H 2 O pentahydrát síranu mědnatého

Vyber správný název Pb(Si. O 3)2 siřičitan olovičitý - křemičitan olovnatý Ca. Se. O 4 selenan vápenatý - selenitan vápenatý - selenan vápenný Na 2 Cr 2 O 7 chroman sodný - chroman disodný - dichroman disodný Ag. Br. O 3 bromičnan stříbrný - bromid stříbrný - bromistan stříbrný Na 2 SO 3. 4 H 2 O tetrahydrát síranu sodného - trihydrát siřičitanu sodného - tetrahydrát siřičitanu sodného Řešení: Pb(Si. O 3)2 křemičitan olovičitý Ca. Se. O 4 selenan vápenatý Na 2 Cr 2 O 7 dichroman disodný Ag. Br. O 3 bromičnan stříbrný Na 2 SO 3. 4 H 2 O tetrahydrát siřičitanu sodného

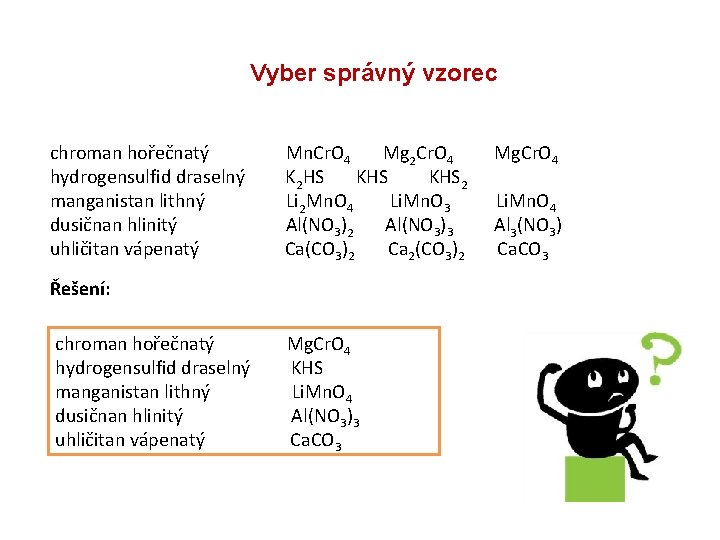
Vyber správný vzorec chroman hořečnatý Mn. Cr. O 4 Mg 2 Cr. O 4 Mg. Cr. O 4 hydrogensulfid draselný K 2 HS KHS 2 manganistan lithný Li 2 Mn. O 4 Li. Mn. O 3 Li. Mn. O 4 dusičnan hlinitý Al(NO 3)2 Al(NO 3)3 Al 3(NO 3) uhličitan vápenatý Ca(CO 3)2 Ca 2(CO 3)2 Ca. CO 3 Řešení: chroman hořečnatý Mg. Cr. O 4 hydrogensulfid draselný KHS manganistan lithný Li. Mn. O 4 dusičnan hlinitý Al(NO 3)3 uhličitan vápenatý Ca. CO 3

Použité zdroje obrázků: - galerie Microsoft office
 071-com-0029
071-com-0029 Příklady na mocniny s racionálním exponentem
Příklady na mocniny s racionálním exponentem Perform surveillance without the aid of electronic device
Perform surveillance without the aid of electronic device 071-com-4407
071-com-4407 Hello
Hello Pb 071
Pb 071 ?3305501049 0000 28|.|091 27|.|071 98|.|553 102|.|311 13`
?3305501049 0000 28|.|091 27|.|071 98|.|553 102|.|311 13` Identify terrain features on a map 071-com-1001
Identify terrain features on a map 071-com-1001 N 3^071
N 3^071 React to indirect fire while dismounted powerpoint
React to indirect fire while dismounted powerpoint 071 atm code
071 atm code 071-com-4407
071-com-4407




















