Sistemas Continuos Un reactor muy eficiente para el


![conjunto de puntos para la [efluente] (ó la velocidad de producción de uno de conjunto de puntos para la [efluente] (ó la velocidad de producción de uno de](https://slidetodoc.com/presentation_image_h2/591cac6677442e376021b2373bf559e1/image-6.jpg)
![Las [biomasa] en el efluente de una fermentación aeróbica en ee sobre glucosa es Las [biomasa] en el efluente de una fermentación aeróbica en ee sobre glucosa es](https://slidetodoc.com/presentation_image_h2/591cac6677442e376021b2373bf559e1/image-7.jpg)







































![Considerando a S 0 como la [medio frresco] e introduciendo el rendimiento, Yxs de Considerando a S 0 como la [medio frresco] e introduciendo el rendimiento, Yxs de](https://slidetodoc.com/presentation_image_h2/591cac6677442e376021b2373bf559e1/image-50.jpg)






- Slides: 57

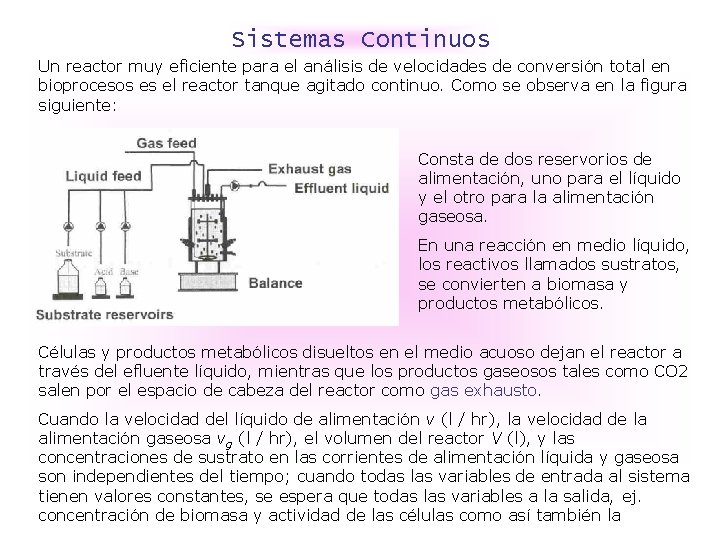
Sistemas Continuos Un reactor muy eficiente para el análisis de velocidades de conversión total en bioprocesos es el reactor tanque agitado continuo. Como se observa en la figura siguiente: Consta de dos reservorios de alimentación, uno para el líquido y el otro para la alimentación gaseosa. En una reacción en medio líquido, los reactivos llamados sustratos, se convierten a biomasa y productos metabólicos. Células y productos metabólicos disueltos en el medio acuoso dejan el reactor a través del efluente líquido, mientras que los productos gaseosos tales como CO 2 salen por el espacio de cabeza del reactor como gas exhausto. Cuando la velocidad del líquido de alimentación v (l / hr), la velocidad de la alimentación gaseosa vg (l / hr), el volumen del reactor V (l), y las concentraciones de sustrato en las corrientes de alimentación líquida y gaseosa son independientes del tiempo; cuando todas las variables de entrada al sistema tienen valores constantes, se espera que todas las variables a la salida, ej. concentración de biomasa y actividad de las células como así también la

Concentración de productos metabólicos en los efluentes líquidos y gaseosos tengan valores constantes. El p. H se mantiene constante agregando ácido ó base de reservorios que están por separado. El bioreactor opera en un modo continuo en estado estacionario, en la mayoría de. los casos todas las variables a la salida son constantes, pueden haber excepciones que son de interés científico y práctico. Además de fijar las concentraciones de sustrato a ciertos valores en las corrientes líquida y gaseosa para alcanzar un cultivo continuo en estado estacionario se requiere que vg y especialmente v , la velocidad de alimentación de la alimentación líquida, se fijen en valores constantes relativos al volumen del medio V en el reactor. Usando medidores de flujo de gas la relación vg / V se puede controlar y mantener en un valor dado para obtener una velocidad de flujo de gas, a menudo especificada en vvm (volumen de gas por volumen de líquido por minuto). La relación entre v y V es una de las variables de entrada más importantes en el bioreactor, y se llama velocidad de dilución y se mide en unidades de recíproca de tiempo, usualmente en hr-1. Velocidad de dilución = D = v / V D es el tiempo espacial ó la recíproca del tiempo de mantenimiento, el término usual para una reacción en ing. química.

Para obtener un valor constante de D hay que usar varias estrategias de control: • El volumen del medio de reacción ó el peso del reactor y medio se miden con una frecuencia de por Ej 10 min y la velocidad de alimentación del líquido se controla para dar un cierto conjunto de puntos para V. Cuando D se fija de ésta forma, Ej controlando una variable de entrada, v , midiendo otras variables también de entrada V, el reactor se dice que opera como un quimiostato. Este es el modo de operación para la mayoría de los tanques agitados continuos de laboratorio, y para la mayoría de los reactores industriales.

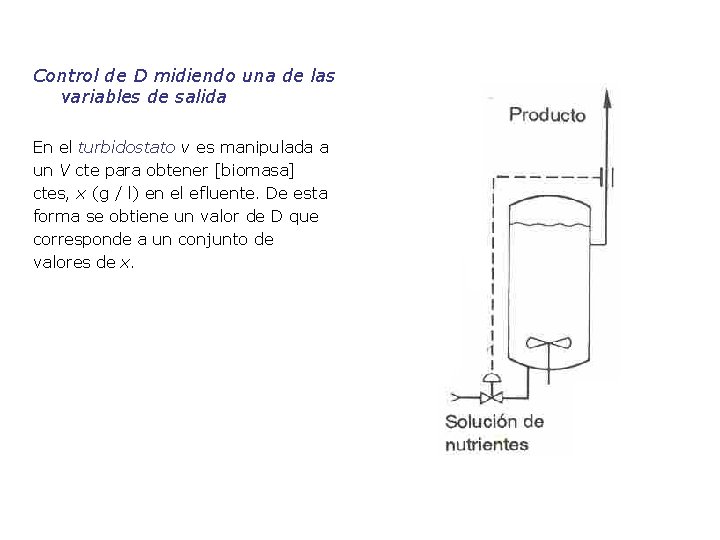
Control de D midiendo una de las variables de salida En el turbidostato v es manipulada a un V cte para obtener [biomasa] ctes, x (g / l) en el efluente. De esta forma se obtiene un valor de D que corresponde a un conjunto de valores de x.

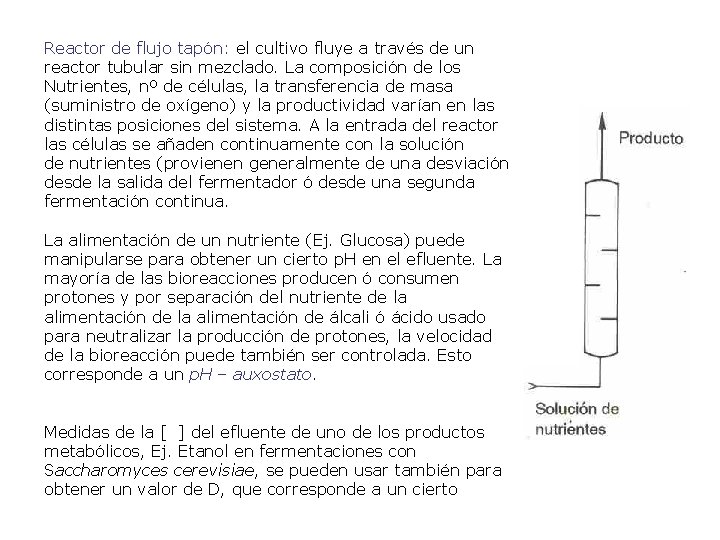
Reactor de flujo tapón: el cultivo fluye a través de un reactor tubular sin mezclado. La composición de los Nutrientes, nº de células, la transferencia de masa (suministro de oxígeno) y la productividad varían en las distintas posiciones del sistema. A la entrada del reactor las células se añaden continuamente con la solución de nutrientes (provienen generalmente de una desviación desde la salida del fermentador ó desde una segunda fermentación continua. La alimentación de un nutriente (Ej. Glucosa) puede manipularse para obtener un cierto p. H en el efluente. La mayoría de las bioreacciones producen ó consumen protones y por separación del nutriente de la alimentación de álcali ó ácido usado para neutralizar la producción de protones, la velocidad de la bioreacción puede también ser controlada. Esto corresponde a un p. H – auxostato. Medidas de la [ ] del efluente de uno de los productos metabólicos, Ej. Etanol en fermentaciones con Saccharomyces cerevisiae, se pueden usar también para obtener un valor de D, que corresponde a un cierto
![conjunto de puntos para la efluente ó la velocidad de producción de uno de conjunto de puntos para la [efluente] (ó la velocidad de producción de uno de](https://slidetodoc.com/presentation_image_h2/591cac6677442e376021b2373bf559e1/image-6.jpg)
conjunto de puntos para la [efluente] (ó la velocidad de producción de uno de los productos). Este se llama un produtostato. Hay otras estrategias que se llaman “closed loop control” que se usan junto con uno ó más modelos matemáticos del proceso, que ocurre en el bioreactor. Se supone que las concentraciones de biomasa y productos metabólicos son idénticas a aquellas que se encuentran en cualquier punto del reactor. Este reactor se llama un bioreactor ideal que trabaja en estado estacionario. La elección de la estrategia va a depender de la sensibilidad a los cambios en el ee, y en las variables usadas para establecer el control de policía. La estrategia, que de la sensibilidad más alta debe elegirse, aunque por razones prácticas la mayoría de las investigaciones se llevan a cabo con un único control para obtener el ee a diferentes velocidades de dilución investigadas. Como se ve en la figura siguiente, para un bioreactor conteniendo un cultivo de Saccharomyces cerevisiae: • perfiles de [biomasa] • perfiles de [etanol] • perfiles de [glucosa] a velocidades de dilución diferentes
![Las biomasa en el efluente de una fermentación aeróbica en ee sobre glucosa es Las [biomasa] en el efluente de una fermentación aeróbica en ee sobre glucosa es](https://slidetodoc.com/presentation_image_h2/591cac6677442e376021b2373bf559e1/image-7.jpg)
Las [biomasa] en el efluente de una fermentación aeróbica en ee sobre glucosa es independiente de D a valores pequeños de D. Por consiguiente un ee a un D pequeño no puede fijarse con seguridad en un turbidostato. La [sustrato] s en el efluente puede variar significativamente sobre una escala relativa, s es proporcional a D para D pequeños. , pero es difícil de medir [s] pequeñas con seguridad suficiente a un valor fijo de v y D. Por lo tanto se prefiere un quimiostato como la estrategia mejor. En el ee cerca de la condición de lavado, la [s] aumenta significativamente y la [biomasa] disminuye de su valor máximo y casi a un valor cte para un D pequeño. Aquí un turbidostato trabaja muy bien ya que para pequeñas variaciones de D hay cambios grandes en x, y el ee se fija basando el control en un conjunto de puntos dados para x. El quimiostato es totalmente inapropiado para cerca de la condición de lavado, pero el p. H – stato es muy satisfactorio ya que la velocidad de producción de protones está acoplada fuertemente (quizás aún es proporcional) a los valores de producción de biomasa.

Alrededor de la velocidad de dilución crítica, Dcrít donde la producción de etanol medida como [etanol] p (ó velocidad de producción de etanol) depende fuertemente de D. Aquí un productostato es la estrategia ideal donde se controlan x ó el coeficiente respiratorio. La relación entre el oxígeno consumido y la producción de CO 2, son menos sensibles, y el quimiostato es unsuited ya que uno no puede controlar v con seguridad suficiente para obtener un ee con un p deseado. En general se toma en el orden de 5 veces el tiempo de mantenimiento (5 D -1) para obtener un nuevo ee y las velocidades medidas pueden estar lejos de los valores establecidos como verdaderos, si la aproximación al nuevo ee no es dentro del 95 – 99 %. El tiempo entre los ee no es wasted ya que el estado transiente por sí mismo contiene mucha información sobre la fisiología del organismo. El tiempo transiente es definitivamente una función de la estrategia de control usada para fijar el nuevo ee. Ej: para una fermentación aeróbica de levaduras sobre glucosa alrededor del Dcrít usando como estrategia un quimiostato se tiene un tiempo transiente cercano a 50 veces el tiempo de mantenimiento, mientras que si se usa un productostato se obtiene un ee correspondiente a 5 veces el tiempo de mantenimiento. Un reactor continuo en ee es el equipo ideal para estudios fisiológicos, y también para obtener datos previos para diseñar una producción industrial. Los datos obtenidos en ee son la base de un tratamiento cuantitativo de las bioreaciones, y las capas más profundas de las respuestas metabólicas se revelan en los estados transientes de un ee al próximo.

Son estos experimentos transientes los que dan la información necesaria para modelar sobre reactores no ideales, en los cuales el efecto de la no homogeneidad se pueden investigar. Reactor Ideal: No hay shunt del sustrato desde que entra hasta que sale, significa que no hay zonas muertas ó aglomerados de sustrato sólido sin disolver. El S es instantáneamente distribuido en todo el volumen de medio y el distribuidor de aire provee un medio G –L intimamente mezclado, por lo tanto no hay burbujas deslizándose a lo largo de las paredes del reactor. Algunos reactores de laboratorio se aproximan al ideal. El tiempo de mezclado está en el orden de 1 ó 2 seg, por lo que la velocidad de transferencia de masa gas – líquido es muy alta, estos reactores estan equipados con sistemas de control, que nos permiten seguir el efecto de pasos transientes impuestos sobre el entorno microbiano. Estas unidades se usan para investigaciones científicas, estudios sobre el metabolismo celular, y para estudiar la célula como un reactor bioquímico. Otros experimentos en cambio se llevan a cabo, sin involucrar una fermentación real en un equipo que luego va a ser usado para la producción industrial. En estos casos se estudia la interacción mecánica de aparatos como agitadores, mezcladores estáticos con ó sin superficies corrugadas, tubos draught con un fluído de propiedades dadas. Se analizan tiempos constantes para el mezclado, para la circulación y para el transporte gas – líquido. Se espera que ambas interacciones químicas entre la célula y su micro entorno, y

las interacciones físicas entre la célula ó el cultivo celular y su macro entorno sean clarificadas con suficiente detalle como para permitir que bioprocesos nuevos sean diseñados con el mínimo de problemas para el cambio de escala. Ahora nuestro enfoque es sobre el reactor exclusivamente: El modelo de Monod se usa tanto para operaciones en estado estacionario y no estacionario. Es unsuited para la descripción del comportamiento celular durante estados transientes rápidos, pero nunca será usado aquí como parte de un modelo transiente de un bioreactor. Los principios generales del comportamiento de un bioreactor se explican bien cuando se usan expresiones cinéticas simples. Reactores usados en la industria química Se dividen en dos grupos principales: Reactor tanque agitado y Reactor tubular ó flujo pistón. A su vez los reactores usados en la bioindustria para la fermentación de microorganismos se dividen en los mismos grupos, pero el más popular es el reactor tanque agitado. La razón es que la velocidad volumétrica de una bioreacción es proporcional a la [biomasa], y por lo tanto el orden de reacción aparente en la concentración de sustrato es negativo pero para niveles muy bajos de sustrato.

Por convención las reacciones químicas son de orden mucho mayor que cero para el reactivo limitante. Por otra parte las fermentaciones aeróbicas no pueden llevarse a cabo en un flujo pistón debido a las diferencias muy grandes entre tiempos constantes entre la bioreacción y el pasaje de gas a través del reactor. Otro problema específico con el flujo pistón en la bioindustria es que la alimentación puede contener biomasa, y la reacción no tendrá lugar a menos que la biomasa haya sido inmovilizada sobre partículas que permanezcan en el reactor. Una alimentación continua de un medio no estéril causaría problemas de contaminación, y por lo tanto no sería el reactor elegido. Los reactores flujo pistón se usan únicamente si se necesita una conversión casi completa del sustrato como es el caso de la bioremediación de desechos de aguas tóxicas. El término reactor tanque agitado se aplica solamente a la fase líquida. En un proceso aeróbico es ventajoso el contacto de una fase líquida bien mezclada con la fase gaseosa, ya que esto dará una velocidad de transferencia de masa más alta, y además contribuye a una mejor utilización de la fase gaseosa al más bajo costo de compresión, si se usa aire. Por lo tanto un bioreactor puede operar como un tanque agitado con respecto a la biomasa y sustratos en la fase líquida tales como glucosa, mientras es deseable tener un flujo pistón para sustratos gaseosos.

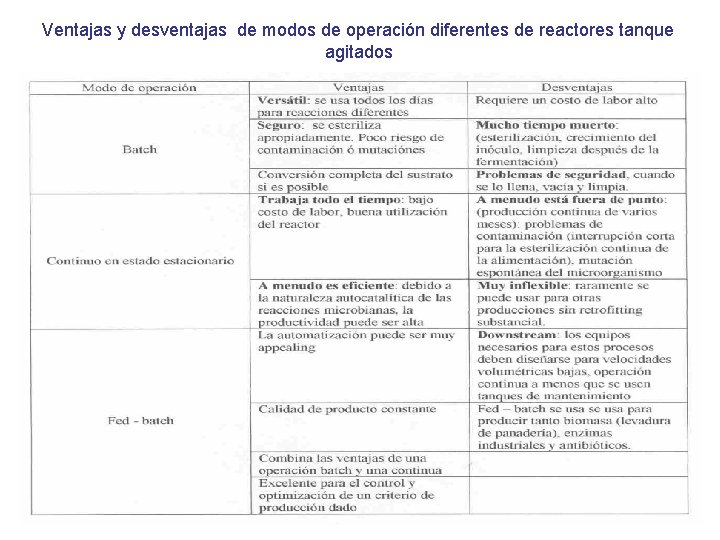
Ventajas y desventajas de modos de operación diferentes de reactores tanque agitados

Bioreactor Tanque Agitado Opera a una presión cercana a la P atm, son de acero inoxidable y están equipados con aparatos para obtener un buen mezclado de la fase líquida y un enfriamiento del medio eficiente. Los sustratos de la fase gaseosa son transferidos a la fase líquida por un distribuidor ó a través de nozzles de eficiencia alta. La coalescencia de las burbujas de gas es minimizada forzando la dispersión gas – líquido a través de mezcladores estáticos ó por redispersión en la vecindad de los mezcladores mecánicos. Todos estos reactores operan en modo Batch, continuo, semi – Batch también llamado Fed – Batch y son los que se usan en la bio industria. Ahora fundamentaremos las razones principales de usar uno u otro tipo de operación: El tratamiento matemático de los reactores tanque involucra una ecuación diferencial de primer orden, consideramos el siguiente vector variable: c = (s, p, x) d(V c) ---- = V (qt + q) + vf cf - ve ce dt c: concentraciones de la fase líquida (kg / m 3) subíndice f: alimentación

subíndice e: efluente V: volumen del reactor (m 3) v: flujo del líquido hacia ó desde el reactor (m 3 / hr) qt : vector de velocidad de transferencia de masa (kg / m 3 hr) q: vector de velocidades de reacción volumétrica (kg / m 3 / hr)

Balances Si nos basamos en las concentraciones medidas en la alimentación y en el efluente para un reactor continuo en ee, las velocidades de reacción se pueden calcular fácilmente de los balances de masa para el reactor. Estas ecuaciones expresan la masa del compuesto producido por la reacción, y es igual a la diferencia entre la alimentación líquida y la salida del reactor. q: vector de velocidad volumétrica (kg / m 3 hr) V: volumen (m 3) v: flujo del líquido (m 3 / hr) s: concentración de sustrato extracelular (kg /m 3) p: concentración de producto metabólico extracelular (kg / m 3) *ec (1, 2 y 3)

x: concentración de biomasa (kg / m 3) qi: velocidad de producción volumétrica (la masa del compuesto i producida por volumen de reactor y por unidad de tiempo) si y pi: son las concentraciones del ith sustrato y producto metabólico respectivamente x: concentración de la biomasa. El subíndice f indica la concentración de la variable en la alimentación líquida del reactor. Para sustratos gaseosos ó productos las ecuaciones serían: medio qi: velocidad de producción del componente i para la reacción bioquímica qti: velocidad a la cual el componente i es transferido de la fase gaseosa al líquido Estas velocidades se expresan como: la construcción del kla: coeficiente de transferencia de masa que depende del medio de fermentación y del componente a ser transferido, también de agitación del medio líquido, de la distribuidor de aire usado (seg-1) s*i y p*i son las concentraciones del componente i en el líquido que está en equilibrio con la fase gaseosa

Ambos dependen de la presión parcial del componente i en la fase gaseosa, temperatura del medio, p. H, etc πi : presión parcial del componente i (atm) Hi : constante de Henri para el componente i (atm l / mol) depende del medio y de las condiciones operativas Finalmente el balance de masa en función de las presiones parciales de la fase gaseosa para un sistema completo es: vg: flujo de gas (m 3 / hr) vf: alimentación líquida del reactor (m 3 / hr vg, f y vg son las velocidades volumétricas de flujo de gas en el espacio de cabeza del reactor y a la entrada. vg, f es diferente de vg si la velocidad de producción volumétrica de los productos gaseosos es diferente de la velocidad de consumo de los sustratos gaseosos ó si los componentes de la fase líquida, típicamente agua son stripped off del medio. Midiendo las concentraciones de las variables a un valor fijo de la variable de entrada D, se pueden calcular las velocidades de reacción fácilmente de los balances de masa de todas las ecuaciones anteriores, incluso si tengo un intercambio con la fase gaseosa.

En un experimento usado para determinar las velocidades de reacción, un nº de variables en los balances de masa son usualmente cero. • No hay biomasa ni producto en la corriente de alimentación • Los componentes transferidos de la fase gaseosa son dispersados solos y típicamente son solubles. Por ej. el oxígeno en la producción de proteína unicelular a partir de una fuente de energía y carbono. Vimos en las ecuaciones (1, 2 y 3) que qi es la velocidad de producción volumétrica, ej: la masa del componente i producido por volumen del reactor y por unidad de tiempo. Las velocidades de las bioreacciones (reacciones dentro de la célula) convencionalmente medidas en masa del componente i producidas por unidad de peso de células (más que por unidad de volumen de células), y por unidad de tiempo son: Diferencia importante entre ri y qi ri : son las velocidades asociadas con las reacciones verdaderas en el reactor real de la célula, mientras que qi se usa en los balances de masa establecidos para el tanque como reactor.

y específicamente para la biomasa se tiene que: rx: vector de velocidad de formación específica de biomasa (kg / kg peso seco hr) qx: velocidad volumétrica de formación de biomasa (kg peso seco / m 3 hr)

Reactor Tanque Agitado Continuo El balance de masa para un continuo, idealmente mezclado, y para un reactor de volumen constante es: Consideramos que el término de acumulación y qt son ambos cero. La alimentación es estéril y no contiene producto, la concentración ci de cualquier sustrato ó producto metabólico es constante en cualquier punto del reactor. En la mayoría de los casos la concentración del efluente es también ci, pero no necesariamente es lo correcto. Considerando la cinética de Monod y esterilidad, además una alimentación libre de productos, los balances en ee serán:

ó bien: (1) Para un dado valor de D, las concentraciones de sustrato, biomasa y producto metabólico se calculan de la ecuación (1). Obviamente, cualquiera de las concentraciones se puede usar como una variable clave a partir de la cual se pueden calcular las variables restantes. Introducimos variables adimensionales de S y X, tal que:

Reemplazando se obtienen las siguientes expresiones para D y para el balance de masa total: Donde a = Ks / sf. Ahora el factor de escala natural es sf más que s 0. El valor más grande posible para S es 1, y por consiguiente la velocidad de dilución más grande posible es: Y ocurre la condición de lavado cuando D es superior a Dmáx. (2) S: concentración de sustrato adimensional X: concentración de biomasa adimensional s: concentración de sustrato extracelular (kg / m 3) x: concentración de biomasa (kg / m 3) sf: concentración de sustrato en la alimentación del bioreactor (kg / m 3) Ysx: constante de rendimiento (kg sustrato / kg células) D: velocidad de dilución (1 / hr) K s: μmáx: velocidad específica de crecimiento máxima (1 / hr)

Para cualquier función de μ (de p ó s), la velocidad de dilución máxima se puede encontrar de la ecuación (2), válida para una cinética de Monod libre de mantenimiento. Típicamente el valor de Dmáx se encuentra para S = 1, pero el valor máximo de D se puede encontrar también para un valor de S en un intervalo abierto [0, 1] Si consideramos una cinética de inhibición por sustrato, se tiene que: (3) donde La función μ (S) tiene un extremo:

Ya que μ es una función creciente de S para 0 < Sextr, la velocidad de dilución máxima se obtiene de una de cualquiera de estas expresiones. El valor de μextr es independiente de sf, mientras que para cualquiera de los valores dados de los parámetros cinéticos Ki y Ks se ha visto que Sextr es inversamente proporcional a sf (por lo tanto sextr es independiente de sf. Cuando μ aumenta en función de S, la operación en un reactor tanque agitado a un valor de D cercano a Dmáx conduce a muy baja productividad. La concentración del sustrato en el efluente es cercana a sf , y consecuentemente no hay ni mucha biomasa ni mucho producto en la corriente del efluente, hablamos entonces de una cinética monotónica. Para cinéticas no monotónicas como la ec (3), la velocidad específica de crecimiento más alta pueden ambas encontrarse a valores de D, cuando S es mucho mas pequeño que 1. La productividad de una especie dada i para un reactor tanque agitado, se define como:

La productividad más alta en general no se encuentra cuando la velocidad específica de crecimiento está en su máximo valor. Considerando la cinética de Monod y alimentación estéril: ó (4) Para la cual el máximo valor es: (5) Px : productividad de la especie x en un quimiostato (kg / m 3 hr) x: concentración de biomasa (kg / m 3)

El valor correspondiente de D es: (6) Los resultados de las ecuaciones (4 a 6) se pueden expresar verbalmente como sigue: • es deseable tratar una corriente de alimentación v de sustrato concentración sf de un reactor tanque agitado de volumen V. La cinética sigue la expresión de Monod con Ks = a sf. Ahora la máxima cantidad (en kg / hr) de sustrato que puede ser convertido es: Donde s = Sópt que se calcula de la ec (5) y D = Dópt de la ec (6). qs : vector de velocidad volumétrica (kg / m 3 hr) • Si un valor dado de la corriente de alimentación v es más grande que Dópt V, lo mejor en este caso es usar una corriente de recirculación de células. Por la misma razón, la productividad de células más alta (en kg / hr) para un dado volumen V, se calcula de la ec (5).

La misma fórmula se puede usar para calcular (Pp, máx ya que: Pp= Yxp Px El término óptimo usado en las ecuaciones (5 y 6) sería erróneo cuando se tiene que pesar el costo del sustrato con el valor de la biomasa ó el producto. Se busca los valores más bajos de sustrato en el efluente dado por la ec (5), al costo de tener que aumentar V, para tener la capacidad suficiente de procesar una corriente de alimentación dada. El trata miento matemático que hicimos se usa solamente para ilustrar como muchos de los problemas de optimización asociados con la operación del bio reactor pueden resolverse. Recirculación de Biomasa Se ha demostrado que para la cinética de una fermentación dada (con ó sin mantenimiento) y para una composición dada de la alimentación, es posible para un reactor continuo en ee calcular la composición completa del efluente basándonos en una única cantidad medida. Puede ser la velocidad de dilución ó la concentración de sustrato, biomasa ó producto en el efluente. Si introducimos un grado de libertad en ela ecuación siguiente:

por relajación de la suposición que la concentración de biomasa xe en el efluente es igual a la concentración de la biomasa x en el reactor, surgen ahora problemas nuevos de diseño. Se mantiene para todos los otros reactivos y productos la suposición de homogeneidad ideal del reactor tanque agitado, pero el valor de D que corresponde a una alimentación dada y las concentraciones del efluente no dependerán sólo sobre x. Cuando x > xe , el reactor es capaz de procesar más alimentación que en la situación base donde x = xe, ya que la velocidad de formación de biomasa es proporcional a x. El enriquecimiento del medio del reactor relativo a la corriente del efluente puede ser alcanzado por medio de una centrífuga de células instalada después del reactor y la recirculación de células a la entrada del reactor a través de un loop exterior. El mismo efecto se puede obtener por medio de un filtro instalado dentro del reactor, para remover las células del medio, es un caso extremo de una separación completa de las células del medio. Las células pueden sufrir una sedimentación parcial en el reactor, células inmovilizadas ó gránulos de un material carrier inactivo tal como partículas de arena ó flocs de microorganismos son Ej típicos. Finalmente la pérdida mas o menos de crecimiento de células sobre las paredes conduce a un enriquecimiento de células en el reactor, aunque las células que crecen sobre las paredes ó en gránulos exhiben un

comportamiento cinético diferente, que las células suspendidas libremente. Para una cinética de Monod libre de mantenimiento, se obtienen las ecuaciones siguientes: (7)

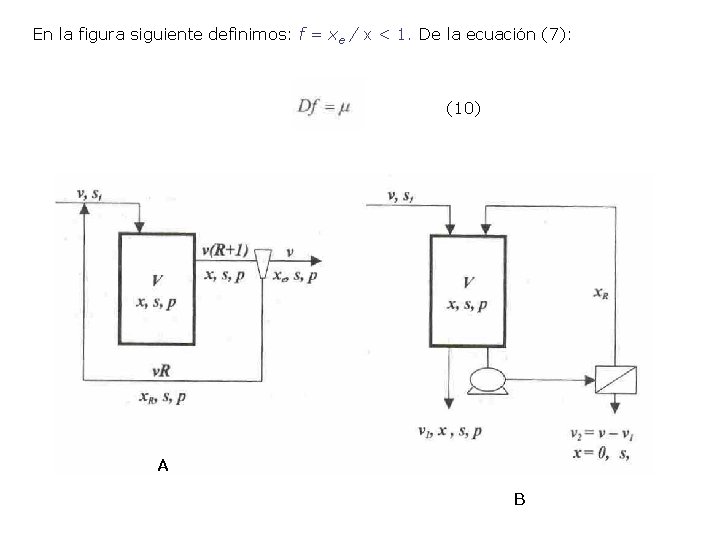
En la figura siguiente definimos: f = xe / x < 1. De la ecuación (7): (10) A B

Los balances para el sustrato y el producto son: (8) (9) Las ecuaciones (8 y 9) muestran que los balances de masa totales para xe y p = pe son idénticos a aquellos de la ecuación (1). El modelo de enriquecimiento de células difiere del modelo básico en un solo aspecto solamente: Para un valor dado de D es posible obtener una composición específica del efluente (se , xe , pe ) con una elección apropiada de f en la ecuación (10). Ahora relacionaremos f con las variables operativas de un diseño de recirculación de células. En la figura A un hidrociclón separa el efluente del reactor en una corriente de producto v y una corriente de recirculación Rv, donde R es el factor de recirculación. La concentración celular es x. R en la corriente de recirculación, y x. R = x β, con β >1.

Ni la concentración de producto, ni la de sustrato se ven afectadas por el hidrociclón. Balance de masa para el hidrociclón: La fracción de células recirculadas al reactor y la concentración de células en el reactor son:

B: Ultrafiltro Balance de masa para la biomasa: Donde Ώ es el factor de separación del filtro definido como v 2 / v y D = v / V como lo usual. La unidad B puede trabajar a una velocidad de dilución ( 1 - Ώ ) agitado continuo común para el cual D ( Ώ = 0 ) = μ. -1 que un reactor Ya que μ se elige para que sea el mismo co ó sin reciclo de biomasa, la productividad de la biomasa se ve aumentada por un factor ( 1 - Ώ ) -1. La biomasa aparece usualmente en una corriente pequeña v 1 = ( 1 - Ώ ) -1 v, y con una concentración mucho mayor: x = x (Ώ = 0 ) ( 1 - Ώ ) -1 que sin reciclo. El producto está en una corriente libre de células v 2 y listo para el proceso de recuperación. Aquí también la productividad se ve aumentada por un factor ( 1 - Ώ ) producto de puede ser recuperado. -1 , si el Si la corriente v 1 es desecho, entonces la productividad de P aumenta por un factor Ώ ( 1 - Ώ ) -1.

Vi: flujo de reacción (kg / kg peso seco hr) Descripción del funcionamiento de la puesta a punto de la recirculación de células μ y por consiguiente las concentraciones en el efluente de sustrato y producto, que son ambos funciones de μ solamente se eligen para el diseño del reactor en valores que son óptimos para algún criterio: puede ser que se necesiten valores bajos del efluente, ó el rendimiento del producto sea pequeño si s es demasiado alto. Se quiere obtener una velocidad de producción volumétrica satisfactoria, por lo tanto elegimos la recirculación ya sea por el esquema A ó B. Los dos parámetros de diseño f en A y Ώ en B se eligen tal que el valor de D (elegido para satisfacer una producción dada en el reactor) se ajusten al valor deseado de μ. En ambos esquemas la productividad más alta se debe a la densidad celular superior en el reactor. Este resultado es al menos en teoría independiente si hay pérdida de sustrato debido a mantenimiento. Ciertamente más sustrato se pierde debido al mantenimiento, pero al mismo tiempo una corriente de alimentación más grande se trata en el sistema. Relativamente hablando el mismo porcentage de sustrato se pierde (la pérdida por mantenimiento depende solamente de μ). El strees sobre las células causado por un bombeo rápido del medio a través del loop de recirculación y el filtro, pueden sin embargo dar una contribución

independiente a la demanda de mantenimiento de las células. En este caso la solución de la recirculación puede ser una desventaja. Por otra parte el aspecto negativo de la recirculación de células es que el costo del bombeo influye mucho sobre el funcionamiento del reactor. Operación Fed - Batch La operación de los bioreactores en un modo semi batch es muy popular en la industria de la fermentación. El reactor comienza como un batch, y se obtiene una cantidad considerable en concentración de biomasa por consumo del sustrato inicial. La velocidad de formación de producto es baja ó aún cero durante el cultivo batch. A un cierto tiempo, usualmente cuando el nivel de sustrato ha disminuído a un nivel muy bajo, una alimentación ( muy concentrada) de sustrato comienza. Al mismo tiempo un inductor puede agregarse para desencadenar una ruta metabólica que conduce al producto deseado. Durante el período fed – batch completo no se retira producto del reactor, y el volumen de medio aumenta continuamente. Al final del período fed – batch se retira una porción del volumen del reactor y se envía al proceso de recuperación. Se agrega sustrato nuevo, y después de un período batch , un segundo fed – batch comienza.

Esto es una operación fed – batch repetida. Se trabajará satisfactoriamente si el remanente de biomasa usado para desarrollar un cultivo nuevo no ha sido ( weakened) desechado, y quizás produzca el producto deseado con un bajo rendimiento. Cuando la corriente de alimentación que varía con el tiempo v (t) contiene uno ó más de los sustratos cf es admitido a un reactor tanque agitado sin withdrawal de la corriente de efluente correspondiente, el balance de masa es: (11) Los balances de masa para un modo operacional fed – batch será: (10) c: vector de concentración (kg / m 3) v: flujo líquido (m 3 / hr) Q: vector de velocidad volumétrica (kg / m 3 hr)

Hay una cierta similitud entre la ecuación (10) y la del balance de masa para un reactor tanque agitado. Aquí la velocidad de dilución D = v (t) / V (t), por supuesto, enf unción del tiempo. Un modelo fed – batch es en principio un modelo puramente transiente, aunque la mayoría de los resultados se obtienen suponiendo que el crecimiento es balanceado. Se puede elegir la función v(t) de forma tal de alcanzar un objetivo dado: que puede elegirse al final de la fermentación donde V(t) ha alcanzado un valor específico. Este problema de control de punto final es un problema clásico de la teoría de control. Ej: elegir sf y los valores iniciales de s 0 y x 0 para caracterizar el estado cuando el proceso fed – batch v(t) se inicia tal que se alcanze (x y s) en el tiempo más corto posible. Estudiaremos dos problemas simples donde la acción del control se aplica con el propósito de alcanzar ciertas condiciones metabólicas para un cultivo de células a cada instante durante las fermentación. El concepto de una acción de control instantáneo se ilustra con un sustrato de crecimiento limitante, y la biomasa establecida como vector. Para simplificar la discusión se considera una cinética libre de mantenimiento.

Consideramos dos situaciones: • Elegir v(t) tal que s = sº a través de la fermentación • Elegir v(y) tal que qx = qºx a través de la fermentación Ambas suposiciones corresponden a una fermentación con velocidad específica de crecimiento constante, y a una velocidad volumétrica de producción de biomasa constante, respectivamente. Cuando s se mantiene a un nivel bajo, parte del cual (sustrato agregado) se convierte en productos indeseables, una gran cantidad de biomasa (junto con una proteína asociada que puede ser un producto real), se produce a una velocidad alta razonable y una concentración alta de biomasa se puede obtener. Ni el reactor tanque agitado continuo (la calida de una levadura puede perderse en una fermentación larga), ni el reactor batch ( conversión de glucosa a etanol, el cual inhibe el crecimiento y representa una pérdida considerable de sustrato) son apropiados para la producción de levadura de panadería, universalmente se aplica para esto una operación en fed – batch. La velocidad volumétrica constante es importante si la remoción del calor de la reacción es un problema, ó si la capacidad para suministrar otro sustrato, Ej oxígeno se excede cuando qx > qºx qx : velocida volumétrica de formación de biomasa (kg peso seco / m 3 hr)

Cálculo de v(t) correspondiente a s = sº constante (significa que μ es constante e igual a μ 0). De la ecuación (11), y con xf = 0: (13) De la ecuación (10) para el balance de masa del sustrato: (12) v: flujo del líquido (m 3 / hr) Sf : concentración de sustrato en la alimentación (kg / m 3) s: concentración de sustrato extracelular (kg / m 3)

V(t) se encuentra integrando la ecuación (12) para t = 0, y x(t) insertando V(t) en la ecuación (13): (14) Donde: y (15) Las ecuaciones (12 y 15) proveen una solución completa al problema de velocidad específica de crecimiento constante. v aumenta exponencialmente con el tiempo. La concentración de biomasa x aumenta en función del tiempo con un límite superior de: para V tendiendo a infinito El valor de x para una relación V / V 0 se calcula de la ecuación (15) usando un valor de t obtenido de la solución de la ecuación (14). La constante qx de una fermentación fed – batch puede diseñarse muy fácilmente, la velocidad específica de crecimiento dará la productividad máxima, siempre y cuando no se formen subproductos. Pero con el aumento de la concentración de biomasa x (ec. (15) hasta alcanzar t = t*, cuando la velocidad de transferencia de oxígeno ó la velocidad de remoción de calor del

reactor no pueden ajustarse al aumento de qx. Desde este punto de vista debemos trabajar con: En el período de μ constante el valor de s = s 0 = s (μ 0) es usualmente muchos órdenes de magnitud más pequeño que sf. En una fermentación continua con qx constante de V* a Vfinal la concentración de sustrato en el reactor disminuye aún si μ x es constante, y por lo tanto no tendría sentido continuar junto t. , si x no aumenta.

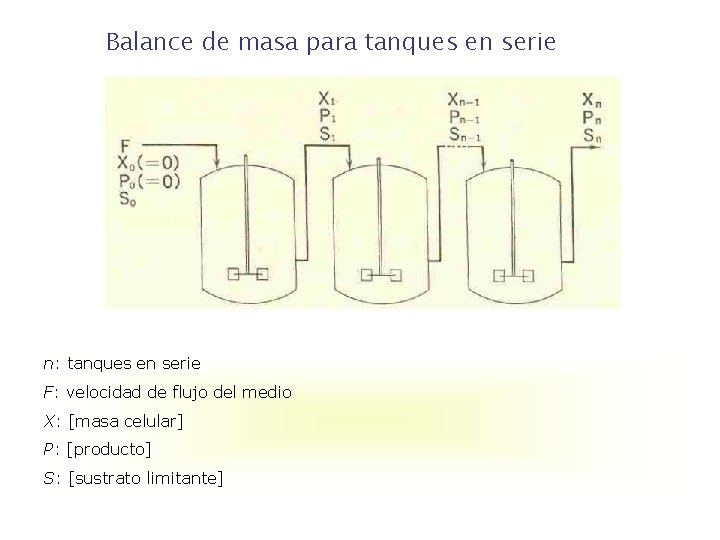
Balance de masa para tanques en serie n: tanques en serie F: velocidad de flujo del medio X: [masa celular] P: [producto] S: [sustrato limitante]

La velocidad de flujo del medio a través de la serie de tanques es F en l / hr, el volumen de cada tanque es V en l. Las ecuaciones de balance para las concentraciones de masa celular X, producto P, sustrato limitante S, son las siguientes: (16) donde: D es la velocidad de dilución = F / V en hr-1 D = 1 / (V / F) = 1 / t = recíproca del tiempo de mantenimiento promedio (ó tiempo de retención) del medio que fluye en cada tanque. Velocidad específica de crecimiento de las células en el nth tanque.

Los subíndices n, (n-1) = nth, (n – 1) th tanques, respectivamente De un modo similar: Donde el coeficiente de rendimiento de producto basado en la masa celular es: Para S:

(18) Donde los coeficientes de rendimiento celular y de producto basados en el sustrato limitante son: Se supone que el medio desde el tanque (n -1) th al nth se mezclan instantáneamente y completamente con los contenidos del tanque nth. Los valores de las constantes de rendimiento Yxs, Ypx, e Yps se suponen constantes, en todos los tanques que se consideran. En condiciones de estado estacionario, el lado izquierdo de todas las ecuaciones es cero. Luego de la ecuación (16):

De acuerdo: (17) La ecuación (17) es útil para estimar el valor de Xn en el nth tanque, ó por el contrario el valor de μn en ee se puede estimar de las concentraciones celulares, Xn-1, etc. Para un solo tanque (n = 1), el valor de X 0 en el lado derecho de la ecuación (16) es cero. Luego:

Como S 1 / (Ks + S 1) < 1, la máxima velocidad de crecimiento que se puede alcanzar en el primer reactor es siempre menor que la velocidad de crecimiento máxima teóricamente posible, ej: D < μmáx. Esto no es verdadero, cuando el reactor no está perfectamente mezclado es decir hay efectos de concentración en la línea de salida, ó cuando hay reciclo. La ecuación en ee para P es: Como el valor de P 0 es cero en un reactor único, en el primero de una serie de reactores continuos, luego: En el ee para el S:

Para n = 1:

Comparación entre Cultivos Batch y Continuos El gráfico siguiente ilustra un ciclo de operación para un cultivo batch. La curva se divide en 4 períodos, crecimiento logarítmico, cosecha de células, preparación de otra corrida batch, y el período de retardo seguido de la inoculación. Estos períodos se designan como tm, t 0, t 1, y t 2, respectivamente. donde: tl = t 0 + t 1 + t 2 en hr, tm: tiempo para el crec. Exponencial en batch, en hr t 0: tiempo requerido para la cosecha en batch, hr Xm: [celular]máx Xi: [celular] inicial
![Considerando a S 0 como la medio frresco e introduciendo el rendimiento Yxs de Considerando a S 0 como la [medio frresco] e introduciendo el rendimiento, Yxs de](https://slidetodoc.com/presentation_image_h2/591cac6677442e376021b2373bf559e1/image-50.jpg)
Considerando a S 0 como la [medio frresco] e introduciendo el rendimiento, Yxs de la ecuación (18): De la misma forma, la velocidad de producción de células en batch, rbatch, será: En operación continua, la velocidad de producción, rcont es:

De las ecuaciones siguientes: (rcont) máx está dada por: (18) Suponiendo que Ks << S 0, la ecuación (18) se reduce a: Ks: constante de saturación en gr / l

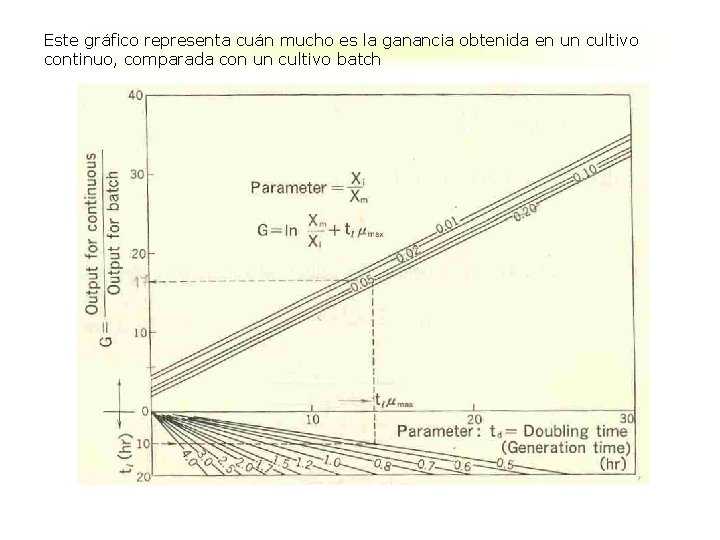
Definiendo el término G, se obtiene la ecuación siguiente: (19) La ecuación (19) se muestra gráficamente en la figura siguiente con parámetros de tamaño de fracción de inóculo, X 1 / Xm y tiempo de duplicación td.

Este gráfico representa cuán mucho es la ganancia obtenida en un cultivo continuo, comparada con un cultivo batch

El valor de G está afectado por los valores de td y tl, pero es menos sensible al valor de Xi / Xm. Un cultivo continuo es más ventajoso con células de crecimiento rápido, esta ventaja también se aplica a la formación de producto, P, en fermentaciones de crecimiento asociado. La ecuación (19) ó bien la figura se derivan suponiendo que los valores de rendimiento, Yxs, permanecen constantes para un organismo en particular, independiente si el cultivo es en batch ó en continuo. Esta suposición no es necesariamente verdadera, pero éste hecho no invalida el uso de la figura de Ganancia de un cultivo continuo comparado a un batch.

Análisis dinámico de reactores tanques agitados continuos El diseño explicado fue para una operación en estado estacionario, aunque los reactores batch y fed – batch pueden operar en modo transiente. Si bien el tiempo es una variable, en batch y fed – batch el diseño del problema fisiológico del cultivo cambia mucho durante la fase de crecimiento exponencial en una fermentación batch, y la fase de retardo puede analizarse adecuadamente usando los modelos de compartimentos simples. En un cultivo fed – batch uno podría trabajar con μ constante (y por consiguiente en un estado fisiológico constante) a menos que haya una transferencia de masa ó de calor insuficiente, lo que hace necesario ajustar una operación a qx constante, por lo tanto disminuye s, pero el estado fisiológico de las células

probablemente no cambia para una fermentación aeróbica de levaduras, ni tampoco en la mayoría de los casos. La fermentación en un tanque agitado continuo es muy sensible a los disturbios en el entorno. Son seguros para predecir el bio proceso de materiales de desecho baratos para hacer productos de valor bajo. Consecuentemente es importante el control del proceso para analizar la dinámica de los reactores tanque agitados continuo. Se lo elige para estudios de calidad científica alta de fisiología de células, muy deseable también para estudios experimentales de estados transientes. Para extraer información fisiológica de estados transientes uno debe ser capaz de modelar la respuesta del reactor a diferentes estados transientes. Se debe estudiar primero la respuesta súbita del reactor a cambios en el entorno. Algunos aspectos fundamentales de la estabilidad del reactor serán el resultado final. Por lo tanto la respuesta del cultivo en un tanque agitado continuo a la contaminación y a cambios en la morfología tienen que estudiarse. La dinámica asociada con cambios en la composición del cultivo son de gran importancia en la industria de la fermentación.

Bibliografía • Nielsen Jens, Villadsen John, Lidén Gunnar. “Bioreaction Engineering Principles”. 2º Edición. Kluwer Academic / Plenum Publishers. 2003 • Aiba Suichi, Humphrey Arthur E, Millis Nancy F. “Biochemical Engineering” 2 ed. Academic Press. 1973
 Sistema continuo definicion
Sistema continuo definicion Ejemplo de sistemas continuos
Ejemplo de sistemas continuos Frases.muy cortas
Frases.muy cortas El mito del carro alado
El mito del carro alado Filosofia de la educacion
Filosofia de la educacion Ejemplo de causa eficiente
Ejemplo de causa eficiente Causas material
Causas material A causa eficiente
A causa eficiente Silogismo exemplos
Silogismo exemplos Cadeia responsiva e eficiente
Cadeia responsiva e eficiente Fronteira eficiente de markowitz
Fronteira eficiente de markowitz Energjia efiçiente
Energjia efiçiente Colombia compra eficiente
Colombia compra eficiente Colombia compra eficiente
Colombia compra eficiente Requisitos de la lectura eficiente
Requisitos de la lectura eficiente Limbajul mainilor
Limbajul mainilor Mi abuela muy elegante para recibirnos
Mi abuela muy elegante para recibirnos Me encantan los espaguetis. son muy _____.
Me encantan los espaguetis. son muy _____. Estructura del past simple
Estructura del past simple Difference between present simple and present continuous
Difference between present simple and present continuous Past perfect simple and continuous
Past perfect simple and continuous Continuos
Continuos Present perfect in passive
Present perfect in passive Datos continuos
Datos continuos Datos discretos o continuos
Datos discretos o continuos Affirmative present progressive
Affirmative present progressive Continuos skill
Continuos skill 5 frasi con while
5 frasi con while Atomizadores continuos
Atomizadores continuos Atomizadores continuos
Atomizadores continuos Present continuous to be ing
Present continuous to be ing Continuos audit
Continuos audit Que son datos discretos y continuos
Que son datos discretos y continuos Present simple vs present continuous examples
Present simple vs present continuous examples Uso del present continuous
Uso del present continuous Future present continuous
Future present continuous Form of past continuous
Form of past continuous Atmica
Atmica Fonemas continuos
Fonemas continuos Sistemas de informacion para ejecutivos
Sistemas de informacion para ejecutivos Sistemas de información para ejecutivos
Sistemas de información para ejecutivos Fees termodinamica
Fees termodinamica Fission reactor nuclearcraft
Fission reactor nuclearcraft Slidetodoc.com
Slidetodoc.com Reactor design pattern
Reactor design pattern Reactor design pattern
Reactor design pattern Magical reactor 3
Magical reactor 3 Which control
Which control Boiling water reactor
Boiling water reactor Nuclear reactor anatomy
Nuclear reactor anatomy Rbmk reactor design flaws
Rbmk reactor design flaws Non isothermal reactor design problems
Non isothermal reactor design problems Reactor pattern
Reactor pattern Tunem
Tunem Como se denomina
Como se denomina Reactor
Reactor Boiling water reactor
Boiling water reactor Reactor design project
Reactor design project