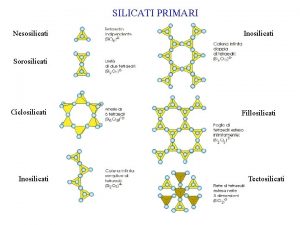
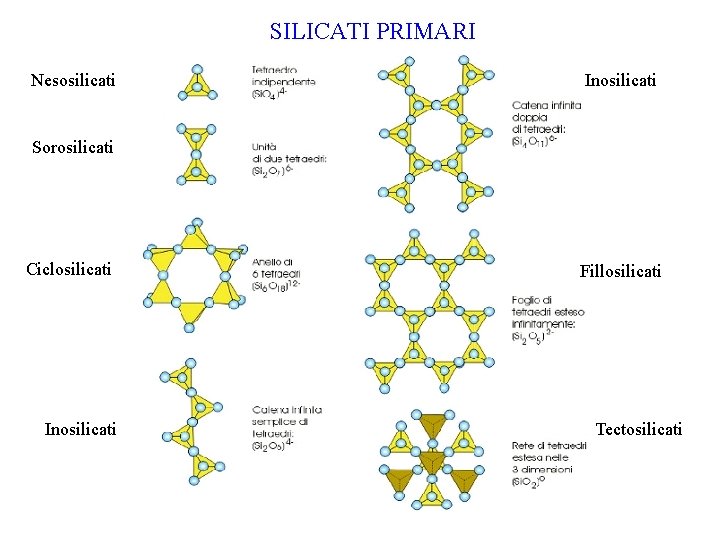
SILICATI PRIMARI Nesosilicati Inosilicati Sorosilicati Ciclosilicati Inosilicati Fillosilicati

























































- Slides: 107

SILICATI PRIMARI Nesosilicati Inosilicati Sorosilicati Ciclosilicati Inosilicati Fillosilicati Tectosilicati

Minerali primari secondari The. Montmorillonites remaining hydroxyoxides. categories of These contain secondary (soil formed) minerals 11. Aluminium gibbsite (Al(OH)3), boehmite 9. or smectites (M+include (Al, Mg)Si O (OH) ). These are the 4 10 2 Minerali resulting from the weathering of primary minerals from soil parent materials. and diaspore (Al. OOH), and allophane. The lossthat of silicon from an secondary Mg and Al rich 2: 1 layer silicates can forn in soils. leaves The M+ secondari By the stagesinof weathering are chemical reached, inherited minerals the Al and time Fe rich residue soil clays. The represents anthese exchangeable cation. composition can invary clay Iron fraction have either disappeared or are present in (Fe. OOH), only minor limonite amounts 12. hydroxyoxides. These include goethite substantially, but the basic expansible structure remains essentially the same. (a hydrated Fe(Ill) hydroxyoxide), and hematite (Fe 2 O 3), lepidocrocite +(Mg, Fe) (Si 8. Interstratified or intermixed layer silicates, vermiculite (M 10. Kaolinite and halloysite (Al Si O (OH) ). The l : 1 layer lattice kaolins 3 are 4 -n (Fe. OOH), ferrihydrite (Fe 2 O 3 • 20. 5 H 2 O) 2 5 4 Aln)O 10 stable (OH)2 oxides. ) and the hydrous (slightly micas. The is M+aleucoxene represents more with time thaninclude the 2: anatase 1 weathered) smectites. Kaolinite common 13. Titanium These and rutile (Ti. O 2), an exchangeable cation. Whether the minerals of thishigh category are component of soil clays and occurs inand relatively concentrations in (hydrated, amorphous titanium oxide), ilmenite (Fe. Ti. O 3), plusinherited zircon from the material or are Titanium secondaryand products derived from inherited moderately weathered soils. (Zr. O 2) andparent corundum (Al 2 O 3). zirconiurn are so immobile in minerals is uncertain in many group cases. are used as indicators of the amount of soils that members of mineral parent material that has weathered to produce a given volume of soil.

Sebbene tutte l minerali sono importanti nel determinare le proprietà dei suoli e la loro fertilità, i minerali inclusi nella frazione argillosa (< 2 m colloidi inorganici) sono i più importanti per l’equilibrio chimico nei suoli: large active surface, electrical charge Main properties of soil colloids Size, Surface area, Surface charges, Adsorption of cations, Adsorption of water, Cohesion, Adhesion, Swelling and shrinkage, Dispersion and flocculation: They display larger reactivity with: ü water ü Chemicals (ions, organic moleculs) übiological components

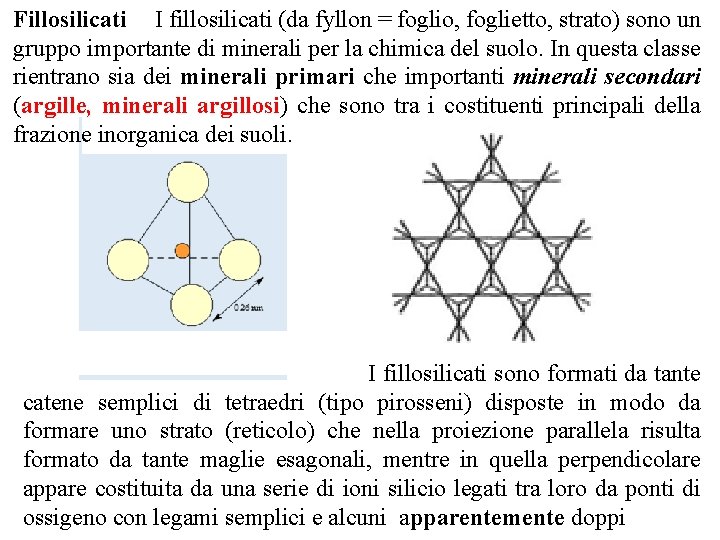
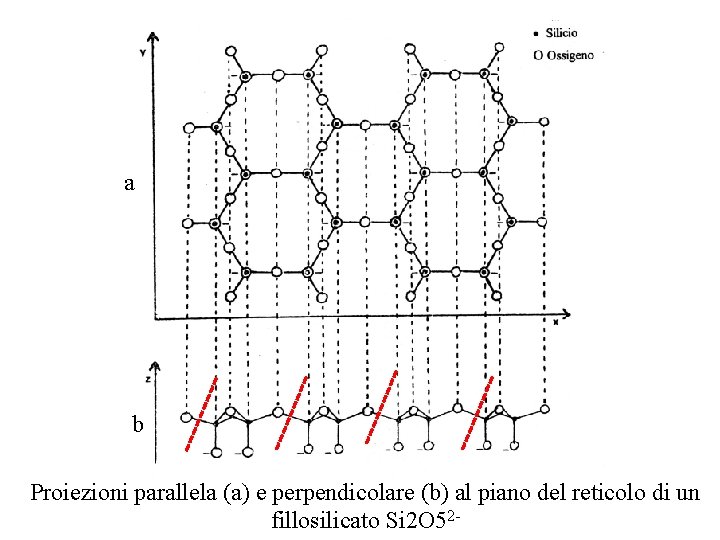
Fillosilicati I fillosilicati (da fyllon = foglio, foglietto, strato) sono un gruppo importante di minerali per la chimica del suolo. In questa classe rientrano sia dei minerali primari che importanti minerali secondari (argille, minerali argillosi) che sono tra i costituenti principali della frazione inorganica dei suoli. I fillosilicati sono formati da tante catene semplici di tetraedri (tipo pirosseni) disposte in modo da formare uno strato (reticolo) che nella proiezione parallela risulta formato da tante maglie esagonali, mentre in quella perpendicolare appare costituita da una serie di ioni silicio legati tra loro da ponti di ossigeno con legami semplici e alcuni apparentemente doppi

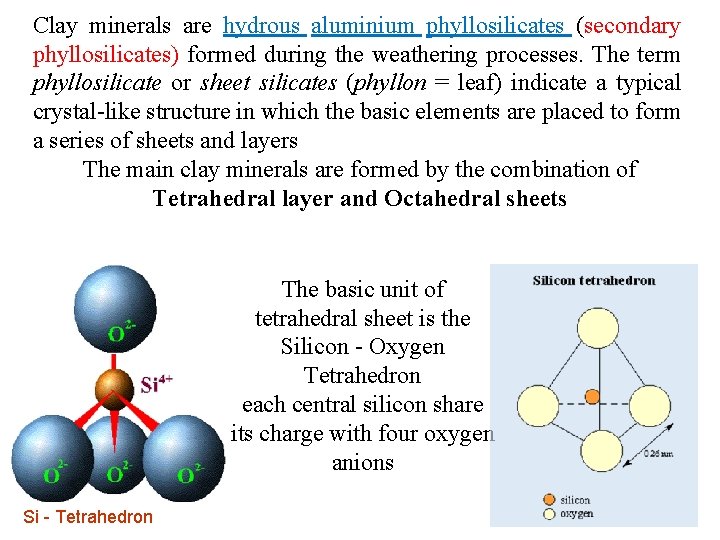
Clay minerals are hydrous aluminium phyllosilicates (secondary phyllosilicates) formed during the weathering processes. The term phyllosilicate or sheet silicates (phyllon = leaf) indicate a typical crystal like structure in which the basic elements are placed to form a series of sheets and layers The main clay minerals are formed by the combination of Tetrahedral layer and Octahedral sheets The basic unit of tetrahedral sheet is the Silicon Oxygen Tetrahedron each central silicon share its charge with four oxygen anions Si - Tetrahedron

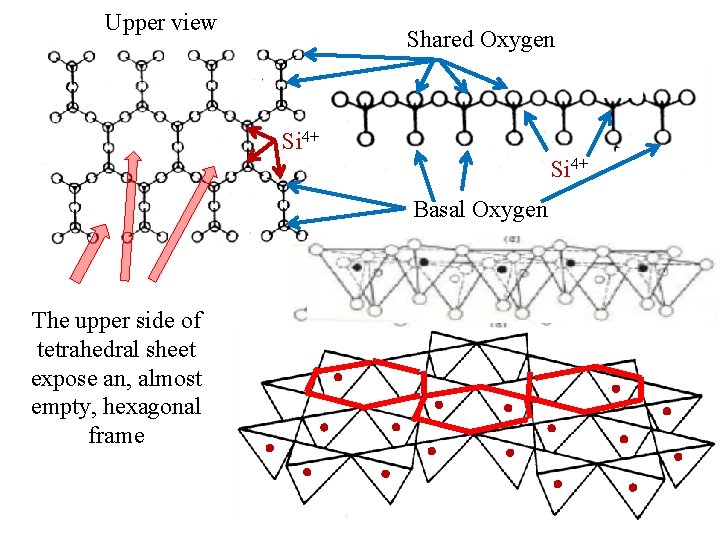
The units are linked to each other to form silica based tetrahedral sheet Along the tetrahedral sheet each Si atom share 3 Oxygen with adjacent tetrahedrons, while 1 Oxygen atoms is not shared; the atoms are dislocated on three level 1 st level O 2 nd level Si 3 rd level O Oxygen Silicon Lateral section

Upper view Shared Oxygen Si 4+ Basal Oxygen The upper side of tetrahedral sheet expose an, almost empty, hexagonal frame

aa b Proiezioni parallela (a) e perpendicolare (b) al piano del reticolo di un fillosilicato Si 2 O 52

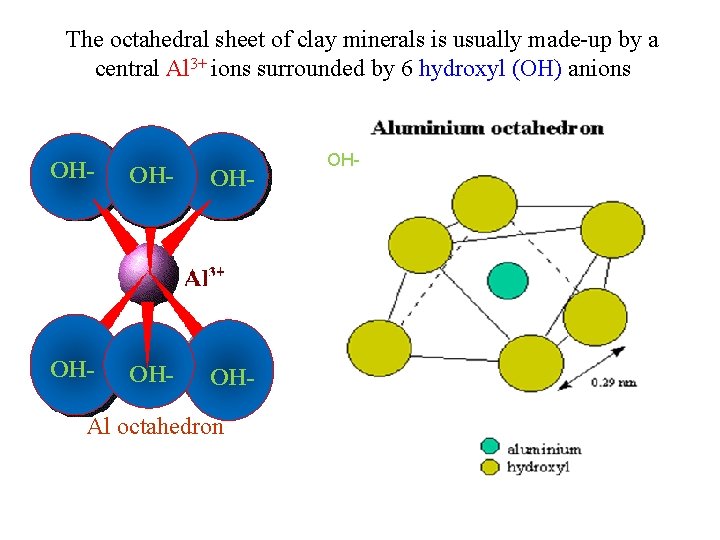
The octahedral sheet of clay minerals is usually made up by a central Al 3+ ions surrounded by 6 hydroxyl (OH) anions OH- OH- OH- Al octahedron OH-

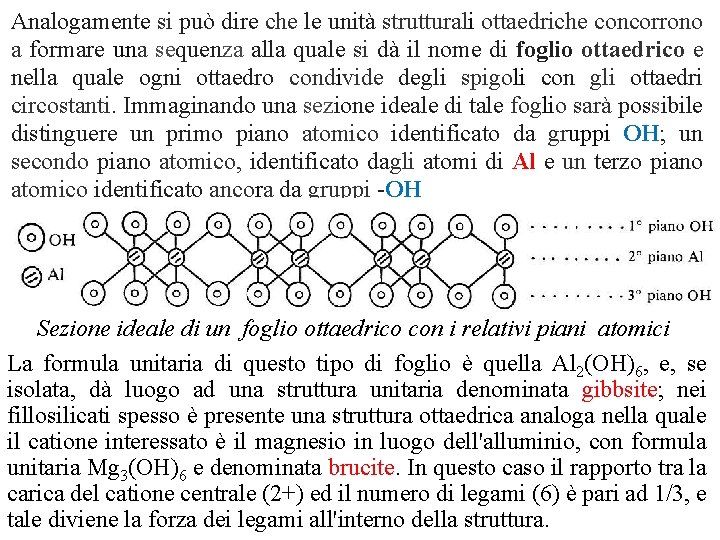
Analogamente si può dire che le unità strutturali ottaedriche concorrono a formare una sequenza alla quale si dà il nome di foglio ottaedrico e nella quale ogni ottaedro condivide degli spigoli con gli ottaedri circostanti. Immaginando una sezione ideale di tale foglio sarà possibile distinguere un primo piano atomico identificato da gruppi OH; un secondo piano atomico, identificato dagli atomi di Al e un terzo piano atomico identificato ancora da gruppi OH Sezione ideale di un foglio ottaedrico con i relativi piani atomici La formula unitaria di questo tipo di foglio è quella Al 2(OH)6, e, se isolata, dà luogo ad una struttura unitaria denominata gibbsite; nei fillosilicati spesso è presente una struttura ottaedrica analoga nella quale il catione interessato è il magnesio in luogo dell'alluminio, con formula unitaria Mg 3(OH)6 e denominata brucite. In questo caso il rapporto tra la carica del catione centrale (2+) ed il numero di legami (6) è pari ad 1/3, e tale diviene la forza dei legami all'interno della struttura.

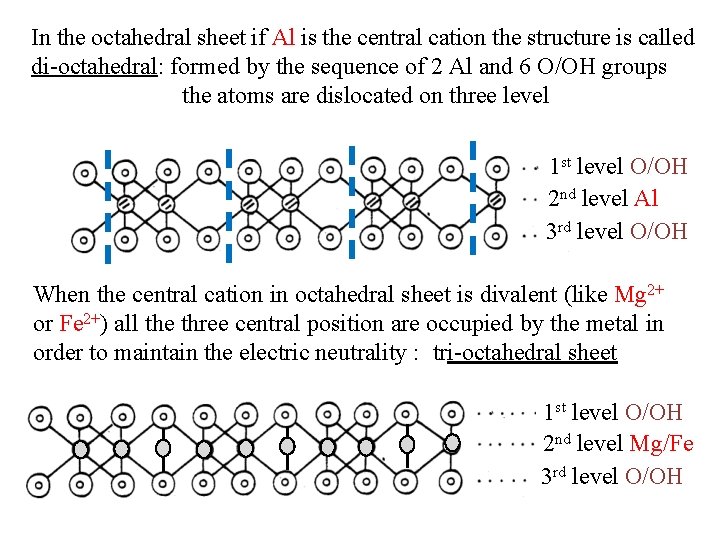
In the octahedral sheet if Al is the central cation the structure is called di octahedral: formed by the sequence of 2 Al and 6 O/OH groups the atoms are dislocated on three level 1 st level O/OH 2 nd level Al 3 rd level O/OH When the central cation in octahedral sheet is divalent (like Mg 2+ or Fe 2+) all the three central position are occupied by the metal in order to maintain the electric neutrality : tri octahedral sheet 1 st level O/OH 2 nd level Mg/Fe 3 rd level O/OH

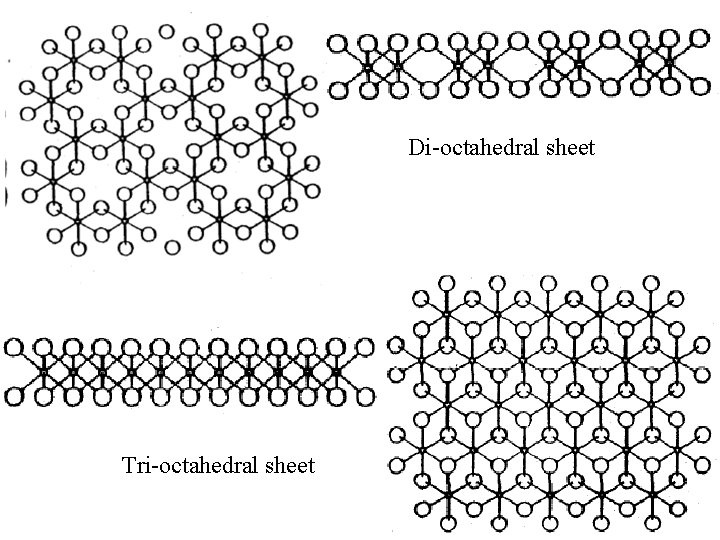
Di octahedral sheet Tri octahedral sheet

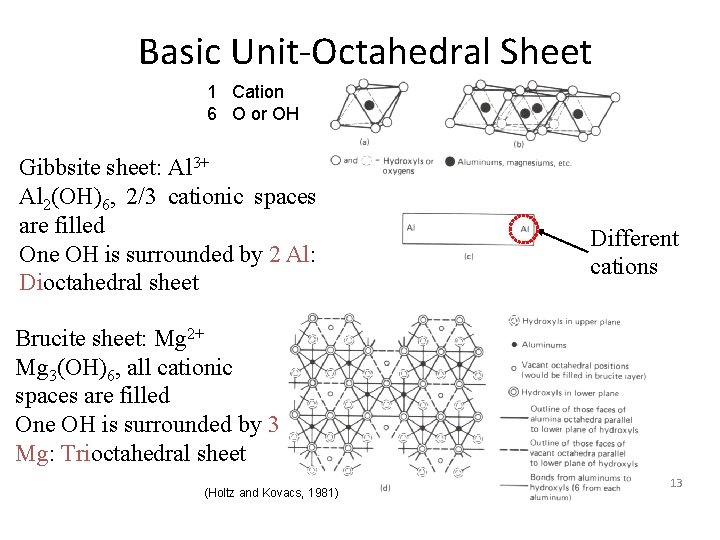
Basic Unit-Octahedral Sheet 1 Cation 6 O or OH Gibbsite sheet: Al 3+ Al 2(OH)6, 2/3 cationic spaces are filled One OH is surrounded by 2 Al: Dioctahedral sheet Different cations Brucite sheet: Mg 2+ Mg 3(OH)6, all cationic spaces are filled One OH is surrounded by 3 Mg: Trioctahedral sheet (Holtz and Kovacs, 1981) 13

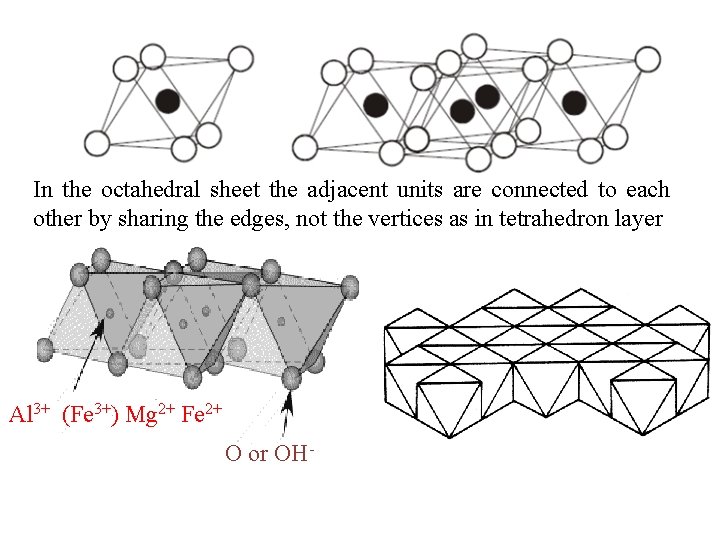
In the octahedral sheet the adjacent units are connected to each other by sharing the edges, not the vertices as in tetrahedron layer Al 3+ (Fe 3+) Mg 2+ Fe 2+ O or OH

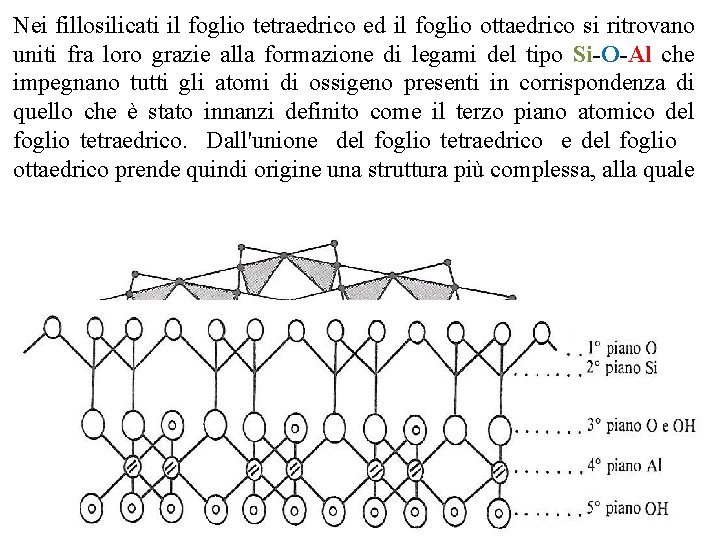
Nei fillosilicati il foglio tetraedrico ed il foglio ottaedrico si ritrovano uniti fra loro grazie alla formazione di legami del tipo Si-O-Al che impegnano tutti gli atomi di ossigeno presenti in corrispondenza di quello che è stato innanzi definito come il terzo piano atomico del foglio tetraedrico. Dall'unione del foglio tetraedrico e del foglio ottaedrico prende quindi origine una struttura più complessa, alla quale si dà il nome di «strato» , od anche di «pacchetto» o di «fascetto» . Nei casi più semplici lo strato è formato dall'unione di un foglio tetraedrico e di un foglio ottaedrico; si parla allora di fillosilicati del tipo 1: 1

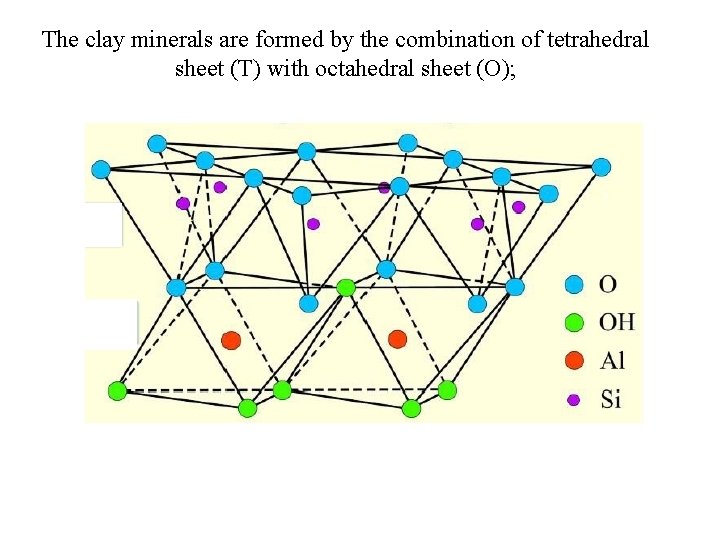
The clay minerals are formed by the combination of tetrahedral sheet (T) with octahedral sheet (O);

The tetrahedral sheet share the basal oxygen atoms with octahe O Si O and OH Al OH

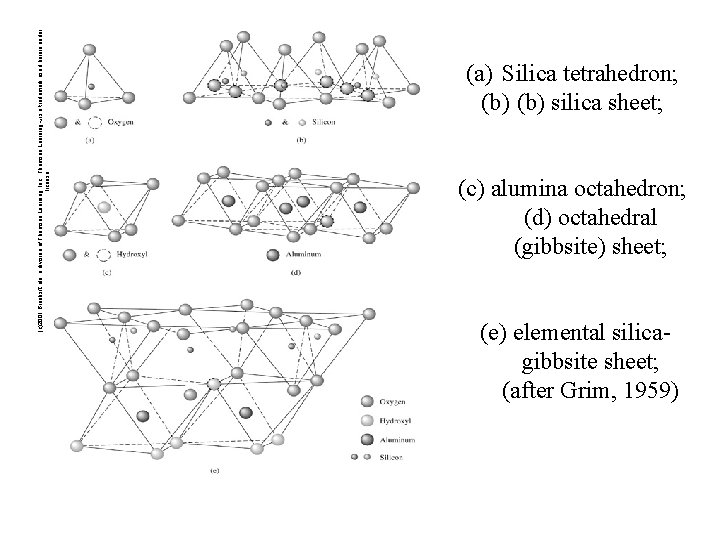
(c)2001 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning ™ is a trademark used herein under license. (a) Silica tetrahedron; (b) silica sheet; (c) alumina octahedron; (d) octahedral (gibbsite) sheet; (e) elemental silica gibbsite sheet; (after Grim, 1959)


Esistono tuttavia anche fillosilicati nei quali lo strato è formato da una sequenza del tipo: foglio tetraedrico foglio ottaedrico foglio tetraedrico; in tal caso si parla di fillosilicati del tipo 2: 1 o di tipo TOT I legami che invece tengono uniti fra loro strati diversi possono essere di diversa natura quali legami idrogeno, forze di van der Waals, ecc. La natura dei legami in atto fra strato e strato condiziona in misura notevolissima le proprietà chimiche e fisiche dei fillosilicati. La forza dei legami agenti fra gli strati condiziona le distanze che intercorrono fra la base di uno strato e la base corrispondente dello strato successivo. Tale distanza, indicata con il nome di «distanza basale» o di «periodo di identità» ed anche il «lato c» costituisce uno dei parametri in base ai quali vengono comunemente caratterizzati i diversi fillosilicati. Quanto più deboli sono le forze agenti fra gli strati, tanto più facilmente il minerale tende a sfaldarsi, assumendo così il tipico aspetto a scaglie proprio delle particelle della maggior parte dei fillosilicati presenti nel terreno

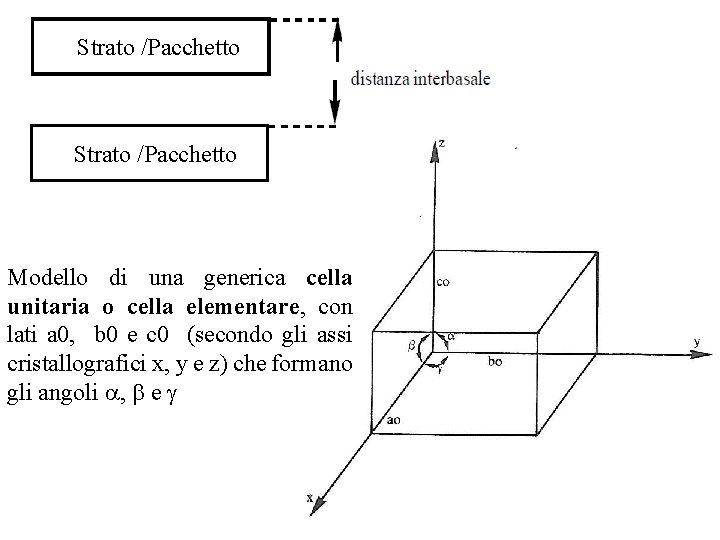
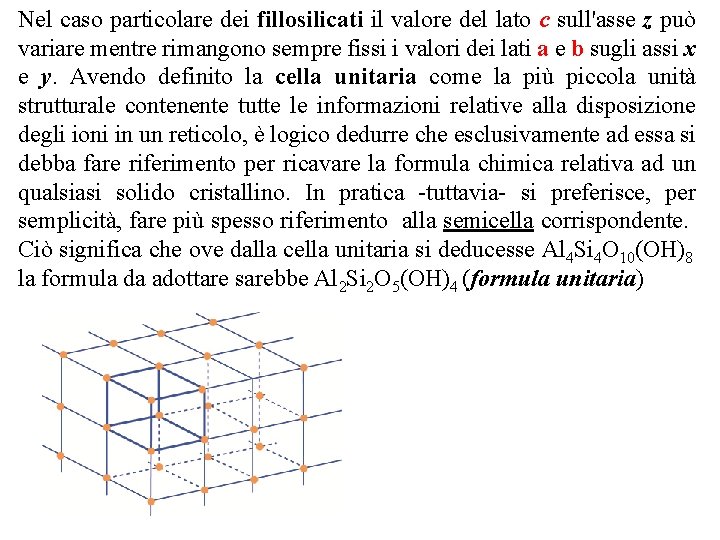
Strato /Pacchetto Modello di una generica cella unitaria o cella elementare, con lati a 0, b 0 e c 0 (secondo gli assi cristallografici x, y e z) che formano gli angoli a, b e g

Modello di una generica cella unitaria o cella elementare, con lati a 0, b 0 e c 0 (secondo gli assi cristallografici x, y e z) che formano gli angoli a, b e g La struttura dei minerali è il risultato della ripetizione, lungo le tre dimensioni dello spazio, di un ideale modulo di base al quale si dà il nome di «cella unitaria» o di «cella elementare» . La cella unitaria si può considerare quindi come la più piccola porzione di un reticolo cristallino contenente tutte le informazioni relative alla disposizione degli atomi o degli ioni nel reticolo stesso. La cella unitaria, che è sempre un parallelepipedo, è definita, generalmente, in base alle sue dimensioni, riferite ad un sistema di due assi perpendicolari x e y, i quali identificano un piano di base, e di un asse z ortogonale al piano stesso e passante per la comune origine di x e di y

Nel caso particolare dei fillosilicati il valore del lato c sull'asse z può variare mentre rimangono sempre fissi i valori dei lati a e b sugli assi x e y. Avendo definito la cella unitaria come la più piccola unità strutturale contenente tutte le informazioni relative alla disposizione degli ioni in un reticolo, è logico dedurre che esclusivamente ad essa si debba fare riferimento per ricavare la formula chimica relativa ad un qualsiasi solido cristallino. In pratica tuttavia si preferisce, per semplicità, fare più spesso riferimento alla semicella corrispondente. Ciò significa che ove dalla cella unitaria si deducesse Al 4 Si 4 O 10(OH)8 la formula da adottare sarebbe Al 2 Si 2 O 5(OH)4 (formula unitaria)

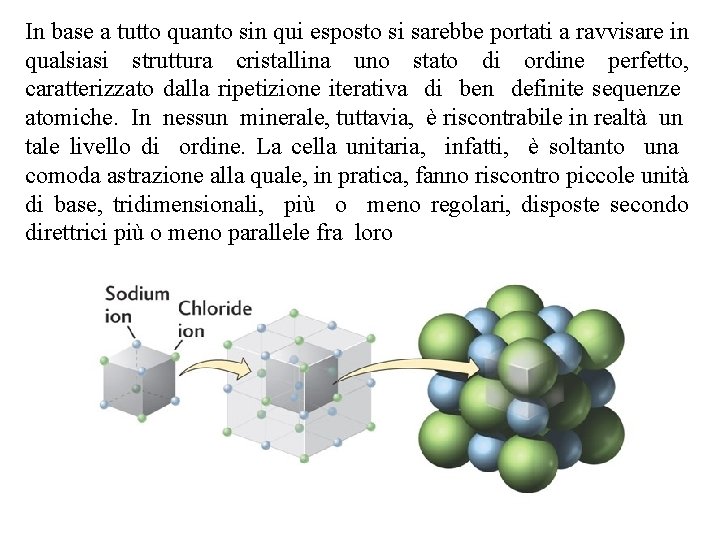
In base a tutto quanto sin qui esposto si sarebbe portati a ravvisare in qualsiasi struttura cristallina uno stato di ordine perfetto, caratterizzato dalla ripetizione iterativa di ben definite sequenze atomiche. In nessun minerale, tuttavia, è riscontrabile in realtà un tale livello di ordine. La cella unitaria, infatti, è soltanto una comoda astrazione alla quale, in pratica, fanno riscontro piccole unità di base, tridimensionali, più o meno regolari, disposte secondo direttrici più o meno parallele fra loro

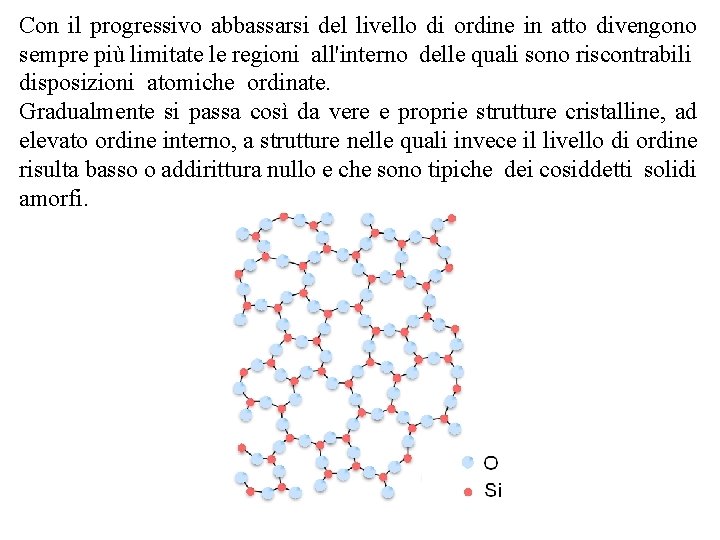
Con il progressivo abbassarsi del livello di ordine in atto divengono sempre più limitate le regioni all'interno delle quali sono riscontrabili disposizioni atomiche ordinate. Gradualmente si passa così da vere e proprie strutture cristalline, ad elevato ordine interno, a strutture nelle quali invece il livello di ordine risulta basso o addirittura nullo e che sono tipiche dei cosiddetti solidi amorfi.


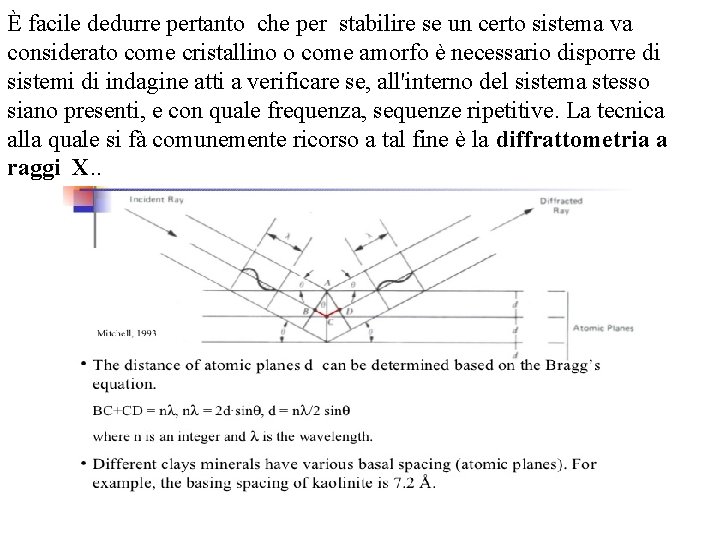
È facile dedurre pertanto che per stabilire se un certo sistema va considerato come cristallino o come amorfo è necessario disporre di sistemi di indagine atti a verificare se, all'interno del sistema stesso siano presenti, e con quale frequenza, sequenze ripetitive. La tecnica alla quale si fà comunemente ricorso a tal fine è la diffrattometria a raggi X. .

La distinzione fra sistemi cristallini e amorfi, per tutto quanto sin qui esposto, resta comunque imprecisa. In linea generale, e per quanto attiene in particolare ai costituenti solidi della frazione argillosa del suolo, vengono considerati cristallini quei sistemi nei quali le sequenze regolari hanno dimensioni di almeno 3 6 nm. I sistemi nei quali le sequenze regolari dei costituenti strutturali non si estendono oltre 1 nm vengono considerati invece amorfi

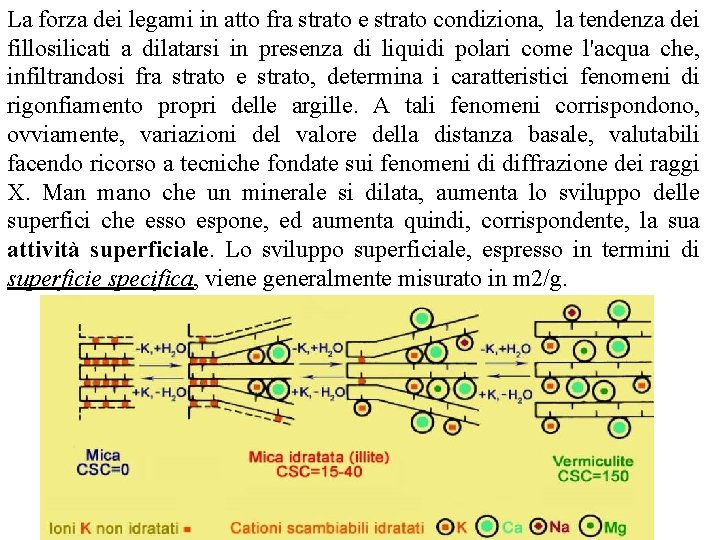
La forza dei legami in atto fra strato e strato condiziona, la tendenza dei fillosilicati a dilatarsi in presenza di liquidi polari come l'acqua che, infiltrandosi fra strato e strato, determina i caratteristici fenomeni di rigonfiamento propri delle argille. A tali fenomeni corrispondono, ovviamente, variazioni del valore della distanza basale, valutabili facendo ricorso a tecniche fondate sui fenomeni di diffrazione dei raggi X. Man mano che un minerale si dilata, aumenta lo sviluppo delle superfici che esso espone, ed aumenta quindi, corrispondente, la sua attività superficiale. Lo sviluppo superficiale, espresso in termini di superficie specifica, viene generalmente misurato in m 2/g.

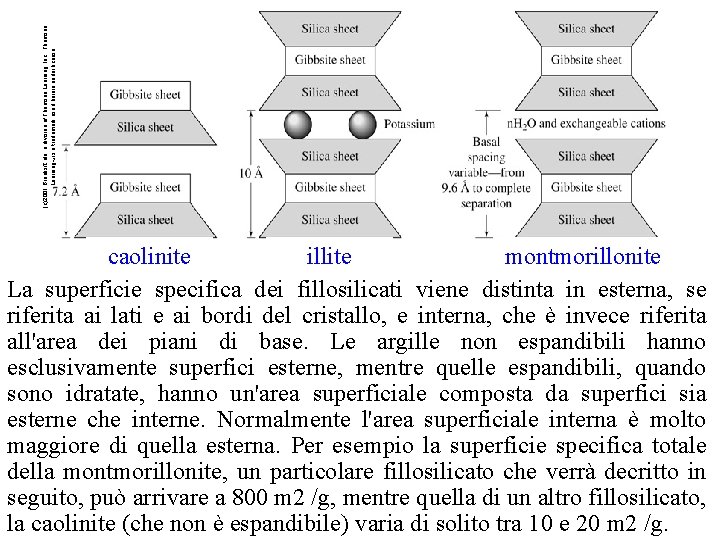
(c)2001 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning ™ is a trademark used herein under license. caolinite illite montmorillonite La superficie specifica dei fillosilicati viene distinta in esterna, se riferita ai lati e ai bordi del cristallo, e interna, che è invece riferita all'area dei piani di base. Le argille non espandibili hanno esclusivamente superfici esterne, mentre quelle espandibili, quando sono idratate, hanno un'area superficiale composta da superfici sia esterne che interne. Normalmente l'area superficiale interna è molto maggiore di quella esterna. Per esempio la superficie specifica totale della montmorillonite, un particolare fillosilicato che verrà decritto in seguito, può arrivare a 800 m 2 /g, mentre quella di un altro fillosilicato, la caolinite (che non è espandibile) varia di solito tra 10 e 20 m 2 /g.

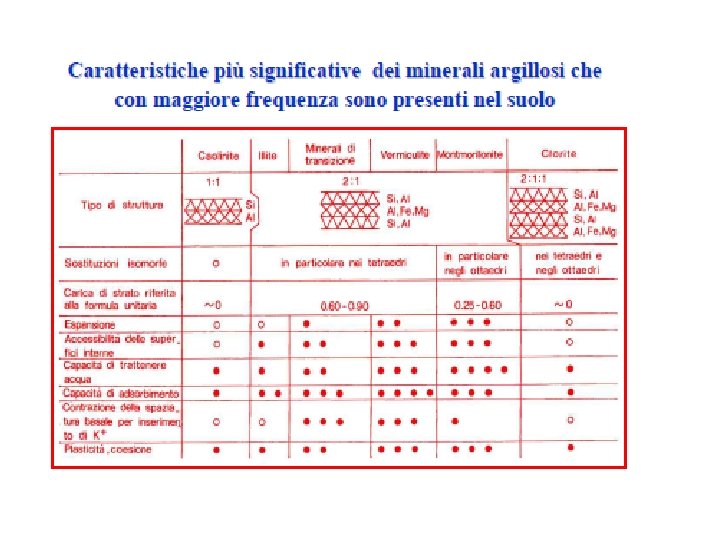
Le diverse classi di fillosilicati I parametri fondamentali sui quali la classificazione dei fillosilicati è fondata sono i seguenti: 1) numero e ordine di successione dei fogli tetraedrici e ottaedrici che concorrono alla formazione dello strato; 2) tipo di coordinazione ottaedrica 3) ioni presenti o prevalenti nei fogli tetraedrici e ottaedrici; 4)formula della cella unitaria o cella elementare 5)natura dei legami in atto fra strato e tipo di cationi eventualmente presenti negli spazi interstrato; 6)valore della distanza basale, o periodo di identità; forma macroscopica di cristallizzazione 7) area superficiale 8)carica della cella unitaria, o carica di strato (sostituzione isomorfa) e posizionamento della sostituzione isomorfa e della carica (strato tetraedrico o ottaedrico) La carica di strato è definita carica permanente poiché dipende dalla costituzione del fillosilicato ed è una proprietà non modificabile

The different clay minerals originate as a consequence of the (chemical) weathering processes: the final arrangement and type of secondary phyllosilicates depends on the type of ionic forms, concentration, p. H, the ortho silic acid (H 4 Si. O 4) may react with etc. ; hydroxy aluminiun ions to form monomers with different Si/Al ratios

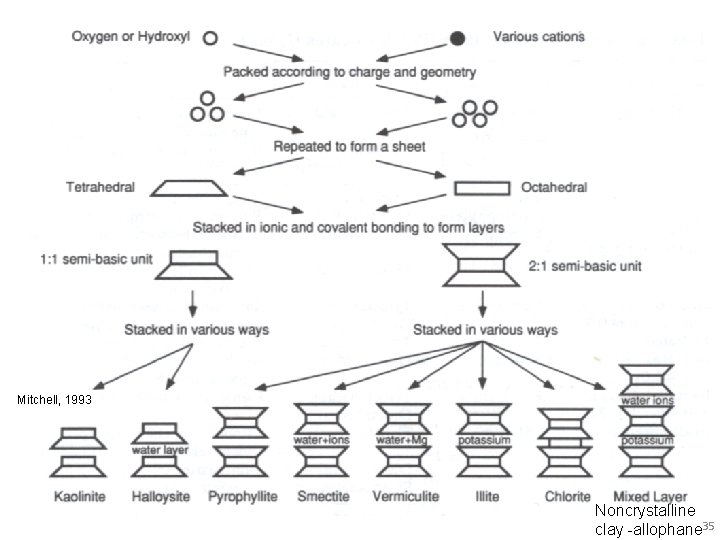
The monomeric forms may progressively polimerize to build up the clay structure, dimorphic (1: 1), trimorphic (2: 1) etc, tetrahedral octahedral sheet 1: 1/T O dimorfico T T O 2: 1/T O T trimorfico

Mitchell, 1993 Noncrystalline clay -allophane 35

The clays are characterized by the following properties and features Ø sequence of tetrahedral and octahedral sheet in the layer (phyllo) • T O dimorfhic or Clay 1: 1 • T O T trimorphic or Clay 2: 1 • T O tetramorphic or Clay 2: 1: 1 Ø Type of interlayer bonding and neutralizing ions (e. g. H bonding, salt bridges, etc. ) Ø basal spacing: thickness of clay layer Ø charge density in the layer or layer charge per unit cell of structure (isomorphic substitution) Ø exposed surface area (m 2/g) Ø type of octahedral sheet (dioctahedral or trioctahedral)

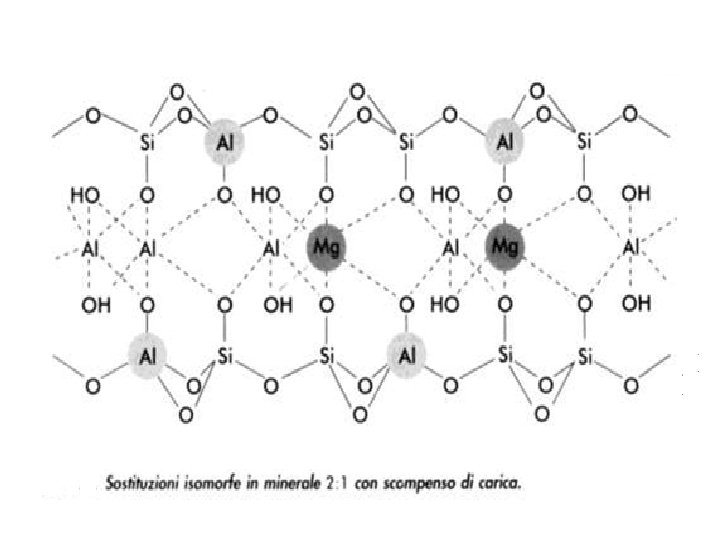
Il parametro relativo alla carica della cella unitaria o carica di strato, viene determinato dalle sostituzioni isomorfe e risulta importante particolarmente ai fini della classificazione dei fillosilicati del tipo 2: 1 (Carica permanente : caratteristiche strutturali del fillosilicato) La Sostituzione Isomorfa avviene durante la formazione dei minerali quando ioni di dimensioni simili ma di valenza diversa si sostituiscono nelle posizioni tetraedriche ed ottaedriche. Al 3+ sostituisce Si 4+ nei tetraedri mentre Mg 2+ sostituisce Al 3+ negli ottaedri. Da ciò deriva che alcune valenze dell’O e del gruppo OH non sono più neutralizzate da cariche positive e le particelle assumono una carica negativa permanente che neutralizzano adsorbendo cationi presenti nella soluzione del suolo. Senza sostituzione isomorfa vi è bilanciamento di carica. Nel Talco 2: 1 non sostituito Al 4 Si 8 O 20(OH)4 La carica è: 4 x 3+ = + 12 per Al; 8 x 4+ = + 32 per Si; 20 x 2 = 40 per O; 4 x 1 = 4 per OH 0 = carica netta

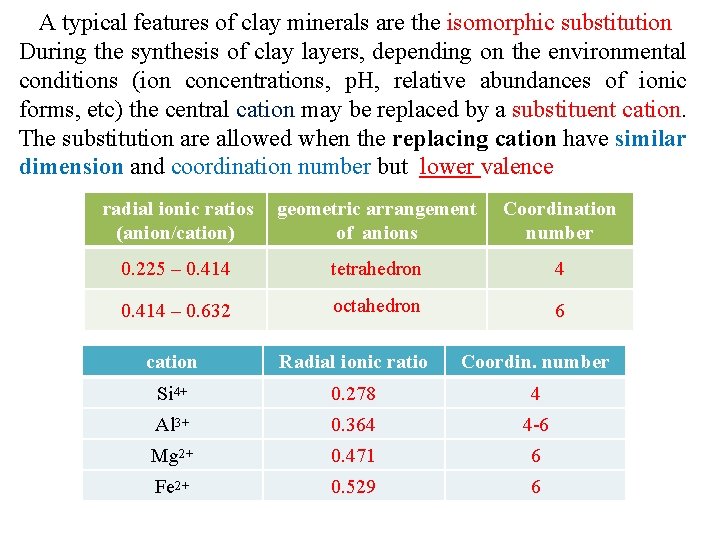
A typical features of clay minerals are the isomorphic substitution During the synthesis of clay layers, depending on the environmental conditions (ion concentrations, p. H, relative abundances of ionic forms, etc) the central cation may be replaced by a substituent cation. The substitution are allowed when the replacing cation have similar dimension and coordination number but lower valence radial ionic ratios (anion/cation) geometric arrangement of anions Coordination number 0. 225 – 0. 414 tetrahedron 4 0. 414 – 0. 632 octahedron 6 cation Radial ionic ratio Coordin. number Si 4+ 0. 278 4 Al 3+ 0. 364 4 6 Mg 2+ 0. 471 6 Fe 2+ 0. 529 6


In the tetrahedral sheet the Si 4+may be replaced by Al 3+ Each Si 4+ balance 1 negative charge of 4 Oxigen (net charge = 0) 4 (O) 2 (OH) Al 3+ 4 Si (3 Si 4+4+) 4+ 4+ 3+4+ 4+ The Al 3+ may partially balance the negative charge of each Oxigen (3/4=0. 75) for each Al – O bond there is a d= 0. 25 of unbalanced negative charge

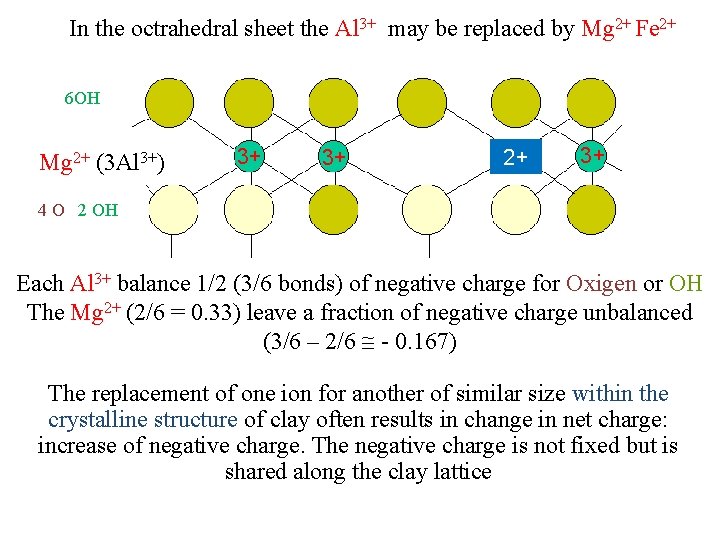
In the octrahedral sheet the Al 3+ may be replaced by Mg 2+ Fe 2+ 6 OH 3+ 3+ 4 Al Mg 2+ (3 Al ) 3+ 3+ 2+ 3+ 3+ 4 O 2 OH Each Al 3+ balance 1/2 (3/6 bonds) of negative charge for Oxigen or OH The Mg 2+ (2/6 = 0. 33) leave a fraction of negative charge unbalanced (3/6 – 2/6 0. 167) The replacement of one ion for another of similar size within the crystalline structure of clay often results in change in net charge: increase of negative charge. The negative charge is not fixed but is shared along the clay lattice


In un minerale che ha subito sostituzione isomorfa ottaedrica: [Al 3. 5 Mg 0. 5]Si 8 O 20(OH)4 (Montmorillonite), sostituzione di 0. 5 moli di Mg per 0. 5 moli di Al in un foglio ottaedrico 3. 5 x 3+ = +10. 5 per Al 0. 5 x 2+ =+1 per Mg 8. 0 x 4+ = +32 per Si 20 x 2 = 40 per O 4 x 1 = 4. 0 per OH 43. 5+ 44 -0. 5 di carica netta per unità di strato Sostituzione tetraedrica Al 4[Si 7 Al]O 20(OH)4 (Illite) 43+ e 44 = 1 carica netta Sostituzione tetraedrica e ottaedrica [Al 3. 7 Mg 0. 3][Si 7. 2 Al 0. 8]O 20(OH)4 0. 3 e 0. 8 = 1. 1 di carica netta si noti che in questa tabella la carica di strato è riferita alla formula unitaria, corrispondente per convenzione a metà della cella unitaria corrispondente.

Gli ioni presenti o prevalenti nei fogli tetraedrici ed ottaedrici costituiscono un altro criterio di classificazione di grande importanza. In particolare risulta spesso determinante ai fini della classificazione la distinzione fra minerali definiti diottaedrici, nei quali cioè due delle tre posizioni della formula unitaria dei fogli ottaedrici sono occupate da cationi trivalenti come l'alluminio (che come si è precedentemente detto assumono il nome di gibbsite) e quelli triottaedrici, nei quali tutte e tre le posizioni sono occupate da cationi bivalenti come il magnesio (brucite). Cationi prevalenti nei fogli ottaedrici dei fillosilicati del tipo 2: 1

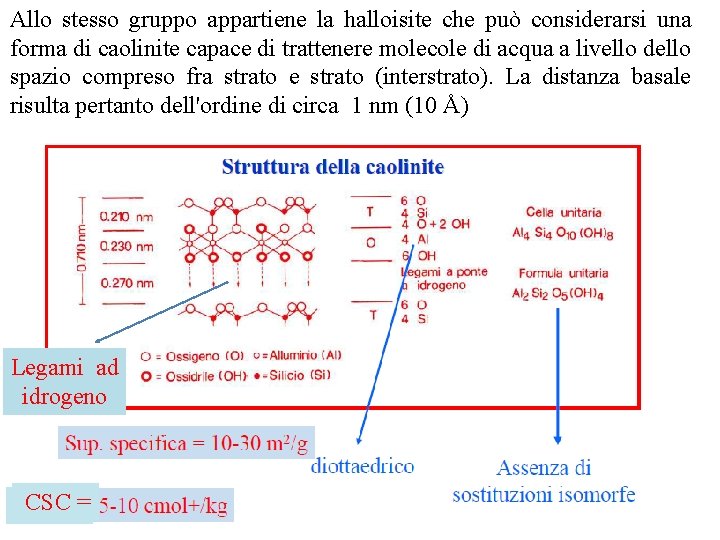
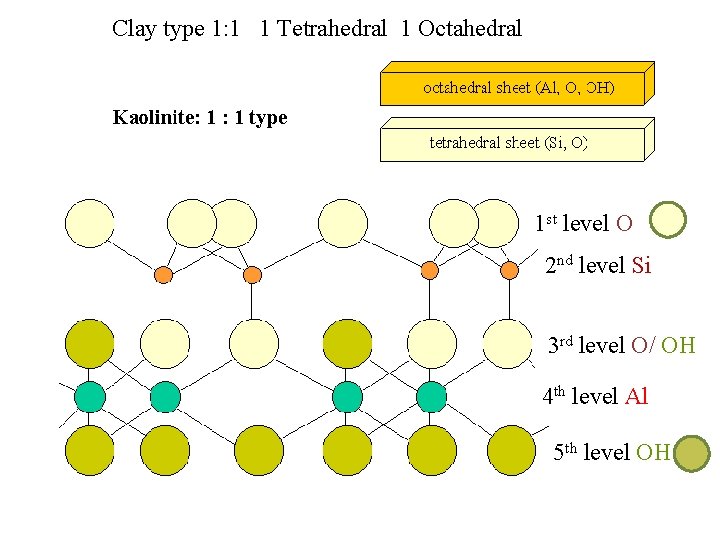
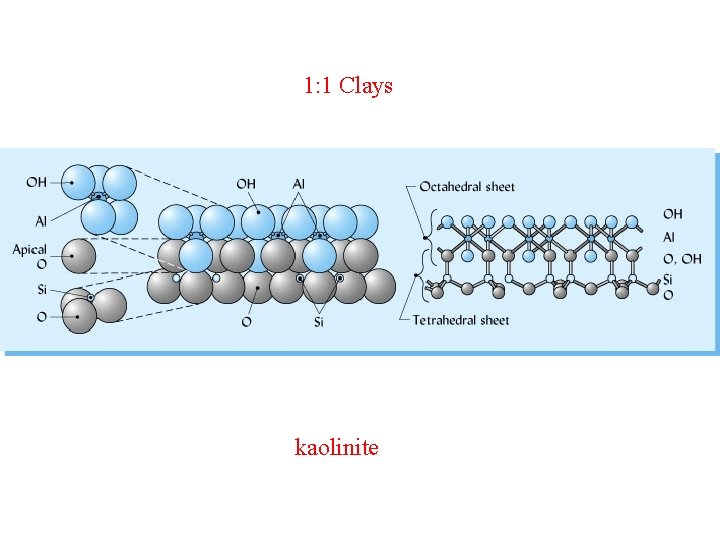
Distanza basale Caoliniti o caolini Sono fillosilicati secondari e di dimensioni grossolane (2 0, 2 micron) del tipo 1: 1 / T O (struttura dimorfica) il più tipico dei quali è rappresentato dalla caolinite, il minerale che dà il nome al gruppo. Dallo schema della cella unitaria di questo minerale si deduce che ad esso va attribuita una formula unitaria del tipo Al 2 Si 2 O 5(OH)4

Sempre sulla scorta di tale schema è possibile notare che fra strato e strato sono in atto legami a idrogeno, i quali impediscono il verificarsi di fenomeni di dilatazione e fanno sì che la distanza basale assuma un valore piuttosto basso (7, 2 Å = 0. 72 nm). Poco estesa risulta pertanto la superficie specifica, compresa fra 10 e 20 m 2/g. Nella formula attribuita alla caolinite il rapporto Si: Al risulta pari ad 1; ciò autorizza a ritenere scarsi o addirittura nulli i fenomeni di sostituzione isomorfa = assenza di carica permanente. Viceversa la presenza, lungo i bordi della cella unitaria della caolinite, e più generalmente di tutti i caolini, di gruppi OH capaci di dissociarsi in rapporto al p. H dell'ambiente nel quale il sistema si ritrova, può determinare la comparsa di una carica elettrica per neutralizzare la quale sono necessari da 1 a 10 milliequivalenti (m. e. ) di ioni di carica opposta per ogni 100 grammi di materiale (CSC). Come si avrà modo di osservare meglio in seguito tale carica che prende il nome di carica variabile o p. H dipendente assume notevole rilevanza nel determinare il comportamento di alcuni importanti costituenti della frazione colloidale del terreno

Allo stesso gruppo appartiene la halloisite che può considerarsi una forma di caolinite capace di trattenere molecole di acqua a livello dello spazio compreso fra strato e strato (interstrato). La distanza basale risulta pertanto dell'ordine di circa 1 nm (10 Å) I minerali fin qui considerati sono diottaedrici. Esiste però tutta una serie di fillosilicati triottaedrici appartenenti sempre allo stesso gruppo, i più importanti dei quali sono i seguenti: i minerali definiti serpentini, con la formula generale Mg 3 Si 2 O 5 (OH)4 la cronstedite, nella quale tipicamente il foglio triottaedrico è occupato da Fe 2+, con sostituzioni di Fe 3+ nelle posizioni sia Legami ad che tetraedriche ottaedriche idrogeno CSC== CSC

1: 1 Silicate Clays • Layers composed of one tetrahedral sheet bound to one octahedral sheet • Kaolinite: one of the most widespread clay minerals in soils; most abundant in warm moist climates • Stable at low p. H, the most weathered of the silicate clays • Synthesized under equal concentrations of Al 3+ and Si 4+

Clay type 1: 1 1 Tetrahedral 1 Octahedral 1 st level O 2 nd level Si 3 rd level O/ OH 4 th level Al 5 th level OH


1: 1 Clays kaolinite

Basic unit (cell) Al 4 Si 4 O 10(OH)8 Unitary formula (Half of cell) H bond Al 2 Si 2 O 5(OH)4 H bonding between layers No Interlayer space Basal spacing Surface area= 10 -30 m 2/g NO isomorphic substitution No layer charge low CEC (2 -15 cmol/kg) Nutrient poor

1: 1 Minerals-Kaolinite Basal spacing is 7. 2 Å layer • Si 4 Al 4 O 10(OH)8. Platy shape • The bonding between layers are van der Waals forces and hydrogen bonds (strong bonding). • There is no interlayer swelling • Width: 0. 1~ 4 m, Thickness: 0. 05~2 m Trovey, 1971 ( from Mitchell, 1993) 17 m 53

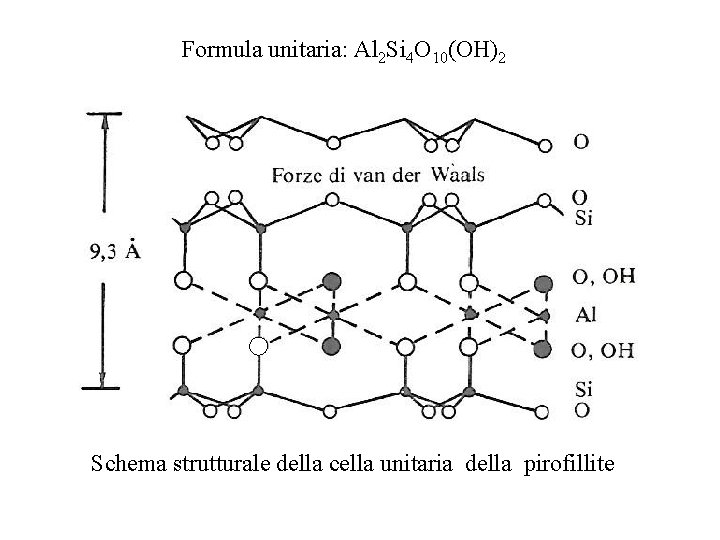
Pirofillite e talco Sono fillosilicati del tipo 2: 1 (T O T); l'unità strutturale è caratterizzata quindi dalla presenza di un foglio ottaedrico chiuso a «sandwich» fra due fogli tetraedrici. Nella cella unitaria della pirofillite, non sono riscontrabili fenomeni di sostituzioni isomorfe e pertanto la carica di strato è nulla. La formula unitaria attribuibile ad essa è Al 2 Si 4 O 10(OH)2. Nella pirofillite i legami in atto fra strato e strato sono piuttosto deboli e attribuibili esclusivamente alle forze di van der Waals e la distanza basale è di 9, 3 Å (0. 93 nm). Un altro materiale, appartenente allo stesso gruppo, è il talco, che si differenzia dalla pirofillite solo per il fatto che il catione predominante a livello ottaedrico è rappresentato dal Mg 2+ anziché dall'Al 3+. Anche nel caso del talco la carica di strato è nulla

Formula unitaria: Al 2 Si 4 O 10(OH)2 Schema strutturale della cella unitaria della pirofillite

Pirofillite Talco

2: 1 Silicate Clays • Two silica tetrahedral sheets linked to one aluminum octahedral sheet • Three key groups: – Smectites (e. g. , montmorillonite) – Vermiculites – Micas (e. g. , illite) • And one “ 2 1 1” (chlorites)

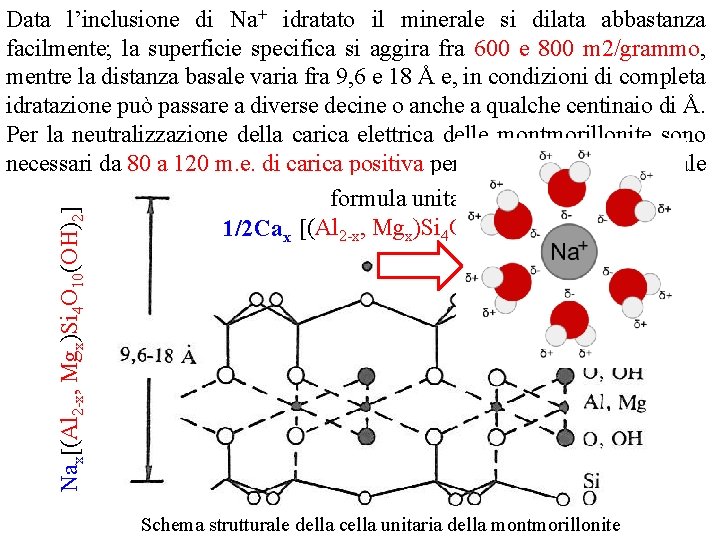
Smectiti o montmorilloniti Sono fillosilicati secondari del tipo 2: 1/ T O T (trimorfici), di dimensioni piccolissime. Il principale carattere che distingue fra loro i materiali montmorillonitici è rappresentato dal tipo e dalla entità dei fenomeni di sostituzione isomorfa che, principalmente a livello ottaedrico, minori a livello tetraedrico, danno origine a cariche elettriche negative, alla neutralizzazione delle quali concorrono cationi posizionati sia tra i foglietti quanto cationi esterni alla struttura (cationi scambiabili) Il materiale più rappresentativo del gruppo e dal quale il gruppo stesso trae il nome è la montmorillonite. Dallo schema della cella unitaria di questo minerale si deduce che ad esso va attribuita una formula del tipo Nax (Al 2 -x. Mgx)Si 4 O 10(OH)2 nella quale lo ione Na+ assume il ruolo del catione che neutralizza la carica di strato, indotta dai fenomeni di parziale sostituzione dell‘Al 3+ ottaedrico da parte di Mg 2+ e talvolta di Fe 2+. Si può avere anche sostituzione del Si 4+ tetraedrico da parte di Al 3+. Il valore della carica di strato è generalmente vicino ad 1

Nax (Al 2 x, Mgx)Si 4 O 10(OH)2 Data l’inclusione di Na+ idratato il minerale si dilata abbastanza facilmente; la superficie specifica si aggira fra 600 e 800 m 2/grammo, mentre la distanza basale varia fra 9, 6 e 18 Å e, in condizioni di completa idratazione può passare a diverse decine o anche a qualche centinaio di Å. Per la neutralizzazione della carica elettrica delle montmorillonite sono necessari da 80 a 120 m. e. di carica positiva per 100 grammi di materiale formula unitaria Naxx (Al 2 x, Mgx)Si 4 O 10(OH)2 1/2 Ca Schema strutturale della cella unitaria della montmorillonite


2: 1 minerals with octahedral layer charge (x) Smectites x = 0. 4 – 1. 2 • Layer charge originates mainly from the substitution of Mg 2+ for Al 3+ in the octahedral sheet • Montmorillonite Mx, H 2 O (Al 3 x, Mgx)(Si 8)O 20(OH)4 • Unstable (weathers to something else) under low p. H and high moisture • Most swelling of all clays • “Nutrient rich

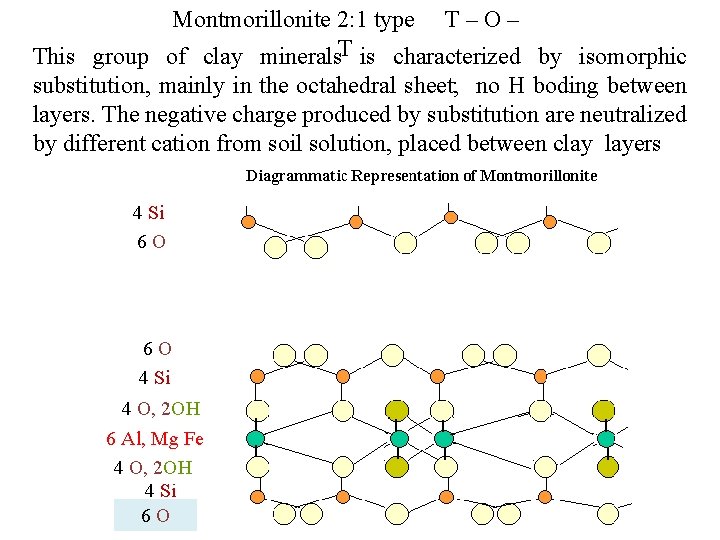
Montmorillonite 2: 1 type T – O – This group of clay minerals. T is characterized by isomorphic substitution, mainly in the octahedral sheet; no H boding between layers. The negative charge produced by substitution are neutralized by different cation from soil solution, placed between clay layers 4 Si 6 O cations 6 O 4 Si 4 O, 2 OH 6 Al, Mg Fe 4 O, 2 OH 4 Si 6 O Na Ca K



(c)2001 Brooks/Cole, a division of Thomson Learning, Inc. Thomson Learning ™ is a trademark used herein under license. Atomic structure of montmorillonite

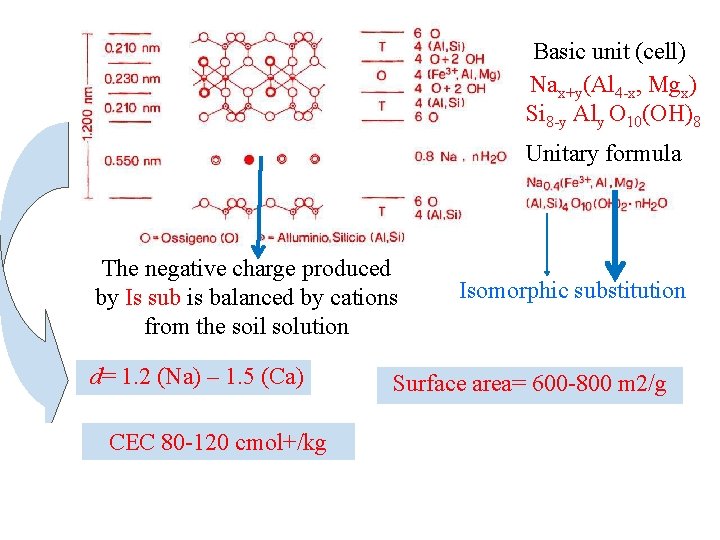
Basic unit (cell) Nax+y(Al 4 x, Mgx) Si 8 y Aly O 10(OH)8 Unitary formula The negative charge produced by Is sub is balanced by cations from the soil solution d= 1. 2 (Na) – 1. 5 (Ca) CEC 80 120 cmol+/kg Isomorphic substitution Surface area= 600 800 m 2/g

2: 1 Minerals Montmorillonite • Si 8 Al 4 O 20(OH)4·n. H 2 O (Theoretical unsubstituted). Film like shape. • There is extensive isomorphous substitution for aluminum by other cations, which results in charge deficiencies of clay particles. • n·H 2 O and cations exist between unit layers, and the basal spacing is from 9. 6 Å to (after swelling). • The interlayer bonding is by van der Waals forces and by cations which balance charge deficiencies (weak bonding). • There exists interlayer swelling, which is very important to engineering practice (expansive clay). • Width: 1 or 2 m, Thickness: 10 Å~1/100 width n·H 2 O+cations 5 m (Holtz and Kovacs, 1981) 67

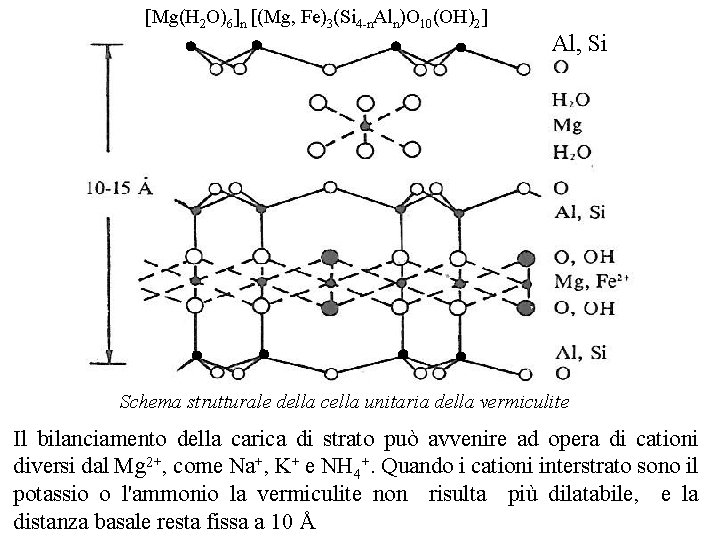
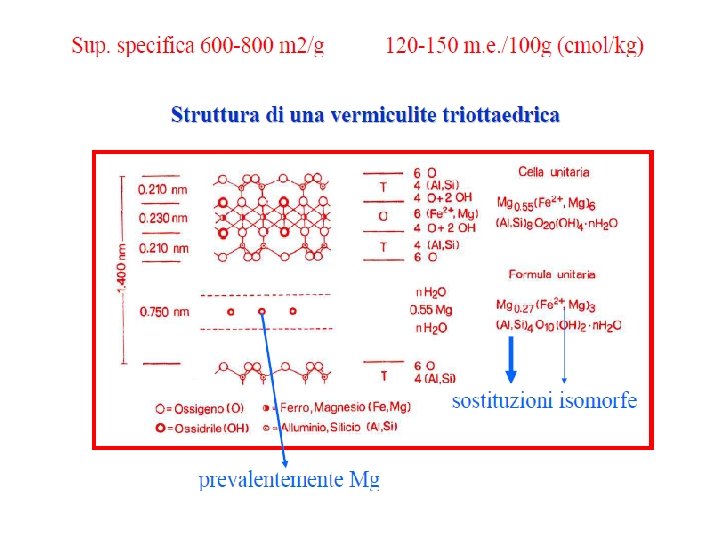
Vermiculiti I minerali di questo gruppo sono considerati come prodotti derivanti da profonde alterazioni pedogenetiche verificatesi a carico di materiali di partenza quali le miche. Sulla base della struttura della cellula unitaria, è possibile rilevare che anche le vermiculiti sono fillosilicati tipo 2: 1 / T O T, a carico dei quali i fenomeni di sostituzione isomorfa hanno interessato sia i fogli tetraedrici, con sostituzione del Si 4+ da parte di Al 3+, sia i fogli ottaedrici, con sostituzione dell'Al 3+ da parte di Mg 2+ e/o Fe 2+; quando la sostituzione dell'Al 3+ è completa si forma uno strato tri ottaedrico Alle vermiculiti tri ottaedriche si può attribuire la formula unitaria generale Mg(H 2 O)6 n (Mg, Fe)3(Si 4 -n. Aln)O 10(OH)2 in cui lo ione Mg 2+ esaidrato assolve alla funzione di neutralizzare parte della carica di strato. Per la neutralizzazione della carica elettrica delle vermiculiti sono necessari da 120 a 150 m. e. di ioni di carica opposta per 100 grammi di materiale. A causa del valore sempre piuttosto elevato della carica di strato, e del suo posizionamento anche nello strato tetraedrico le vermiculiti risultano in genere meno dilatabili delle montmorilloniti; la distanza basale è compresa pertanto fra 10 e 15 Å (1 1. 5 nm) mentre la superficie specifica è in genere dell'ordine di 600 800 m 2 /g

Mg(H 2 O)6 n (Mg, Fe)3(Si 4 n. Aln)O 10(OH)2 Al, Si Schema strutturale della cella unitaria della vermiculite Il bilanciamento della carica di strato può avvenire ad opera di cationi diversi dal Mg 2+, come Na+, K+ e NH 4+. Quando i cationi interstrato sono il potassio o l'ammonio la vermiculite non risulta più dilatabile, e la distanza basale resta fissa a 10 Å


Nelle vermiculiti triottaedriche può avvenire la sostituzione isomorfa del Mg 2+ con Al 3+ o Fe 3+ con sviluppo di un parziale eccesso di carica positiva nello strato ottaedrico (che comunque non bilancia la carica negativa dovuta alle sostituzioni isomorfe nello strato tetraedrico)

Vermiculites (2: 1) • • • Alteration product of micas (rock form) Formed from loss of K+ Interlayer K+ of mica replaced with Mg 2+ High layer charges: BOTH tetra and octa “nutrient rich!”

Lots of charge imbalance, both sheets: High nutrient supply capacity = Al = Fe = Mg

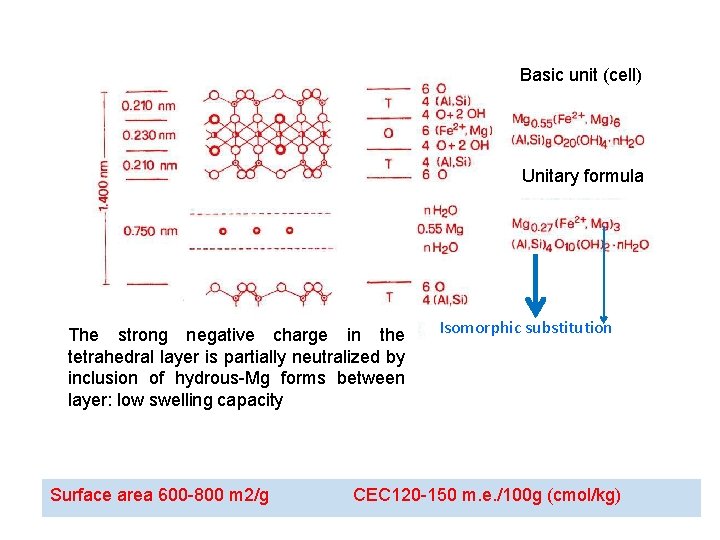
Basic unit (cell) Unitary formula The strong negative charge in the tetrahedral layer is partially neutralized by inclusion of hydrous-Mg forms between layer: low swelling capacity Surface area 600 -800 m 2/g Isomorphic substitution CEC 120 -150 m. e. /100 g (cmol/kg)

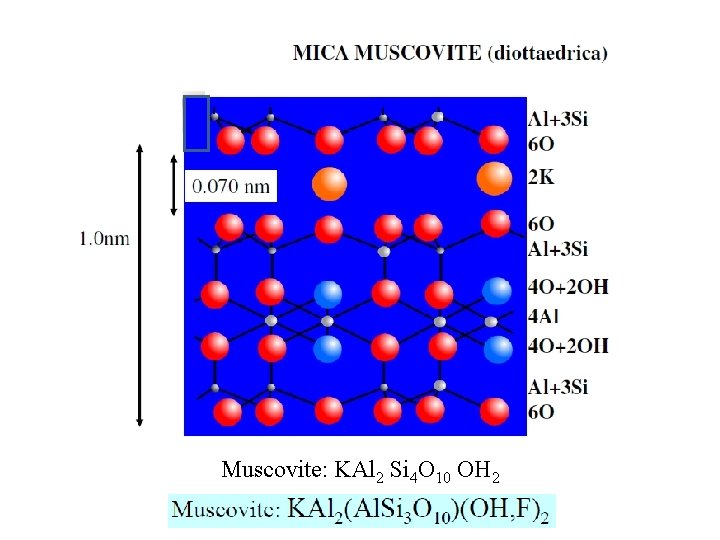
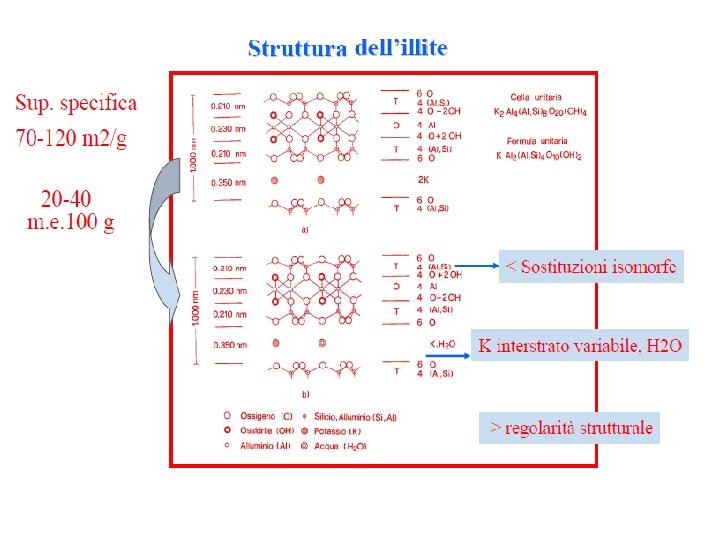
Illite (Miche secondarie – Idromiche) Parlando delle vermiculiti si è detto che esse possono considerarsi come prodotti derivanti dall'alterazione pedogenetica di minerali primari costituiti dalle miche. Accanto alle miche primarie si ritrovano nel suolo anche miche secondarie che ricadono nel gruppo dei fillosilicati del tipo 2: 1 caratterizzati, per lo più, da fenomeni di sostituzione isomorfa verificatisi a livello tetraedrico con dell'Al 3+ al posto del Si 4+. Data l’origine dai minerali che contenevano potassio come componente strutturale, la carica di strato che in tal modo prende origine è neutralizzata da ioni K+ (e NH 4+) che si inseriscono fra strato e strato, all’interno dei reticoli esagonali dello strato tetraedrico con riduzione della solvatazione e limitando la dilatabilità dei minerali in questione i quali pertanto esibiscono distanze basali non superiori ai 10 Å. Dallo schema della cella unitaria delle illiti, risulta che ad esse è attribuibile una formula generale del tipo K Al 2(Al. Si 3) O 10(OH)2

Muscovite: KAl 2 Si 4 O 10 OH 2

Malgrado il valore relativamente alto della carica di strato, per la neutralizzazione della carica elettrica delle miche sono sufficienti da 20 a 40 m. e. di ioni di carica opposta per 100 g di materiale. Sempre in conseguenza della scarsa dilatabilità la superficie specifica risulta ridotta, non superando in genere i 70 120 m 2 /g K Al 2(Al. Si 3) O 10(OH)2 Schema strutturale della cella unitaria delle miche

NH 4+ K+


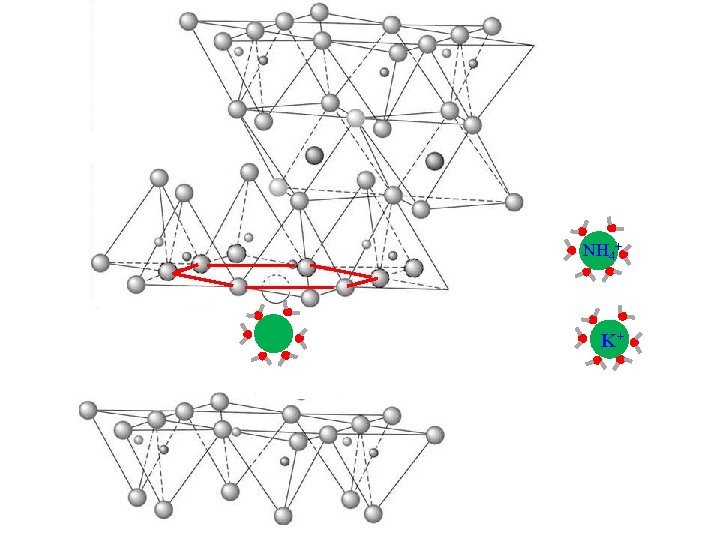
Illite (2: 1, secondary Micas) • • Al 3+ substitution for Si 4+ on the tetrahedral sheet Strong surface charge “fairly nutrient poor” Non-swelling, The prevalent substitution occurs in tetrahedral sheet thereby producing a strong negative charge close to the layer surface; strong attraction of cations. The K+ and NH 4+ may then loose the hydration molecules and will be fixed in the hexagonal spaces in the silica sheet surfaces: these nutrients are not hence available for plant roots

d- d- H 2 NOH 4+ Al 3+ d- d- d- Al 3+ HK 2 O + d- d- d- 1. Isomorphous substitution is in the tetrahedral sheets 2. K+ and NH 4+ come into the interlayer space to satisfy the charge and “locks up” the structure

2: 1 Minerals-Illite (mica-like minerals) potassium K 7. 5 m • Si 8(Al, Mg, Fe)4~6 O 20(OH)4·(K, H 2 O)2. Flaky shape. • The basic structure is very similar to the mica, so it is sometimes referred to as hydrous mica. • Some of the Si 4+ in the tetrahedral sheet are replaced by the Al 3+, and some of the Al 3+ in the octahedral sheet are substituted by the Mg 2+ or Fe 3+. Those are the origins of charge deficiencies. • The charge deficiency is balanced by the potassium ion between layers. Note that the potassium atom can exactly fit into the hexagonal hole in the tetrahedral sheet and form a strong interlayer bonding. • The basal spacing is fixed at 10 Å in the presence of polar liquids (no interlayer swelling). • Width: 0. 1~ several m, Thickness: ~ 30 Å Trovey, 1971 ( from Mitchell, 1993) 82

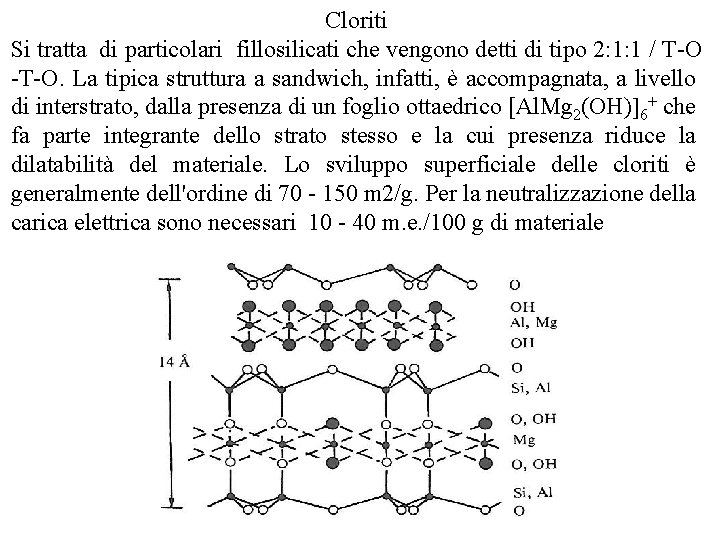
Cloriti Si tratta di particolari fillosilicati che vengono detti di tipo 2: 1: 1 / T O. La tipica struttura a sandwich, infatti, è accompagnata, a livello di interstrato, dalla presenza di un foglio ottaedrico [Al. Mg 2(OH) 6+ che fa parte integrante dello strato stesso e la cui presenza riduce la dilatabilità del materiale. Lo sviluppo superficiale delle cloriti è generalmente dell'ordine di 70 150 m 2/g. Per la neutralizzazione della carica elettrica sono necessari 10 40 m. e. /100 g di materiale



Examples of Unitary formulas and layer charges (C) montmorillonite Mx (Mgx Al 2 x) Si 4 O 10 (OH)2. n. H 2 O (Mg 0. 35 Al 1. 65) (Al 0. 09 Si 3. 91)O 10(OH)2. n. H 2 O C octahedric ( 0. 35) + C tetrahedric ( 0. 09) = 0. 44 Vermiculite (tri. Mx+y [(Al, Fe 3+)x Mg 3 -x] (Aly Si 4 y) O 10 (OH)2. n. H 2 O octahedric) (Fe Al Mg ) (Al Si )O (OH). n. H O 0. 10 0. 29 2. 61 1. 05 2. 95 10 2 2 C octahedric (+0. 39) + C tetrahedric ( 1. 05) = 0. 66 Illite Mx+y (Mgx Al 2 x] (Aly Si 4 y) O 10 (OH)2. n. H 2 O (Mg 0. 25 Al 1. 75) (Al 0. 5 Si 3. 5)O 10(OH)2. n. H 2 O C octahedric ( 0. 25) + C tetrahedric ( 0. 50) = 0. 75

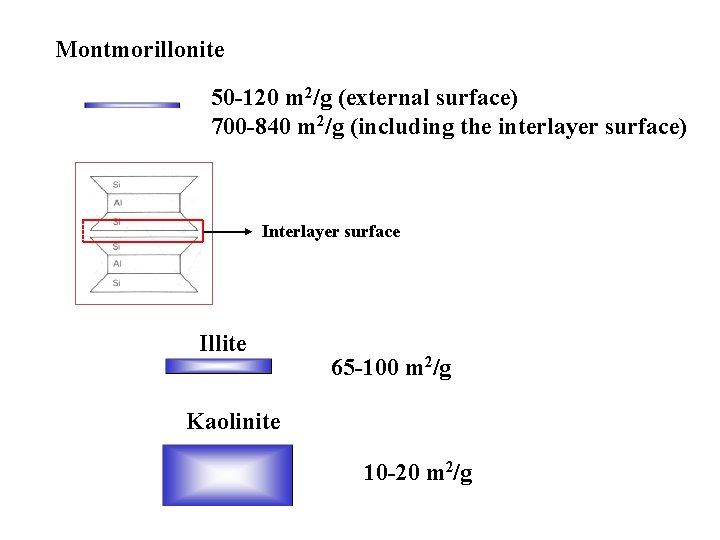
Montmorillonite 50 -120 m 2/g (external surface) 700 -840 m 2/g (including the interlayer surface) Interlayer surface Illite 65 -100 m 2/g Kaolinite 10 -20 m 2/g


Allofane: sono gel alluminosilicici (alluminosilicati amorfi) formati da Al 2 O 3, Si. O 2 e H 2 O in rapporti di combinazione variabili. n. Al 2 O 3 m. Si. O 2 p. H 2 O La caratteristica principale di tali argille è la loro struttura amorfa. Sono presenti in piccole quantità in molti suoli come prodotto intermedio del processo di decomposizione dei minerali primari la cui geometria del reticolo cristallino sarebbe alterata dai processi pedogenetici di fratturazione creando quello stato di disordine che è caratteristico dello stato amorfo. Esistono suoli nei quali l’allofane è presente in elevate quantità come i suoli vulcanici soprattutto dell’area del pacifico. In tali suoli l’allofane è unita fortemente alla sostanza organica, cosicchè il colore di questi terreni è di solito nerastro. Nella “Soil Taxonomy” tali suoli sono classificati come Andosuoli dal giapponese “ando” che significa appunto “scuro”.

Ossidi e idrossidi (Fe , Al, Mn. . . ) Nella classe granulometrica dell’argilla (frazione colloidale inorganica < 2 m), assieme ai fillosilicati secondari si ritrovano altri costituenti inorganici, che sono considerati anch'essi come prodotti di neoformazione, prendendo origine nel corso dei processi pedogenetici. Tali prodotti si differenziano fra loro in quanto alcuni, come i composti del Si tendono in alcuni ambienti ad essere progressivamente lisciviati, mentre altri come gli ossidi di Fe, Al, Mn etc tendono ad accumularsi nella frazione colloidale del suolo. Caratteristica comune a tutti i composti in questione è la loro organizzazione strutturale, che può passare da livelli di massimo disordine, tipici dello stato amorfo, a livelli di ordine elevato, propri dello stato cristallino. Mentre lo stato amorfo è metastabile, lo stato cristallino è caratterizzato invece da condizioni di massima stabilità. Nella frazione colloidale del suolo i composti più importanti appartenenti a questo gruppo sono rappresentati dagli ossidi e idrossidi di alluminio e ferro (corindone = A 2 O 3, gibbsite = Al 2(OH)6, boemite e diasporo = Al. OOH, ematite = Fe 2 O 3, goetite e lepidocrocite = Fe. OOH, limonite = Fe 2 O 3 · n. H 2 O) e dalla silice (Si. O 2)

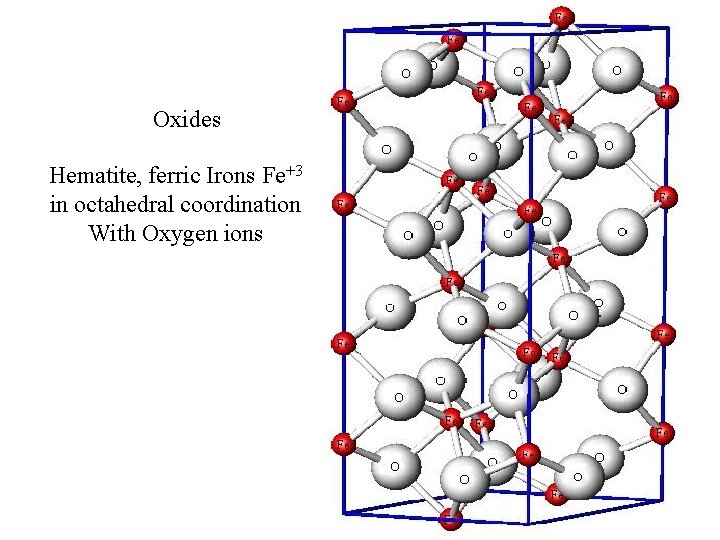
Oxides Hematite, ferric Irons Fe+3 in octahedral coordination With Oxygen ions

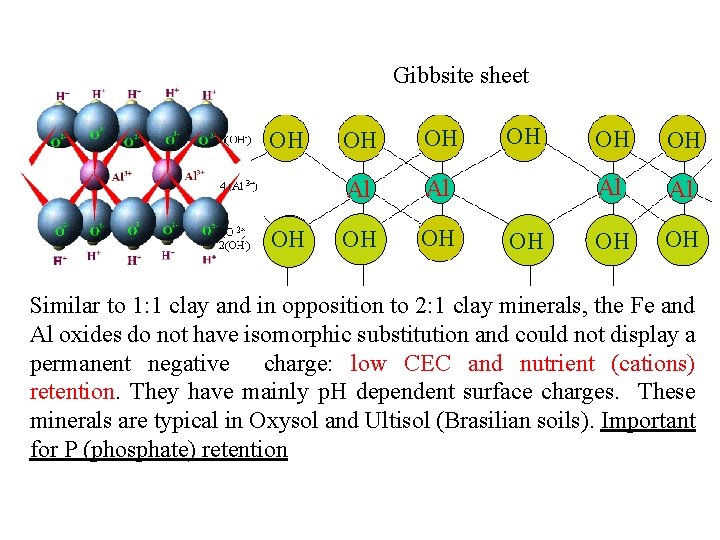
Gibbsite sheet OH OH Al Al OH OH Similar to 1: 1 clay and in opposition to 2: 1 clay minerals, the Fe. OH and Al oxides do not have isomorphic substitution and could not display a permanent negative charge: low CEC and nutrient (cations) retention. They have mainly p. H dependent surface charges. These minerals are typical in Oxysol and Ultisol (Brasilian soils). Important for P (phosphate) retention




Catione idratato


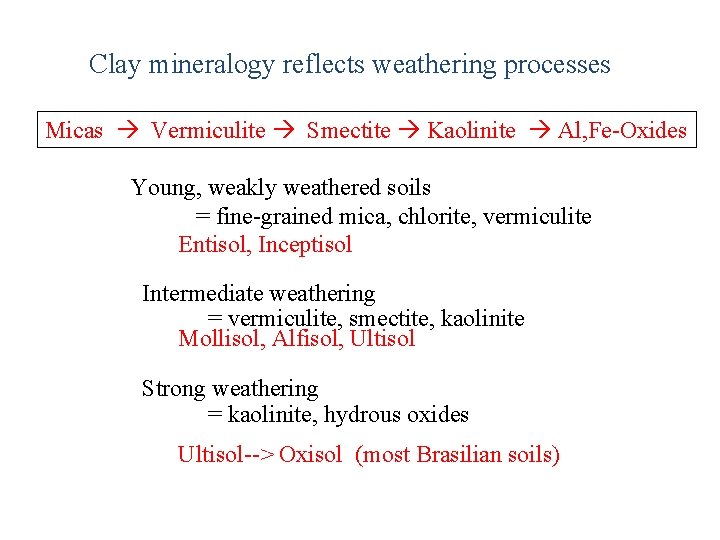
Clay mineralogy reflects weathering processes Micas Vermiculite Smectite Kaolinite Al, Fe Oxides Young, weakly weathered soils = fine grained mica, chlorite, vermiculite Entisol, Inceptisol Intermediate weathering = vermiculite, smectite, kaolinite Mollisol, Alfisol, Ultisol Strong weathering = kaolinite, hydrous oxides Ultisol > Oxisol (most Brasilian soils)

Lisciviazione (eluviazione)

Per quanto attiene ai fillosilicati si è visto che essi esibiscono una carica netta generalmente negativa che corrisponde alla somma algebrica della carica permanente, indotta dai fenomeni di sostituzione isomorfa. Accanto alla carica permanente i fillosilicati possono sviluppare una carica variabile o p. H dipendente, che è dovuta all’esposizione di gruppi superficiali (O / OH) protonabili in funzione del p. H del mezzo (soluzione circolante). Ciò significa che se il p. H del sistema prende progressivamente ad innalzarsi, ossia se la concentrazione idrogenionica tende progressivamente ad abbassarsi, i gruppi capaci di funzionare da donatori di protoni, sempre presenti sulle particelle colloidali, tenderanno naturalmente a deprotonarsi assumendo così una carica negativa che andrà a sommarsi alla carica permanente, anch'essa negativa. Se, viceversa il p. H del sistema prende progressivamente ad abbassarsi, ossia se la concentrazione idrogenionica tende progressivamente ad innalzarsi, i gruppi capaci di funzionare da accettori di protoni, tenderanno naturalmente a protonarsi dando origine così a cariche positive che, con la loro presenza abbasseranno il valore della carica negativa netta del sistema.

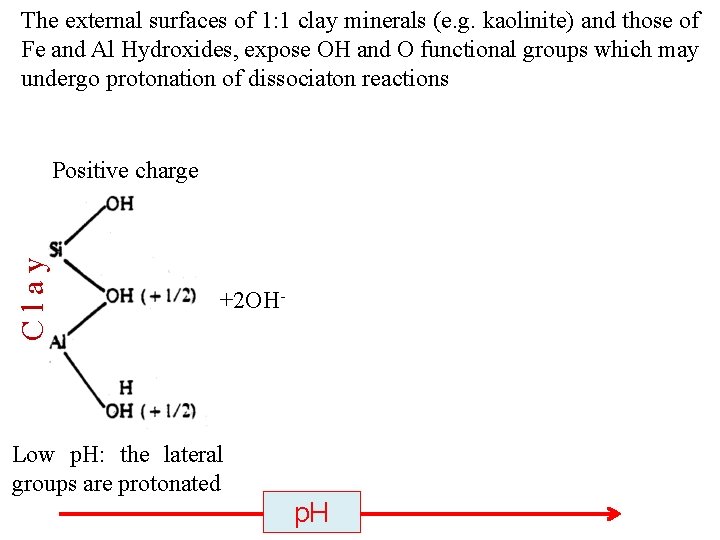
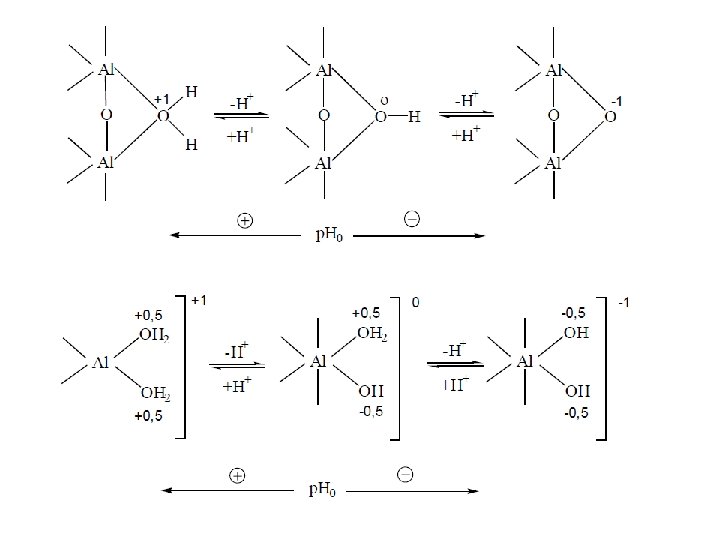
The external surfaces of 1: 1 clay minerals (e. g. kaolinite) and those of Fe and Al Hydroxides, expose OH and O functional groups which may undergo protonation of dissociaton reactions “zero” charge Clay Positive charge Negative charge +2 OH Low p. H: the lateral groups are protonated Neutral p. H increasing p. H: lateral groups dissociated the are

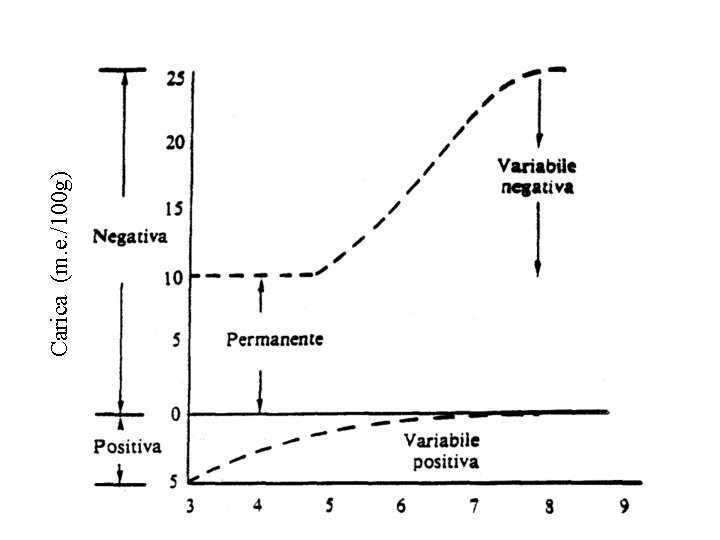
Carica (m. e. /100 g)

A differenza dei fillosicati (argille) gli ossidi e idrossidi non presentano sostituzioni isomorfe e sviluppo si cariche permanenti (strutturali). La loro reattività e legata principalmente alla presenza sulle superfici esterne di gruppi ossigeno e funzioni ossidriliche protonabili in funzione del p. H del mezzo (soluzione circolante) Schematizzando con M OH la struttura di un ossido, dove M sta a rappresentare il reticolo, O gli ioni ossigeno superficiali ed H i protoni neutralizzanti si avranno, in funzione del p. H del mezzo, le seguenti reazioni: Per i diversi colloidi, che a seconda del p. H presentano o carica positiva o carica negativa, sarà possibile definire il cosiddetto p. H 0, ossia il p. H che segna il passaggio da una carica a quella di segno opposto ed in corrispondenza del quale il colloide è elettricamente neutro (punto di carica zero PZC). Il p. H 0 degli ossidi di Fe e Al si posiziona a p. H intorno a 8 e 9

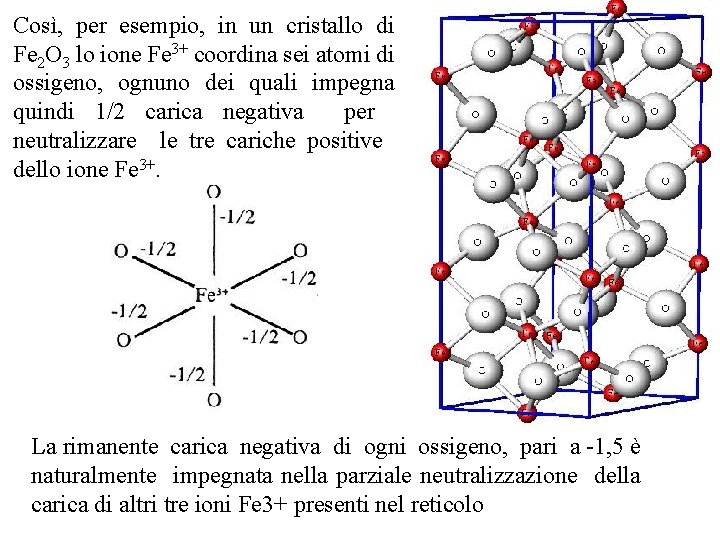
Così, per esempio, in un cristallo di Fe 2 O 3 lo ione Fe 3+ coordina sei atomi di ossigeno, ognuno dei quali impegna quindi 1/2 carica negativa per neutralizzare le tre cariche positive dello ione Fe 3+. La rimanente carica negativa di ogni ossigeno, pari a 1, 5 è naturalmente impegnata nella parziale neutralizzazione della carica di altri tre ioni Fe 3+ presenti nel reticolo

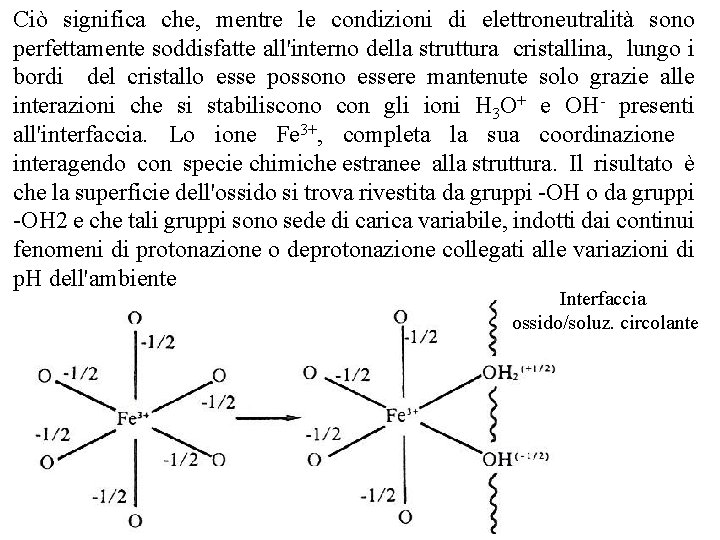
Ciò significa che, mentre le condizioni di elettroneutralità sono perfettamente soddisfatte all'interno della struttura cristallina, lungo i bordi del cristallo esse possono essere mantenute solo grazie alle interazioni che si stabiliscono con gli ioni H 3 O+ e OH presenti all'interfaccia. Lo ione Fe 3+, completa la sua coordinazione interagendo con specie chimiche estranee alla struttura. Il risultato è che la superficie dell'ossido si trova rivestita da gruppi OH o da gruppi OH 2 e che tali gruppi sono sede di carica variabile, indotti dai continui fenomeni di protonazione o deprotonazione collegati alle variazioni di p. H dell'ambiente Interfaccia ossido/soluz. circolante


Point of “zero” charge - pzc Correspond to the p. H value at which the electrical charge density on a surface is zero. When the p. H is lower than the pzc value, the system is said to be "below the pzc. “ Below the pzc, the acidic water donates more protons than hydroxide groups, and so the adsorbent surface is positively charged (attracting anions). Conversely, above pzc the surface is negatively charged (attracting cations/repelling anions). mineral Kaolinite Al hydroxides Fe hydroxides PZC 7. 0 8. 0 9. 0 Clay 2: 1 Humic substances 4. 0 3. 0

 Sorosilicati esempi
Sorosilicati esempi I tectosilicati sono silicati caratterizzati da
I tectosilicati sono silicati caratterizzati da Rocce sialiche e femiche
Rocce sialiche e femiche Nesosilicati
Nesosilicati Legame covalente dativo
Legame covalente dativo Teoria degli stakeholder
Teoria degli stakeholder Spinoza affetti primari e secondari
Spinoza affetti primari e secondari Paisatge agrari atlantic
Paisatge agrari atlantic Acidi biliari primari
Acidi biliari primari Stakeholder primari e secondari
Stakeholder primari e secondari Metaboliti primari
Metaboliti primari Dati primari e secondari
Dati primari e secondari Somma colori primari
Somma colori primari Marna
Marna Ciclo istruzionale
Ciclo istruzionale