SIFAT KOLIGATIF LARUTAN Oleh Sunarto Sulkan S Pd






















- Slides: 24

SIFAT KOLIGATIF LARUTAN Oleh : Sunarto Sulkan, S. Pd MA MATHALIBUL HUDA MLONGGO

PETUNJUK MENJALANKAN PROGRAM • • • Tekan tombol F 5 pada keyboard untuk memulai/ menjalankan program Gunakan/gerakan mouse sehingga pointer kelihatan Klik tanda untuk memulainya Start Setelah masuk pada layar menu pilih/klik salah satu menu yang diinginkan Klik tanda untuk melanjutkan Klik tanda untuk kembali pada layar sebelumnya Next Klik tanda untuk kembali ke menu utama Back Tutorial ini di sampaikan dalam 3 X pertemuan (6 X 45 menit) Home Selamat belajar, semoga sukses…

• Standar kompetensi : – Mendeskripsikan sifat-sifat larutan , metode pengukuran dan terapannya • Kompetensi Dasar : - Mendiskripan kemolaran, kemolalan, fraksi mol - Mendeskripsikan penurunan tekanan uap, kenaikan titikdidih, penurunan titik beku, dan tekanan osmotik. By Sunarto Sulkan, SPd.

INDIKATOR : • Menghitung kemolaran, kemolalan, fraksi mol • Menjelaskan penurunan tekanan uap, kenaikan titikdidih, penurunan titik beku, dan tekanan osmotik. • Menghitung penurunan tekanan uap, kenaikan titikdidih, penurunan titik beku, dan tekanan osmotik

Kemolaran ( M ) Menyatakan banyaknya mol zat terlarut dalam setiap 1 liter larutan

Kemolalan atau molalitas ( m ) Konsentrasi larutan yang menyatakan jumlah mol terlarut dalam 1 kg zat pelarut. 1 kg pelarut

Kemolaran ( M ) Kemolalan ( m ) Fraksi mol ( Xt dan Xp ) merupakan pernyataan konsentrasi atau kepekatan larutan yang menginformasikan dengan jelas jumlah mol zat terlarut dan jumlah mol pelarut.

Fraksi mol merupakan penyataan konsentrasi suatu larutan yang menyatakan perbandingan jumlah mol zat terlarut terhadap jumlah mol total komponen larutan ( jumlah mol pelarut + jumlah mol terlarut ) Fraksi mol pelarut Fraksi mol terlarut Jumlah mol pelarut Jumlah mol terlarut

Hubungan antara Molal, Molar, dan Fraksi Mol

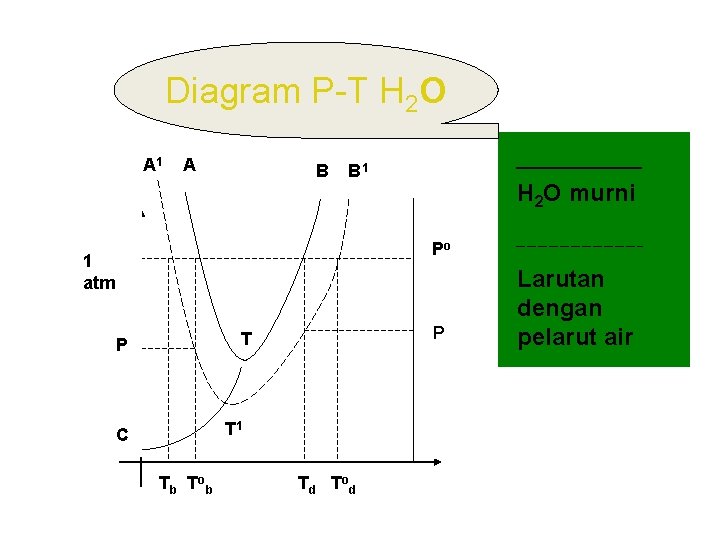
Diagram P-T H 2 O A 1 A B B 1 Po 1 atm P H 2 O murni P T 1 C T b T ob T d T od Larutan dengan pelarut air

Sifat Koligatif Larutan Elektrolit dan Non-elektrolit

Sifat koligatif adalah sifat yang bergantung hanya pada jumlah partikel zat tertentu, bukan pada jenis partikelnya. Contoh • Larutan HCl 0, 1 M, larutan Na. OH 0, 1 M, larutan glukosa 0, 2 M mempunyai kemolaran yang berbeda tetapi mempunyai sifat koligatif larutan yang sama karena memiliki jumlah partikel zat terlarut yang sama.

Penurunan Tekanan Uap Jenuh Larutan Untuk larutan nonelektrolit Untuk larutan elektrolit

Kenaikan Titik Didih ( ∆Tb ) Untuk larutan non elektrolit Untuk larutan elektrolit

Penurunan Titik Beku ( ∆Tf ) Untuk larutan nonelektrolit Untuk larutan elektrolit

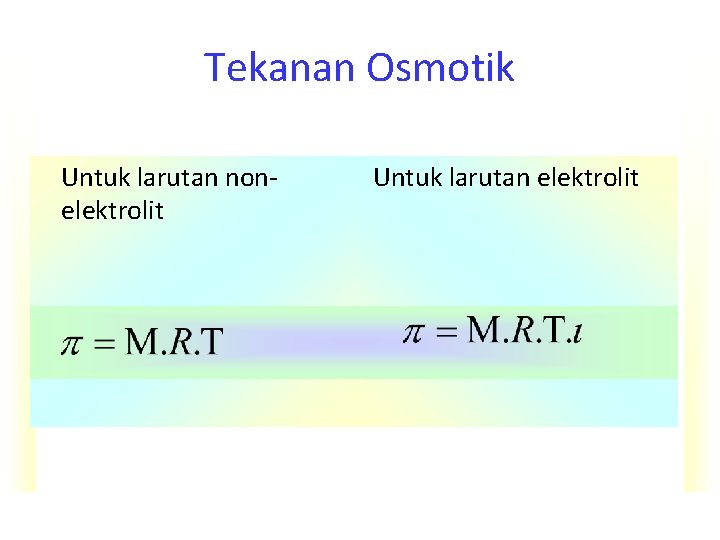
Tekanan Osmotik Untuk larutan nonelektrolit Untuk larutan elektrolit

LATIHAN SOAL 1. Sebanyak 3 mol elektrolit M 2 Z dilarutkan dalam 2 kg air sehingga mengalami ionisasi pertama sebesar 70% dan ionisasi kedua sebesar 20%. Tentukan titik didih larutan!

2. Sebuah larutan X yang membeku pada suhu 1, 543 o. C terdiri dari 16 gram zat X dilarutkan dalam 500 gram air. Diketahui Mr larutan: 98, Kf: 1, 86 o. C/m. tentukan apakah larutan tersebut terdisosiasi? Jika ya, tentukan derajat ionisasinya!

3. Untuk menentukan rumus asam oksalat hidrat, sebanyak 25, 2 gram asam oksalat hidrat dilarutkan dalam 500 ml air, ternyata larutan tersebut mempunyai titik didih 100, 520 C. Jika asam tersebut mengionsebanyak 75%, kd air : 0, 520 C/m. Tentukan rumus kristal tersebut! (Ar H: 1 C: 12 O: 16)

4. Sebanyak 25, 5 gram Ag. NO 3(Mr: 170) dalam 500 ml air dicampur dengan 36, 5 gr HCl (Mr: 36. 5) dalam 1000 ml air. Tentukan titik beku larutan setelah dicampur! (Kf air : 1, 860 C/m)

1. M 2 Z MZ- + M+ 3 2, 1 0, 9 2, 1 MZ- M+ + Z 22, 1 0, 42 1, 68 0, 42 Mol yang tersisa = 5, 52 mol

2. ∆ Tf = - 1, 543 gram t = 16 gr ∆ Tf = 1, 543 gram p = 500 gr 1, 543 = 16 x 100 x 1, 86 x I 98 18 1, 543 = 16, 87 I I = 0, 092

3. H 2 C 2 O 4 x H 2 O H 2 C 2 O 4 2 H+ + C 2 O 42 gram t = 25, 2 gr p = 500 ml ∆ Td = 0, 52 α = 0, 75 0, 52 = 25, 2 x 1000 x 0, 52 x (1+(2 -1) 0, 75) Mr 500 Mr = 126 (2 + 24 + 64) + 10 x = 126 x =2

4. t 1 = 25, 5 gr t 2 = 36, 5 gr p 1 = 500 ml p 2 = 1000 ml ∆ Tb = 25, 5 x 1000 x 1, 86 + 36, 5 x 1000 x 1+(2 -1) 1 x 1, 86 170 500 = 4, 278 ° C Tb = 0 – 4, 278 = - 4, 278 ° C 36, 5 1000
 Pengertian sifat koligatif
Pengertian sifat koligatif Ppt kenaikan titik didih
Ppt kenaikan titik didih Materi kimia kelas 12 semester 1 sifat koligatif larutan
Materi kimia kelas 12 semester 1 sifat koligatif larutan Sifat - sifat -sifat pemerintah reformasi di indonesia
Sifat - sifat -sifat pemerintah reformasi di indonesia Makalah sifat wajib mustahil dan jaiz bagi allah
Makalah sifat wajib mustahil dan jaiz bagi allah Kamanto sunarto
Kamanto sunarto Pengertian globalisasi menurut waters dalam kamanto sunarto
Pengertian globalisasi menurut waters dalam kamanto sunarto Kobra indická
Kobra indická Campuran larutan larutan berikut bersifat buffer kecuali
Campuran larutan larutan berikut bersifat buffer kecuali Definisi larutan penyangga
Definisi larutan penyangga Rumus asam lemah
Rumus asam lemah Saf olmayan madde örnekleri
Saf olmayan madde örnekleri Homojen karışım nedir
Homojen karışım nedir çözeltilerin koligatif özellikleri
çözeltilerin koligatif özellikleri Molarite normalite çevirme
Molarite normalite çevirme Koligatif özellikler
Koligatif özellikler Ciri materi esensial
Ciri materi esensial Sublimisasi
Sublimisasi Efek tyndall
Efek tyndall Sifat-sifat kas
Sifat-sifat kas Fungsi komposisi
Fungsi komposisi 3 sifat atmosfer
3 sifat atmosfer Scalar times vector
Scalar times vector Cara menghitung luas layang layang
Cara menghitung luas layang layang Kesetimbangan asam basa
Kesetimbangan asam basa












































