Semmelweis Egyetem Gygyszerszi Kmiai Intzet igazgat Prof Dr















































- Slides: 75

Semmelweis Egyetem, Gyógyszerészi Kémiai Intézet igazgató: Prof. Dr. Noszál Béla az MTA doktora Gyógyszeripar, Gyógyszerkutatás Új trendek 1990 -2010 Szakgyógyszerészképzés, I. évf. 2010. május 8. Kökösi József SE Gy. KI

Áttekintés • Gyógyszeripar: átrendezödések, globalizáció, biotechnológia, „high tech”, innováció, „me-too drug” • Gyógyszerkutatási és fejlesztési folyamat Strukturaváltás, kooperáció • Számítógépes (Informatikai) közelítések • Kémiai-informatika – – QSAR Virtuális kombinatorikus kémia Molekuláris Diverzitás Analizis Virtuális Screening

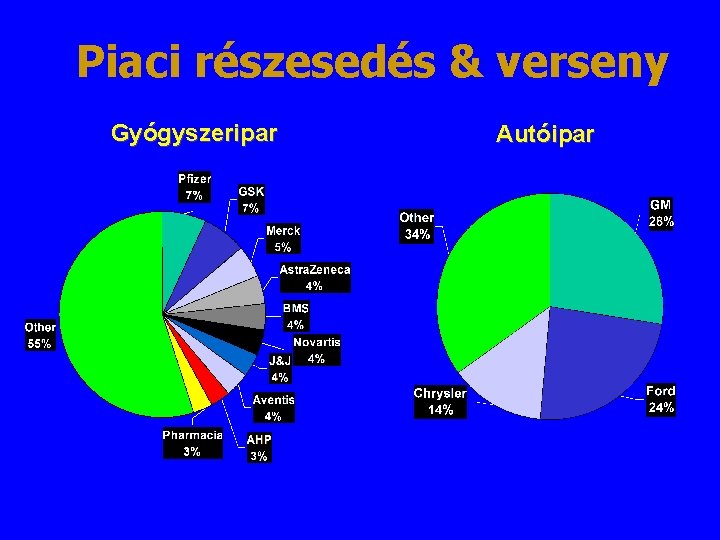
Piaci részesedés & verseny Gyógyszeripar Autóipar

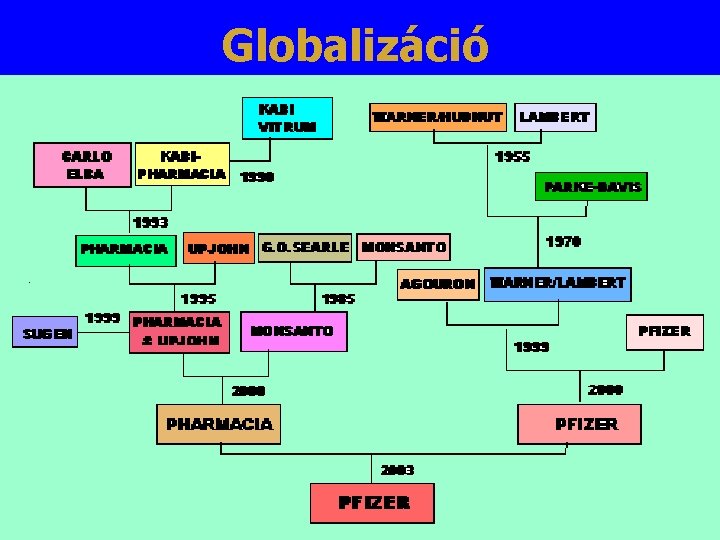
Globalizáció

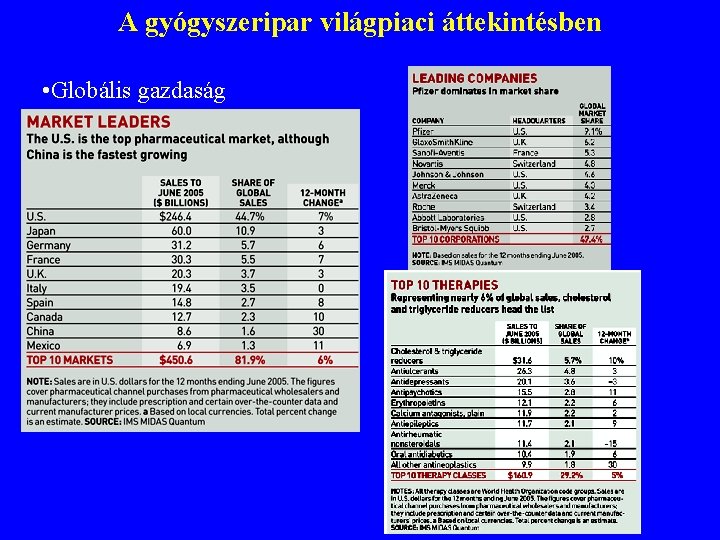
A gyógyszeripar világpiaci áttekintésben • Globális gazdaság

Földrajzi és szerkezeti átrendezödés • Távol-keleti országok – - nagy gyártó kapacitások áttelepítése, ill. kialakítása – környezeti kémiai kiszorítás Kina, India a hatóanyag beszállítók Kina, India, (Brazilia, Oroszország) dinamikus piacbövülés • Kiszerelö és formuláló üzemek világhálózata • Generikus készítmények növekvö gazdasági súlya • Kutatási profil átstrukturálódása – 30% formulálás, nanotechnológia • Kutatási kapacitások koncentrálása és külső mikro-kooperáció • Szigorodó környezetvédelemi és energia kibocsátási elöírások

Demográfia • Egyre elterjedtebb és növekvö neuropszichológiai betegségek: - Schizophrenia (3 millió) - Parkinson kór (1. 5 millió) - Alzheimer kór (4 millió) - Pánikbetegség (>> 5 millió) - Depresszió (> 20 millió) - Stroke (3 millió) - Traumatikus agykárosodások (2. 5 millió) - Fájdalom (#1 Páciens panaszok)

Gyógyszerkutatás 2000 Gyógyszerfejlesztés után –SE Gy. KI

GYÓGYSZERKUTATÁS originális generikus Módszerek, stratégiák: - 1960 hagyományos (tapasztalati) módszerek 1960 – 1990 racionális gyógyszertervezés QSAR, CADD 1990 – 2003 HTS, kombinatorikus kémia 2003 - posztgenomika korszaka

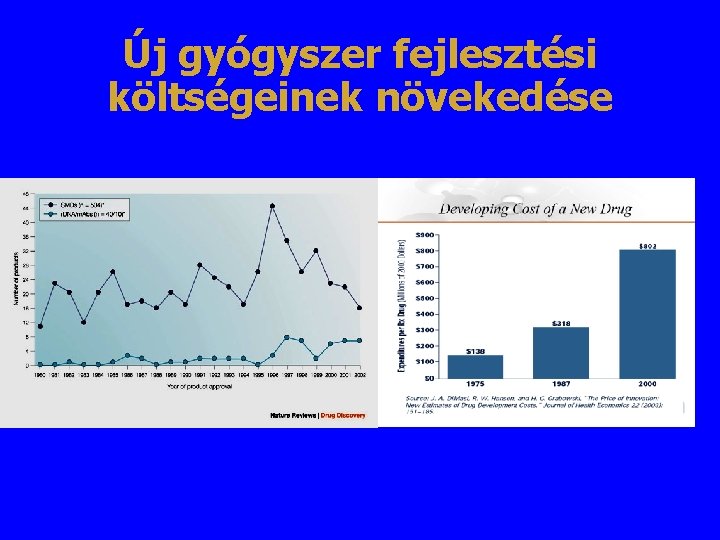
Új gyógyszer fejlesztési költségeinek növekedése

Gyógyszerkutatási folyamat Idő és pénz 50, 000 - 5, 000 vegyületet kell gyakran screenelni, hogy egy gyógyszert találjunk >1, 000 “találat” 12 “vezér” 6 gyógyszerjelölt Felfedezés és preklinikai fázis 1 gyógyszer Klinikai fázis: Fásis I, : Fásis III 12 - 24 év 500 - >2000 millió $

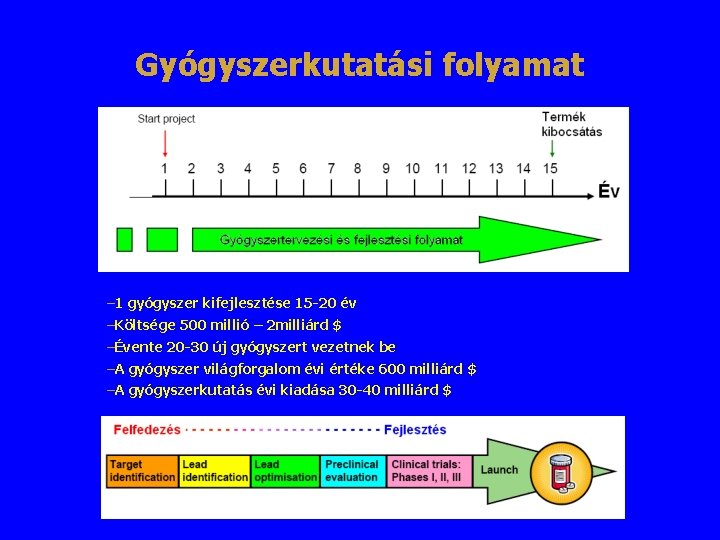
Gyógyszerkutatási folyamat – 1 gyógyszer kifejlesztése 15 -20 év –Költsége 500 millió – 2 milliárd $ –Évente 20 -30 új gyógyszert vezetnek be –A gyógyszer világforgalom évi értéke 600 milliárd $ –A gyógyszerkutatás évi kiadása 30 -40 milliárd $

A GYÓGYSZERKUTATÁS FOLYAMATA Kutatás Koncepció Szintézis Biológiai vizsgálatok Optimalizálás Aktivitás Szelektivitás Orális abszorpció Hatástartam FEJLESZTÉS Preklinikai vizsgálatok 5 -10 000 molekula Humán klinikai vizsgálatok in vitro állatkísérletek Fázis III 1 -2 év 6 -8 év 50 Törzskönyvezés Fázis I Méretnövelés Fizikai-kémiai vizsgálatok Analitika Stabilitás Farmakokinetika Formulálás 2 -4 év BEVEZETÉS Fázis II 10 3 1 -2 év 1 T E R M E L É S

Technológia trend a gyógyszerkutatásban –Humán Genom Projekt Post-Genom időszak Géninformáció Protein funkciók Új gyógyszer célpontok -Nagy teljesítményű technológiák Nagy áteresztő képességű tesztek Teszt eredmények Kombinatorikus kémia Kémiai könytárak ADME/Tox (Abszorpció, Megoszlás, Metabolizmus, Kiválasztás, Toxicitás) -Számítógépes Technológiák, Bioinformatika Genomika Informatika, Proteomika Informatika, Kémiai Informatika, Metabolikus Informatikai rendszer integráció Komputeres gyógyszertervezés és optimalizáció

Jelenlegi gyógyszercélpontok biokémiai osztályai –Receptorok 45% –Ismeretlen 7% –Enzimek –Ioncsatornák 5% 28% –Nukleár receptorok 2% –Hormonok és faktorok 10% –DNS 2% –A közel 500 célpont a humán genomika fejlödésével 10000 -re növekszik

Genomika története • 1900 DNS kromoszóma elmélet • 1953 DNS szerkezetének megfejtése • 1980 – Az elsö komplett orgamizmus genom szekvencia – FX 174 - 5, 386 bázis pár, kilenc proteint kódol. (~5 Kb) • 1995 – Haemophilus influenzea genom szekvencia (flu bacteria, 1. 8 Mb) • 1996 – Saccharomyces cerevisiae (baker's yeast, 12. 1 Mb) • 1997 – E. coli (4. 7 Mb) • 2000 – Pseudomonas aeruginosa (6. 3 Mbp) – A. thaliana genom (100 Mb) – D. melanogaster genom (180 Mb) 2003 The Big One (3 Gb) humán genom 2009 3 D humán genom

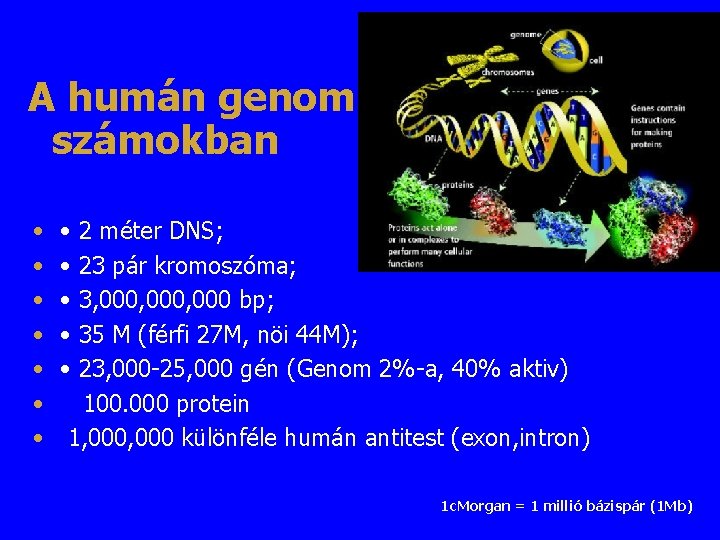
A humán genom számokban • • • 2 méter DNS; 23 pár kromoszóma; 3, 000, 000 bp; 35 M (férfi 27 M, nöi 44 M); 23, 000 -25, 000 gén (Genom 2%-a, 40% aktiv) 100. 000 protein 1, 000 különféle humán antitest (exon, intron) 1 c. Morgan = 1 millió bázispár (1 Mb)

Genetikai térkép és müködési biokémiai gráf modell

Humán genom funkcionális feltérképezése Gene Functions

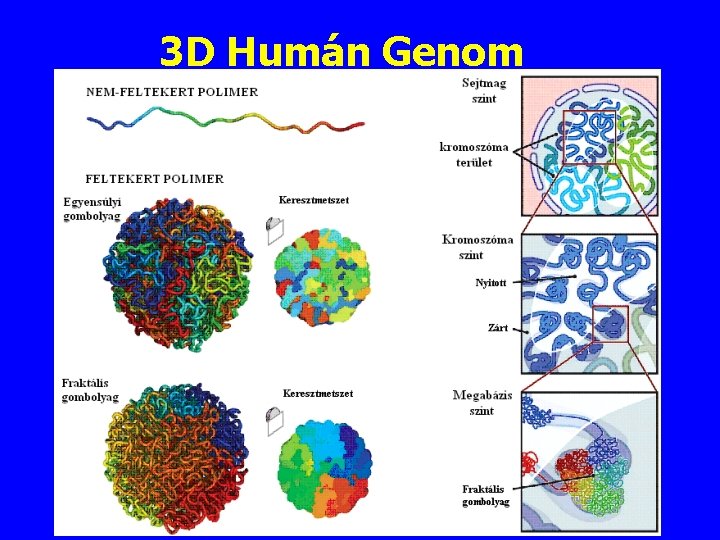
3 D Humán Genom

3 D Humán Genom Hilbert görbe Erez Lieberman-Aiden, et al. Job Dekker 5† Comprehensive Mapping of Long-Range Interactions Reveals Folding Principles of the Human Genome Science 326, 289 (2009);

Posztgenom korszak – Komparativ Genomika Genom összehasonlító analizise – Funkcionális Genomika Génfunkciók feltérképezése – Strukturális Genomika Teljes genom müködési mechanizmus Proteomika (PROTEin és gen. OM) Genom által kódolt fehérjék Kvalitativ és kvantitativ vizsgálata

Gyógyszerészeti Biotechnológia Szövetkulturák, élő sejtek vagy a sejtek enzimeinek felhasználása olyan termékek elöállítására, amelyeket diagnosztikus, terápiás és gyógyszer célból alkalmazunk. Van Noordwijk

Fő biotechnológiai technikák Rekombináns DNS technológia (klónozás) Polimeráz láncreakció (PCR) Monoklonális antitestek Nukleotid blokád (antiszensz, i. RNS) Gén terápia Genomika Oligonukleotid kémia Szénhidrát kémia Kombinatorikus kémia Protein engineering Molekula modellezés Kis-molekulás kémia

Biotech Gyógyszerfejlesztés 2008 371 biotechnológiai medicina áll fejlesztés alatt közel 200 betegség új kezelésére 250 millió beteg kezelésében használnak már biotechnológiai úton kifejlesztett gyógyszert és vakcinát.

Biotechnológiai Medicinák/Vakcinák a fejlesztésben Terápiás kategoriák szerint

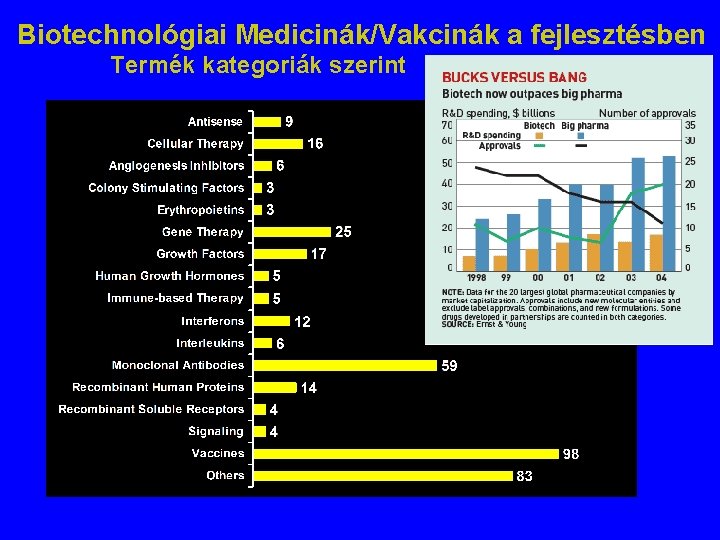
Biotechnológiai Medicinák/Vakcinák a fejlesztésben Termék kategoriák szerint

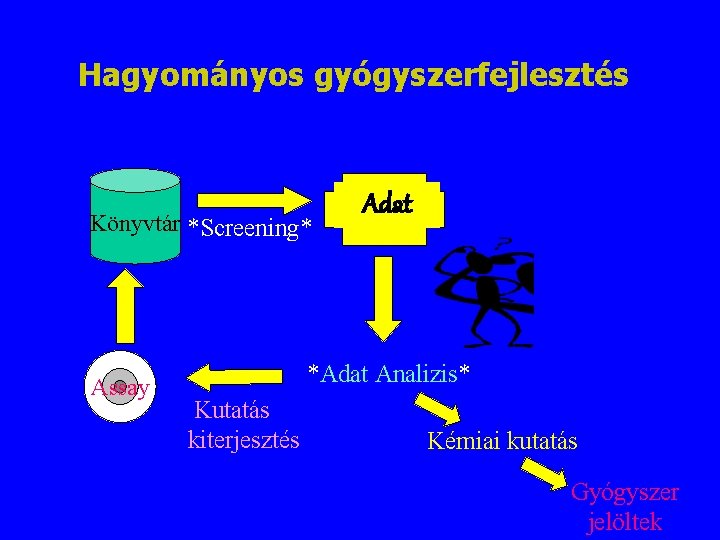
Hagyományos gyógyszerfejlesztés Könyvtár *Screening* Assay Adat *Adat Analizis* Kutatás kiterjesztés Kémiai kutatás Gyógyszer jelöltek

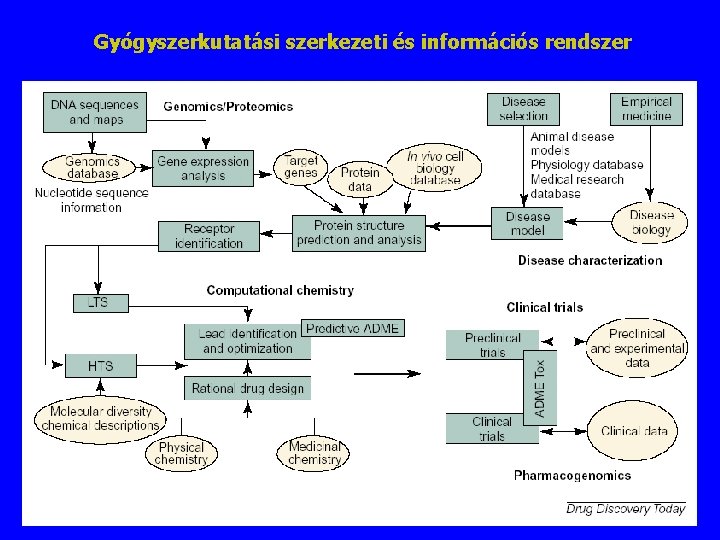
Gyógyszerkutatási szerkezeti és információs rendszer


Hatóanyag keresés folyamata Olyan új vegyületek azonosítása, melyek gyógyszerfejlesztésre felhasználhatóak Ø Vegyületek (tíz, száz) ezer számra készülnek és kerülnek tesztelésre minden évben (“screening”) • tesztek általában egyszerü kötődési tesztek (kötödik-e a molekula a cél-proteinhez? ) Ø Tesztelés két fázisban történik • Vezérmolekula generálás (kötödő molekulát találni) • Vezérmolekula Optimalizáció (molekulát találni amely jobban kötödik) Ø kémiai hasonlóság mindkét fázisban fontos

Vezérmolekula Optimálás Ø Ha a vezérmolekulát megtaláltuk, a következökben hasonló molekulát keresünk, amely még jobban kötödik – Hasonlósági keresés korábban szintetizált vagy kereskedelmileg hozzáférhető molekula adatbázisból, Ø Utolsó lépcső, gyógyszerkémikus a vezérmolekulán specifikus átalakitásokat végez a kötödési affinitás megjavítása céljából, mellékhatások csökkentése végett

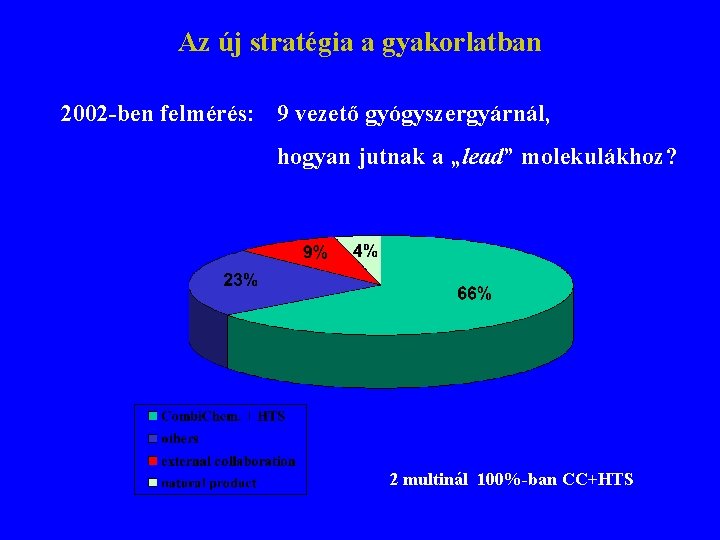
Az új stratégia a gyakorlatban 2002 -ben felmérés: 9 vezető gyógyszergyárnál, hogyan jutnak a „lead” molekulákhoz? 2 multinál 100%-ban CC+HTS

Standard Vezérmolekula közelítés • Cél azonosítása (enzim, receptor, ion csatorna, transzporter) • DNS és protein szekvencia meghatározása • Protein szerkezet és funkció tisztázása • Terápiás koncepció bizonyítása állatokon (“knock-outs”) • Nagyteljesítményű molekula screen assay kifejlesztése • Tömeges screening és/vagy célzott szintézis program • Egy vagy több vezérmolekula kiválasztása

Gyógyszercélpontok és hatásmechanismusok • Enzimek – inhibitorok (reversibilis, irreversibilis) • Receptorok – agonisták és antagonisták • Ion Csatornák – blokkolók • Transporterek – uptake inhibitorok • DNA – interkalációs ágensek, antiszensz hatóanyagok

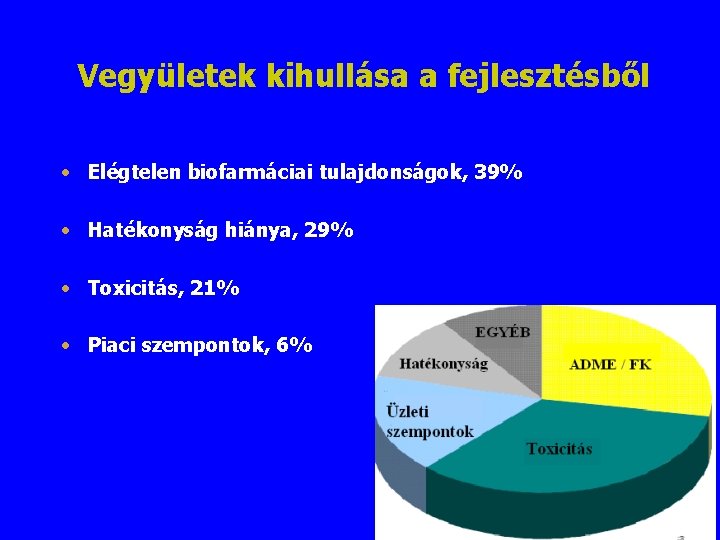
Vegyületek kihullása a fejlesztésből • Elégtelen biofarmáciai tulajdonságok, 39% • Hatékonyság hiánya, 29% • Toxicitás, 21% • Piaci szempontok, 6%

Gyógyszerjelölt gyógyszerü tulajdonságait már korai fázisban figyelembe kell venni Szigorú ADME követelmények: • Kisérletes szabályok – Lipinski szabály (MW, c. Log. P, #HD, #HA) • Gyógyszerűség – Ajay & Murcko (J Med Chem, 1998, 41, 3314 -3324) – Sadowski & Kubinyi (J Med Chem, 1998 , 41, 3325 -3329)

Gyógyszerű viselkedés Lipinski “ 5 -ös szabály” Ø Ø Ø (1) Molekulasúly 500 (opt = ~350) # Hidrogénkötés Akceptorok 10 (opt = ~5) # Hidrogénkötés Donorok 5 (opt = ~2) -2 < c. Log P < 5 (opt = ~3. 0) # Rotáló kötések száma 5 Gyógyszerjelölt gyógyszerü tulajdonságait már a fejlesztés korai fázisában figyelembe kell venni ! 1: C. Lipinski et al, Adv. Drug. Del. Rev, 23, 3 -25 (1997)

Biohozzáférhetőség és Log. P • Log P = Oktanol/víz megoszlási hányados (log. KOW) • Meghatározza a molekulák biohozzáférhetőségét – hidropfób/hidrofil egyensúly – hidrofil eléggé, hogy vizoldható legyen (vér) – hidrofób eléggé, hogy átjusson a sejt membránokon • Jellemző értékintervallum: -3 (nagyon hidrofil) és +7 (nagyon hidrofób) között • Legtöbb gyógyszermolekula Log. P értékei 2 -4 között

Megfelelő farmakokinetikai tulajdonságot befolyásoló tényezők(FK) • • • Vízoldékonyság Membrán passziv permeabilitás Cytochrome P 450 activitás Plazma protein kötödés Efflux pumpa és aktiv transzport –Gyógyszerűség Ajay & Murcko (J Med Chem, 1998, 41, 3314 -3324) Sadowski & Kubinyi (J Med Chem, 1998 , 41, 33253329)

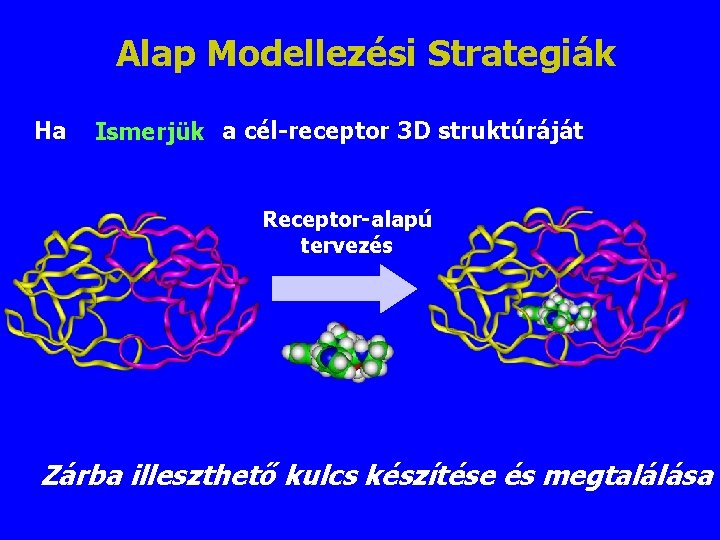
Alap Modellezési Strategiák Ha Ismerjük a cél-receptor 3 D struktúráját Receptor-alapú tervezés Zárba illeszthető kulcs készítése és megtalálása

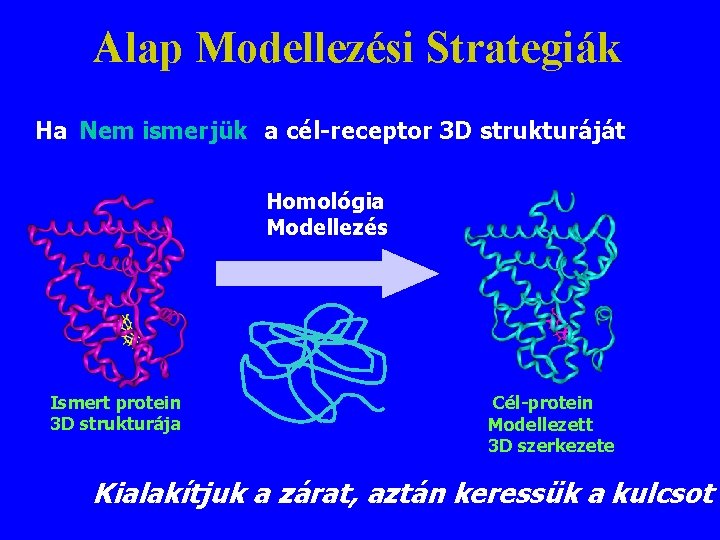
Alap Modellezési Strategiák Ha Nem ismerjük a cél-receptor 3 D strukturáját Homológia Modellezés Ismert protein 3 D strukturája Cél-protein Modellezett 3 D szerkezete Kialakítjuk a zárat, aztán keressük a kulcsot

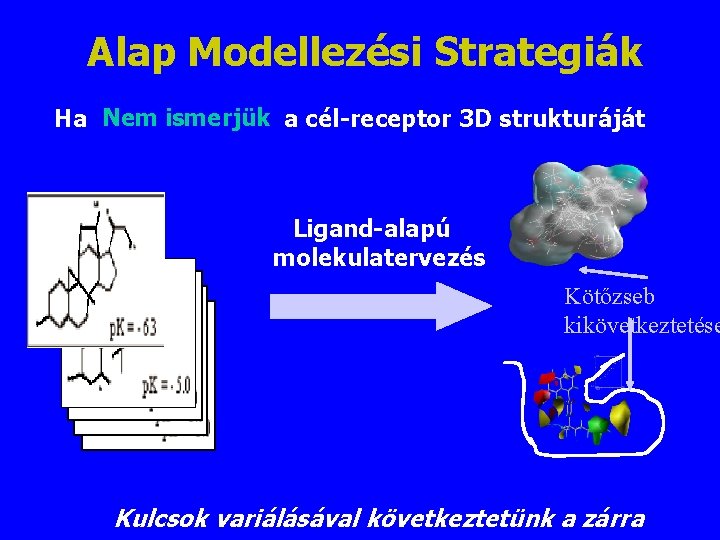
Alap Modellezési Strategiák Ha Nem ismerjük a cél-receptor 3 D strukturáját Ligand-alapú molekulatervezés Kötőzseb kikövetkeztetése Kulcsok variálásával következtetünk a zárra

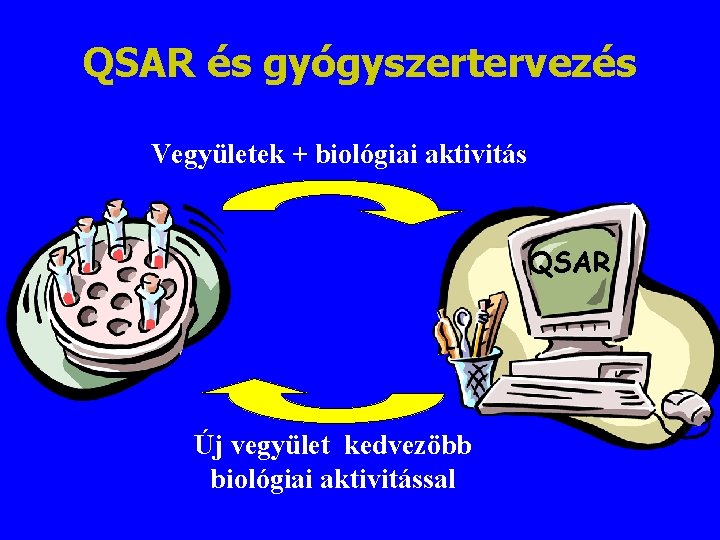
QSAR és gyógyszertervezés Vegyületek + biológiai aktivitás QSAR Új vegyület kedvezöbb biológiai aktivitással

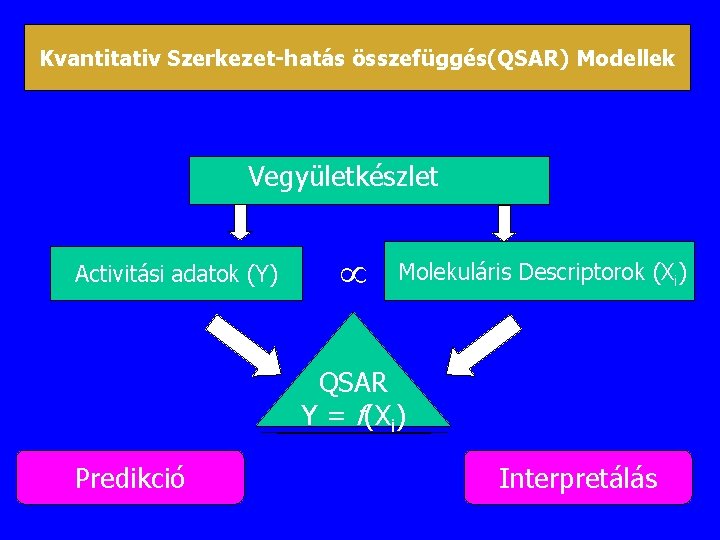
Kvantitativ Szerkezet-hatás összefüggés(QSAR) Modellek Vegyületkészlet Activitási adatok (Y) Molekuláris Descriptorok (Xi) QSAR Y = f(Xi) Predikció Interpretálás

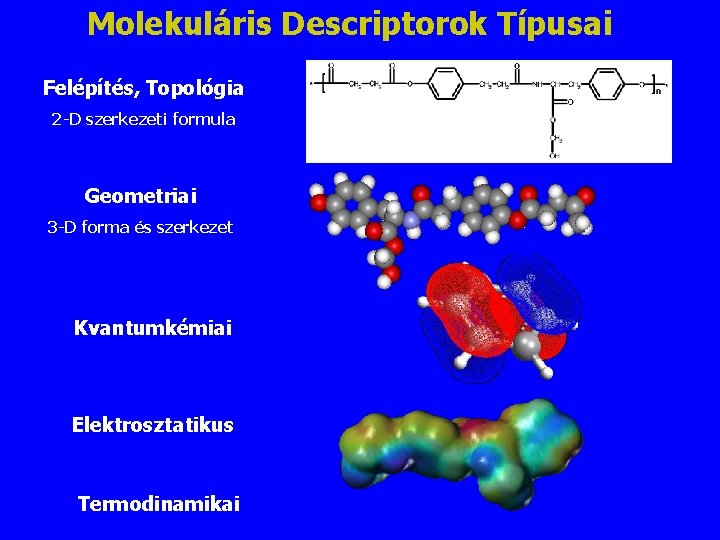
Molekuláris Descriptorok Típusai Felépítés, Topológia 2 -D szerkezeti formula Geometriai 3 -D forma és szerkezet Kvantumkémiai Elektrosztatikus Termodinamikai

Kvantitativ Szerkezet-hatás összefüggés (QSAR) Modellek Descriptorok képzése és tabulázása

QSAR Modellek felépítése (kis. tulajdonság/ aktivitás) (molekula descriptorok) Y = f(Xi) Egyszerü(Univariáns) Lineáris Regresszió Hammett, 1939 p. Ki = ao + a 1 (Mol Voli) független változó Függő változó “legjobban-illeszkedő” konstansok Töbszörös Lineáris Regresszió (MLR) Hansch, 1969 p. Ki = ao + a 1 (Mol Voli) + a 2 (log. P) + a 3 ( i) +. . . Legkisebb négyzetek (PLS) módszere Wold, et al. 1984 p. Ki = ao + a 1 (PC 1) + a 2 (PC 2) + a 3 (PC 3) +. . .

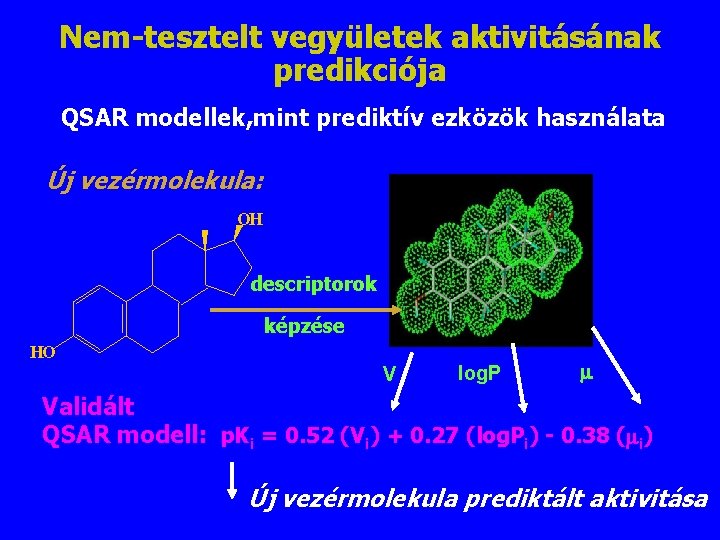
Nem-tesztelt vegyületek aktivitásának predikciója QSAR modellek, mint prediktív ezközök használata Új vezérmolekula: OH descriptorok képzése HO V log. P Validált QSAR modell: p. Ki = 0. 52 (Vi) + 0. 27 (log. Pi) - 0. 38 ( i) Új vezérmolekula prediktált aktivitása

Gyógyszerkutatási Stratégia Ø Vezérmolekula keresési könyvtárak: nagy kémiai diverzitás § valódi és virtuális molekula adatbásisok kutatása Ø Vezérmolekula optimalizációs könyvtár: nagy hasonlóság § nagyteljesítményű kombinatorikus kémia alkalmazása Ø Gyógyszer-szerű karakter fontosabb mint a szintetikus hozzáférhetöség § Gyógyszerkémia fontossága és ismert szűrőinek alkalmazása

Virtuális Screenelés • Nagyszámú tesztelni kívánt molekula esetén meg kell adni a proritásokat • A szürés emelkedö finomitási szintje maximálja a potenciális vezérmolekulák számát – “Gyógyszerüségi” megfontolások – Hasonlósági keresés( 2 D és 3 D) kezdeti gyenge vezérmolekulák felhasználásával – 3 D szubstruktúra keresés egy lehetséges farmakofór séma azonosítására – Dokkoltatás az ismert biologiai célpont 3 D struktúrájához

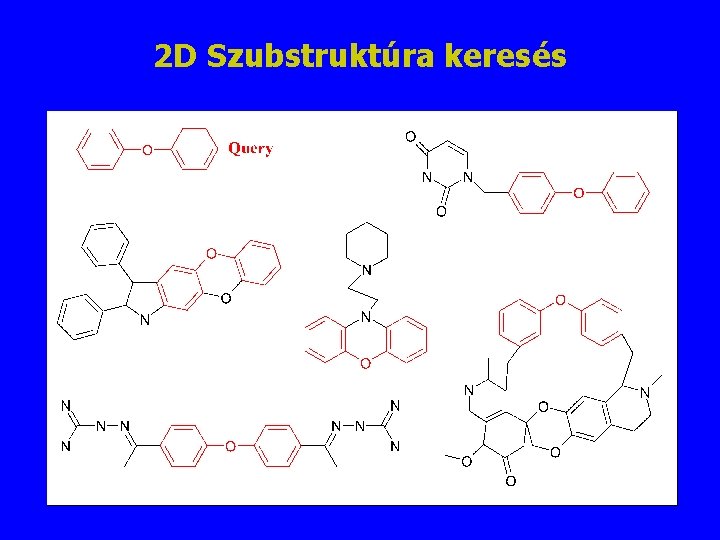
2 D Szubstruktúra keresés

2 D Hasonlósági lekérdezés

3 D Fragmensek • mindegyik fragmens 3 farmakofór pontból áll – a pontok közötti távolságokat és szögeket használjuk fel egy ujjlenyomat képzésére • 4 -pontos farmakofór fragmenseket is használnak • Különböző felhasználók a farmakofór pontokat kissé különböző módon definiálják

3 D Szubstruktúra keresés • Térbeli kapcsolatok • Kötéstávok és szögek tartományának definiálása • Konformáció megadása – általában a legalacsonyabb energiájú

Bioizosztérek Kémiai csoport egy hasonló csoportot képes utánozni. Számos helyettesités a molekulában hasonló biológiai aktivitást eredményez – a ‘hasonlóság’további példái Forgalomban lévő gyógyszerek 70%-a bioizoszter Helyettesítések eredménye!!!

Néhány Bioizosztér

Representativ vegyületek szelektálása Virtuális könyvtárakból Az összes molekulából választunk egy diverz alkészletet REPRESENTATIV MOLEKULA VÁLOGATÁS NAGYTELJESITMÉNYŰ SCREENING KIVÁLASZTOTT CÉLPONTON

Kémiai tér Descriptor-1 Descriptor-2 • • De sc rip t or -3 FÓKUSZÁLT KÖNYVTÁR 1. Gyógyszerüség 2. Strukturális Diversitás Szállitó A: bibor Szállitó B: sárga Szállitó C: zöld Szállitó D: piros

Kombinatorikus könyvtárak Exponenciális növekedése diacid component O Y C O CH 2 C NH CH CH 2 O C O O Kombinatorikus R Robbanás!!!n diphenol component Size of library C O O Y or R

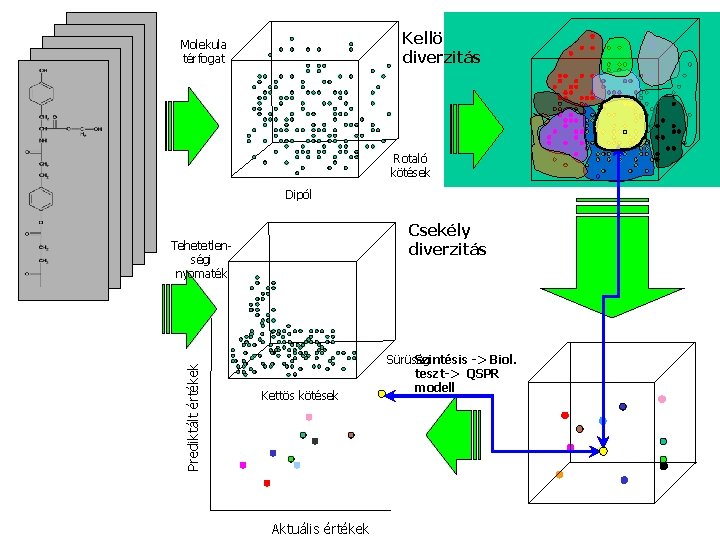
Kellö diverzitás Molekula térfogat Rotaló kötések Dipól Csekély diverzitás Prediktált értékek Tehetetlenségi nyomaték Kettös kötések Aktuális értékek Szintésis -> Biol. Sürüség teszt-> QSPR modell

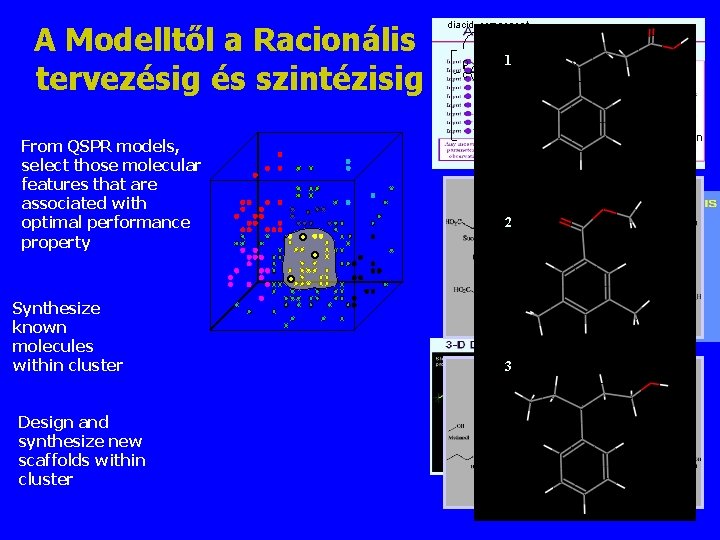
A Modelltől a Racionális tervezésig és szintézisig diacid component O C Y O 1 CO O CH 2 C NH CH CH 2 C O O O R From QSPR models, select those molecular features that are associated with optimal performance property Synthesize known molecules within cluster Design and synthesize new scaffolds within cluster n diphenol component 2 3



Királis váltás („chiral switch”): Enantiomerek keverékét (racém elegyet) tartalmazó gyógyszerek újbóli kifejlesztése és engedélyeztetése egyetlen enantiomert (az eutomert) tartalmazó gyógyszerré. Enantiomer: azonos összegképletűek tükörképi pár molekulák, fedésbe nem hozhatók eutomer: a hatásos izomer disztomer: a kevébé hatásos; hatástalan vagy toxikus izomer

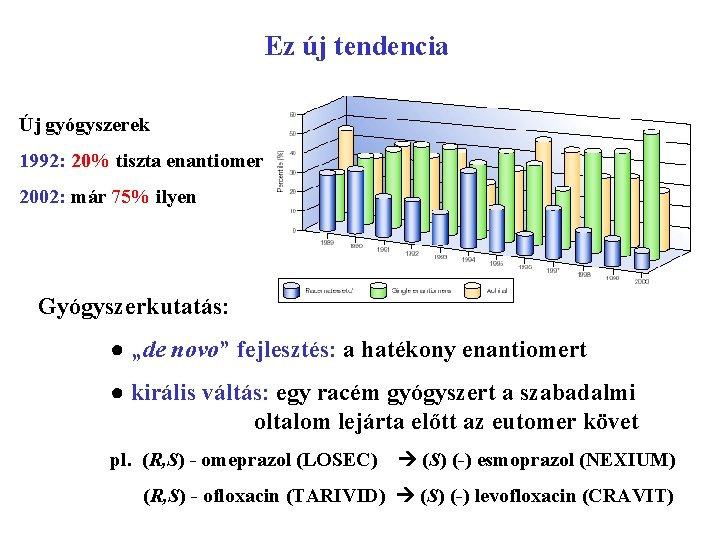
Ez új tendencia Új gyógyszerek 1992: 20% tiszta enantiomer 2002: már 75% ilyen Gyógyszerkutatás: ● „de novo” fejlesztés: a hatékony enantiomert ● királis váltás: egy racém gyógyszert a szabadalmi oltalom lejárta előtt az eutomer követ pl. (R, S) - omeprazol (LOSEC) (S) (-) esmoprazol (NEXIUM) (R, S) - ofloxacin (TARIVID) (S) (-) levofloxacin (CRAVIT)

Miért jó ez? az enantiomereket a szervezet eltérő ágensként ismeri fel („chiral discrimination”) a receptorok királisak enantiomerek: nincs köztük hatásbeli különbség hatáserősségbeli differencia van a két antipód eltérő biológiai hatású a disztomer hatástalan a disztomer toxikus

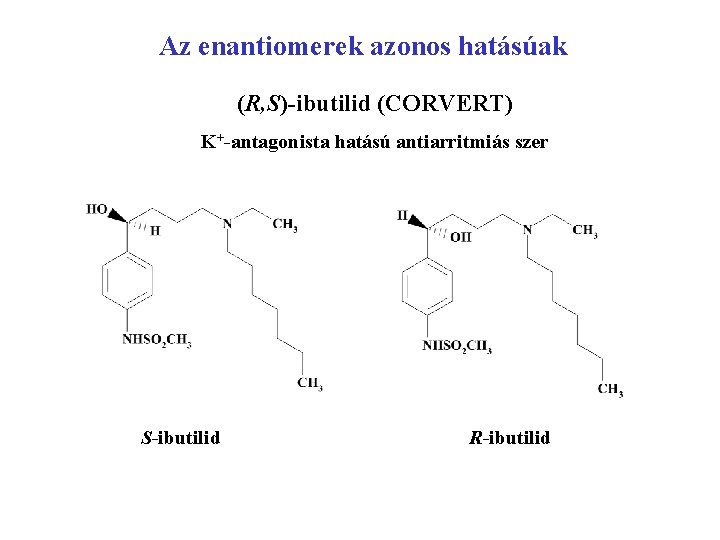
Az enantiomerek azonos hatásúak (R, S)-ibutilid (CORVERT) K+-antagonista hatású antiarritmiás szer S-ibutilid R-ibutilid

Az enantiomerek eltérő hatáserősségűek Norepinefrin

R-Norepinefrin kötődése a receptorhoz + H-híd ( 5. domén ) ( 3. domén ) ionos kötés ( 6. domén )

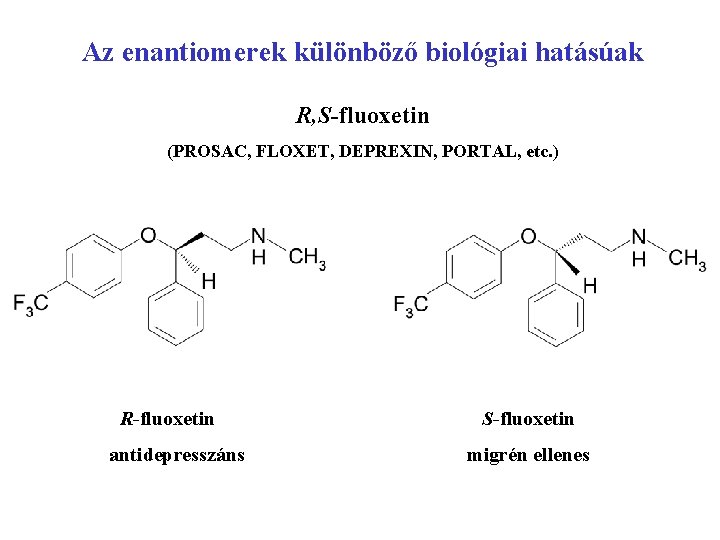
Az enantiomerek különböző biológiai hatásúak R, S-fluoxetin (PROSAC, FLOXET, DEPREXIN, PORTAL, etc. ) R-fluoxetin antidepresszáns S-fluoxetin migrén ellenes

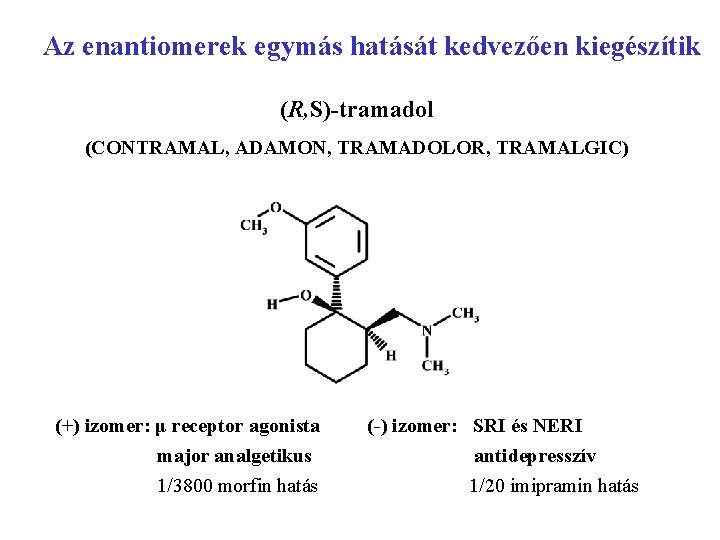
Az enantiomerek egymás hatását kedvezően kiegészítik (R, S)-tramadol (CONTRAMAL, ADAMON, TRAMADOLOR, TRAMALGIC) (+) izomer: μ receptor agonista (-) izomer: SRI és NERI major analgetikus antidepresszív 1/3800 morfin hatás 1/20 imipramin hatás

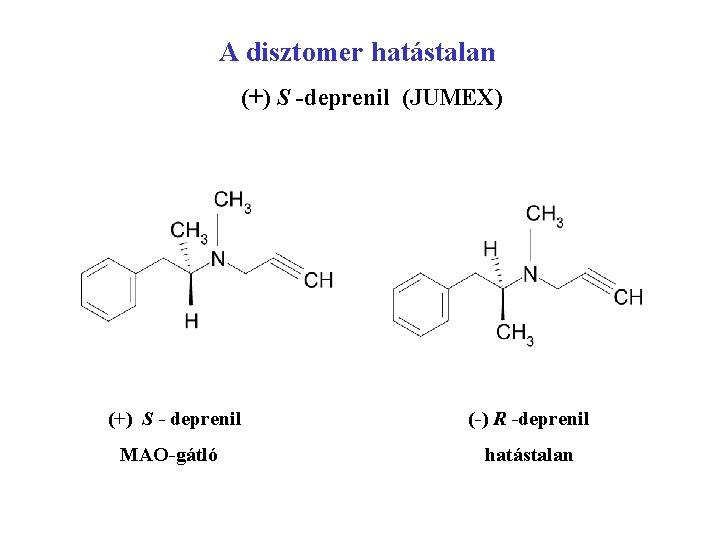
A disztomer hatástalan (+) S -deprenil (JUMEX) (+) S - deprenil (-) R -deprenil MAO-gátló hatástalan

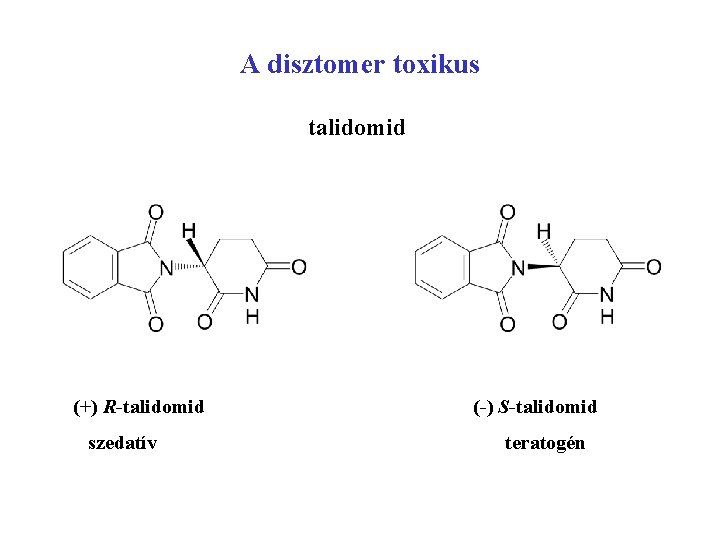
A disztomer toxikus talidomid (+) R-talidomid szedatív (-) S-talidomid teratogén

ÖSSZEGZÉS racém gyógyszerek kora lejárt az eutomert kell használni de alaposan ki kell vizsgálni a disztomer hatását is mindez fejlett technológiát igényel enantiomer-szelektív szintézis rezolválási technikák enantiomer-tisztaság vizsgálat (HPLC, CD)
 Semmelweis egyetem konzerváló fogászati klinika budapest
Semmelweis egyetem konzerváló fogászati klinika budapest Semmelweis egyetem humán erőforrás
Semmelweis egyetem humán erőforrás Semmelweis szemészeti klinika
Semmelweis szemészeti klinika Se etk dse
Se etk dse Hr alrendszerek
Hr alrendszerek Semmelweis doktori iskola
Semmelweis doktori iskola Magnéziumszalag égése
Magnéziumszalag égése Kmiai
Kmiai Arna kmiai
Arna kmiai Kiber nyomozó
Kiber nyomozó Debreceni egyetem karok
Debreceni egyetem karok Debreceni egyetem karok
Debreceni egyetem karok óbudai egyetem napelem
óbudai egyetem napelem Völgy angolul
Völgy angolul Nemzeti kozszolgalati egyetem
Nemzeti kozszolgalati egyetem Rendészeti egyetem ponthatárok
Rendészeti egyetem ponthatárok Tűzoltó készülék debrecen
Tűzoltó készülék debrecen Debreceni egyetem karok
Debreceni egyetem karok Obudai egyetem neptun
Obudai egyetem neptun Bűnügyi nyomozó szak
Bűnügyi nyomozó szak Debreceni egyetem műszaki kar gépészmérnöki tanszék
Debreceni egyetem műszaki kar gépészmérnöki tanszék Károli gáspár református egyetem tanulmányi osztály
Károli gáspár református egyetem tanulmányi osztály Budai egyetem
Budai egyetem Dr dávid imre debreceni egyetem
Dr dávid imre debreceni egyetem Pannon egyetem matematika tanszék
Pannon egyetem matematika tanszék Gyker
Gyker Debreceni egyetem könyvtár beiratkozás
Debreceni egyetem könyvtár beiratkozás Campus mundi debreceni egyetem
Campus mundi debreceni egyetem Debreceni egyetem informatikai kar
Debreceni egyetem informatikai kar Pannon egyetem testnevelés pete
Pannon egyetem testnevelés pete Neptun miskolci egyetem
Neptun miskolci egyetem Vörösházi zsolt
Vörösházi zsolt Anatomie semmelweis
Anatomie semmelweis Resorptionszone
Resorptionszone Orthodontics semmelweis
Orthodontics semmelweis Absorbtion
Absorbtion Semmelweis portál
Semmelweis portál Erasmus plus semmelweis
Erasmus plus semmelweis Semmelweis arc
Semmelweis arc Retikulinfasern leber
Retikulinfasern leber Gsi semmelweis
Gsi semmelweis Semmelweis university faculty of medicine
Semmelweis university faculty of medicine Semmelweis
Semmelweis Hyperparathyreosis
Hyperparathyreosis Pathophysiologie semmelweis
Pathophysiologie semmelweis Tsh szint
Tsh szint Itc semmelweis seka
Itc semmelweis seka Vesicle fusion
Vesicle fusion Zuzana 6357
Zuzana 6357 Spf -all vs ~all
Spf -all vs ~all Ignas semmelweis
Ignas semmelweis Semmelweis
Semmelweis Sote doktori hivatal
Sote doktori hivatal Semmelweis reflex
Semmelweis reflex Konservierende zahnheilkunde semmelweis
Konservierende zahnheilkunde semmelweis Plasma and serum difference
Plasma and serum difference Agnes csaki semmelweis
Agnes csaki semmelweis Garattasak
Garattasak Itc semmelweis
Itc semmelweis Gastrulation and neurulation
Gastrulation and neurulation Semmelweis
Semmelweis Semmelweis.itc
Semmelweis.itc Professor robert galavan
Professor robert galavan Xml sax dom
Xml sax dom Agamenon roberto
Agamenon roberto Prof jamasri
Prof jamasri @prof.aline gaque
@prof.aline gaque Studenti e prof uniti per
Studenti e prof uniti per Dr munjiza
Dr munjiza Poetry prof
Poetry prof Pneumonia definition
Pneumonia definition Translation
Translation Prof dr aysun idil
Prof dr aysun idil Prof slamet widodo
Prof slamet widodo Prof dr ahmet bekar
Prof dr ahmet bekar Prof w c wilson
Prof w c wilson