Seminar Prparate 1 1 Reinigung und Trennung von






















- Slides: 37

Seminar: Präparate 1

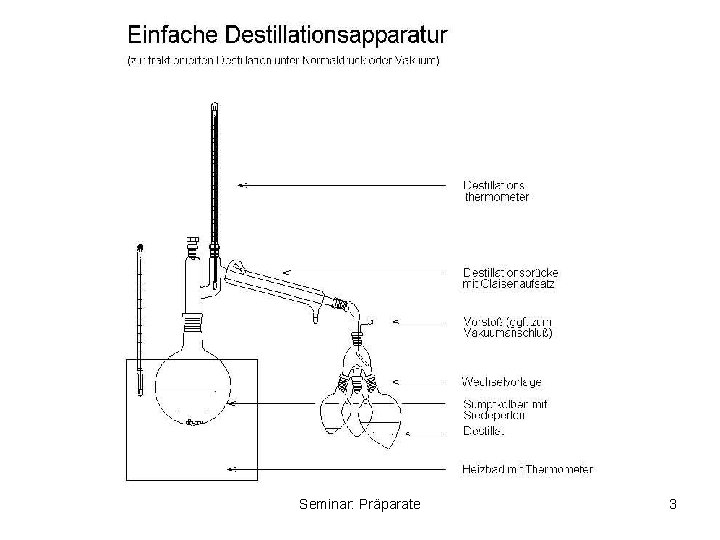
1. Reinigung und Trennung von Verbindungen 1. 1 Reinigung von Flüssigkeiten: • Destillation – Eine flüssige Stoffmischung wird verdampft – Komponenten verflüchtigen sich in der Reihenfolge ihrer Siedepunkte – Anschließende Kondensation – Komponente mit dem niedrigeren Siedepunkt ist im Dampf angereichert, diese Zusammensetzung der Gasphase bliebt im Kondensat erhalten – Destilliert man das Kondensat erneut, wird eine weitere Auftrennung des Gemisches erreicht fraktionierte Destillation Seminar: Präparate 2

Seminar: Präparate 3

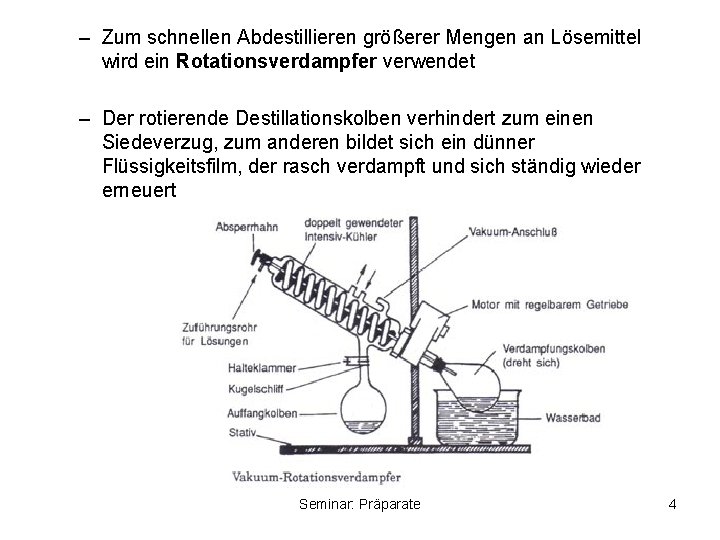
– Zum schnellen Abdestillieren größerer Mengen an Lösemittel wird ein Rotationsverdampfer verwendet – Der rotierende Destillationskolben verhindert zum einen Siedeverzug, zum anderen bildet sich ein dünner Flüssigkeitsfilm, der rasch verdampft und sich ständig wieder erneuert Seminar: Präparate 4

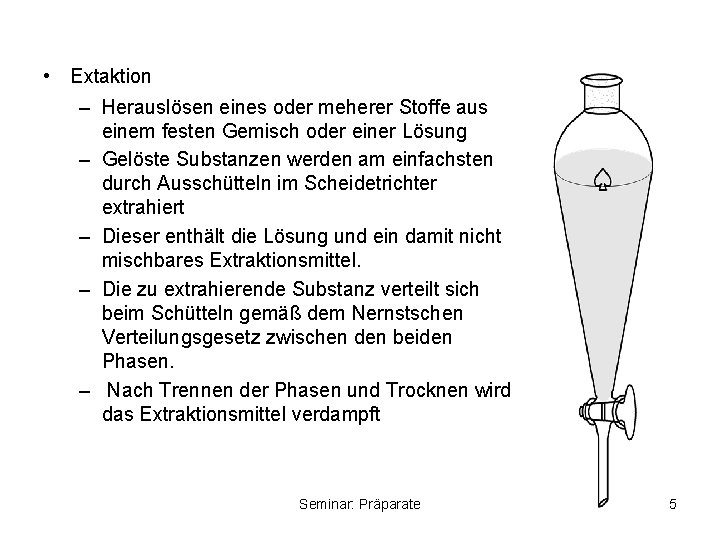
• Extaktion – Herauslösen eines oder meherer Stoffe aus einem festen Gemisch oder einer Lösung – Gelöste Substanzen werden am einfachsten durch Ausschütteln im Scheidetrichter extrahiert – Dieser enthält die Lösung und ein damit nicht mischbares Extraktionsmittel. – Die zu extrahierende Substanz verteilt sich beim Schütteln gemäß dem Nernstschen Verteilungsgesetz zwischen den beiden Phasen. – Nach Trennen der Phasen und Trocknen wird das Extraktionsmittel verdampft Seminar: Präparate 5

1. 2 Reinigung von Feststoffen: • Kristallisation – die wichtigste Reinigungsmethode für Feststoffe – die verunreinigte Substanz wird in der Wärme in einem geeigneten Lösemittel gelöst und heiß filtriert – das Filtrat lässt man abkühlen, wobei die Substanz reiner auskristallisiert – Das Lösemittel ist so zu wählen, dass • es keine chemische Reaktion mit der Substanz eingeht • möglichst leicht zu entfernen ist • sein Siedepunkt 10 -20°C unter dem Schmelzpunkt der Substanz liegt Seminar: Präparate 6

• Sublimation Feste Stoffe können manchmal durch Sublimation gereinigt werden. Dabei geht die Substanz direkt vom festen in den gasförmigen Zustand über und wird aus dem Dampf durch Abkühlen als Feststoff wieder abgeschieden. Seminar: Präparate 7

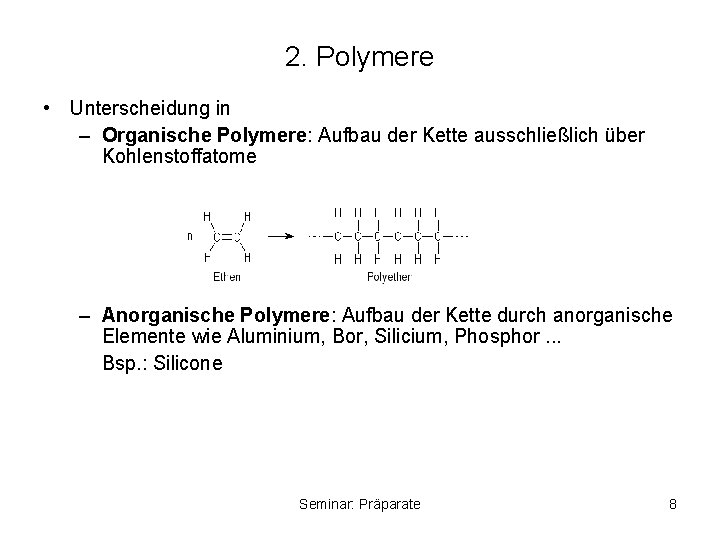
2. Polymere • Unterscheidung in – Organische Polymere: Aufbau der Kette ausschließlich über Kohlenstoffatome – Anorganische Polymere: Aufbau der Kette durch anorganische Elemente wie Aluminium, Bor, Silicium, Phosphor. . . Bsp. : Silicone Seminar: Präparate 8

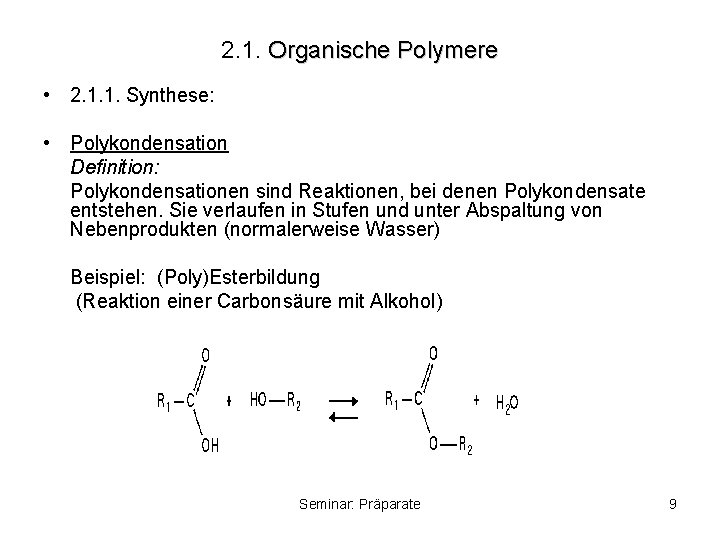
2. 1. Organische Polymere • 2. 1. 1. Synthese: • Polykondensation Definition: Polykondensationen sind Reaktionen, bei denen Polykondensate entstehen. Sie verlaufen in Stufen und unter Abspaltung von Nebenprodukten (normalerweise Wasser) Beispiel: (Poly)Esterbildung (Reaktion einer Carbonsäure mit Alkohol) Seminar: Präparate 9

• Polyaddition: Definition: Analoge Reaktion wie Polykondensation nur ohne Abspaltung eines Nebenprodukts, dafür Verschiebung von Atomen und Elektronenpaaren Beispiel: Polyurethane (Reaktion eines Dialkohols mit Diisocyanat) Seminar: Präparate 10

• Radikalische Polymerisation: Seminar: Präparate 11

• Kationische Polymerisation: Seminar: Präparate 12

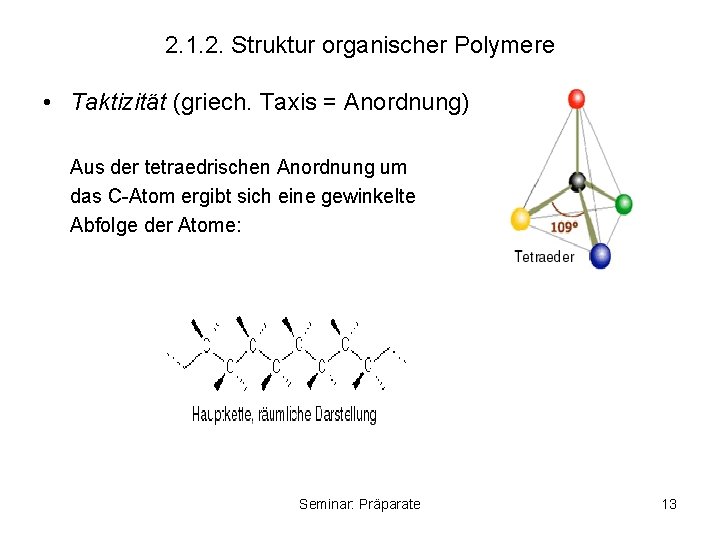
2. 1. 2. Struktur organischer Polymere • Taktizität (griech. Taxis = Anordnung) Aus der tetraedrischen Anordnung um das C-Atom ergibt sich eine gewinkelte Abfolge der Atome: Seminar: Präparate 13

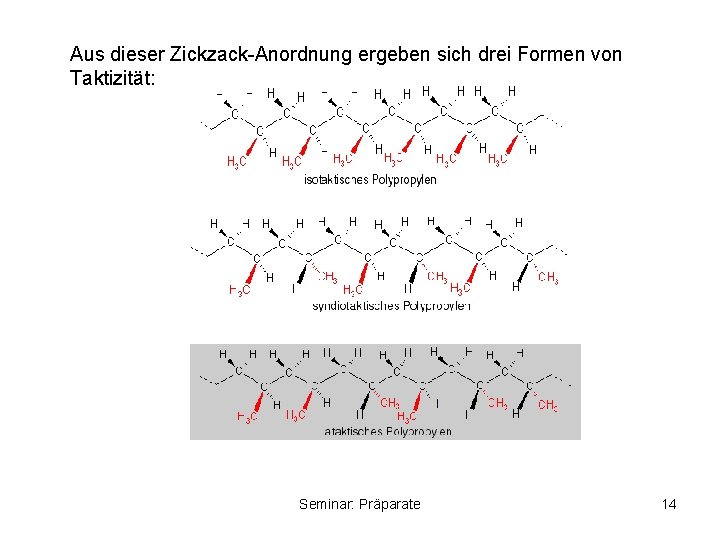
Aus dieser Zickzack-Anordnung ergeben sich drei Formen von Taktizität: Seminar: Präparate 14

Folgen der Taktizität: • Gleichmäßige Moleküle bilden leichter Kristalle • Je kristalliner ein Kunststoff ist, desto härter und spröder ist er Formbeständigkeit und Schmelzpunkt nehmen zu, da aufgrund der gleichmäßigeren Anordnung der Moleküle zwischenmolekulare Kräfte besser wirken können. Seminar: Präparate 15

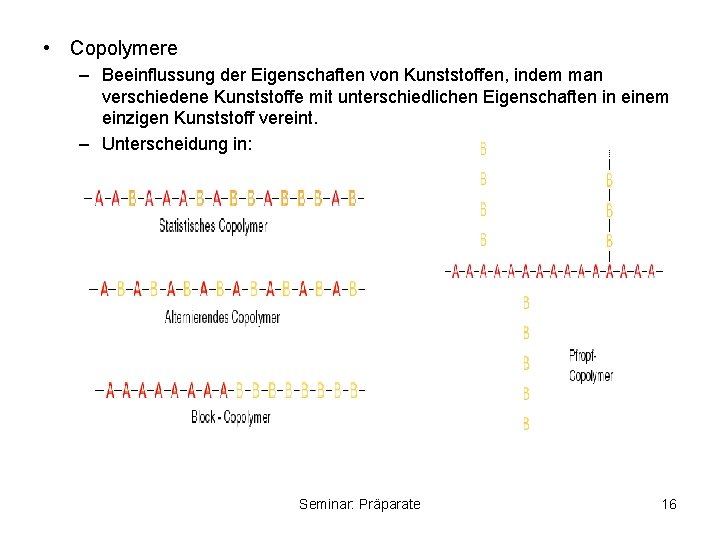
• Copolymere – Beeinflussung der Eigenschaften von Kunststoffen, indem man verschiedene Kunststoffe mit unterschiedlichen Eigenschaften in einem einzigen Kunststoff vereint. – Unterscheidung in: Seminar: Präparate 16

• Vernetzung Unvernetzte Kunststoffe werden schnell weich und schmelzen bei niedrigen Temperaturen. Eine Vernetzung erhöht die Festigkeit der Bindungen der einzelnen Polymerstränge untereinander. Vernetzung z. B durch kovalente Bindungen Seminar: Präparate 17

Einteilung von Kunststoffen in • Thermoplasten, – in der Regel kettenförmig und nur geringfügig vernetzt – gehen in einem bestimmten Temperaturintervall von dem harten, festen, spröden Zustand in einen plastischen über – sind daher mechanisch verformbar • Elastomere – weimaschig vernetzte Polymere – Können bereits bei Raumtemperatur durch Einwirken einer äußeren Kraft stark gedehnt werden, gehen danach jedoch wieder in ihrer ursprüngliche Form zurück. • Duroplasten – sehr engmaschig verknüpft – bei Raumtemperatur hart und spröde – schmelzen auch bei erhöhter Temperatur nicht und sind somit nicht formbar, sondern zersetzen sich. Seminar: Präparate 18

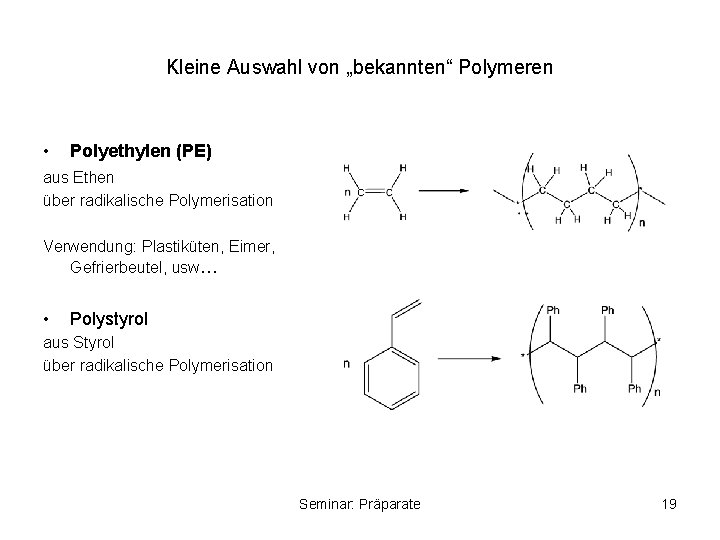
Kleine Auswahl von „bekannten“ Polymeren • Polyethylen (PE) aus Ethen über radikalische Polymerisation Verwendung: Plastiküten, Eimer, Gefrierbeutel, usw… • Polystyrol aus Styrol über radikalische Polymerisation Seminar: Präparate 19

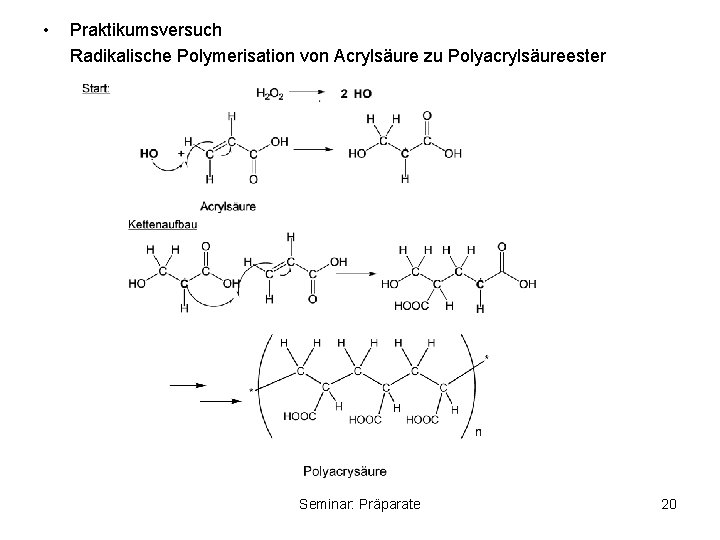
• Praktikumsversuch Radikalische Polymerisation von Acrylsäure zu Polyacrylsäureester Seminar: Präparate 20

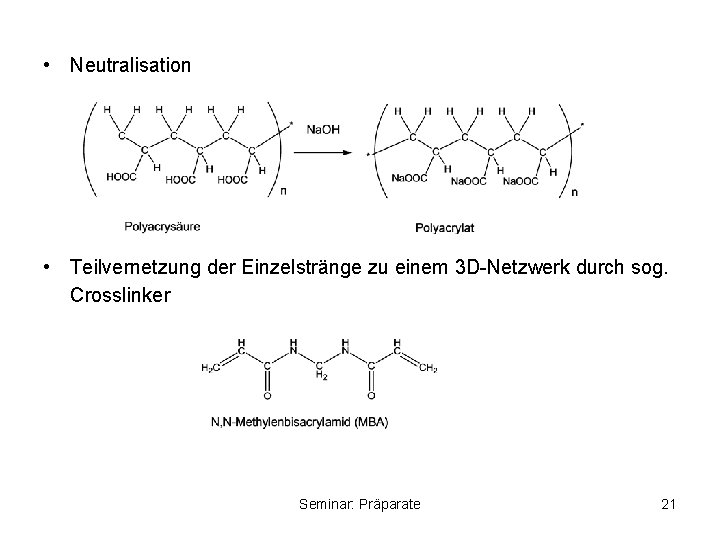
• Neutralisation • Teilvernetzung der Einzelstränge zu einem 3 D-Netzwerk durch sog. Crosslinker Seminar: Präparate 21

• Verwendung von Polyacrylaten: – Superabsorber Seminar: Präparate 22

Seminar: Präparate 23

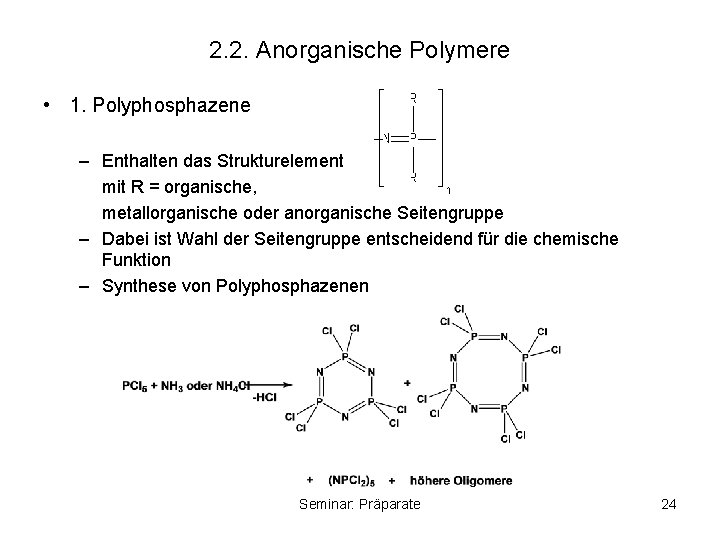
2. 2. Anorganische Polymere • 1. Polyphosphazene – Enthalten das Strukturelement mit R = organische, metallorganische oder anorganische Seitengruppe – Dabei ist Wahl der Seitengruppe entscheidend für die chemische Funktion – Synthese von Polyphosphazenen Seminar: Präparate 24

• Verwendung von Phosphazenen: • Poly(fluoroalkoxy)phosphazene der allgemeinen Formel [NP(OCH 2 CF 3)(OCH 2(CF 2)m. CF 2 H)]n sind lösungsmittelresistente Elastomere - Nutzung für Benzinleitungen, Dichtungsringe und andere gegen Kohlenwasserstoffe resistente Bauteile • feuerfeste Polyphosphazene werden zur Imprägnierung von Textilfasern, für Hitze-, Strom- oder Schallisolatoren verwendet • Hydrogele zur kontrollierten Freisetzung von Pharmaka • Membranen • Biomaterialien - Herzklappen, Blutgefäße, chirurgische Fäden, Kontaktlinsen Seminar: Präparate 25

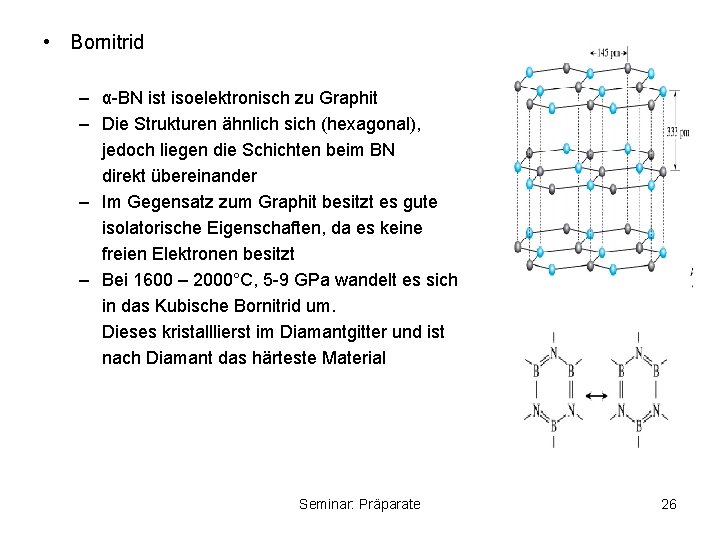
• Bornitrid – α-BN ist isoelektronisch zu Graphit – Die Strukturen ähnlich sich (hexagonal), jedoch liegen die Schichten beim BN direkt übereinander – Im Gegensatz zum Graphit besitzt es gute isolatorische Eigenschaften, da es keine freien Elektronen besitzt – Bei 1600 – 2000°C, 5 -9 GPa wandelt es sich in das Kubische Bornitrid um. Dieses kristalllierst im Diamantgitter und ist nach Diamant das härteste Material Seminar: Präparate 26

• Synthese von Bornitrid Erhitzen ortho-Borsäure mit Harnstoff (Quelle für NH 3) n B(OH)3 + n NH 3 (BN)n + n H 2 O • Verwendung von Bornitrid: – Hexagonales Bornitrid wird als Festschmierstoff verwendet. – Kubisches Bornitrid als Schneidewerkzeug und Schleifmittel Seminar: Präparate 27

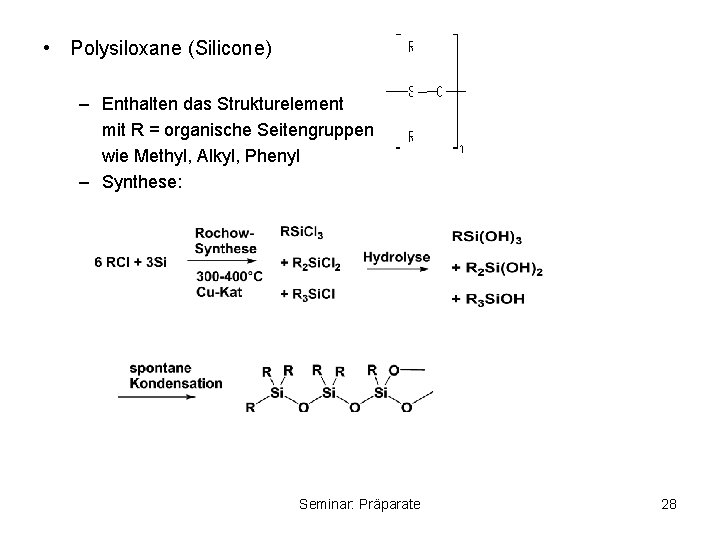
• Polysiloxane (Silicone) – Enthalten das Strukturelement mit R = organische Seitengruppen wie Methyl, Alkyl, Phenyl – Synthese: Seminar: Präparate 28

Dabei dient – das Silanol als Kettenendgruppe – das Silandiol als Kettenglied – Das Silantriol als Verzweigungsstelle • durch geeignete Mischung kann der Polymerisationsgrad eingestellt werden • Je nach Mischungsverhältnis entstehen – Siliconöle (flüssig): kettenförmige, nicht vernetzte Makromoleküle mit mäßiger Kettenlänge – Siliconkautschuk (gummiartig): gering vernetzte Ketten – Siliconharze (fest, harzartig): stark vernetzte Siloxane Seminar: Präparate 29

• Anwendung von Silicon: – Glas-/Keramikindustrie: Korrosionsschutz, Formentrennmittel, Hydrophobierungsmittel – Textilindustrie: Faserhydrophobierung, Imprägnierung – Papierindustrie: Trennmittel, Reduktion von elektrostatischer Aufladung – Bautenschutz: Verringerung der Benetzung, Frostschutz, Staub und Schmutzabweisung – Getränkeindustrie: Entschäumer, Glasvergütung – Gummindustrie: Formentrennmittel – Landwirtschaft: kontrollierte Freisetzung von Chemikalien – Elektroindustrie: elektrische Isolatoren, dielektrische Flüssigkeiten – Medizin: plastische Chirurgie (Prothesen, Gesichtsrekonstruktionen), künstliche Organe, Röhren und Katheder, künstliche Haut, Kontaktlinsen – Pharmazie: Bestandteil von Salbengrundlagen, Hydrophobierungsmittel für Gläser, Arzneistoff, Arzneifreisetzungssysteme Seminar: Präparate 30

3. Präparate • 1. Silicate – Salze der Kieselsäure, H 4 Si. O 4 – in Silicaten hat Silicium die CN=4 und ist tetraedrisch von Sauerstoff umgeben – Die Si. O 4 -Tetraeder sind nur über gemeinsame Ecken verknüpft, nicht über Kanten oder Flächen – Die Einteilung der Silicate erfolgt nach der Anordnung der Si. O 4 Tetraeder: • Inselsilicate: – isolierte [Si. O 4]4 - -Tetraeder, die durch Kationen miteinander verbunden sind • Gruppensilicate: – enthalten Doppeltetraeder [Si 2 O 7]6 - • Ringsilicate: – – Dreierringe [Si 3 O 9]6 - ; Viererringe [Si 4 O 12]8 - ; Sechserringe [Si 6 O 18]12 - ; Achterringe [Si 8 O 24]16 Seminar: Präparate 31

• Kettensilicate: – Tetraeder zu unendlichen Ketten oder Bänder verknüpft; Ketten ordnen sich paralell zueinander an • Schichtsilicate: – Si. O 4 -Tetraeder sind über drei Ecken mit den Nachbartetraedern verknüpft; es entstehen 2 D unendliche Schichten » Treten zwischen den Schichten nur Van-der-Waals-Kräfte auf, resultieren weiche Mineralien mit leicht gegeneinander verschiebbaren Schicht (Talk) » Werden die Schichten durch Kationen zusammengehalten, wächst die Härte, aber paralell zu den Schichten existiert gute Spaltbarkeit (Glimmer) • Gerüstsilicate: – Si. O 4 -Tetraeder sind über alle Ecken verknüpft – Es entsteht ein dreidimensionales, lockeres Gerüst – Unterscheidung in » Feldspate » Zeoltihe Seminar: Präparate 32

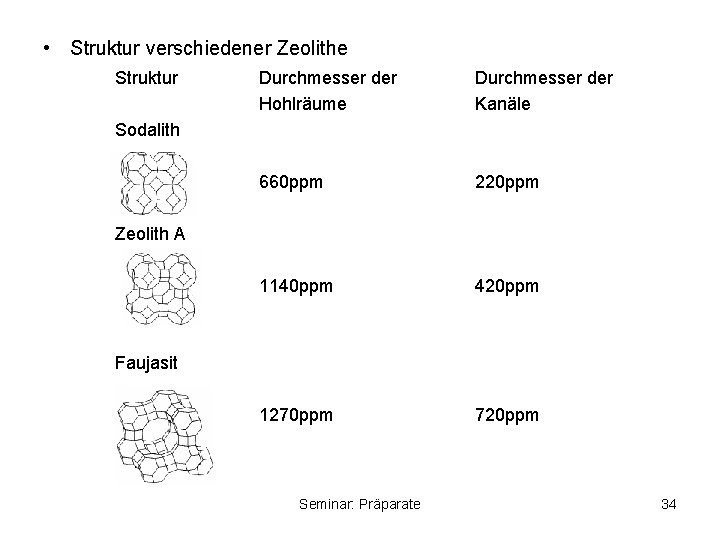
• Zeolithe – kristalline, hydratisierte Alumosilicate Si 4+ teilweise durch Al 3+ ersetzt – die überschüssige negative Ladung wird durch Alkali- und Erdalkalimetallionen ausgeglichen – allg. Zusammensetzung von Zeolithe (Me+, Me 2+0, 5)x(Al. O 2)x(Si. O 2)y(H 20)z – in der Struktur existieren große Hohlräume, die durch kleinere Kanäle verbunden sind – in den Hohlräumen befinden sich die Metallionen und H 2 O-Moleküle – die Metallionen können leicht ausgetauscht werden, da sie nicht festgebunden sind – durch gezielte Synthese können Zeolithe mit unterschiedlich großen Hohlräumen und Kanälen hergestellt werden Seminar: Präparate 33

• Struktur verschiedener Zeolithe Struktur Durchmesser der Hohlräume Durchmesser der Kanäle 660 ppm 220 ppm 1140 ppm 420 ppm 1270 ppm 720 ppm Sodalith Zeolith A Faujasit Seminar: Präparate 34

• Verwendung von Zeolith: – Ionenaustauscher z. B. Wasserenthärtung In den Hohlräumen enthaltene Na+ - Ionen können durch Ca 2+ ausgetauscht werden. Na-Zeolith A erstetzt umweltschädliche Phosphate in Waschmitteln – Adsorption da nur Moleküle adsorbiert werden können, die in die Kanäle passen, können Moleküle unterschiedlicher Größe getrennt werden Molekularsiebe – Katalyse auf der inneren Oberfläche können katalytisch aktive Zentren eingebaut werden (z. B. –COOH, Pd, Pt) z. B Isomerisierung von n- zu iso-Paraffinen Seminar: Präparate 35

• 2. Pigmente – Pigmente sind feinteilige Farbträger, die in Löse- oder Bindemitteln praktisch unlöslich sind und somit als sehr kleine Kristalle vorliegen. – Im Gegensatz zu den meist wasserlöslichen Farbstoffen sind Pigmente immer wasserunlöslich und liegen in Form von sehr kleinen Kristallen vor. – Der Farbeindruck wird wesentlich durch Lichtstreuung an den Pigmentteilchen beeinflusst. Je kleiner diese sind, um so höher ist die Farbstärke des Pigments. Die Farbstärke ist das Maß für die Fähigkeit eines Pigments, die Farbe eines anderen Stoffes zu verändern. Die optimale Kristallgröße liegt zwischen 0, 5 und 2 Mikrometer. – Beispiel: Thenards Blau, Rinnmanns Grün Seminar: Präparate 36

• 3. Gläser – Gläser sind allgemein amorphe Festkörper, die aus einer Schmelz durch Abkühlung ohne merkliche Kristallisation erstarren. Sie besitzen keine scharfen Erstarrungstemperaturen, sondern einen kontinuierlichen Transformationsbereich. – Borsilicatglas ist ein Spezialglas der Zusammensetzung 70 -80% Si. O 2 4 - 8 % Na 2 O, K 2 O 7 -13 % B 2 O 3 2 - 7 % Al 2 O 3 – B 2 O 3 bewirkt eine Erniedrigung des thermischen Ausdehnungskoeffizienten, dadurch wird das Glas unempfindlicher gegenüber Temperaturdifferenzen. Außerdem erhöht chemische Resistenz gegen sauren Medien. – Al 2 O 3 verbessert Korrisionsverhalten und senkt die Sprödigkeit Seminar: Präparate 37
 Housekeeping aufgaben
Housekeeping aufgaben Chemieingenieur interviewfragen
Chemieingenieur interviewfragen Wind von backbord weicht wind von steuerbord
Wind von backbord weicht wind von steuerbord Erasmus von rotterdam beeinflusst von
Erasmus von rotterdam beeinflusst von Aess seminar
Aess seminar Ap seminar part b outline
Ap seminar part b outline Seminar on education in india
Seminar on education in india Ncaa regional rules seminar
Ncaa regional rules seminar Preaching seminar
Preaching seminar Ta'limni tashkil etishning shakli nima
Ta'limni tashkil etishning shakli nima Lord of the flies socratic seminar
Lord of the flies socratic seminar Herzlich willkommen zum seminar
Herzlich willkommen zum seminar Juristisches seminar datenbanken
Juristisches seminar datenbanken Receiving god's gifts life in the spirit seminar
Receiving god's gifts life in the spirit seminar Xbrl seminar
Xbrl seminar Greetings in seminar
Greetings in seminar Seminar elektronisches urkundenarchiv
Seminar elektronisches urkundenarchiv Englisches seminar wwu erasmus
Englisches seminar wwu erasmus Dbt funding agency
Dbt funding agency Future enhancement of ethical hacking
Future enhancement of ethical hacking Operating system seminar
Operating system seminar Parasitic computing seminar report
Parasitic computing seminar report Organic led seminar
Organic led seminar Airport security seminar
Airport security seminar Work morals
Work morals First year experience auburn
First year experience auburn Examples of level three questions
Examples of level three questions Moodle seminar weingarten
Moodle seminar weingarten Sixth sense technology seminar
Sixth sense technology seminar Reiki seminar
Reiki seminar Big family
Big family Basic bible seminar module
Basic bible seminar module Zoom facilitation tips
Zoom facilitation tips Transition readiness seminar
Transition readiness seminar Presentation adjective
Presentation adjective Soft skills seminar
Soft skills seminar Is ap seminar difficult
Is ap seminar difficult Socratic seminar meaning
Socratic seminar meaning