Semana 30 PROTENAS QUMICA 2020 1 SEMANA 30

















- Slides: 30

Semana 30 PROTEÍNAS QUÍMICA 2020 1

SEMANA 30 PROTEÍNAS Definición. Clasificación por su función biológica y por su composición. Estructura Proteica: -Primaria, secundaria, terciaria y cuaternaria. Enlaces y características. Estructura e importancia biológica de: Insulina, Colágeno, Mioglobina y Hemoglobina Desnaturalización -Agentes desnaturalizantes: Calor, agitación, compuestos orgánicos, ácidos y bases, metales pesados. Enzimas Clasificación según la Comisión Internacional de Enzimas. Ejemplos de reacciones enzimáticas para cada grupo. Aplicación de los conceptos en la salud humana. Importancia de las enzimas séricas en el diagnóstico de daño al tejido (LDH, AST, CK, ALT, ALP, PA, CE, LPS, ACP, PSA) Lecturas en libro de texto - La Química en la Salud “Priones y enfermedad de las vacas locas” “Anemia drepanocìtica o de células falciformes” “Las isoenzimas como recurso para establecer un diagnóstico” Laboratorio: Desnaturalización de proteínas y Actividad enzimática. 2

PROTEÍNAS • Macromoléculas formadas por polímeros (heteropolímeros) lineales (cadenas polipeptídicas) de más de 50 alfa aminoácidos. • Contienen C, H, O, N, S, P • Tienen actividad biológica específica • Se clasifican por: Su composición química: Simples y conjugadas Su función biológica. 3

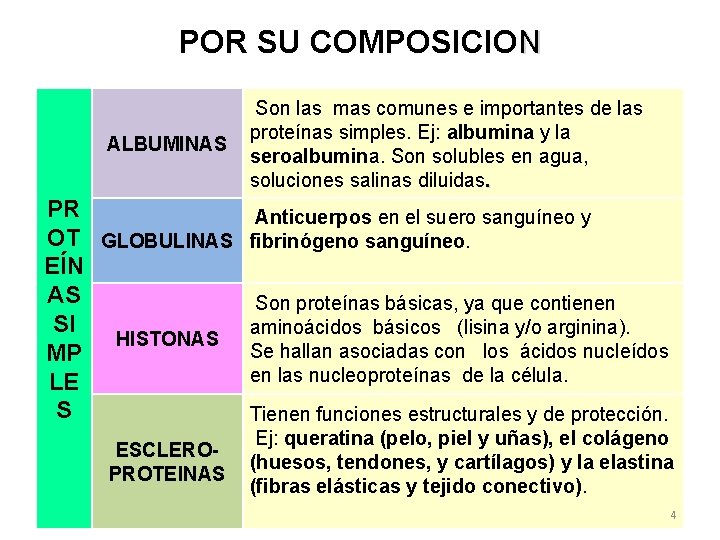
POR SU COMPOSICION ALBUMINAS Son las mas comunes e importantes de las proteínas simples. Ej: albumina y la seroalbumina. Son solubles en agua, soluciones salinas diluidas. PR Anticuerpos en el suero sanguíneo y OT GLOBULINAS fibrinógeno sanguíneo. EÍN AS Son proteínas básicas, ya que contienen SI aminoácidos básicos (lisina y/o arginina). HISTONAS Se hallan asociadas con los ácidos nucleídos MP en las nucleoproteínas de la célula. LE S Tienen funciones estructurales y de protección. ESCLEROPROTEINAS Ej: queratina (pelo, piel y uñas), el colágeno (huesos, tendones, y cartílagos) y la elastina (fibras elásticas y tejido conectivo). 4

PROTEÍNAS CONJUGADAS formadas por dos partes: APOPROTEINA: es la porción protéica y GRUPO PROSTÉTICO: es la porción no proteica Proteinas con grupo prostético azúcar. GLUCOPROTEINAS Ej: gamaglobulina. Proteinas con grupo prostético hemo. Ej: PR CROMOPROTEINAS hemoglobina y mioglobina OT EÍN Proteínas con grupo prostético lípidos, AS LIPOPROTEINAS incluyendo el colesterol. CO NJ METALOPROTEINA Proteínas con grupo prostético ión UG S metalico. Ej: algunas enzimas. AD AS NUCLEOPROTEINA Proteínas con grupo prostético acidos nucleicos. Ej: en los ribosomas S FOSFOPROTEINAS Proteínas con grupo prostético esterfosfato , Ej: caseína 5

ENZIMAS Catalizan las reacciones bioquímicas en las células. Ej: TRIPSINA cataliza la hidrólisis de proteínas y la SACARASA la hidrólisis de la sacarosa CONTRACTIL Responsables de la contracción muscular. Ej: MIOSINA y la ACTINA. HORMONAL Regulan el metabolismo corporal. Ej: HORMONA DEL CRECIMIENTO, que regula el crecimiento y la INSULINA regula el nivel de glucosa en la sangre FU NCI ON PROTECTORAS BIO LO GIC A ALMACENAMIENTO TRANSPORTE ESTRUCTURAL Ayudan al cuerpo a defenderse de sustancias extrañas. Ej: INMUNOGLOBULINAS y el FIBRINÓGENO. Almacenan los nutrientes. Ej: CASEÍNA almacena las proteínas de la leche y la FERRITINA almacena hierro en el hígado y bazo Transportan sustancias esenciales en el cuerpo. Ej: HEMOGLOBINA transporta oxigeno y las LIPOPROTEINAS transportan lípidos Mantienen unidas estructuras del cuerpo. Ej: COLÁGENO forma tendones y cartílagos. QUERATINA forma cabello, piel, unas y lana. 6

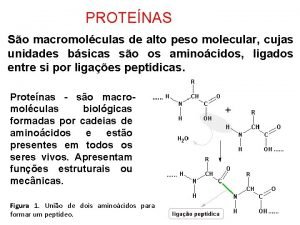
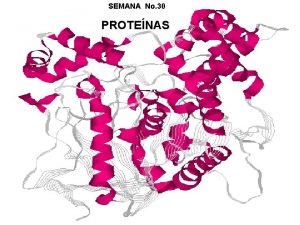
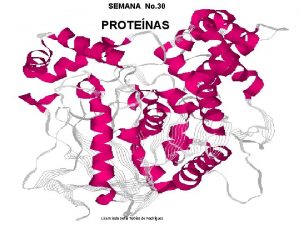
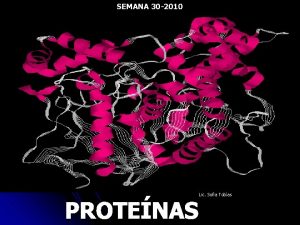
Niveles estructurales de las proteínas Estructuras: 1ª, 2ª, 3ª y 4ª ESTRUCTURA PRIMARIA: • Se refiere al número y la secuencia específica de los aminoácidos que forman la cadena polipeptídica de una proteína. Los ENLACES PEPTÍDICOS son los enlaces que mantienen la estructura 1ª. Unen los aa desde el extremo N-terminal hasta el extremo C-terminal. Ej: la insulina. 7

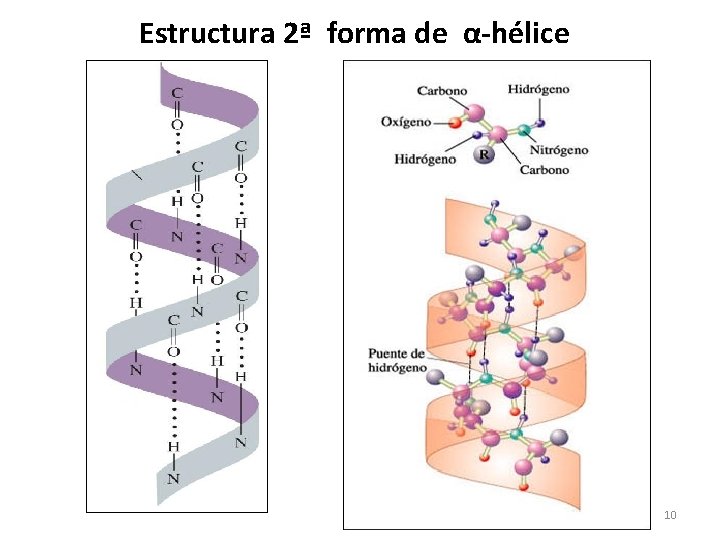
ESTRUCTURA SECUNDARIA: • Es la forma que adquiere la cadena polipeptídica de una proteína, cuando los aminoácidos de su cadena forman puentes de Hidrógeno entre sus grupos amino y carboxilo. • Los PUENTES DE HIDRÓGENO son los enlaces o atracciones que la mantienen estable la estructura 2ª. Tipos de estructuras secundarias que pueden presentar las proteínas: • Alfa hélice • Hoja plegada beta • Triple hélice 8

Estructura 2ª en alfa-hélice (α) • Se refiere a la forma de espiral (α-hélice) que adquiere la cadena polipeptídica al enrollarse. • Esta estructura es mantenida por los puentes de Hidrógeno que se forman entre los -H del grupo amino (-NH 2) de un aa y el -O del carboxilo (-COOH) de otro aa. Se forman cada 4 aminoácidos de la cadena peptídica. 9

Estructura 2ª forma de α-hélice 10

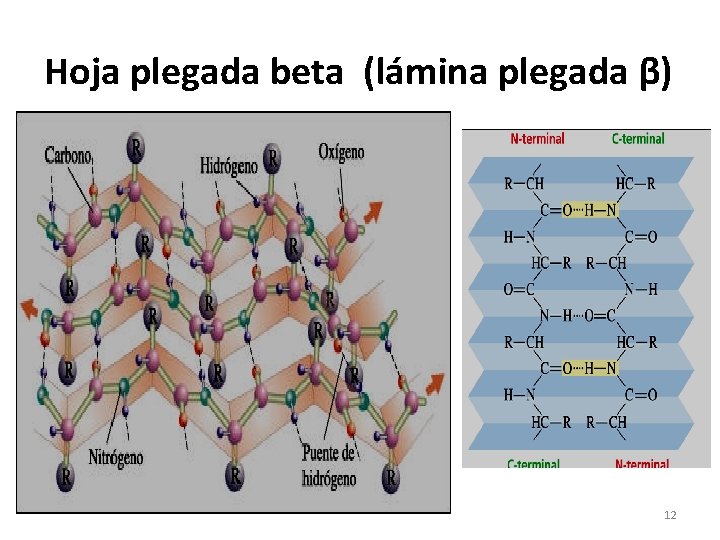
Estructura 2ª en Hoja ó lámina plegada-β • Es cuando se mantienen capas enlazadas de proteína. Forman estructuras fibrosas. Ej: la seda. • Se debe a enlaces por puentes de H que se forman entre los grupos -NH 2 y –COOH de aminoácidos ubicados en secciones de una misma cadena polipeptídicas ó en diferentes cadenas. 11

Hoja plegada beta (lámina plegada β) 12

Estruct. 2ª en TRIPLE HELICE • Estructura formada por tres cadenas de α hélice que se enrollan como trenza y se mantienen unidas mediante puentes de hidrógeno. Ej: las fibras de Colágeno. 13

ESTRUCTURA TERCIARIA: • Se refiere a la forma tridimensional específica (propia de cada proteína) que adquiere la cadena peptídica de una proteína. • Se estabiliza mediante interacciones como atracciones ó repulsiones entre los grupos –R de los aminoácidos de la cadena, formando dobleces ó estiramientos en la estructura. • Ej: la mioglobina 14

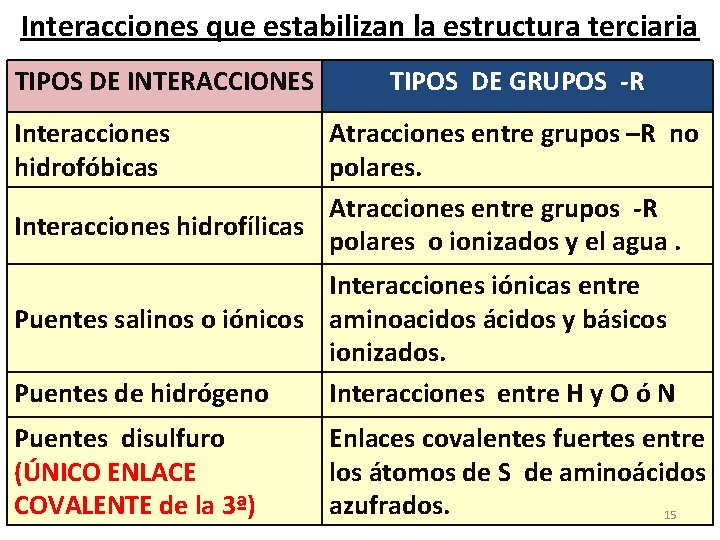
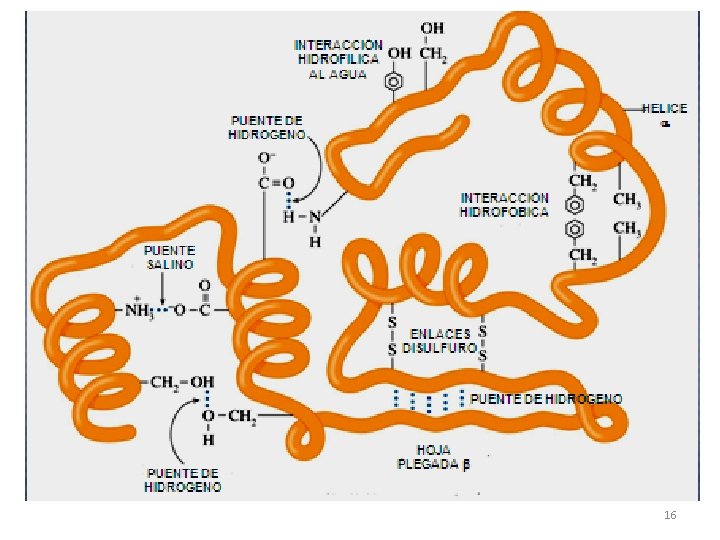
Interacciones que estabilizan la estructura terciaria TIPOS DE INTERACCIONES TIPOS DE GRUPOS -R Interacciones hidrofóbicas Atracciones entre grupos –R no polares. Atracciones entre grupos -R Interacciones hidrofílicas polares o ionizados y el agua. Interacciones iónicas entre Puentes salinos o iónicos aminoacidos ácidos y básicos ionizados. Puentes de hidrógeno Interacciones entre H y O ó N Puentes disulfuro (ÚNICO ENLACE COVALENTE de la 3ª) Enlaces covalentes fuertes entre los átomos de S de aminoácidos azufrados. 15

16

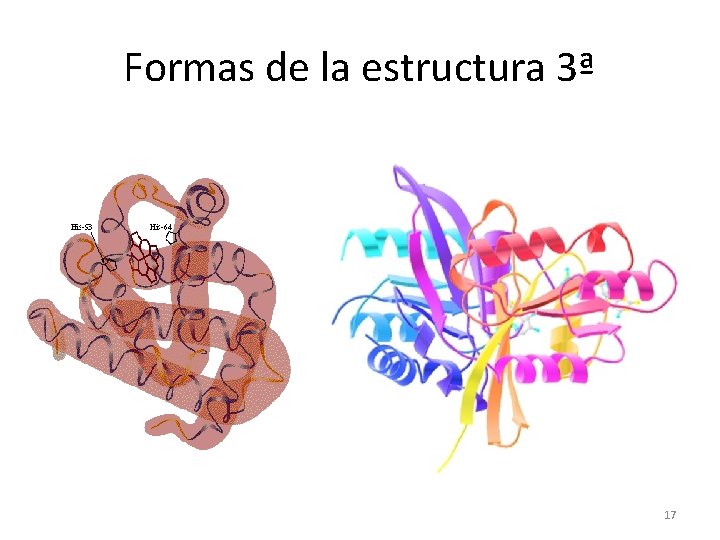
Formas de la estructura 3ª 17

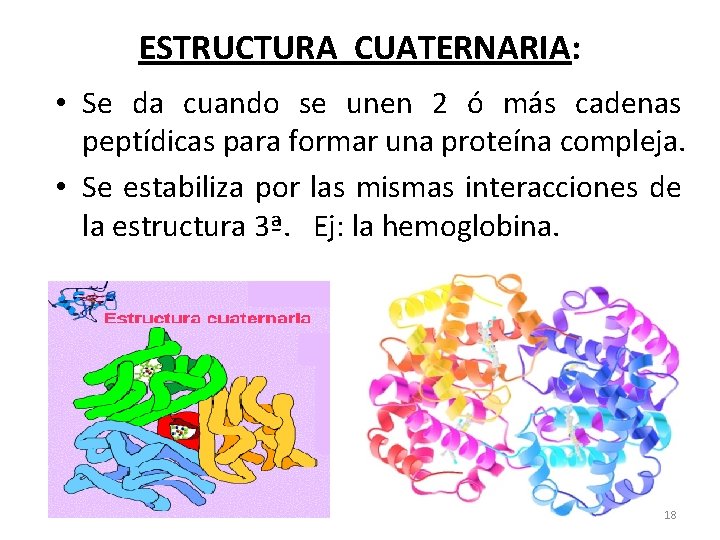
ESTRUCTURA CUATERNARIA: • Se da cuando se unen 2 ó más cadenas peptídicas para formar una proteína compleja. • Se estabiliza por las mismas interacciones de la estructura 3ª. Ej: la hemoglobina. 18

ESTRUCTURAS DE LAS PROTEINAS 19

Importancia de algunas proteínas Insulina • Hormona que regula el nivel de glucosa en la sangre. • Solo tiene estructura 1ª pero consiste es dos cadenas polipeptídicas unidas por enlaces disulfuro. 20

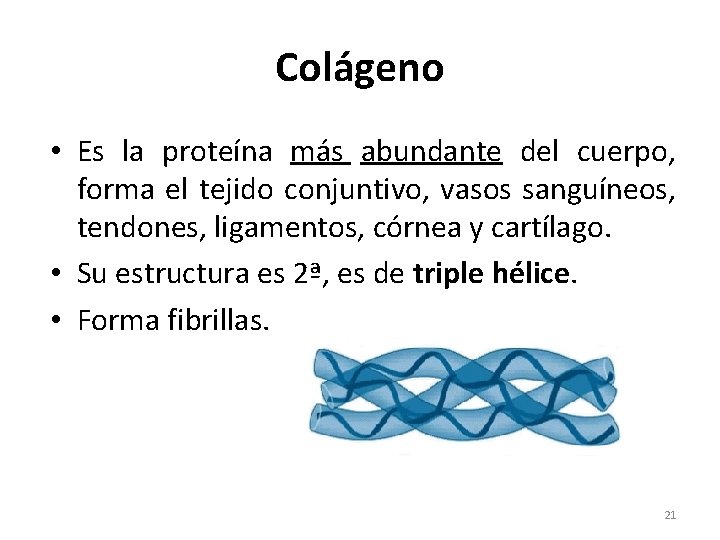
Colágeno • Es la proteína más abundante del cuerpo, forma el tejido conjuntivo, vasos sanguíneos, tendones, ligamentos, córnea y cartílago. • Su estructura es 2ª, es de triple hélice. • Forma fibrillas. 21

Mioglobina • Es una proteína globular que almacena oxígeno en el músculo. • Su estructura es 3ª, formada por 1 sola cadena, es compacta y enlaza en el centro un grupo HEMO que contiene hierro. • No tiene estructura 4ª. • Su estructura y función se parece a la hemoglobina. 22

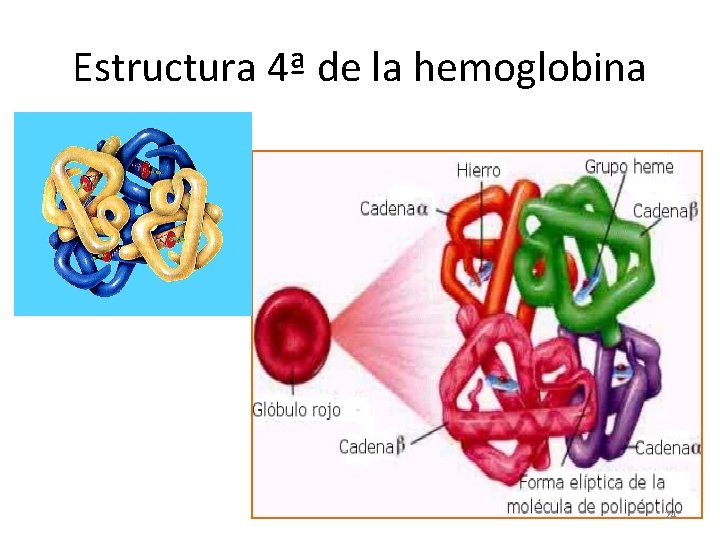
Hemoglobina • Es una proteína globular que transporta oxígeno en la sangre. • Su estructura es 4ª y consta de 4 subunidades ó 4 cadenas polipeptídicas (dos alfa y dos beta). • Contiene 4 grupos HEMO (1 en cada subunidad) por lo que puede transportar hasta 4 moléculas de oxígeno. 23

Estructura 4ª de la hemoglobina 24

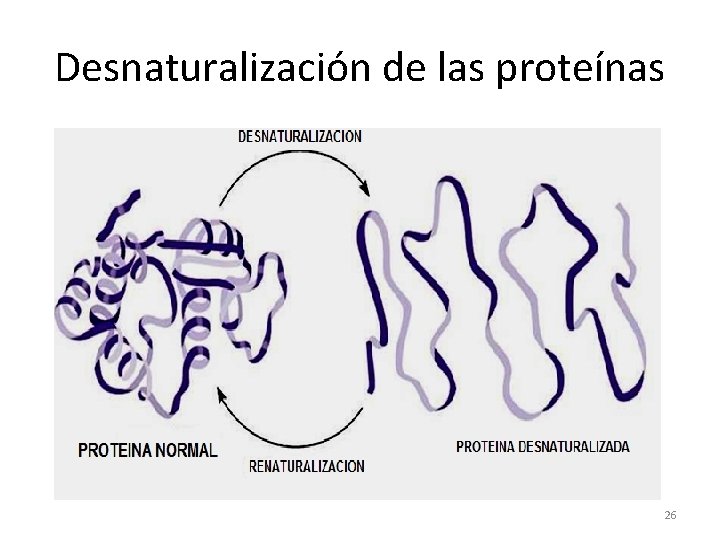
Desnaturalización de las proteínas • Se le llama así a la alteración ó rompimiento de las estructuras 2ª, 3ª ó 4ª de una proteína, sin causar daño ó ruptura de la estructura 1ª. • Se mantienen los enlaces peptídicos (amida). • La proteína desnaturalizada pierde su actividad biológica. Precipita ó coagula. • Es causada por: temperaturas elevadas, ácidos y bases, alcoholes, metales pesados, agitación. 25

Desnaturalización de las proteínas 26

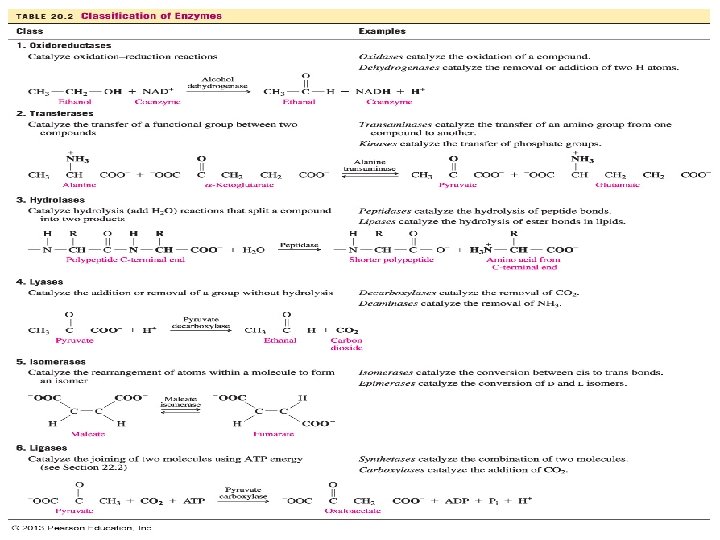
ENZIMAS: son proteínas que catalizan reacciones biológicas. CLASIFICACIÓN CLASE OXIDOREDUC TASAS REACCION CATALIZADA Reacciones de oxidaciónreducción EJEMPLOS Las oxidasas oxida, las reductasas reducen, las deshidrogenasas eliminan a 2 H para formar un doble enlace Transferencia de TRANSF un grupo entre 2 ERASAS compuestos Las transaminasas transfiere grupos amino, las quinasas transfieren grupos fosfato HIDROL Reacciones de ASAS hidrólisis Las proteasas hidrolizan enlaces peptidicos Las lipasas hidroliza los enlaces de tipo ester en los lípidos Las carbohidrasas enlaces glucosídico de los carbohidratos. Las fosfatasas hidrolizan los enlaces tipo ester fofórico 27 Las nucleasas hidroliza ácidos nucléicos

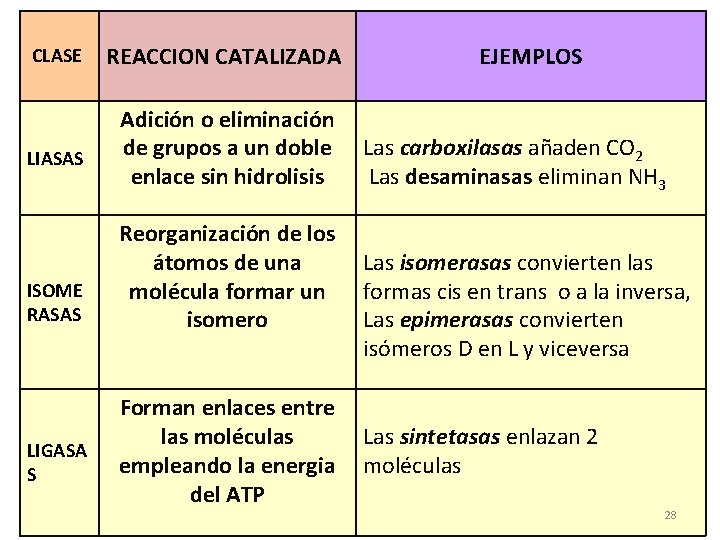
CLASE LIASAS ISOME RASAS LIGASA S REACCION CATALIZADA Adición o eliminación de grupos a un doble enlace sin hidrolisis Reorganización de los átomos de una molécula formar un isomero Forman enlaces entre las moléculas empleando la energia del ATP EJEMPLOS Las carboxilasas añaden CO 2 Las desaminasas eliminan NH 3 Las isomerasas convierten las formas cis en trans o a la inversa, Las epimerasas convierten isómeros D en L y viceversa Las sintetasas enlazan 2 moléculas 28


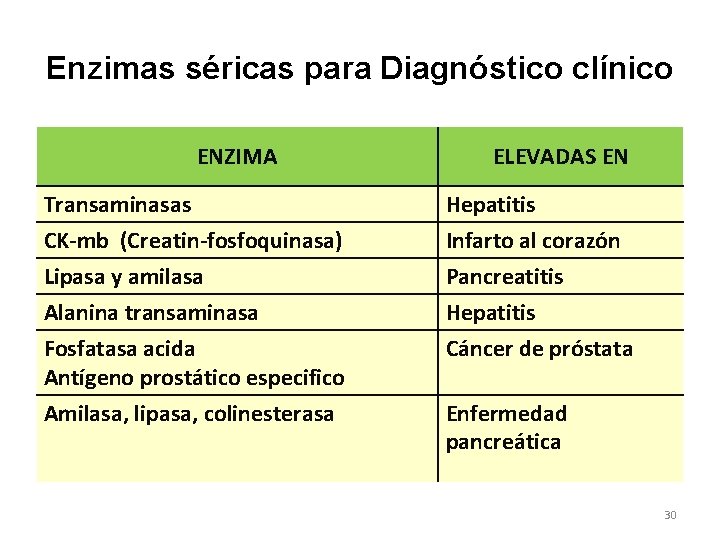
Enzimas séricas para Diagnóstico clínico ENZIMA ELEVADAS EN Transaminasas CK-mb (Creatin-fosfoquinasa) Hepatitis Infarto al corazón Lipasa y amilasa Alanina transaminasa Fosfatasa acida Antígeno prostático especifico Amilasa, lipasa, colinesterasa Pancreatitis Hepatitis Cáncer de próstata Enfermedad pancreática 30
 Ejemplos de cromoproteinas
Ejemplos de cromoproteinas So
So Protenas
Protenas Protenas
Protenas Protenas
Protenas Proteinas monomericas
Proteinas monomericas Protenas
Protenas Protenas
Protenas Funciones de las proteinas
Funciones de las proteinas Protenas
Protenas Esquema de los aminoácidos
Esquema de los aminoácidos Protenas
Protenas Reação endergônica
Reação endergônica Qumica
Qumica Truta
Truta Qumica
Qumica Energia en los enlaces quimicos
Energia en los enlaces quimicos Qumica
Qumica Mistura quimica
Mistura quimica Enlace dativo
Enlace dativo Homopolissacarideos significado
Homopolissacarideos significado Geometria sp2
Geometria sp2 Caracteristicas dos seres vivos composição quimica
Caracteristicas dos seres vivos composição quimica Peracidos
Peracidos Qumica
Qumica Qumica
Qumica Que estudia la quimica aplicada
Que estudia la quimica aplicada Qumica
Qumica Enantiomeros
Enantiomeros Stoicheon
Stoicheon Qumica
Qumica