Semana 30 Protenas Captulo 19 PROTENAS Son polipptidos























- Slides: 38

Semana 30 Proteínas Capítulo 19

PROTEÍNAS ØSon polipéptidos de 50 o más aminoácidos que tienen actividad biológica. ØSon los principales componentes estructurales de los animales y su función básica es el desarrollo y mantenimiento del cuerpo. ØSon los "instrumentos moleculares" mediante los cuales se expresa la información genética; es decir, las proteínas ejecutan las órdenes dictadas por los ácidos nucléicos.

PROTEÍNAS • Son polímeros formados por α-L-aminoácidos, unidos a través de enlaces peptídicos. • La composición elemental es aproximadamente: 53% de carbono, 7% de hidrógeno, 23% de oxígeno, 16% de nitrógeno, 1% de azufre y menos del 1% de fósforo.

Clasificación según su composición: • HOLOPROTEÍNAS O SIMPLES: Formadas solamente por aminoácidos • Globulares: Con forma esférica y compacta, solubles en agua y en soluciones salinas acuosas. • Prolaminas: Zeína (maíza), gliadina (trigo), hordeína (cebada) • Globulinas: como los anticuerpos, gamma globulinas • Albúminas: Seroalbúmina (sangre), ovoalbúmina (huevo), lactoalbúmina (leche) • Hormonas: Insulina, hormona del crecimiento, prolactina, tirotropina • Enzimas: Hidrolasas, Oxidasas, Ligasas, Liasas, Transferasas. . . etc. • Histonas: generalmente están asociadas a los ácidos nucléicos. Albúmina humana

Según su composición: • Fibrosas: Con forma de fibras alargadas, insolubles en agua y en casi todos los solventes. • Ejemplos: • Colágeno: en tejidos conjuntivos, cartilaginosos • Queratina: En formaciones epidérmicas: pelos, uñas, plumas, cuernos. • Elastina: En tendones y vasos sanguíneos • Fibroína: En hilos de seda, (arañas, insectos)

Según su composición: • HETEROPROTEÍNAS O CONJUGADAS: Formadas por una fracción proteica y por un grupo no proteico, que se denomina "grupo prostético” • • Glucoproteínas: Proteínas unidas por enlaces glucosídicos a carbohidratos. Ribonucleasa Mucoproteínas Anticuerpos Hormona luteinizante

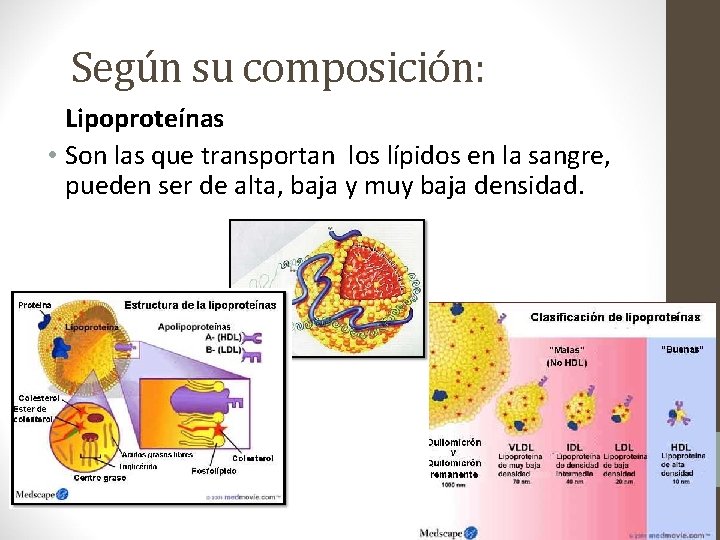
Según su composición: Lipoproteínas • Son las que transportan los lípidos en la sangre, pueden ser de alta, baja y muy baja densidad.

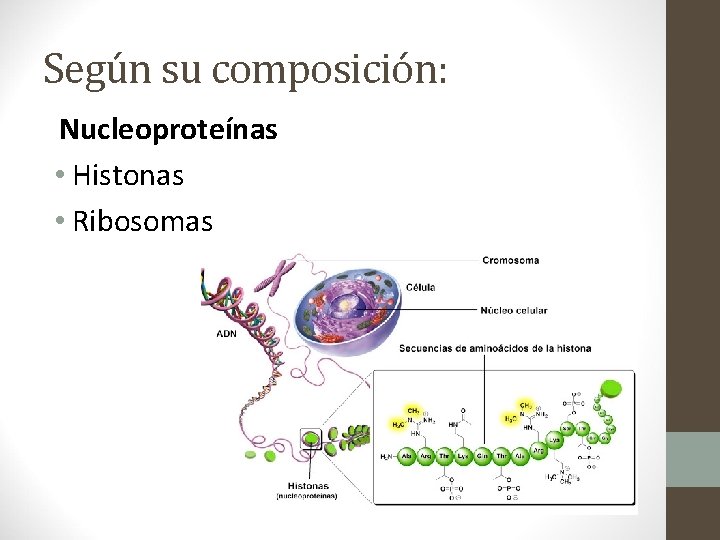
Según su composición: Nucleoproteínas • Histonas • Ribosomas

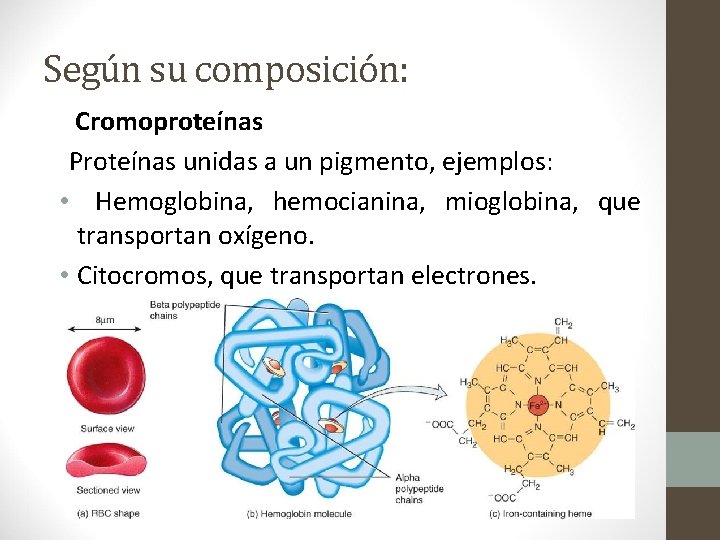
Según su composición: Cromoproteínas Proteínas unidas a un pigmento, ejemplos: • Hemoglobina, hemocianina, mioglobina, que transportan oxígeno. • Citocromos, que transportan electrones.

Según su función:

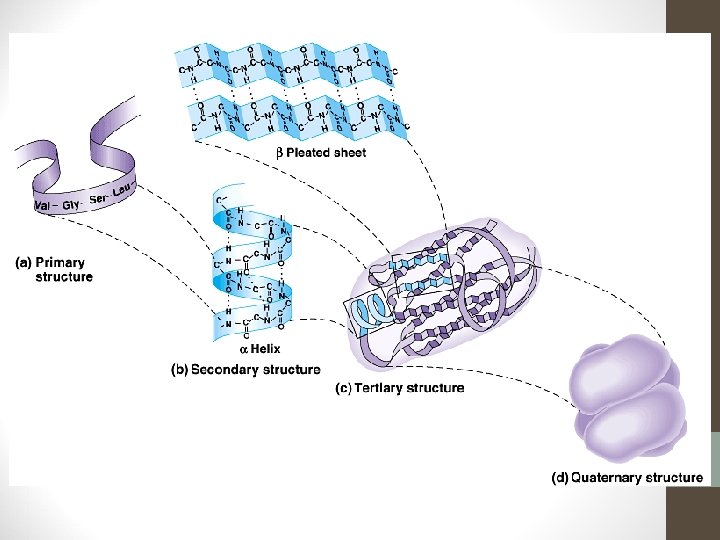
Estructura de las Proteínas • Determina sus propiedades y actividad biológica. • Cada proteína tiene una forma tridimensional o conformación que se divide en cuatro niveles estructurales.


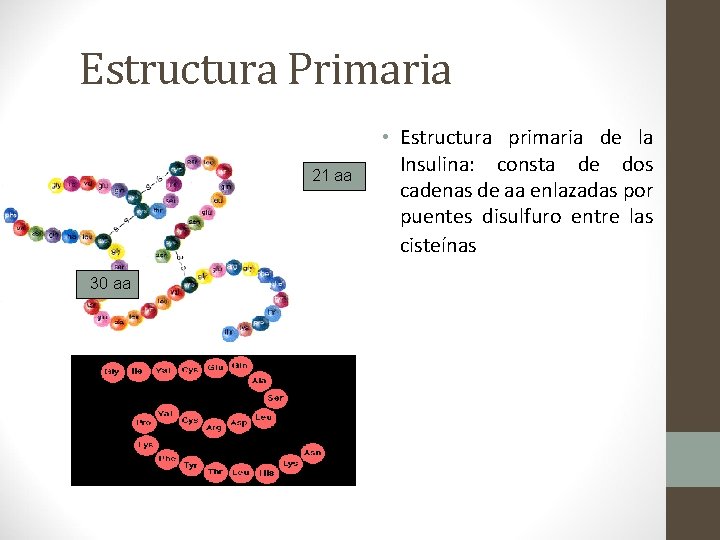
Estructura Primaria • Se refiere al número y secuencia de aa en sus cadenas polipeptídicas. • Indica qué aa componen la cadena y el orden en que dichos aa se encuentran. El ordenamiento de los aminoácidos en cada cadena peptídica, no es arbitrario sino que obedece a un plan predeterminado en el ADN. • La función de una proteína depende de su secuencia de aa y de la forma que ésta adopte.

Estructura Primaria 21 aa 30 aa • Estructura primaria de la Insulina: consta de dos cadenas de aa enlazadas por puentes disulfuro entre las cisteínas

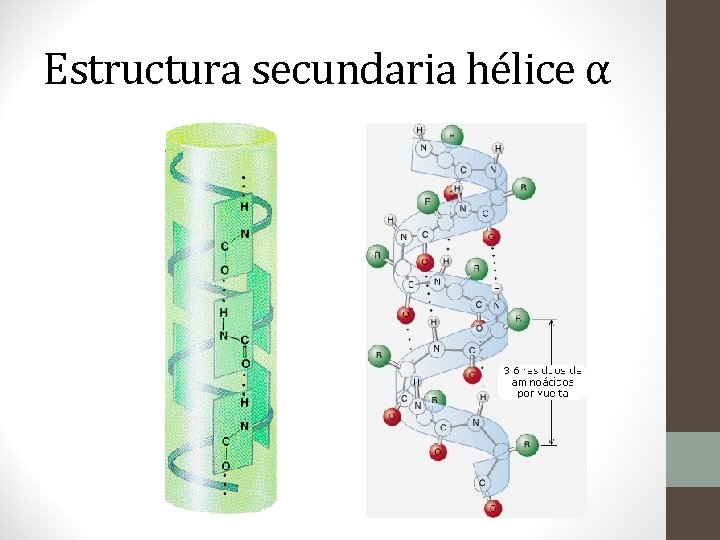
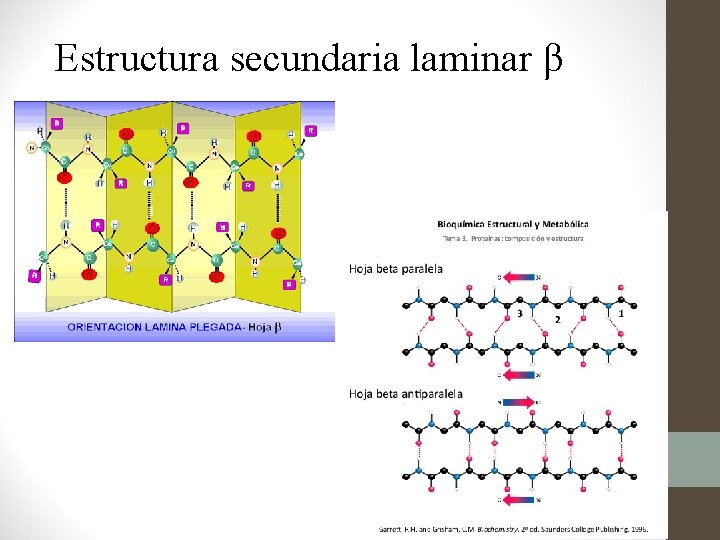
Estructura Secundaria • Se refiere a la estructura que adquiere la proteína cuando los aminoácidos se unen por puentes de hidrógeno dentro la misma cadena o entre varias cadenas. • Las tres formas comunes son: • Hélice alfa • Hélice beta • Hélice triple

Estructura Secundaria • Hélices alfa: • Son estructuras enrolladas como una espiral estabilizada por puentes de hidrógeno entre el hidrógeno amídico de un enlace peptídico y el oxígeno carboxílico superior que se halla en la siguiente vuelta. • La estructura está enrollada hacia la derecha y las cadenas laterales (R) se proyectan hacia afuera. • Cada vuelta de la espiral se compone de aproximadamente cuatro aa. • Ej. Lana, pelo, plumas, uñas.

Estructura secundaria hélice α

Estructura Secundaria • Láminas beta • Está formada por n cadenas paralelas o antiparalelas que van en zig-zag debido a las repulsiones R-R. • Se estabilizan por puentes de hidrógeno entre dipolos pero pertenecientes a diferentes cadenas diferentes segmentos de la misma cadena. • Ej. Seda. o

Estructura secundaria laminar β

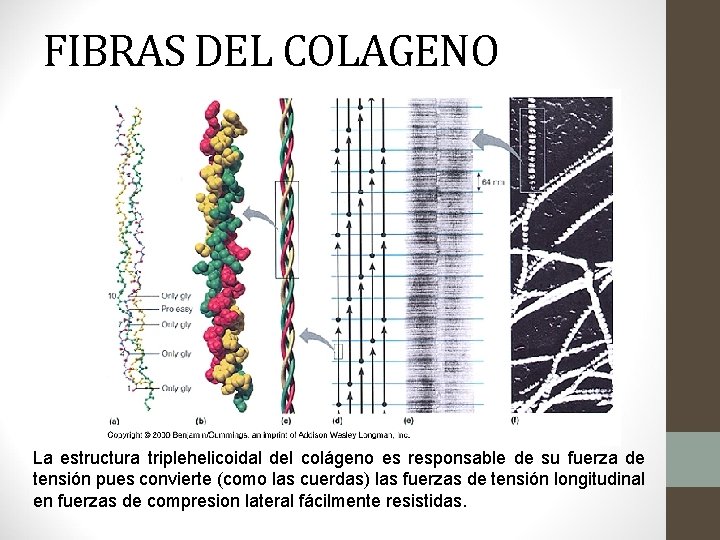
Estructura Secundaria • Hélice Triple • Presente en el Colágeno que es la proteína más abundante del cuerpo, constituye hasta 1/3 de todas las proteínas. • Su estructura consta de tres hélices α entretejidos que forman una triple hélice. • Un residuo de glicina cada 3 (cada vuelta de hélice) permite que las 3 cadenas se empaqueten estrechamente, con las glicinas en el interior y los otros aminoácidos en el exterior. Glicina Prolina Alanina

COLAGENO • Se encuentra en: • tejido conectivo • vasos sanguíneos • piel • tendones • ligamentos • cornea del ojo • cartílagos

FIBRAS DEL COLAGENO La estructura triplehelicoidal del colágeno es responsable de su fuerza de tensión pues convierte (como las cuerdas) las fuerzas de tensión longitudinal en fuerzas de compresion lateral fácilmente resistidas.

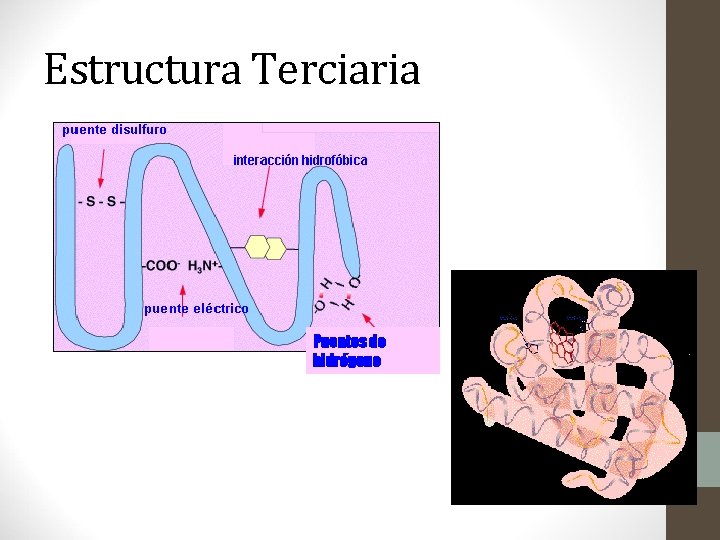
Estructura Terciaria: • Forma tridimensional única, que resulta del plegamiento y flexión precisos de la vuelta en espiral, originando una conformación globular. • Es la estructura más importante porque es cuando la proteína adquiere su actividad biológica o función. • Esta conformación globular facilita la solubilidad en agua.

Estructura Terciaria: • Los enlaces responsables de mantener esta conformación estable depende de la naturaleza de las cadenas laterales de los aa, entre ellos: • Enlaces iónicos(+-) o puentes salinos • Enlaces de hidrógeno • Enlaces disulfuro • Interacciones hidrófobas • Interacciones hidrofílicas

Estructura Terciaria Puentes de hidrógeno

Estructura Cuaternaria: • Es la forma en que las cadenas separadas de polipéptidos se adaptan entre sí en las proteínas que tienen más de una cadena. • Las fuerzas que la estabilizan son las mismas que en la estructura terciaria.

Estructura Cuaternaria

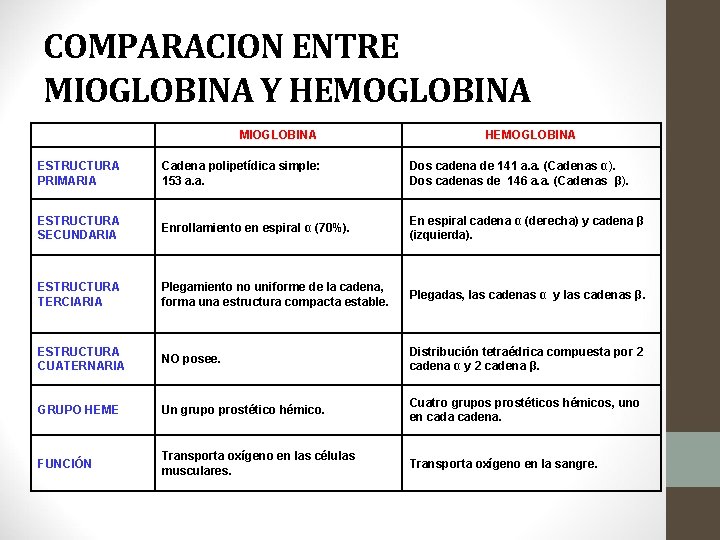
COMPARACION ENTRE MIOGLOBINA Y HEMOGLOBINA MIOGLOBINA HEMOGLOBINA ESTRUCTURA PRIMARIA Cadena polipetídica simple: 153 a. a. Dos cadena de 141 a. a. (Cadenas α). Dos cadenas de 146 a. a. (Cadenas β). ESTRUCTURA SECUNDARIA Enrollamiento en espiral α (70%). En espiral cadena α (derecha) y cadena β (izquierda). ESTRUCTURA TERCIARIA Plegamiento no uniforme de la cadena, forma una estructura compacta estable. Plegadas, las cadenas α y las cadenas β. ESTRUCTURA CUATERNARIA NO posee. Distribución tetraédrica compuesta por 2 cadena α y 2 cadena β. GRUPO HEME Un grupo prostético hémico. Cuatro grupos prostéticos hémicos, uno en cada cadena. FUNCIÓN Transporta oxígeno en las células musculares. Transporta oxígeno en la sangre.

Comparación de la Estructura de Hemoglobina y Mioglobina: simple. M MIOGLOBINA 70% esm espiral alfa estructura terciaria, compacta. Hemoglobina DHos chad. HE y dos unidas por HEMOGLOBINA interacciones no covalentes entre cadenas laterales polares

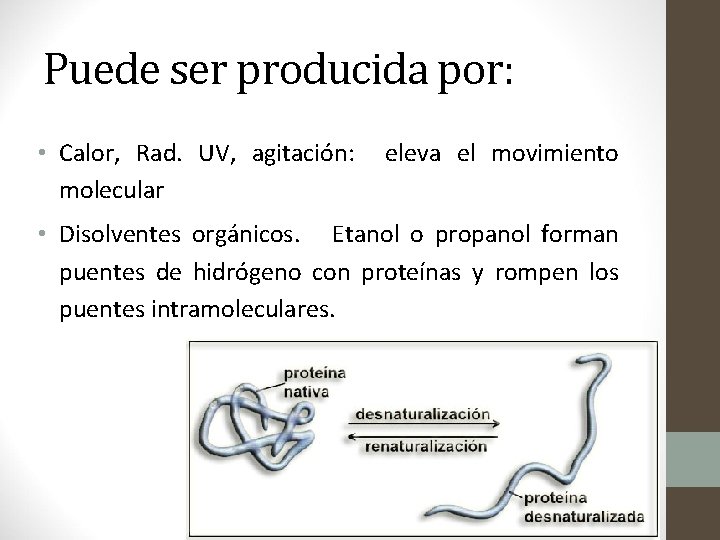
Desnaturalización: • Todo cambio que altera la configuración tridimensional única de una proteína sin causar ruptura de enlaces peptídicos. • En estos casos las proteínas se transforman en filamentos lineales y delgados que se entrelazan hasta formar compuestos fibrosos e insolubles en agua. • Se altera la estructura secundaria, terciaria y cuaternaria pero no la primaria.

Puede ser producida por: • Calor, Rad. UV, agitación: molecular eleva el movimiento • Disolventes orgánicos. Etanol o propanol forman puentes de hidrógeno con proteínas y rompen los puentes intramoleculares.

Puede ser producida por: • Ácidos o bases: Rompen los enlaces salinos alterando estado de ionización de grupos carboxilo y amino. • Sales de iones metálicos pesados (Hg 2+, Ag+, Pb 2+): Los cationes forman enlaces muy fuertes con aniones carboxilato de aminoácidos o SH. Precipita como sal insoluble metal-proteína.

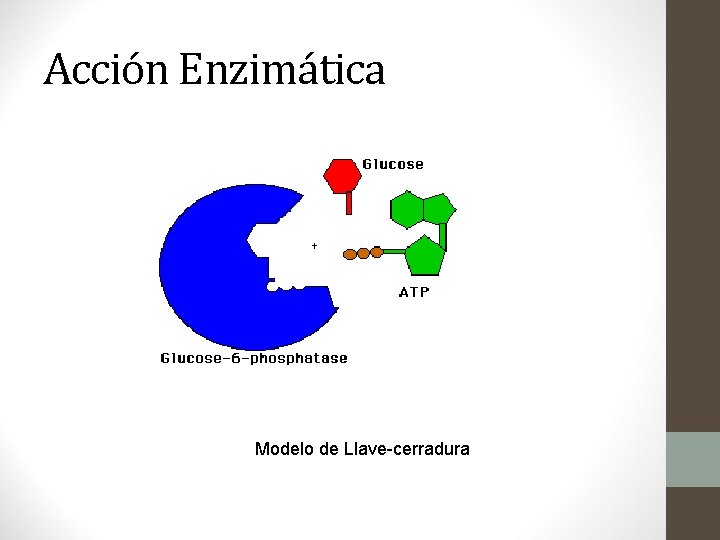
Enzimas (capítulo 20) • Catalizadores orgánicos complejos que producen las células vivas. • A la sustancia sobre la cual actúa una enzima se le llama substrato. • Todas las enzimas son proteínas.

Acción Enzimática Modelo de Llave-cerradura

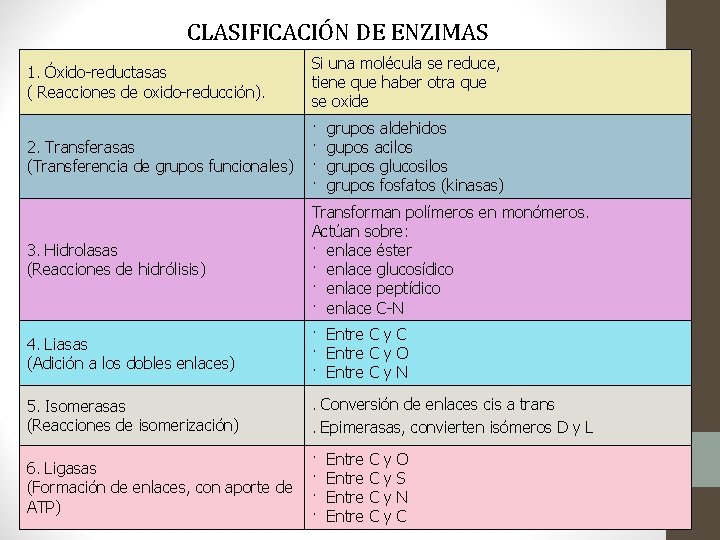
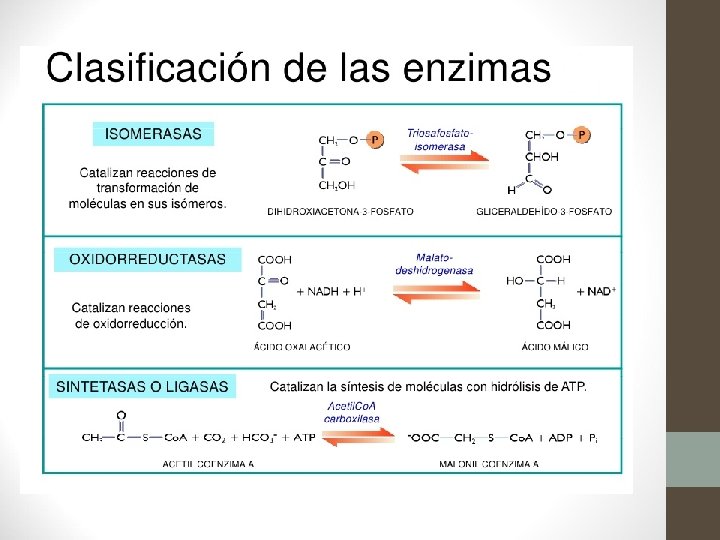
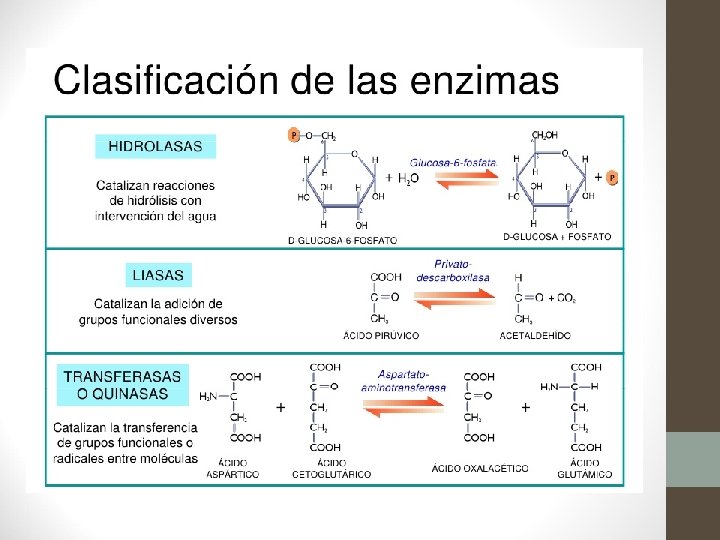
CLASIFICACIÓN DE ENZIMAS 1. Óxido-reductasas ( Reacciones de oxido-reducción). Si una molécula se reduce, tiene que haber otra que se oxide 2. Transferasas (Transferencia de grupos funcionales) · · 3. Hidrolasas (Reacciones de hidrólisis) Transforman polímeros en monómeros. Actúan sobre: · enlace éster · enlace glucosídico · enlace peptídico · enlace C-N 4. Liasas (Adición a los dobles enlaces) · Entre C y C · Entre C y O · Entre C y N 5. Isomerasas (Reacciones de isomerización) . Conversión de enlaces cis a trans. Epimerasas, convierten isómeros D y L 6. Ligasas (Formación de enlaces, con aporte de ATP) · · grupos aldehidos gupos acilos grupos glucosilos grupos fosfatos (kinasas) Entre C C y y O S N C



FIN