Sekundrn lnek Akumultor Akumultor je technick zazen na











- Slides: 13

Sekundární článek Akumulátor

Akumulátor je technické zařízení na opakované uchovávání energie, obvykle elektrické. Akumulátor je sekundární článek, který je potřeba nejdříve nabít a teprve potom je možné jej použít jako zdroj energie. Na rozdíl od sekundárních článků (akumulátorů) primární články dodávají energii ihned po svém sestavení a zpravidla je není možné dobíjet, například zinkouhlíkové baterie.

Druhy akumulátorů energie Akumulátory energie pracují na různých principech například tepelné, chemické či jiné akumulace energie. Nejznámější je průmyslový princip akumulace energie do potenciální energie vody v přečerpávacích elektrárnách, rybních či přehradách. V případě, že elektřina slouží k výrobě tepla, dá se akumulovat i vytvořené teplo. Na tomto principu jsou založena akumulační kamna nebo bojler. Základní druhy akumulátorů elektrické energie: Elektrochemický akumulátor Tepelný akumulátor Mechanický akumulátor

Elektrochemický akumulátor Nejběžnější typy akumulátorů jsou založeny na elektrochemickém principu. Elektrochemické akumulátory využívají přeměnu elektrické energie na energii chemickou, kterou je možno v případě potřeby transformovat zpět na elektrickou energii. Princip akumulátoru Procházející proud v elektrochemickém akumulátoru vyvolá vratné chemické změny, které se projeví rozdílným elektrochemickým potenciálem na elektrodách. Z elektrod se pak dá čerpat elektrická energie zpět. Protože jsou napětí na článcích elektrochemických akumulátorů relativně malá (okolo 1, 2 – 3, 7 V), jsou tyto články také sdružovány do akumulátorových baterií pro dosažení vyššího napětí.

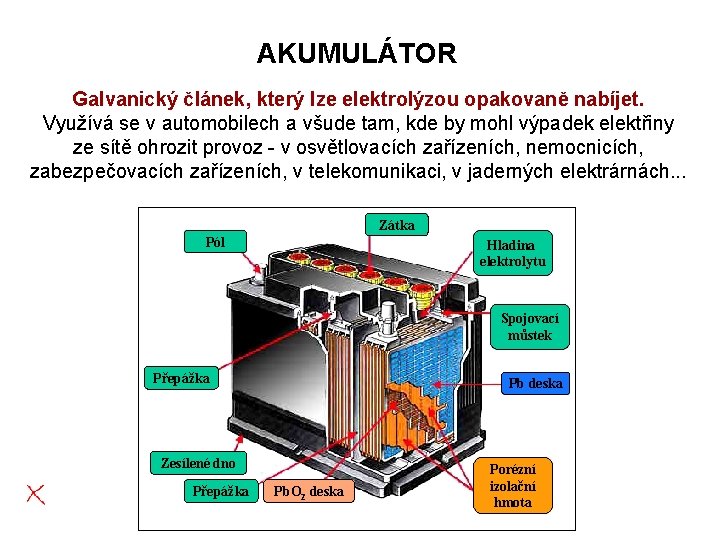
AKUMULÁTOR Galvanický článek, který lze elektrolýzou opakovaně nabíjet. Využívá se v automobilech a všude tam, kde by mohl výpadek elektřiny ze sítě ohrozit provoz - v osvětlovacích zařízeních, nemocnicích, zabezpečovacích zařízeních, v telekomunikaci, v jaderných elektrárnách. . . Zátka Pól Hladina elektrolytu Spojovací můstek Přepážka Pb deska Zesílené dno Přepážka Pb. O 2 deska Porézní izolační hmota

Akumulátor - řez spojovací můstek přepážka Pb deska Pb. O 2 deska porézní izolační hmota zesílené dno

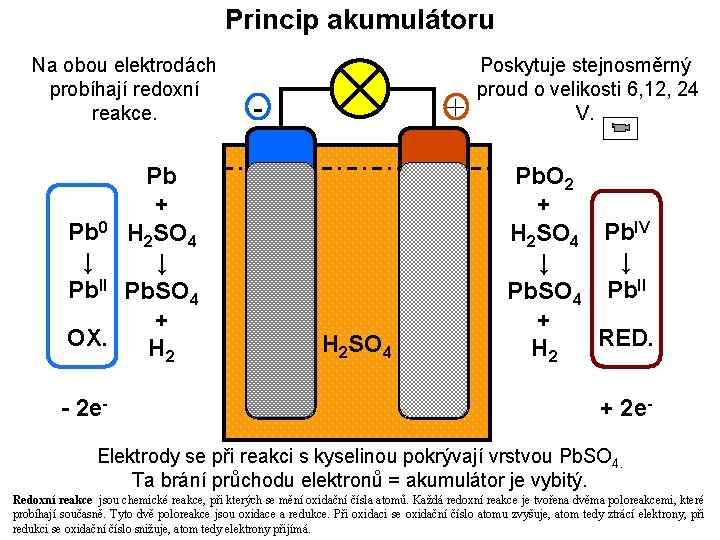
Princip akumulátoru Na obou elektrodách probíhají redoxní reakce. Pb + Pb 0 H 2 SO 4 ↓ ↓ Pb. II Pb. SO 4 + OX. H 2 - 2 e- - + Pb. O 2 Pb H 2 SO 4 Poskytuje stejnosměrný proud o velikosti 6, 12, 24 V. Pb. O 2 + H 2 SO 4 Pb. IV ↓ ↓ Pb. SO 4 Pb. II + RED. H 2 + 2 e- Elektrody se při reakci s kyselinou pokrývají vrstvou Pb. SO 4. Ta brání průchodu elektronů = akumulátor je vybitý. Redoxní reakce jsou chemické reakce, při kterých se mění oxidační čísla atomů. Každá redoxní reakce je tvořena dvěma poloreakcemi, které probíhají současně. Tyto dvě poloreakce jsou oxidace a redukce. Při oxidaci se oxidační číslo atomu zvyšuje, atom tedy ztrácí elektrony, při redukci se oxidační číslo snižuje, atom tedy elektrony přijímá.

Nabíjení akumulátoru Principem je obrácení směru reakcí. Akumulátor připojíme ke zdroji stejnosměrného proudu stejné velikosti, ale opačného směru. To způsobí obrácení směru reakcí – rozpuštění Pb. SO 4. Akumulátor je opět ve stavu, v jakém byl před vybíjením.

Rozdělení elektrických akumulátorů Podle typu elektrolytu • s kyselým elektrolytem • se zásaditým elektrolytem • s bezvodým elektrolytem Podle provedení • otevřené • uzavřené (též hermetické nebo řidčeji plynotěsné) Podle principu • Olověný (Pb) • Nikl-kadmiový (Ni. Cd) • Nikl-metal hydridový (Ni. MH) • Nikl-železný (Ni-Fe) • Nikl-zinkový (Ni-Zn) • Stříbro-zinkový (Ag-Zn) • Lithium-iontový (Li-ion) • Lithium-polymerový (Li-Pol) • Lithium-železo fosfátový akumulátor Li. Fe. PO 4 (Li-Fe. PO 4) • Sodíkovo-sírový (Na-S) • Alkalický (RAM)

Rozdělení elektrických akumulátorů Podle použití • průmyslové akumulátory • standardní aplikace • vojenské aplikace • pro vysoké odběrové proudy • rychlonabíjecí • pro trvalé dobíjení • pro vysoké teploty • s MBU (Memory Back-up) Podle tvaru • válcové (tužkové) • diskové (knoflíkové) • podle průměru (např. Ø 6, 8 mm, Ø 11, 5 mm, Ø 15, 5 mm, Ø 25 mm, …) • oválné • hranolovité (+ jejich sestavy)

Životnost většiny elektrochemických akumulátorů se pohybuje řádově ve stovkách nabíjecích/vybíjecích cyklů; např. Ni. MH akumulátory 500– 1000 cyklů. Po tuto dobu postupně klesá kapacita akumulátoru (tj. celkový náboj, který je při plném nabití schopen pojmout - odlišné od veličiny elektrická kapacita!) kvůli chemické korozi jeho elektrod. Životnost je značně ovlivněna způsobem vybíjení a nabíjení a také provozní teplotou.

Využití Akumulátory se využívají v mnoha složitějších strojích jako pomocný zdroj energie. Olověné akumulátory jsou součástí prakticky každého automobilu jako zdroj pro startér. Akumulátory pohání klasické ponorky, jsou prováděny i pokusy s pohonem mnoha dalších dopravních prostředků. Elektromobily zatím obyčejné automobily nenahradily, ale jako golfové vozíky nebo akumulátorové vozíky na nádražích a ve skladových areálech se užívají již desítky let. Důležité je i využití ve spotřební elektronice. Je jimi vybaven například notebook nebo mobilní telefon. Akumulátor je součástí nepřerušitelného zdroje energie - UPS. Akumulátory jsou také součástí nouzových svítidel. Nouzová svítidla zajišťují osvětlení při výpadku dodávek elektrické energie. U tramvají zajišťují akumulátory takzvaný nouzový pojezd - při průjezdu mycí linkou není normální napájení z troleje možné.

Otázky ke zkoušení 1) 2) 3) 4) 5) 6) Definuj co je to akumulátor. Vysvětli jaký je rozdíl mezi primárními a sekundárními články. Vyjmenuj jaké jsou základní druhy akumulátorů. Jaké je rozdělení elektrických akumulátorů podle typu elektrolytu. Jaké je rozdělení elektrických akumulátorů podle provedení. Jaké je rozdělení elektrických akumulátorů podle principu (napiš alespoň 3 možnosti). 7) Jaké je rozdělení elektrických akumulátorů podle použití (napiš alespoň 3 možnosti). 8) Jaké je rozdělení elektrických akumulátorů podle tvaru. 9) Vysvětli co je to životnost akumulátoru. 10)Jaké je využití akumulátorů ?





















