Sekcja Pediatryczna PTAIT Sedacja dzieci podczas intensywnej terapii



























![44 Deksmedetomidyna (S)-4 -[1 -(2, 3 -dimethylphenyl)ethyl]-3 H-imidazole DEX CLO Biodostępność 90% 75 -95% 44 Deksmedetomidyna (S)-4 -[1 -(2, 3 -dimethylphenyl)ethyl]-3 H-imidazole DEX CLO Biodostępność 90% 75 -95%](https://slidetodoc.com/presentation_image/156d9875b52d86f580b11c849c924171/image-44.jpg)














- Slides: 64

Sekcja Pediatryczna PTAIT Sedacja dzieci podczas intensywnej terapii Alicja Bartkowska-Śniatkowska

2 Fizjologia snu

3 Teorie snu • „passive theory of the sleep” układ siatkowaty w pniu mózgu ulega depresji i hamowaniu • „active theory of the sleep” pobudzeniu ulegają tzw. układy hamujące

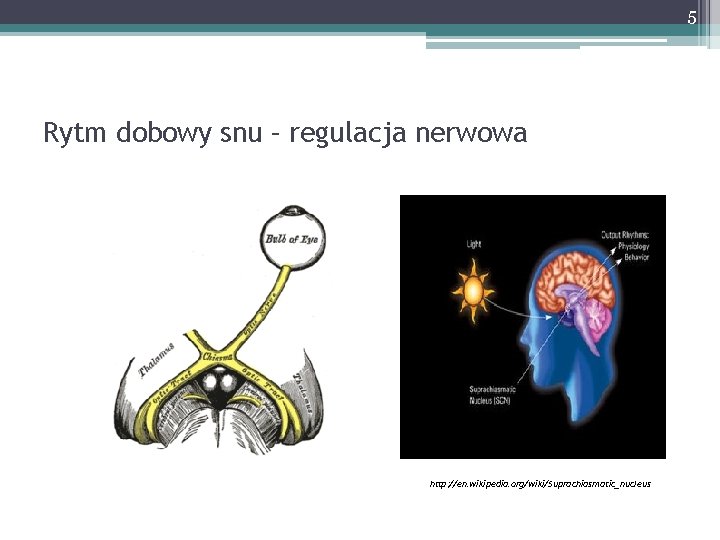
4 Mechanizmy snu Aktywacja ośrodkowego układu nerwowego • Jądro szwu (raphe nucleus), miejsce sinawe (locus coeruleus) w dolnej części mostu i rdzenia kręgowego • Jądro pasma samotnego (nucleus of the tractus solitarius) w moście i rdzeniu kręgowym • Rozsiane miejsca we wzgórzu i podwzgórzu, okolica nad skrzyżowaniem nerwów wzrokowych (suprachiasmiatic nucleus and area) Wydzielanie substancji neurohormonalnych • Czynnik S, obecny w płynie mózgowo-rdzeniowym i moczu ssaków • Nanopeptyd, wyizolowany z krwi • Czynnik dotychczas nieoceniony molekularnie, obecny we krwi

5 Rytm dobowy snu – regulacja nerwowa http: //en. wikipedia. org/wiki/Suprachiasmatic_nucleus

6 Rytm dobowy snu – regulacja hormonalna

7 Rola snu fizjologicznego • Przywrócenie właściwej równowagi pomiędzy neuronami OUN • „Wyzerowanie” aktywności mózgu • Wyhamowanie aktywności współczulnej i przywspółczulnej narządów obwodowych • „Tajemnicza” rola snu, będąca polem badań psychologów i psychiatrów

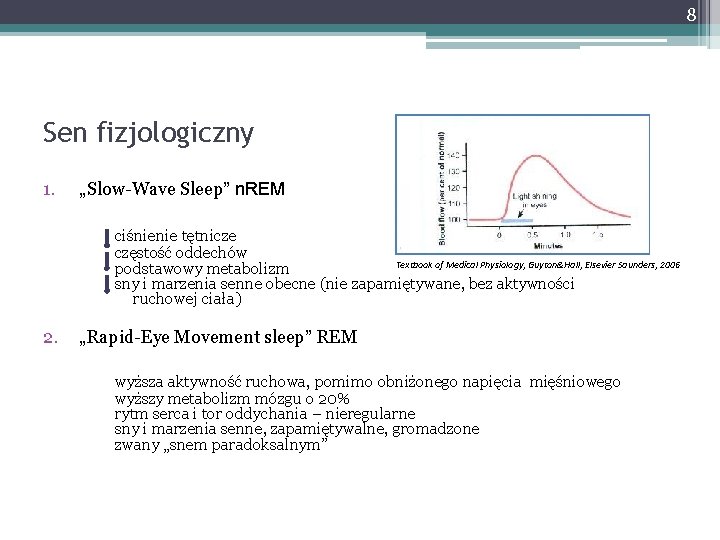
8 Sen fizjologiczny 1. „Slow-Wave Sleep” n. REM ciśnienie tętnicze częstość oddechów Textbook of Medical Physiology, Guyton&Hall, Elsevier Saunders, 2006 podstawowy metabolizm sny i marzenia senne obecne (nie zapamiętywane, bez aktywności ruchowej ciała) 2. „Rapid-Eye Movement sleep” REM wyższa aktywność ruchowa, pomimo obniżonego napięcia mięśniowego wyższy metabolizm mózgu o 20% rytm serca i tor oddychania – nieregularne sny i marzenia senne, zapamiętywalne, gromadzone zwany „snem paradoksalnym”

9 Aktywność elektryczna mózgu (EEG)

10 Zmiany w zapisie EEG podczas snu

11 Farmakologia a sen

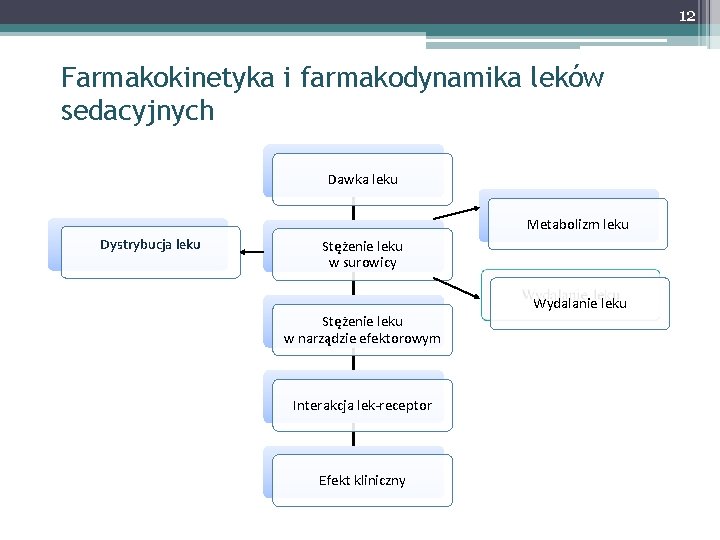
12 Farmakokinetyka i farmakodynamika leków sedacyjnych Dawka leku Metabolizm leku Dystrybucja leku Stężenie leku w surowicy Stężenie leku w narządzie efektorowym Interakcja lek-receptor Efekt kliniczny Wydalanie leku

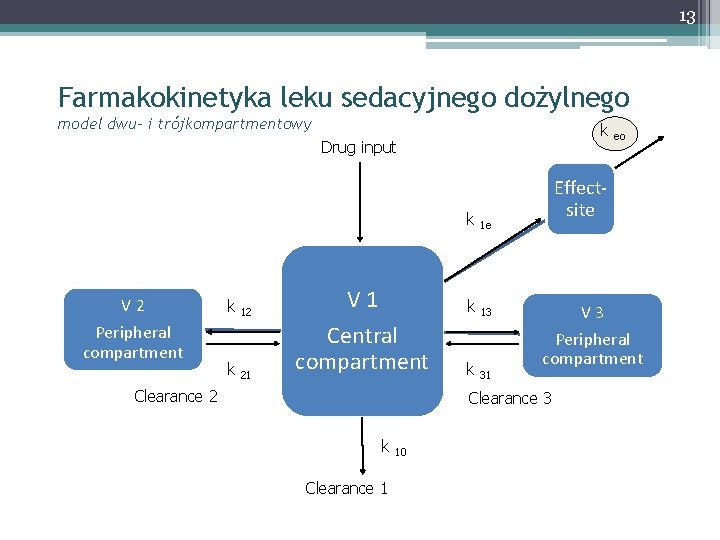
13 Farmakokinetyka leku sedacyjnego dożylnego model dwu- i trójkompartmentowy k Drug input V 2 Peripheral compartment k 12 k 21 V 1 Central compartment Clearance 2 k 1 e k 13 k 31 Effectsite V 3 Peripheral compartment Clearance 3 k Clearance 1 10 eo

14 Objętość dystrybucji a efekt farmakokinetyczny • Objętość dystrybucji różni się u noworodków, niemowląt, dzieci i dorosłych

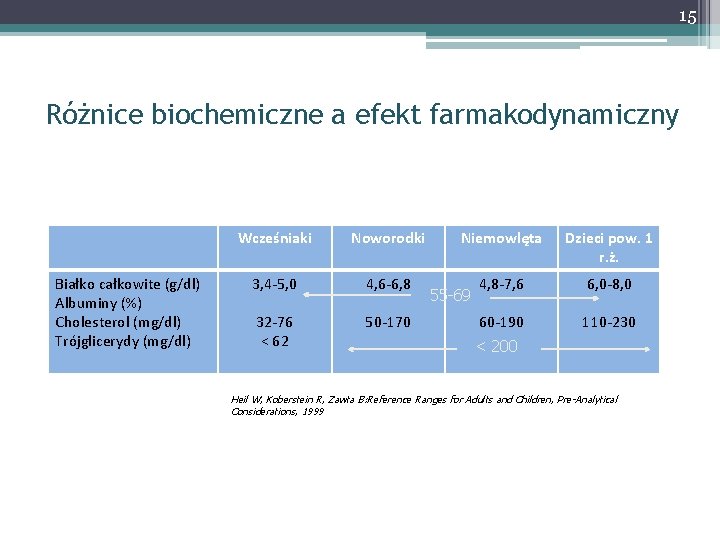
15 Różnice biochemiczne a efekt farmakodynamiczny Białko całkowite (g/dl) Albuminy (%) Cholesterol (mg/dl) Trójglicerydy (mg/dl) Wcześniaki Noworodki 3, 4 -5, 0 4, 6 -6, 8 32 -76 < 62 50 -170 Niemowlęta Dzieci pow. 1 r. ż. 4, 8 -7, 6 6, 0 -8, 0 60 -190 110 -230 55 -69 < 200 Heil W, Koberstein R, Zawta B: Reference Ranges for Adults and Children, Pre-Analytical Considerations, 1999

16 Analgosedacja w intensywnej terapii dziecięcej Sedatio (łac. ) - uspokojenie

17 Cele sedacji • Redukcja stresu, ochrona przed urazami i pobudzeniem Redukcja bólu • Zmniejszenie dyskomfortu i bólu Badanie USG, ECHO serca: 0 -2 • Im bardziej niedojrzały noworodek tym więcej czynności lub procedur, ale często Odsysanie z j. ustnej, CPAP, badanie oczu: 2 -4 rzadziej otrzymuje analgezję Eva Cignacco; Pediatric Critical Care Medicine 2007 Odsysanie z rurki intubacyjnej, cewnikowanie pęcherza: 4 -6 • Zmniejszenie uogólnionej odpowiedzi ogólnoustrojowej w stanie krytycznym Iniekcja i. m. , usunięcie drenu opłucnowego: 6 -8 • Ułatwienie wykonania niezbędnych procedur lekarskich, pielęgniarskich i diagnostycznych itp. Intubacja, nakłucie lędźwiowe, kaniulacja centralna, drenaż opłucnej : 9 -10 • Redukcja stresu rodziców, obserwujących dziecko poddane intensywnej terapii „Najbardziej stresującym dla rodzica jest widzieć jak cierpi jego dziecko i nie móc mu pomóc. . . ” Eva Cignacco, Pediatric Critical Care Medicine 2007

18 Nadmierna sedacja • • Trudna ocena stanu neurologicznego Trudności z wybudzeniem Depresja układu krążenia Depresja układu oddechowego Przedłużona wentylacja mechaniczna Upośledzenie perystaltyki Ryzyko rozwoju odleżyn Przedłużony pobyt w intensywnej terapii

19 Niedostateczna sedacja • • Zaburzenia wentylacji Obkurczenie naczyń płucnych Nieplanowana samoistna ekstubacja Uraz układu oddechowego Nadmierne pobudzenie serca i układu krążenia Problemy sprzętowe Reakcja zespołu leczącego Zmniejszenie tolerancji i/lub brak akceptacji rodziców/opiekunów

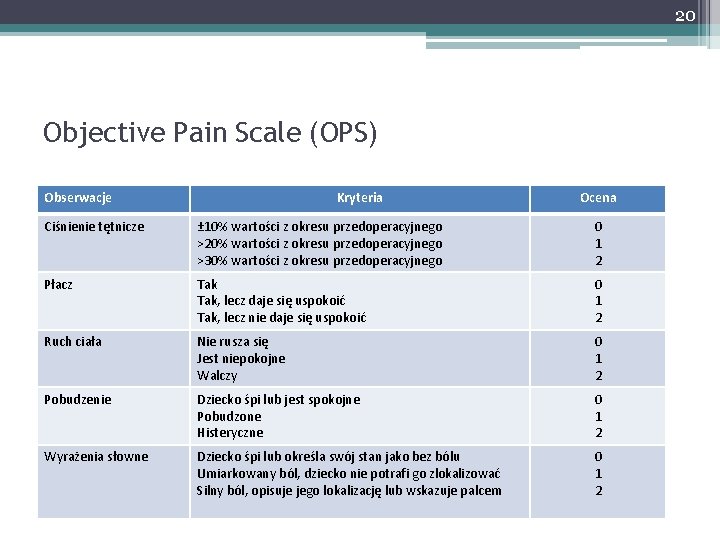
20 Objective Pain Scale (OPS) Obserwacje Kryteria Ocena Ciśnienie tętnicze ± 10% wartości z okresu przedoperacyjnego >20% wartości z okresu przedoperacyjnego >30% wartości z okresu przedoperacyjnego 0 1 2 Płacz Tak, lecz daje się uspokoić Tak, lecz nie daje się uspokoić 0 1 2 Ruch ciała Nie rusza się Jest niepokojne Walczy 0 1 2 Pobudzenie Dziecko śpi lub jest spokojne Pobudzone Histeryczne 0 1 2 Wyrażenia słowne Dziecko śpi lub określa swój stan jako bez bólu Umiarkowany ból, dziecko nie potrafi go zlokalizować Silny ból, opisuje jego lokalizację lub wskazuje palcem 0 1 2

21 Neonatal Infant Pain Scale (NIPS) Nie boli Trochę boli Bardzo boli Buzia Spokojna Grymas Ból Płacz Brak Popłakuje Krzyczy Oddech Spokojny Przyspieszony Wysiłkowy Rączki Swobodne Zgięte Wyprostowane Nóżki Swobodne Zgięte Wyprostowane Rozumek śpi Nie śpi Pobudzony

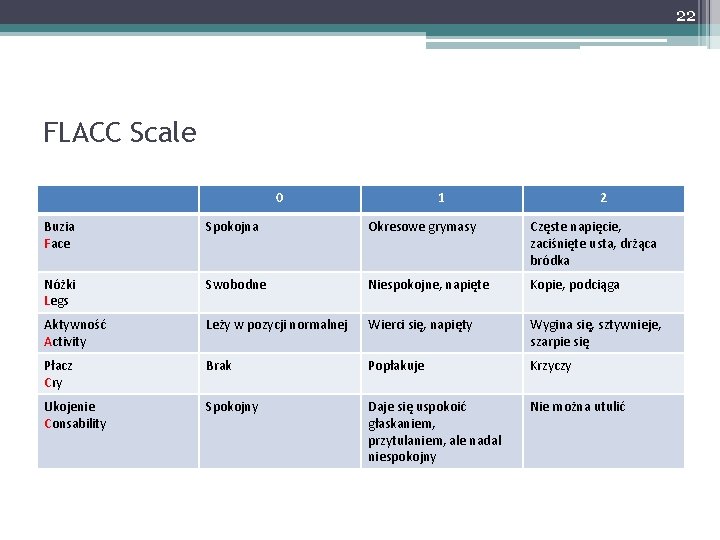
22 FLACC Scale 0 1 2 Buzia Face Spokojna Okresowe grymasy Częste napięcie, zaciśnięte usta, drżąca bródka Nóżki Legs Swobodne Niespokojne, napięte Kopie, podciąga Aktywność Activity Leży w pozycji normalnej Wierci się, napięty Wygina się, sztywnieje, szarpie się Płacz Cry Brak Popłakuje Krzyczy Ukojenie Consability Spokojny Daje się uspokoić głaskaniem, przytulaniem, ale nadal niespokojny Nie można utulić

23 Comfort Scale 1 2 3 4 5 Świadomość Śpi głęboko Śpi płytko Śpiący Aktywny Hiperaktywny Nastrój Spokojny Lekko zaniepokojony Niespokojny Bardzo niespokojny Panika Oddech Nie oddcyha, nie kaszle Oddycha, prawie nie kłóci się Okresowo kaszle lub kłóci się z respiratorem Kaszle, aktywnie walczy z respiratorem Walczy z respiratorem, sinieje z wysiłku Ruchy Nie rusza się Porusza się od czasu do czasu Częste ruchy Żywe ruchy Miota się MAP Poniżej normy W normie Wzrasta o 15% co jakiś czas Wzrasta często o ponad 15% Stale podwyższone powyżej 15% HR Poniżej normy W normie j. w. Napięcie mięśni Brak Obniżone Prawidłowe Wzmożone, zgniata Bardzo wzmozone, palce na granicy kurczu Wyraz buzi Bez wyrazu, śpi Normalny, bez napięcia Wyraźne napięcie w niektórych mięśniach Wyraźne napięcie we wszystkich mięśniach Skrzywiony, grymaśny

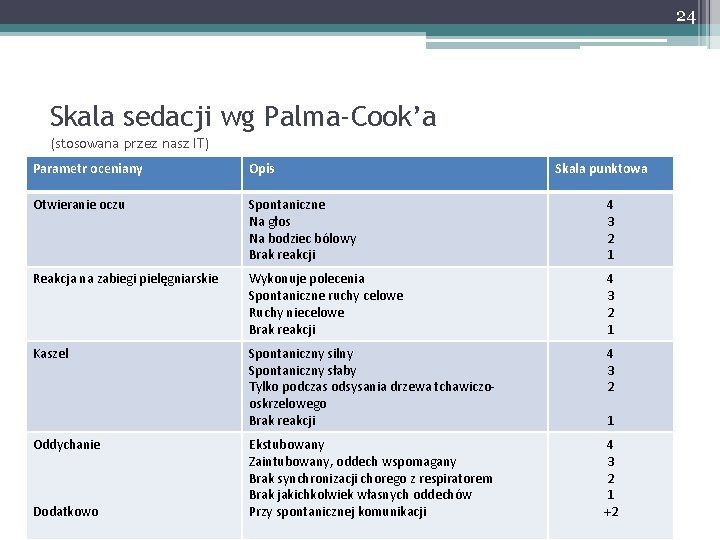
24 Skala sedacji wg Palma-Cook’a (stosowana przez nasz IT) Parametr oceniany Opis Otwieranie oczu Spontaniczne Na głos Na bodziec bólowy Brak reakcji 4 3 2 1 Reakcja na zabiegi pielęgniarskie Wykonuje polecenia Spontaniczne ruchy celowe Ruchy niecelowe Brak reakcji 4 3 2 1 Kaszel Spontaniczny silny Spontaniczny słaby Tylko podczas odsysania drzewa tchawiczooskrzelowego Brak reakcji 4 3 2 Ekstubowany Zaintubowany, oddech wspomagany Brak synchronizacji chorego z respiratorem Brak jakichkolwiek własnych oddechów Przy spontanicznej komunikacji 4 3 2 1 +2 Oddychanie Dodatkowo Skala punktowa 1

25 Leki stosowane podczas analgosedacji w intensywnej terapii dziecięcej

26 Leki nasenne

27 Idealny lek… Właściwości fizyczne • • • Rozpuszczalny w wodzie Stabilny w roztworze Stabilny pod wpływem światła Stabilny w pokojowej temperaturze Niedrogi Właściwości farmakologiczne • • Początek działania szybki, w tzw. „czasie ręka – mózg” Nie wywołujący bólu, drgawek etc, podczas podawania Nie wpływający istotnie na wydolność układu krążenia, oddechowego Nie powodujący wzrostu ciśnienia śródczaszkowego Bez wpływu na wydolność wątroby i nerek Bez efektu kumulacji podczas wlewu oraz powstawania aktywnych metabolitów Brak efektu teratogennego

28 Dlaczego droga podania dożylna? • • • Szybki początek działania Brak redukcji stężenia w wyniku efektu „pierwszego przejścia” Całkowita dawka niższa Szybkie wybudzenie Lepsza kontrola dawkowania

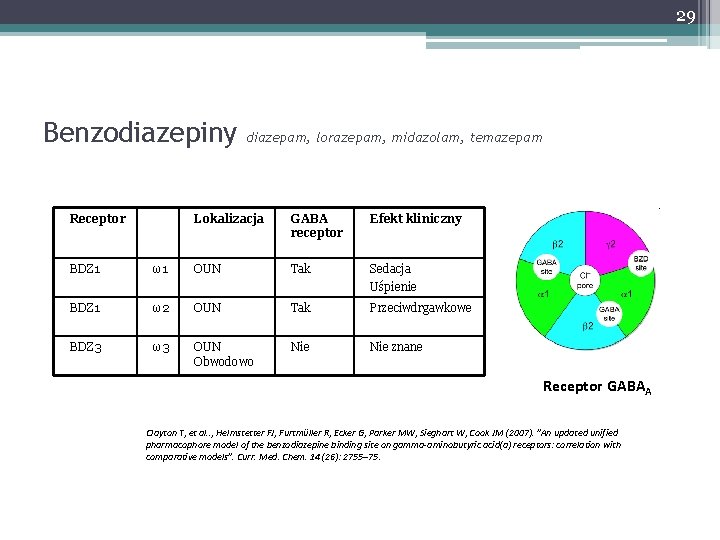
29 Benzodiazepiny Receptor diazepam, lorazepam, midazolam, temazepam Lokalizacja GABA receptor Efekt kliniczny BDZ 1 ω1 OUN Tak Sedacja Uśpienie BDZ 1 ω2 OUN Tak Przeciwdrgawkowe BDZ 3 ω3 OUN Obwodowo Nie znane Receptor GABAA Clayton T, et al. . , Helmstetter FJ, Furtmüller R, Ecker G, Parker MW, Sieghart W, Cook JM (2007). "An updated unified pharmacophore model of the benzodiazepine binding site on gamma-aminobutyric acid(a) receptors: correlation with comparative models". Curr. Med. Chem. 14 (26): 2755– 75.

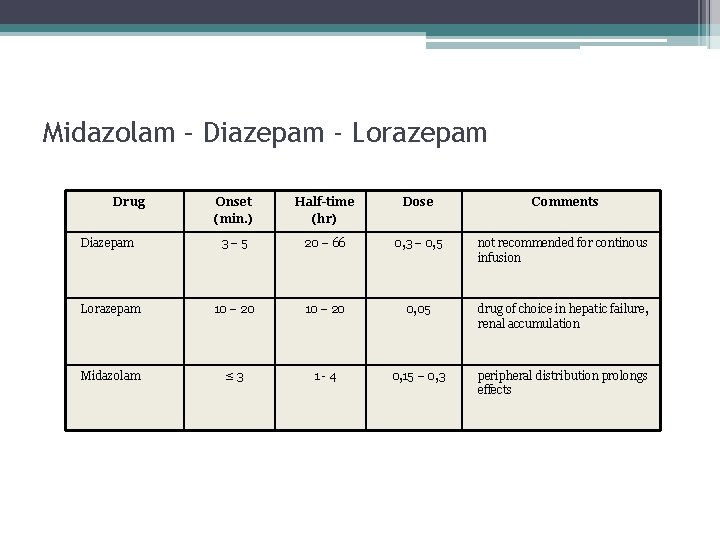
Midazolam – Diazepam - Lorazepam Drug Onset (min. ) Half-time (hr) Dose Comments Diazepam 3 – 5 20 – 66 0, 3 – 0, 5 not recommended for continous infusion Lorazepam 10 – 20 0, 05 drug of choice in hepatic failure, renal accumulation Midazolam ≤ 3 1 - 4 0, 15 – 0, 3 peripheral distribution prolongs effects

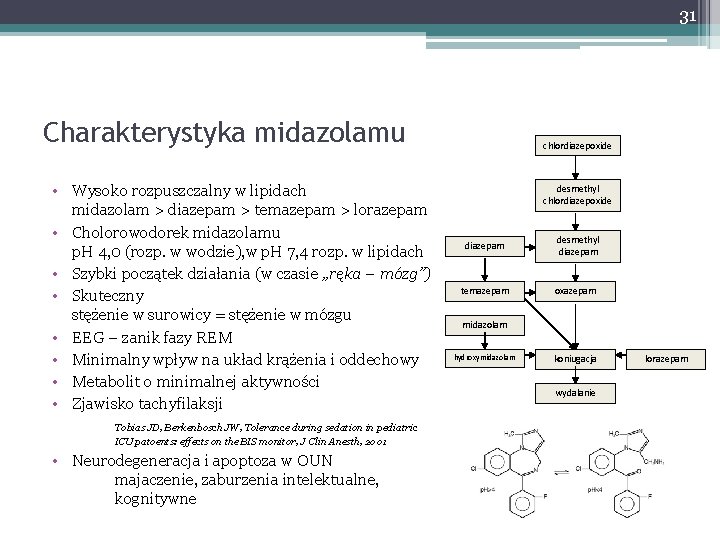
31 Charakterystyka midazolamu • Wysoko rozpuszczalny w lipidach midazolam > diazepam > temazepam > lorazepam • Cholorowodorek midazolamu p. H 4, 0 (rozp. w wodzie), w p. H 7, 4 rozp. w lipidach • Szybki początek działania (w czasie „ręka – mózg”) • Skuteczny stężenie w surowicy = stężenie w mózgu • EEG – zanik fazy REM • Minimalny wpływ na układ krążenia i oddechowy • Metabolit o minimalnej aktywności • Zjawisko tachyfilaksji Tobias JD, Berkenbosch JW, Tolerance during sedation in pediatric ICU patoents: effects on the BIS monitor, J Clin Anesth, 2001 • Neurodegeneracja i apoptoza w OUN majaczenie, zaburzenia intelektualne, kognitywne chlordiazepoxide desmethyl chlordiazepoxide diazepam desmethyl diazepam temazepam oxazepam midazolam hydroxymidazolam koniugacja wydalanie lorazepam

32 Badania własne i inne I. Czynniki wpływające na farmakokinetykę midazolamu • wydolność nerek • wydolność wątroby • stosowanie leków hamujących aktywność Cytochromu P 450 S. N. de Wildt et al. : Population pharmacokinetics and metabolism of midazolam in pediatric intensive care patients. Crit Care Med. 2003 II. Ocena rytmów dobowych podczas sedacji midazolamem w ITP • istotne różnice dzień - noc wykazano dla HR (p=0. 003) i DBP (p=0. 013) • tylko u 1/4 pacjentów (p<0. 05) Parametr SAP DAP HR T Rytm istotny (Nliczba pacjentów) 4 * 11* (p=0. 013) 5* (p=0. 003) 3 Rytm nieistotny (Nliczba pacjentów) 14 7 13 15 Bienert A, Śniatkowska A. i wsp. Ocena rytmów okołodobowych u dzieci poddawanych sedacji midazolamem w oddziale intensywnej terapii, 2012, wysł. do druku

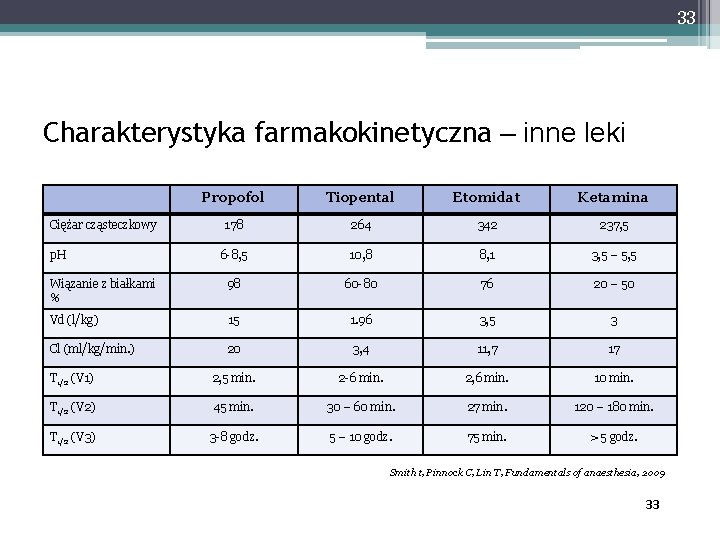
33 Charakterystyka farmakokinetyczna – inne leki Propofol Tiopental Etomidat Ketamina 178 264 342 237, 5 6 -8, 5 10, 8 8, 1 3, 5 – 5, 5 Wiązanie z białkami % 98 60 -80 76 20 – 50 Vd (l/kg) 15 1. 96 3, 5 3 Cl (ml/kg/min. ) 20 3, 4 11, 7 17 T 1/2 (V 1) 2, 5 min. 2 -6 min. 2, 6 min. 10 min. T 1/2 (V 2) 45 min. 30 – 60 min. 27 min. 120 – 180 min. T 1/2 (V 3) 3 -8 godz. 5 – 10 godz. 75 min. > 5 godz. Ciężar cząsteczkowy p. H Smith t, Pinnock C, Lin T, Fundamentals of anaesthesia, 2009 33

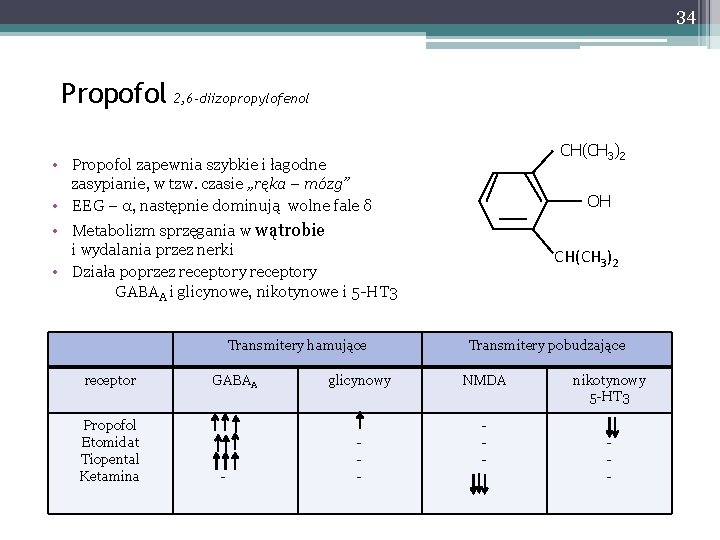
34 Propofol 2, 6 -diizopropylofenol CH(CH 3)2 • Propofol zapewnia szybkie i łagodne zasypianie, w tzw. czasie „ręka – mózg” • EEG – α, następnie dominują wolne fale δ • Metabolizm sprzęgania w wątrobie i wydalania przez nerki • Działa poprzez receptory GABAA i glicynowe, nikotynowe i 5 -HT 3 Transmitery hamujące receptor Propofol Etomidat Tiopental Ketamina GABAA - glicynowy - OH CH(CH 33))22 CH(CH Transmitery pobudzające NMDA - nikotynowy 5 -HT 3 34

35 PRIS- propofol infusion syndrom kwasica rhabdomioliza bradykardia hiperlipidemia stłuszczenie watroby czynniki ryzyka młody wiek ciężka choroba ogólnoustrojowa niewydolność wielonarządowa, steroidy katecholaminy

36 Etomidat imidazol • Etomidat - szybkie i łagodne zasypianie, podobnie do propofolu, w tzw. czasie „ręka – mózg” • EEG – fala epileptoidalna • Sedacja w IT – ograniczona 11 -β-hydroksylazy – syntezy kortykosteoridów i mineralokortykosteroidów

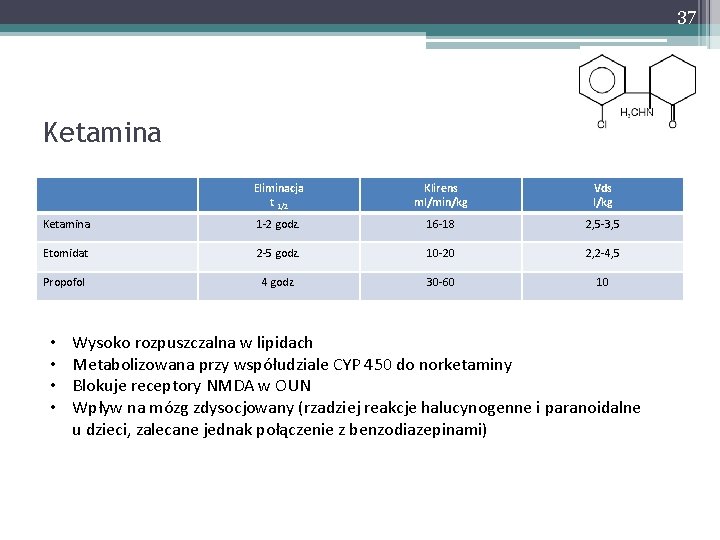
37 Ketamina Eliminacja t 1/2 Klirens ml/min/kg Vds l/kg Ketamina 1 -2 godz. 16 -18 2, 5 -3, 5 Etomidat 2 -5 godz. 10 -20 2, 2 -4, 5 Propofol 4 godz. 30 -60 10 • • Wysoko rozpuszczalna w lipidach Metabolizowana przy współudziale CYP 450 do norketaminy Blokuje receptory NMDA w OUN Wpływ na mózg zdysocjowany (rzadziej reakcje halucynogenne i paranoidalne u dzieci, zalecane jednak połączenie z benzodiazepinami)

38 Tiopental tiobarbituran Phenobarbital • p. H 11 99% zjonizowany, nieaktywny p. H 7. 4 66% niezjonizowany, rozpuszczalny w lipidach, aktywny • Stężenie terapeutyczne – 40 ug/ml • Depresja kory mózgowej CMRO 2, CBF, ICP • EEG – linia izoelektryczna, zależna od szybkości wlewu • działanie immunospuresyjne – zwiększone ryzyko min. ARDS i innych zakażeń hamuje transkrypcję NF-k. B hamuje ekspresję IL-2, IL-6 i IL -8 oraz interferonu γ hamuje aktywację CD 3+ w limfocytach Loop T at al. Thiopental Inhibits the Activation of Nuclear Factor κB, Anesthesiology 2002 • Kontrowersyjne zastosowanie neuroprotekcyjne tak, gdy wzrost ICP!!! raczej niższe dawki 1 -2 mg/kg/godz. American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care, Circulation 2010

39 α 2 – mimetyki α 2 – receptory Lokalizacja (alfa-2 A, alfa-2 B, alfa-2 C) • część presynaptyczną zakończeń nerwów sympatycznych i neuronów noradrenergicznych ośrodkowego układu nerwowego • miejsce sinawe, jądra podsinawe, nerw błędny, rdzeń przedłużony, rdzeń kręgowy • część postsynaptyczną receptorów w wątrobie, trzustce, nerkach, płytkach krwi i oku Efekt kliniczny • Spadek albo wzrost ciśnienia tętniczego • Działanie nasenno-uspokajające • Działanie analgetyczne

40 Receptor α 2 adrenergiczny Mechanizm działania • hamowanie aktywności cyklazy adenylowej • przyśpieszanie wymiany jonów sodu i wodoru przez błony komórkowe • aktywacja potasowych kanałów jonowych • hamowanie jonowych kanałów wapniowych • modulowanie aktywności fosfolipazy C związanej z błoną komórkową.

41 Leki α 2 – agonistyczne klonidyna, deksmedetomidyna Aktywność alfa-2 : alfa-1 DEX 1600 : 1 CLO 200 : 1 Selektywność alfa-2 : alfa-1 DEX 1300 : 1 CLO 39 : 1 http: //en. wikipedia. org/wiki/Adrenergic_receptor

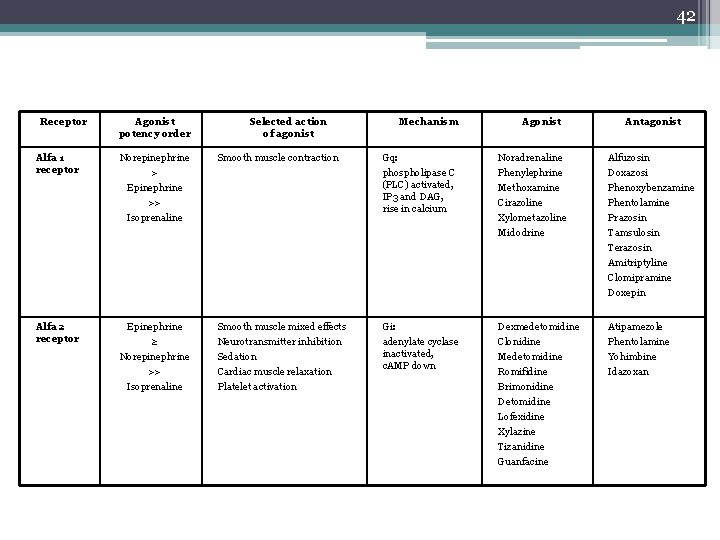
42 Receptor Agonist potency order Selected action of agonist Mechanism Agonist Antagonist Alfa 1 receptor Norepinephrine > Epinephrine >> Isoprenaline Smooth muscle contraction Gq: phospholipase C (PLC) activated, IP 3 and DAG, rise in calcium Noradrenaline Phenylephrine Methoxamine Cirazoline Xylometazoline Midodrine Alfuzosin Doxazosi Phenoxybenzamine Phentolamine Prazosin Tamsulosin Terazosin Amitriptyline Clomipramine Doxepin Alfa 2 receptor Epinephrine ≥ Norepinephrine >> Isoprenaline Smooth muscle mixed effects Neurotransmitter inhibition Sedation Cardiac muscle relaxation Platelet activation Gi: adenylate cyclase inactivated, c. AMP down Dexmedetomidine Clonidine Medetomidine Romifidine Brimonidine Detomidine Lofexidine Xylazine Tizanidine Guanfacine Atipamezole Phentolamine Yohimbine Idazoxan

43 Klonidyna • • • chlorowodorek 2 -(2, 6 - dwuchlorofenylamino)-2 -imidazoliny poprawia stabilność hemodynamiczną układu krążenia zmniejsza zużycie tlenu przez mięsień sercowy ogranicza częstość incydentów niedokrwienia serca w okresie okołooperacyjnym zmniejsza całkowite zużycie tlenu w okresie pooperacyjnym zmniejsza ryzyko niedokrwienia serca ogranicza odpowiedź stresową na laryngoskopię, intubację dotchawiczą etc nie wpływa na układ oddechowy, nawet podawana z morfiną osłabia odpowiedź hiperglikemiczną na uraz, stres zapobiega dreszczom hamuje wydzielanie śliny, zapobiega nudnościom i wymiotom
![44 Deksmedetomidyna S4 1 2 3 dimethylphenylethyl3 Himidazole DEX CLO Biodostępność 90 75 95 44 Deksmedetomidyna (S)-4 -[1 -(2, 3 -dimethylphenyl)ethyl]-3 H-imidazole DEX CLO Biodostępność 90% 75 -95%](https://slidetodoc.com/presentation_image/156d9875b52d86f580b11c849c924171/image-44.jpg)
44 Deksmedetomidyna (S)-4 -[1 -(2, 3 -dimethylphenyl)ethyl]-3 H-imidazole DEX CLO Biodostępność 90% 75 -95% Wiązanie z białkami 97% 20 -40% Metabolizm w wątrobie do nieaktywnych metabolitów (CYP 450) T ½ 2 godz. (pocz. po 6 min. ) 12 -33 godz. Wydalanie 95%, z moczem 40 -50%, z moczem Klirens 2 -20 m. ż. : 1, 2 -1, 0 l/kg/godz. > 2. r. ż. : 0, 8 l/kg/godz. Starsze dzieci i dorośli: 0, 5 -0, 6 l/kg/godz.

45 Charakterystyka DEX w populacji pediatrycznej PK / PD • Stężenie docelowe • Klirens • Objętość dystrybucji 0. 6 μg/l porównywalne do dorosłych niższy w 1 r. ż wyższy u małych dzieci wyższa u noworodków i niemowląt 125, 3 l/70 kg (Vss dorosłi 103, 5– 126, 71 l/70 kg) Korzyści kliniczne • • Sedacja bez stadium delirium Sedacja w odzwyczajaniu od opioidowych leków przeciwbólowych Analgezja Neuroprotekcja poprzez hamowanie apoptozy (midazolam i ketamina stymulują proces neurodegeneracji na drodze apoptozy!!!) 1. Amanda AL. Et al. . Dexmedetomidine pharmacokinetics in pediatric intensive care – a pooled analysis Pediatric Anesthesia, 2009 2. R. D. Sanders; D. Ma; P. Brooks; M. Maze. Balancing Paediatric Anaesthesia: Preclinical Insights Into Analgesia, Hypnosis, Neuroprotection, and Neurotoxicity. Br J Anaesth. 2008.

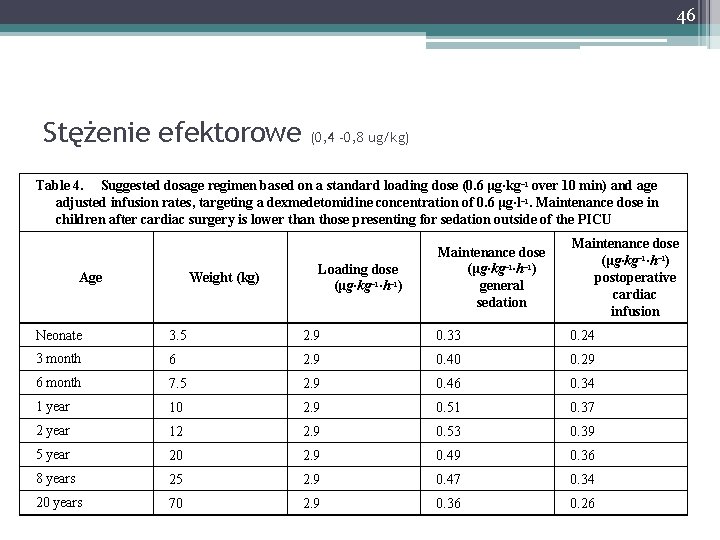
46 Stężenie efektorowe (0, 4 -0, 8 ug/kg) Table 4. Suggested dosage regimen based on a standard loading dose (0. 6 μg·kg− 1 over 10 min) and age adjusted infusion rates, targeting a dexmedetomidine concentration of 0. 6 μg·l− 1. Maintenance dose in children after cardiac surgery is lower than those presenting for sedation outside of the PICU Age Weight (kg) Loading dose (μg·kg− 1·h− 1) Maintenance dose (μg·kg− 1·h− 1) general sedation Maintenance dose (μg·kg− 1·h− 1) postoperative cardiac infusion Neonate 3. 5 2. 9 0. 33 0. 24 3 month 6 2. 9 0. 40 0. 29 6 month 7. 5 2. 9 0. 46 0. 34 1 year 10 2. 9 0. 51 0. 37 2 year 12 2. 9 0. 53 0. 39 5 year 20 2. 9 0. 49 0. 36 8 years 25 2. 9 0. 47 0. 34 20 years 70 2. 9 0. 36 0. 26

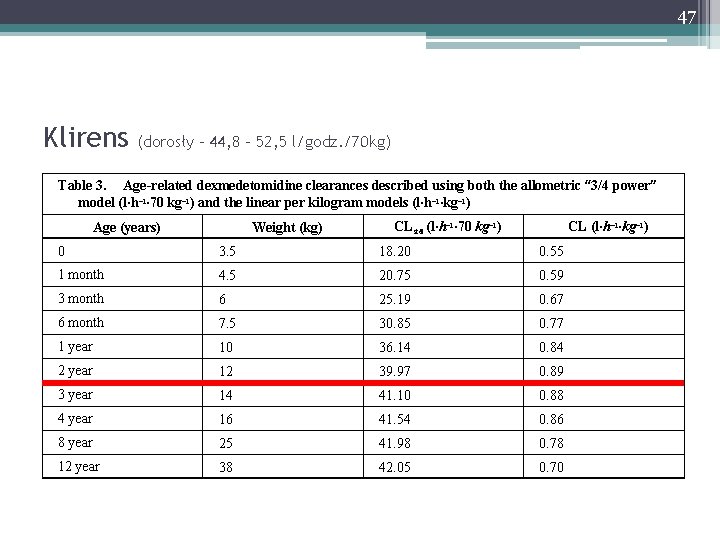
47 Klirens (dorosły - 44, 8 – 52, 5 l/godz. /70 kg) Table 3. Age-related dexmedetomidine clearances described using both the allometric “ 3/4 power” model (l·h− 1· 70 kg− 1) and the linear per kilogram models (l·h− 1·kg− 1) Age (years) Weight (kg) CLstd (l·h− 1· 70 kg− 1) CL (l·h− 1·kg− 1) 0 3. 5 18. 20 0. 55 1 month 4. 5 20. 75 0. 59 3 month 6 25. 19 0. 67 6 month 7. 5 30. 85 0. 77 1 year 10 36. 14 0. 84 2 year 12 39. 97 0. 89 3 year 14 41. 10 0. 88 4 year 16 41. 54 0. 86 8 year 25 41. 98 0. 78 12 year 38 42. 05 0. 70

48 Wzrost ciśnienia tętniczego Group 1. 2. Age Incidence of hypertension (%) Number of patients Duration of hypertension (min) Duration of sedation is reported in terms of median and interquartile range. *Significantly higher incidence than groups 4, 5, and 6 (P < 0. 05, logistic regression). 1 0– 6 months 118 10 (8. 5)* 33 (10– 75) 2 6– 12 months 266 21 (7. 9)* 15 (10– 32) 3 1– 3 years 1085 66 (6. 1)* 20 (10– 30) 4 3– 6 years 1212 45 (3. 7) 19 (10– 30) 5 6– 12 years 725 29 (4. 0) 19 (10– 30) 6 12– 18 years 116 1 (0. 9) 10 (10– 10) All 0– 18 years 3522 172 (4. 9) 20 (10– 30) MASON, K. P. , ZURAKOWSKI, D. , ZGLESZEWSKI, S. , et al. . . (2010), Incidence and predictors of hypertension during high-dose dexmedetomidine sedation for pediatric MRI. Pediatric Anesthesia, 20: 516– 523 .

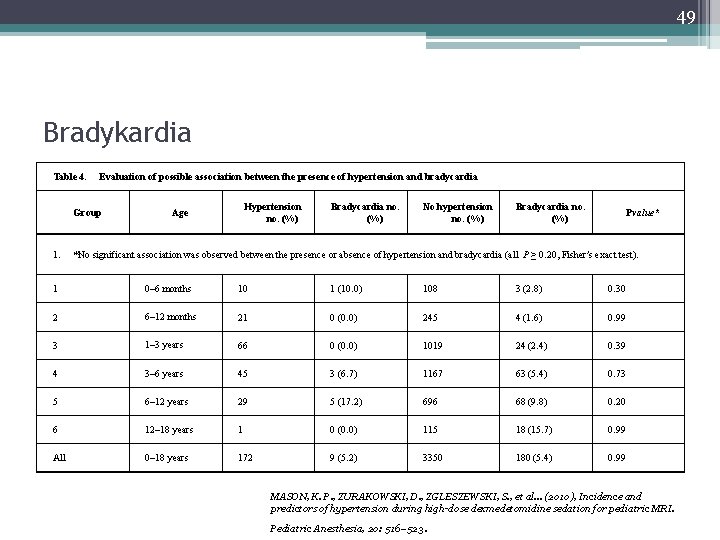
49 Bradykardia Table 4. Evaluation of possible association between the presence of hypertension and bradycardia Group 1. Hypertension no. (%) Age Bradycardia no. (%) No hypertension no. (%) Bradycardia no. (%) Pvalue* *No significant association was observed between the presence or absence of hypertension and bradycardia (all P ≥ 0. 20, Fisher’s exact test). 1 0– 6 months 10 1 (10. 0) 108 3 (2. 8) 0. 30 2 6– 12 months 21 0 (0. 0) 245 4 (1. 6) 0. 99 3 1– 3 years 66 0 (0. 0) 1019 24 (2. 4) 0. 39 4 3– 6 years 45 3 (6. 7) 1167 63 (5. 4) 0. 73 5 6– 12 years 29 5 (17. 2) 696 68 (9. 8) 0. 20 6 12– 18 years 1 0 (0. 0) 115 18 (15. 7) 0. 99 All 0– 18 years 172 9 (5. 2) 3350 180 (5. 4) 0. 99 MASON, K. P. , ZURAKOWSKI, D. , ZGLESZEWSKI, S. , et al. . . (2010), Incidence and predictors of hypertension during high-dose dexmedetomidine sedation for pediatric MRI. Pediatric Anesthesia, 20: 516– 523 .

50 MAP, HR Marcia L. Buck, Pharm. D. , FCCP; Douglas F. Willson, M. D. Use of Dexmedetomidine in the Pediatric Intensive Care Unit Pharmacotherapy. 2008; 28(1): 51 -57.

51 Leki przeciwbólowe

52 Czynniki wpływające na ból w ITD (1) • Wiek Różnice związane z wiekiem wynikają z różnorodnych wpływów neurobiologicznych, behawioralnych czy poznawczych 1. Crutcher K. A. , Aging and neuronal plasticity; lessions from a model, Auton Neurosci, 2002 2. Edwards R. R. , Fillingim R. B. , Ness T. J. , Age-related differences in endogenous pain modulation: a comparison of diffuse noxiuos inhibitory controls in healthy older and younger adults, Pain, 2003 • Płeć Istotne różnice pomiędzy płcią męską i żeńską: próg bólu percepcja bólu tolerancja bólu radzenie sobie z bólem zapotrzebowanie na analgetyki

53 Czynniki wpływające na ból w ITD (2) • Genetyka COMT (catechol-O-methyltransferase), enzym metabolizujący katecholaminy ** polimorfizm chromosomu 22 - zmniejszenie 3 -4 razy aktywności enzymu efekt - lepsza reakcja na naloxon, wzrost ilości μ-receptorów w mózgu, mniejsze zapotrzebowanie na morfinę UDP-glucuronylotransferaza, enzym metabolizujący morfinę do glukuronianiu morfiny (silniejszy niż morfina) **polimorfizm genów może zaburzać syntezę tego enzymu SNP (Single-nucleotide-polymorphism) genów odpowiedzialnych za kodowanie receptora μ-opioidowego: A 118 G – Asn 40 Asp – mutacja 10 -40% populacji efekt – zmniejszona odpowiedź na opioidy

54 Jak stosować analgetyki? (wg Andrzej Piotrowski) • Ból pooperacyjny opiaty i opioidy, tramadol, paracetamol, pyralgina, NSAID • Ból zabiegowy (zadawany) ketamina, morfina, EMLA Opioidy Paracetamol NSAID Pobudzenie receptorów opioidowych Ośrodkowe i obwodowe hamowanie Cox-1/Cox-2 μ λ σ δ Hamowanie syntezy PG Ośrodkowe i obwodowe hamowanie Cox-1/Cox-2 Interakcja z inhibitorami zstępującej drogi serotoninergicznej Hamowanie syntezy P

55 Porównanie farmakokinetyki i siły działania opioidów (1) Preparat Czas do Min. czas Średni czas Siła działania max. działania Fentanyl 5 -8 min 20 -30 min 60 -120 min 125 Sufentanyl 2 -4 min 30 min 100 -150 min 1000 Remifentanyl 1, 5 -2 min 3 - 5 min ok. 10 min 200 zmodyf. wg Larsen „Anestezjologia”

56 Porównanie farmakokinetyki i siły działania opioidów (2) Preparat Wstępna dawka Wlew podtrzymujący Dodatkowe bolusy Fentanyl 4 -20 g/kg 2 -10 g/kg/godz 25 -100 g Sufentanyl 0, 25 -2 g/kg 0, 5 -1, 5 g/kg/godz 2, 5 -10 g Remifentanyl 1 -2 g/kg 0, 1 -1, 0 g/kg/min 0, 1 -1, 0 g/kg zmodyf. wg Miller’s Anaesthesia

57 Sufentanyl • • Wzór chemiczny - C 22 H 30 N 2 O 2 S wysoce rozpuszczalny w tłuszczach niska Vd krótki T 1/2 wysokie powinowactwo do receptora μ 1 działanie-bólowe niewielkie powinowactwo do receptora μ 2 działania niepożądane szybko wiązany przez albuminy nie kumuluje się

58 Charakterystyka kliniczna Su. FN • rozszerza naczynia płucne (działanie to blokowane jest przez nalokson) • zmniejsza zapotrzebowanie na leki inotropowo-dodatnie • stabilizuje stężenie endogennych katecholamin • nie obserwuje się zmian w zakresie przepływu krwi przez nerki • nie obserwuje się przedłużonego działania nawet u chorych ze schyłkową niewydolnością nerek agoniści receptora μ hamowanie wydzielania H 2 O, Na, K • może upośledzać odpowiedź immunologiczną pobudzenie receptora μ

59 Context-sensitive-half-time (CSHT) a opioidy • czas, w którym stężenie leku w osoczu po zakończeniu jego podawania w ciągłym wlewie obniża się o 50% • jest to czas, którego nie można przewidzieć na podstawie biologicznego okresu półtrwania, ponieważ zależy on również od złożonej dystrybucji leku Dawka nasycająca Wlew 0, 25 ug/kg u noworodka 0, 5 ug/kg u dzieci i dorosłych 0, 35 – 0, 75 ug/kg/godz. CSHT dla dawka dobierana indywidualnie w zależności od wieku remifentanylu wynosi 3 -4 minuty , i reaktywności pacjenta nawet po długotrwałym wlewie (>8 h) rekomendacje wg M. Rawicz

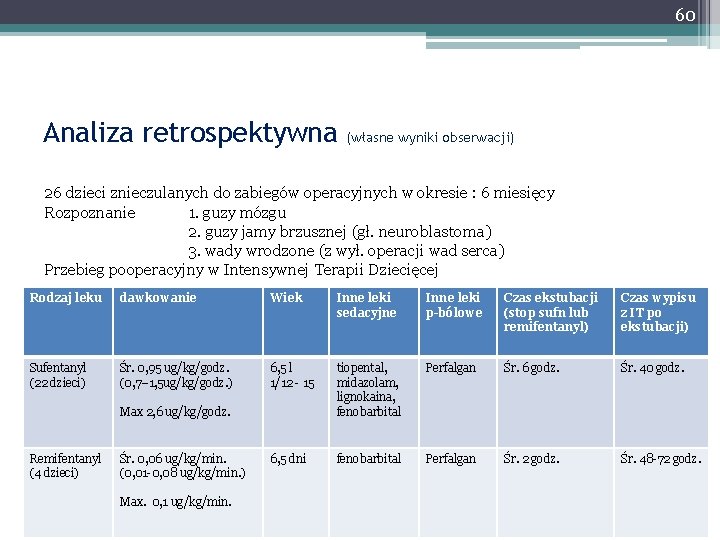
60 Analiza retrospektywna (własne wyniki obserwacji) 26 dzieci znieczulanych do zabiegów operacyjnych w okresie : 6 miesięcy Rozpoznanie 1. guzy mózgu 2. guzy jamy brzusznej (gł. neuroblastoma) 3. wady wrodzone (z wył. operacji wad serca) Przebieg pooperacyjny w Intensywnej Terapii Dziecięcej Rodzaj leku dawkowanie Wiek Inne leki sedacyjne Inne leki p-bólowe Czas ekstubacji (stop sufn lub remifentanyl) Czas wypisu z IT po ekstubacji) Sufentanyl (22 dzieci) Śr. 0, 95 ug/kg/godz. (0, 7– 1, 5 ug/kg/godz. ) 6, 5 l 1/12 - 15 tiopental, midazolam, lignokaina, fenobarbital Perfalgan Śr. 6 godz. Śr. 40 godz. 6, 5 dni fenobarbital Perfalgan Śr. 2 godz. Śr. 48 -72 godz. Max 2, 6 ug/kg/godz. Remifentanyl (4 dzieci) Śr. 0, 06 ug/kg/min. (0, 01 -0, 08 ug/kg/min. ) Max. 0, 1 ug/kg/min.

61 Leki zwiotczające mięśnie

62 • Mechanizm działania poprzez receptory: nikotynowe, muskarynowe • Uwalnianie histaminy • Efekt autonomiczny • Critical Illness Polyneuropathy (CIP) Critical Illness Myopathy (CIM) 70% ciężka sepsa lekka p. – kilka tygodni ciężka p. – kilka miesięcy

63 Wskazania do NDMR • Ułatwienie wentylacji mechanicznej (optymalnie do 48 godz. ) 1. Wentylacja ochraniająca płuca (lung protective ventilation) 2. Techniki zapobiegające atelektazjom › 90% pacjentów w IT I. PEEP 4 -10 cm H 20 II. VCM (Vital Capacity Manoeuvre) – PEEP 40 przez 10 sek. III. PEEP do 15 i Peak pressure do 40 przez 10 oddechów, | stopniowo powrót do wartości wyjściowych • Wysokie ICP • Badania i/lub procedury diagnostyczne i terapeutyczne

64 Dziękuję za uwagę
 Ptait
Ptait Kim jest prodziekan
Kim jest prodziekan Sekcja krytyczna
Sekcja krytyczna Wielkopolskie towarzystwo terapii systemowej
Wielkopolskie towarzystwo terapii systemowej Osobowość masochistyczna
Osobowość masochistyczna Mechanizm iluzji i zaprzeczeń przykłady
Mechanizm iluzji i zaprzeczeń przykłady Zarys terapii dziecka
Zarys terapii dziecka Rakowski sierosław
Rakowski sierosław Podczas tablerowania mięsnej masy mielonej
Podczas tablerowania mięsnej masy mielonej Zabrania się strzelać z broni technicznie niesprawnej
Zabrania się strzelać z broni technicznie niesprawnej Niemetal o symbolu se
Niemetal o symbolu se Orogeneza kaledońska era
Orogeneza kaledońska era Wypoczywa podczas wakacji
Wypoczywa podczas wakacji Działania ratownicze i zabezpieczające podczas powodzi
Działania ratownicze i zabezpieczające podczas powodzi Etykieta oficjalnych przyjęć
Etykieta oficjalnych przyjęć Podczas przemian metabolicznych
Podczas przemian metabolicznych Działania ratownicze i zabezpieczające podczas powodzi
Działania ratownicze i zabezpieczające podczas powodzi Przykładowy meldunek bojowy
Przykładowy meldunek bojowy Na boisku bawiło się 13 dzieci
Na boisku bawiło się 13 dzieci Zagadki ortograficzne
Zagadki ortograficzne Komputer budowa
Komputer budowa Pan dymek wiersz
Pan dymek wiersz Metody wychowawcze korczaka
Metody wychowawcze korczaka Piosenki do jezusa
Piosenki do jezusa Dzie matki
Dzie matki Język żyrafy w szkole
Język żyrafy w szkole Cechy dobrego przyjaciela prezentacja
Cechy dobrego przyjaciela prezentacja Co to jest dialog
Co to jest dialog Higiena osobista film edukacyjny dla dzieci
Higiena osobista film edukacyjny dla dzieci Budowa rowera
Budowa rowera Test zuchory dla dzieci
Test zuchory dla dzieci Wiersze o aniołach dla dzieci
Wiersze o aniołach dla dzieci Higiena pracy przy komputerze dla dzieci
Higiena pracy przy komputerze dla dzieci Głoski dźwięczne
Głoski dźwięczne Pismo klinowe alfabet
Pismo klinowe alfabet Budowa komputera opis dla dzieci
Budowa komputera opis dla dzieci Warszawska syrenka karty pracy
Warszawska syrenka karty pracy Tydzień dzieci miał siedmioro wiersz
Tydzień dzieci miał siedmioro wiersz Fair play w sporcie prezentacja
Fair play w sporcie prezentacja Królowa wiktoria hanowerska
Królowa wiktoria hanowerska Budowa komputera dla dzieci
Budowa komputera dla dzieci Himalaje prezentacja
Himalaje prezentacja Piramida zdrowego żywienia
Piramida zdrowego żywienia Staropolska miara dlugosci tkanin
Staropolska miara dlugosci tkanin Symbole unii europejskiej dla dzieci
Symbole unii europejskiej dla dzieci Zasady bezpiecznego internetu dla dzieci
Zasady bezpiecznego internetu dla dzieci Mysz polna prezentacja dla dzieci
Mysz polna prezentacja dla dzieci Budowa komputera pc
Budowa komputera pc Witajcie drogie dzieci
Witajcie drogie dzieci Renifer
Renifer Naladuj
Naladuj Znaki i symbole ekologiczne
Znaki i symbole ekologiczne Wniebowstąpienie katecheza
Wniebowstąpienie katecheza Dziecko kochane
Dziecko kochane Normy żywieniowe dla dzieci w wieku szkolnym
Normy żywieniowe dla dzieci w wieku szkolnym Zaklinaczka dzieci
Zaklinaczka dzieci Tatrzański park narodowy prezentacja dla dzieci
Tatrzański park narodowy prezentacja dla dzieci Piramida żywienia najnowsza
Piramida żywienia najnowsza Zamek na kociej skale gdzie się znajduje
Zamek na kociej skale gdzie się znajduje Zasady korzystania z książek dla dzieci
Zasady korzystania z książek dla dzieci Prezentacja o wielkiej brytanii dla dzieci
Prezentacja o wielkiej brytanii dla dzieci Droga mleczna prezentacja
Droga mleczna prezentacja Piosenka o wężu dla dzieci
Piosenka o wężu dla dzieci Hans christian andersen biografia
Hans christian andersen biografia Listy dzieci do pana boga
Listy dzieci do pana boga
























































































