Section 6 2 Les formules empiriques et les
















- Slides: 17

Section 6. 2: Les formules empiriques et les formules moléculaires • Formule moléculaire: Formule qui indique le nombre d’atomes de chaque élément dont est formée une molécule de composé. Ex. H 2 O 2 (rapport entre les atomes d’oxygène et d’hydrogène est 2: 2) • Formule empirique: Formule qui représente le plus petit rapport entre les éléments d'un composé, exprimé en nombre entier. Ex. HO (rapport entre les atomes d’oxygène et d’hydrogène 1: 1) 1

• Dans certains cas la formule empirique et la même que la formule moléculaire. Ex. H 2 O • Les composés ioniques n’ont qu’une seule configuration possible. On utilise donc leur formule empirique. • Voir tableau 6. 1 page 269 du manuel. 2

Déterminer la formule empirique et la formule moléculaire d’un composé chimique selon le pourcentage de composition Source: Apprentissage en ligne Ontario

EXEMPLE 1 : Déterminer la formule empirique (simple) Détermine la formule empirique d’un composé chimique dont la composition est de 80, 04 % de carbone et de 19, 96 % d’hydrogène. Les Écris indices la formule d’une enformule utilisant chimique comme doivent indicesélément les être nombres des nombre de moles entiers. Détermine Suppose que le la nombre masse de totale moles dede l’échantillon chaque est de en 100 utilisant grammes. la La formule empirique du composé chimique est CH. Si calculés. l’indicen. Divise se trouve ensuite +/-ces 0, 1 d’un nombre par le plus entier, petit il nombre estde permis dede moles formule Convertis le = m/M. pourcentage Leà symbole deindices composition M correspond en àdonnées la masse molaire masse. de 3 carbone l’arrondir. pour déterminer Sinon, illafaut formule multiplier empirique. les indices par un facteur approprié. l’élément. m 80, 04 g = → 80, 04 g% → n= = 6, 66 moles de carbone 12, 011 g/mol M CALCULER LE NOMBRE DE MOLES CONVERTIR hydrogène → 19, 96 % g DÉTERMINER LA FORMULE EMPIRIQUE → n= m M = 19, 96 g 1, 008 g/mol C 1 H 2, 93 6, 66 19, 80 6, 66 = 19, 80 moles d’hydrogène FINALISER LA FORMULE EMPIRIQUE 4

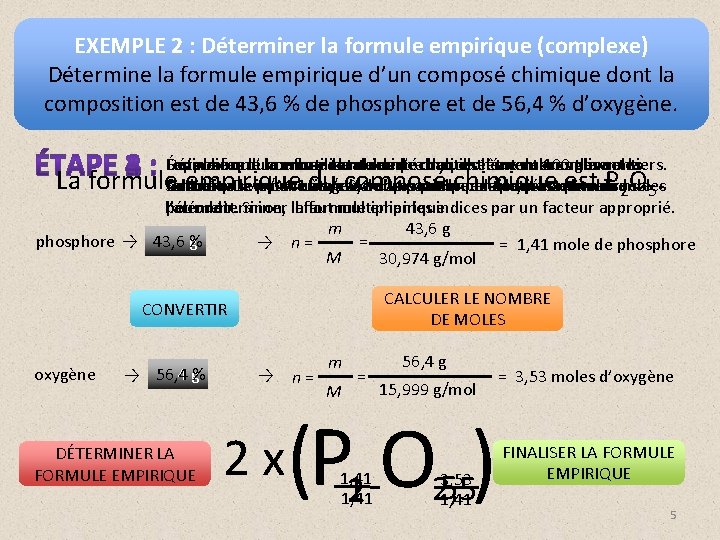
EXEMPLE 2 : Déterminer la formule empirique (complexe) Détermine la formule empirique d’un composé chimique dont la composition est de 43, 6 % de phosphore et de 56, 4 % d’oxygène. Les Écris indices la formule d’une enformule utilisant chimique comme doivent indicesélément les être nombres desen nombre de moles entiers. Suppose Détermine que le la nombre masse de totale moles de de l’échantillon chaque est de 100 utilisant grammes. la La formule. Sicalculés. empirique composé est Pde O l’indice se trouve ensuite à symbole +/-ces 0, 1 d’un nombre par lechimique plus entier, il nombre estde permis de Convertis formule n. Divise le = m/M. pourcentage Ledu deindices composition M correspond en données àpetit la masse molaire masse. de 5. 2 moles l’arrondir. pour déterminer Sinon, illafaut formule multiplier empirique. les indices par un facteur approprié. l’élément. m 43, 6 g = phosphore → 43, 6 % g → n= = 1, 41 mole de phosphore M 30, 974 g/mol CALCULER LE NOMBRE DE MOLES CONVERTIR oxygène → 56, 4 g% DÉTERMINER LA FORMULE EMPIRIQUE → n= 2 x m M = 56, 4 g 15, 999 g/mol (P 12 O 2, 55 ) 1, 41 3, 53 1, 41 = 3, 53 moles d’oxygène FINALISER LA FORMULE EMPIRIQUE 5

Ce tableau peut t’aider à convertir les indices. 6

Exemple 3 page 272 du manuel 7

8

EXEMPLE 4 : Déterminer la formule moléculaire Détermine la formule moléculaire du xylène, un composé chimique dont la formule empirique est C 4 H 5 et dont la masse molaire est de 106, 0 g/mol. Détermine la masse molaire de la formule empirique. MC H 4 5 = 4 MC + 5 MH = 4(12, 011 g/mol) + 5(1, 008 g/mol) = 53, 084 g/mol Divise la masse molaire de la formule moléculaire par la masse molaire de la formule empirique. Tu obtiendras ainsi un facteur de multiplication. 106, 0 g/mol 53, 084 g/mol = 1, 9968 ≈ 2 Multiplie la formule empirique par le facteur. Tu obtiendras ainsi la formule moléculaire. 2 (C 48 H 105 ) La formule moléculaire du xylène est C 8 H 10. 9

Voir tableau de synthèse de comment déterminer les formules empirique et moléculaire. • Page 276 du manuel. • Vérifie tes connaissances: https: //nouvelon. apprentissageelectroniqueont ario. ca/d 2 l/lor/viewer/view. d 2 l? ou=8201&lo. Ide nt. Id=158696 10

À toi de jouer! Applique tes nouvelles connaissances en faisant les exercices suivants: Page 270 #7, 9 et 10 Page 273#32 -33 Page 275#42 -47

Les hydrates et leur formules chimiques (page 277) • Hydrate: Composé qui contient un nombre défini de molécules d’eau liées à chaque formule chimique. • Ex. Le sulfate de calcium dihydraté (s) Chaque unité de formule a 2 molécules d’eau qui lui sont liées. 12

Les hydrates et leur formules chimiques (page 277) • Anhydre: Composé à l’état solide qui n’est pas lié à des molécules d’eau. • Ex. Le sulfate de calcium Ca. SO 4 (s) La réactivité des 2 formes de ce composé chimique ne change pas. Cependant sa masse va changer. 13

Les hydrates et leur formules chimiques (page 277) La façon la plus simple de déterminer en laboratoire le nombre de molécules d’eau liées à l’échantillon est la suivante: Note la masse de l’hydrate. Chauffe-le afin de te débarrasser des molécules d’eau. Note la masse de l’échantillon anhydre. La différence de masse représente la masse de l’eau. Ceci te permettra de trouver le pourcentage massique de l’eau et donc la formule chimique de l’hydrate. 14

Exemple d’un problème portant sur les composés hydratés Source: Apprentissage électronique Ontario 15

Exemple d’un problème portant sur les composés hydratés (suite) 16

À toi de jouer! Applique tes nouvelles connaissances en faisant les exercices suivants: Page 278 # 51, 52, 53, 55 , 56 et 60.