Scheikunde Hoofdstuk 2 Moleculaire Stoffen 2 2 Elektrisch






























- Slides: 32

Scheikunde Hoofdstuk 2 Moleculaire Stoffen

2. 2 Elektrisch geleidingsvermogen en naamgeving • Stoffen kunnen worden ingedeeld in groepen door te kijken naar het elektrisch geleidend vermogen.

Wat is elektrische stroom? • Letterlijk: transport van geladen deeltjes Er zijn twee mogelijkheden: 1) Elektronen die door een draad bewegen (natuurkunde) 2) Ionen (alleen in vloeibare fase of in oplossingen)

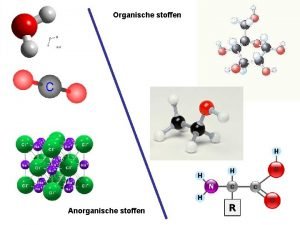
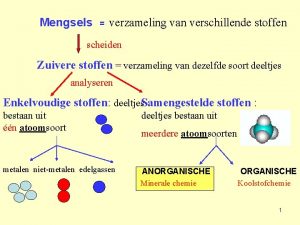
Moleculaire stoffen • • Bestaan alleen uit niet-metaal atomen Bevatten atoombindingen Geleiden geen stroom Voorbeelden: Aardgas CH 4 Zuurstof O 2 Glucose C 6 H 12 O 6

Moleculaire stoffen geleiden geen stroom • Zuiver water is een moleculaire stof en kan geen stroom geleiden. Als je keukenzout in water doet geleid water wel stroom zie onderstaande afbeelding • Dat komt omdat keukenzout GEEN moleculaire stof is • Keukenzout heeft als formule Na. Cl: Na is een metaal dus is keukenzout niet moleculair! » Hieronder een oplossing van keukenzout in water

Voorbeelden • Kaarsvet bestaat uit stearinezuur en heeft de volgende formule: C 17 H 35 COOH Kan gesmolten kaarsvet stroom geleiden? • • Oplossing Kijk naar de formule van kaarsvet: Kijk met behulp van Binas tabel 99 of de atomen in kaarsvet niet-metalen zijn Ja C = niet metaal H= niet metaal O = niet metaal Kaarsvet is moleculair kan dus geen stroom geleiden

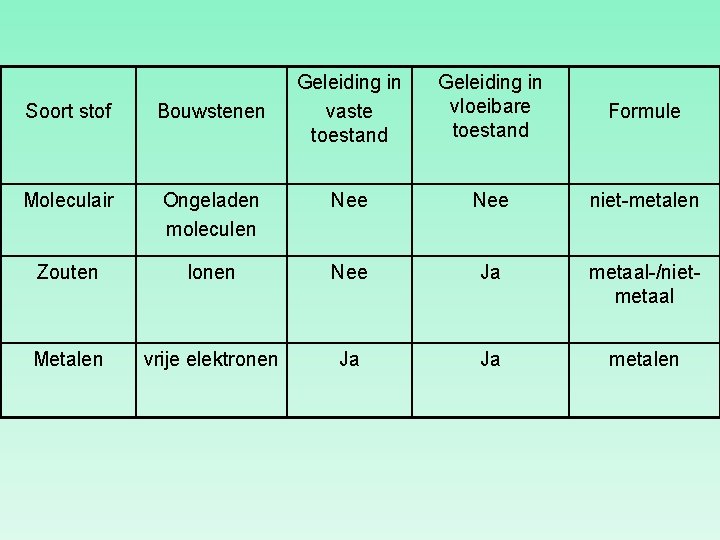
Geleiding in vaste toestand Geleiding in vloeibare toestand Formule Soort stof Bouwstenen Moleculair Ongeladen moleculen Nee niet-metalen Zouten Ionen Nee Ja metaal-/nietmetaal Metalen vrije elektronen Ja Ja metalen

Element • Als de atomen allemaal hetzelfde zijn Bijvoorbeeld: N 2 stikstof

Verbinding • Als de atomen verschillend zijn Bijvoorbeeld: NO 2 Stikstofdioxide http: //vimeo. com/4433312

Molecuulformule • Aan een molecuulformule kun je zien hoeveel en welke atomen aan elkaar zijn gebonden. Bijvoorbeeld : coëfficent Water: notatie : 3 H 2 O index 3 moleculen water die elk bestaan uit 2 waterstof en 1 zuurstofatoom

Systematische naamgeving • De index in de molecuulformule geven we aan met een voorvoegsel (BINAS 66 C) INDEX voorvoegsel 1 mono 2 di 3 tri 4 tetra 5 penta 6 hexa

Tweede symbool achtervoegsel ide Tweede symbool O S N Naam oxide sulfide nitride P Se fosfide selenide Voorbeeld 1: CS 2 monokoolstofdisulfide

Voorbeeld 2 • Systematische naam H 2 O 2 • Index H-atoom: 2 di • Index O-atoom: 2 di • De naam wordt dan diwaterstofdioxide

Voorbeeld 3 • Systematische naam P 2 O 5 • Index P-atoom: 2 di • Index O-atoom: 5 penta • De naam wordt dan difosforpentaoxide telwoord- atoomsoort- telwoord-atoomsoort-ide

Voorbeeld 4 • As 2 O 3 • • • As = niet-metaal O = niet-metaal Index As = 2 di Index O = 3 tri Naam: diarseentrioxide

Triviale namen Naam formule Glucose C 6 H 12 O 6 Methaan CH 4 Water H 2 O Waterstofperoxide H 2 O 2

2. 3 Atoombindingen

Structuurformule • Kun je zien hoe de atomen in een molecuul zijn gebonden • Atoombindingen worden aangegeven met streepjes. • Een atoombinding wordt ook wel covalente binding genoemd.

Covalentie • Getal dat aangeeft hoeveel atoombindingen een atoomsoort kan vormen. Elementen Covalentie H , F, I, Cl , Br 1 O N C 2 3 4

Structuurformules pentaan 2 - methylbutaan

Atoom(covalente)binding • Worden gevormd door overlap van e-wolken. • Elk atoom levert per atoombinding 1 e-. De 2 e- samen noemt men het bindings- of gemeenschappelijk e- - paar. Als moleculen kapot gaan worden er atoombindingen verbroken.


Waterstof heeft maar 1 edus kan ook nooit meer dan 1 binding vormen. Alleen de e- in de buitenste schil spelen een rol, deze enoemt de valentie-e-.

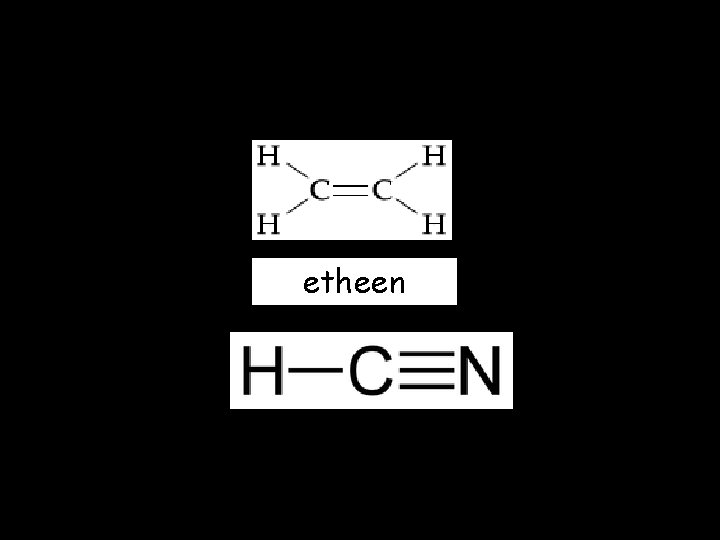
Meervoudige bindingen • Een koolstofatoom heeft covalentie 4. Er moeten dus altijd vier bindingen om heen getekend worden , dit heeft soms tot gevolg dat er een meervoudige binding ontstaat. Ethyn (C 2 H 2) HCN

etheen

2. 4 Vanderwaalsbindingen

Vander. Waalsbindingen • Aantrekkende krachten tussen moleculen: cohesie. • Er geldt in het algemeen: Hoe groter de molecuulmassa, hoe sterker de Vander. Waalsbindingen, hoe hoger het smelt, - kookpunt.

Vast H 2 O(s)= ijs • De moleculen zitten vast in een rooster (gestapeld), trillen beetje • Tussen de moleculen heb je Vander. Waalsbindingen • Kleine intermoleculaire ruimten

Vloeibaar H 2 O (l)= water • Moleculen bewegen door elkaar, sommige laten elkaar los • Vander. Waalsbinding kleiner

GAS H 2 O(g) = waterdamp • Moleculen bewegen los en ver van elkaar • De moleculen trekken elkaar niet aan • De intermoleculaire ruimte is zeer groot • Er zijn geen Vander. Waalsbindingen meer aanwezig

Fase-overgangen • Bij een fase-overgang spelen alleen de Fvdw een rol Bijvoorbeeld: verdampen Als een stof verdampt worden de Fvdw verbroken. De atoombindingen blijven heel.

2. 4 Waterstofbruggen Powerpoint grt
 Triviale naam
Triviale naam Exploitatiebegroting betekenis
Exploitatiebegroting betekenis Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Elektrisch geleidingsvermogen
Elektrisch geleidingsvermogen Noughts and crosses book summary
Noughts and crosses book summary Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur What is voltage
What is voltage Foto elektrisch effect
Foto elektrisch effect Elektrisch veld definitie
Elektrisch veld definitie Wiskunde havo 4 handig tellen
Wiskunde havo 4 handig tellen Hoofdstuk in een opera
Hoofdstuk in een opera Radiaal elektrisch veld
Radiaal elektrisch veld Symbool relais
Symbool relais Joint drehmaschine elektrisch
Joint drehmaschine elektrisch Hoofdstuk 3
Hoofdstuk 3 Wiskunde a havo 4 hoofdstuk 3
Wiskunde a havo 4 hoofdstuk 3 Badehilfen haßfurt
Badehilfen haßfurt De belofte van pisa samenvatting
De belofte van pisa samenvatting Vaste stoffen blussen
Vaste stoffen blussen Ruhe stoffen
Ruhe stoffen Autotrofe organismen voorbeelden
Autotrofe organismen voorbeelden Biologische stoffen vca
Biologische stoffen vca Welke stoffen lossen op in water
Welke stoffen lossen op in water Metaalatomen
Metaalatomen Hypojodigzuur
Hypojodigzuur Dichten von stoffen
Dichten von stoffen Energieleverende stoffen
Energieleverende stoffen Zure stoffen
Zure stoffen Dichtheid stoffen
Dichtheid stoffen Mengen en scheiden
Mengen en scheiden Gevaarlijke stoffen etiketten
Gevaarlijke stoffen etiketten Sterke zuren en basen tabel
Sterke zuren en basen tabel Mol berekenen
Mol berekenen