SCH 3 2 LES GROUPES LA SANT CARATRISTIQUES













- Slides: 19

SCH 3. 2 LES GROUPES LA SANTÉ CARATRISTIQUES DE FONCTIONS 1. Quelques groupes caractéristiques de fonctions:

Quel est le point commun entre les molécules présentées ? Le groupe carbonyle Le formol (méthanal ou L’éthanal (acétaldéhyde) est un formaldéhyde) peut être composant liquide incolore et volatil, utilisé comme désinfectant L’acétone (propan-2 -one est particulièrement réactif et en médecine vétérinaire. un isomère du propanal) inflammable. L'éthanal est Beaucoup plus utilisé dans existe naturellement en très naturellement présent dans le tabac, l’industrie. petite quantité dans le les feuilles de chêne, les fruits mûrs C’est une molécule très ou le café. Il a des propriétés monde du vivant. polluante, C’est cependant un produit toxiques et cancérogènes, et ce, à manipuler avec précaution. notamment de manière établie chez les animaux. Sous sa forme hydrogénée, il donne de l'éthanol.

Les composés carbonylés : aldéhydes et cétones terminaison al ou one Les aldéhydes et les cétones contiennent le groupe caractéristique carbonyle. — C = O Dans les aldéhydes ce groupe est "au bout" de la chaîne carbonée, le carbone fonctionnel est donc lié à au moins un atome d'hydrogène. Dans les cétones ce groupe est "à l'intérieur" de la chaîne carbonée, le carbone fonctionnel est donc lié à deux atomes de carbone. Donc le groupement C=O que l'on trouve aussi dans les aldéhydes et les cétones, fait que l'on englobe ces 2 familles dans un ensemble appelé composés carbonylés

Le groupe carbonyle L’éthanal (acétaldéhyde) I Le groupe — C = O est « au bout » de la chaine carbonée donc lié à au moins un atome d’hydrogène C’est donc, une aldéhyde L’acétone (propan-2 -one) I Le groupe — C = O est à l’intérieur de la chaine carbonée ATTENTION : une exception Le formol (méthanal ou formaldéhyde) : finit en ol mais n’est pas un alcool ! C’est bien une aldéhyde donc entre deux atomes de carbone C’est donc, une cétone Le groupe est liée à au moins un atome d’hydrogène

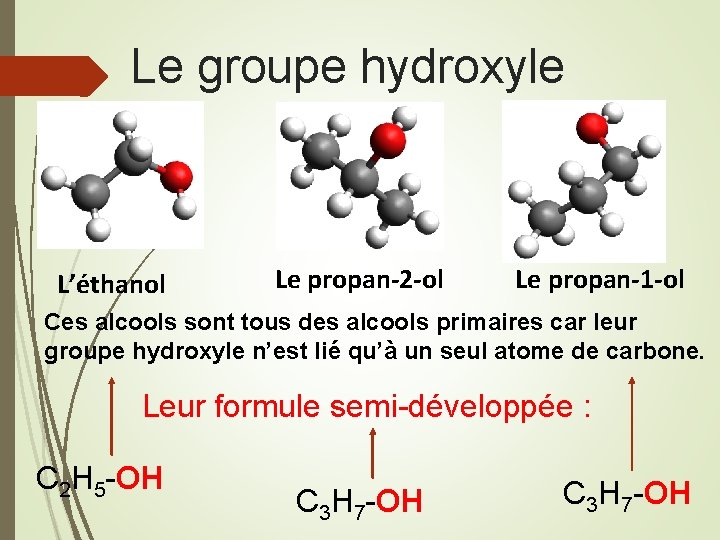
Quel est le point commun entre les molécules présentées ? Le groupe hydroxyle L’éthanol, est utilisé comme désinfectant En médecine, le propan-2 -ol peut être utilisé pour stériliser le matériel. Il est davantage utilisé dans l’industrie comme solvant. Le propan-1 -ol

Les alcools terminaison ol Les alcools possèdent un groupe I caractéristique hydroxyle — C — OH Le nom d'un alcool dérive de celui de l'alcane correspondant. On peut regrouper les alcools en différentes classes : Dans un alcool primaire l’atome de carbone fonctionnel est lié au plus à un seul autre atome de carbone. Dans un alcool secondaire l’atome de carbone fonctionnel est lié à deux autres atomes de carbone. Dans un alcool tertiaire l’atome de carbone fonctionnel est lié à trois autres atomes de carbone.

Le groupe hydroxyle L’éthanol Le propan-2 -ol Le propan-1 -ol Ces alcools sont tous des alcools primaires car leur groupe hydroxyle n’est lié qu’à un seul atome de carbone. Leur formule semi-développée : C 2 H 5 -OH C 3 H 7 -OH

Les alcanes : début de nomenclature Les alcanes sont des hydrocarbures saturés. Ils ne sont constitués que d'atomes de carbone (C) et d'hydrogène (H), liés entre eux par des liaisons simples. Les atomes de carbone sont reliés à un nombre maximal d'atomes d'hydrogène d'où le nom de « saturé » . Les alcanes non cycliques possèdent une formule brute de la forme Cn. H 2 n+2 où n est un entier naturel non nul.

Un début de nomenclature… Le nom est formé : d'un radical indiquant le nombre d'atomes de carbone de la chaîne carbonée principale. 1 méth 2 éth 3 prop 4 but 5 pent 6 hex 7 hept 8 oct 9 non 10 dec d'un suffixe -ane précisant le groupe fonctionnel (alcane)

QUELQUES EXEMPLES AVEC LES PREMIERS ALCANES LINÉAIRES Méthane (CH 4) • Éthane (C 2 H 6) • Propane (C 3 H 8) • Butane (C 4 H 10) Pentane (C 5 H 12) • Hexane (C 6 H 14) • Heptane (C 7 H 16) • Octane (C 8 H 18) Nonane (C 9 H 20) • Décane (C 10 H 22) • Undécane (C 11 H 24) Dodécane (C 12 H 26) • Tridécane (C 13 H 28) • Tétradécane (C 14 H 30) Pentadécane (C 15 H 32) • Cétane (C 16 H 34) • Heptadécane (C 17 H 36) Octadécane (C 18 H 38) • Nonadécane (C 19 H 40) • Eicosane (C 20 H 42) Heneicosane (C 21 H 44) • Docosane (C 22 H 46) • Tricosane (C 23 H 48) Tétracosane (C 24 H 50) • Pentacosane (C 25 H 52) • Hexacosane (C 26 H 54) Heptacosane (C 27 H 56) • Octacosane (C 28 H 58) • Nonacosane (C 29 H 60) Triacontane (C 30 H 62) • Untriacontane (C 31 H 64) • Dotriacontane (C 32 H 66) Tritriacontane (C 33 H 68) • Tétratriacontane (C 34 H 70) Pentatriacontane (C 35 H 72) • Hexatriacontane (C 36 H 74) Heptatriacontane (C 37 H 76) • Octatriacontane (C 38 H 78) Nonatriacontane (C 39 H 80) • Tétracontane (C 40 H 82)

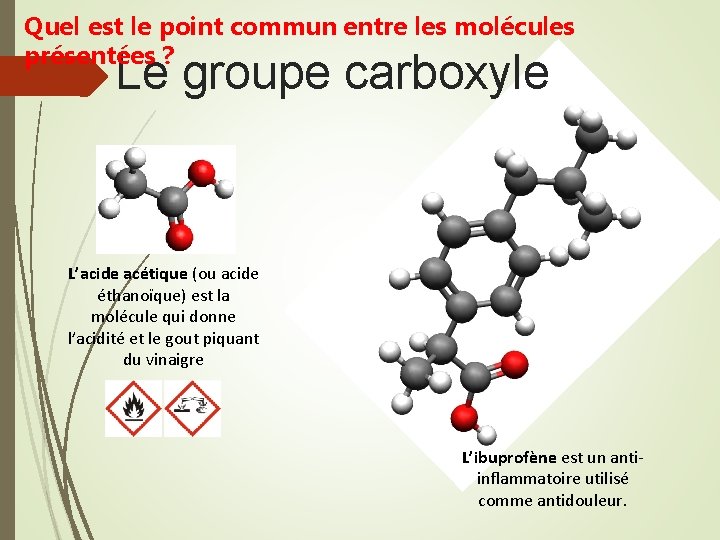
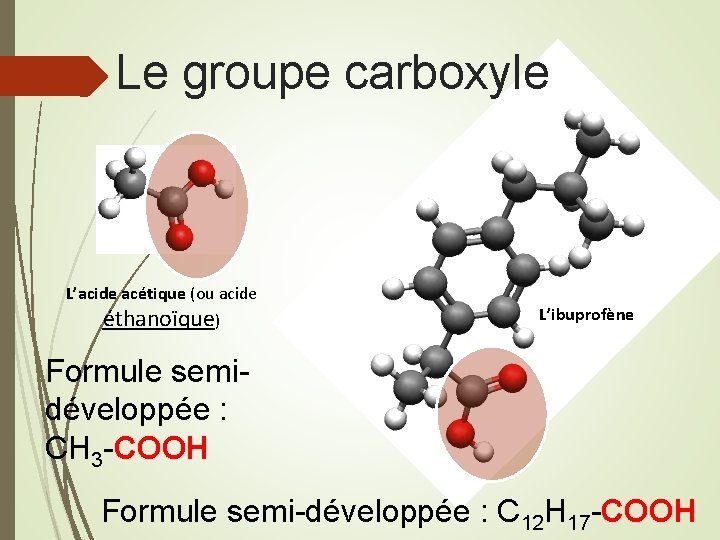
Quel est le point commun entre les molécules présentées ? Le groupe carboxyle L’acide acétique (ou acide éthanoïque) est la molécule qui donne l’acidité et le gout piquant du vinaigre L’ibuprofène est un antiinflammatoire utilisé comme antidouleur.

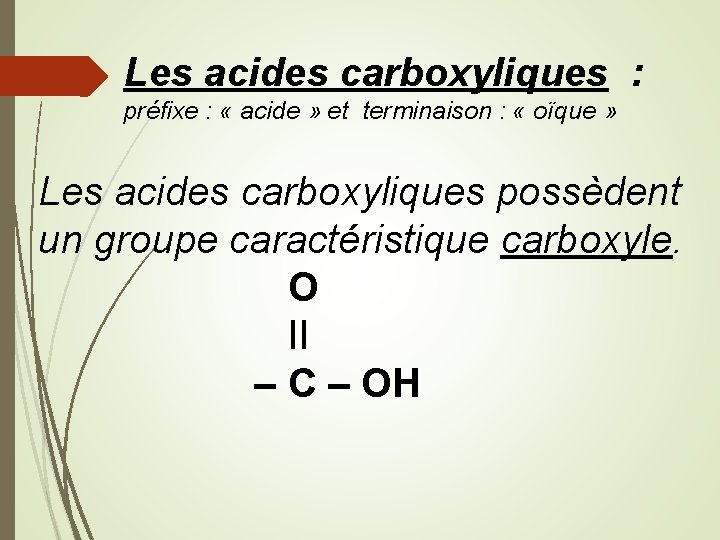
Les acides carboxyliques : préfixe : « acide » et terminaison : « oïque » Les acides carboxyliques possèdent un groupe caractéristique carboxyle. O II – C – OH

Le groupe carboxyle L’acide acétique (ou acide éthanoïque) L’ibuprofène Formule semidéveloppée : CH 3 -COOH Formule semi-développée : C 12 H 17 -COOH

Quel est le point commun entre les molécules présentées ? Le groupe amino L’isoleucine est un acide aminé ramifié, non polaire et hydrophobe. C’est un acide aminé essentiel chez l’Homme, et doit donc être apporté par l'alimentation. L’aniline, connue également sous les noms de phénylamine ou aminobenzène, est un composé organique aromatique. Son intérêt commercial originel vient de sa capacité à teindre avec un bon rendement. En sus des teintures, l'aniline a été le produit de départ de la synthèse d'un grand nombre de médicaments. C'est une amine primaire aromatique dérivée du benzène, toxique pour l'homme et l'environnement.

Quel est le point commun entre les molécules présentées ? Le groupe halogéno Le sévoflurane est un agent anesthésique volatil de la famille des éthers halogénés utilisé pour l'induction et l'entretien des anesthésies générales. Sa bonne tolérance clinique et son comportement pharmacologique permettant un réveil rapide l'ont fait progressivement préférer, avec le desflurane, aux molécules plus anciennes (halothane, enflurane et isoflurane) dans les pays occidentaux. Le dichlorométhane ou chlorure de méthylène (dénommé R 30 dans la liste des gaz fluorés et frigorigènes), est un composé chimique se présentant à température ambiante comme un liquide incolore et volatil émettant une odeur douceâtre relativement forte pouvant mettre certaines personnes mal à l'aise. Il est surtout utilisé comme solvant de composés organiques

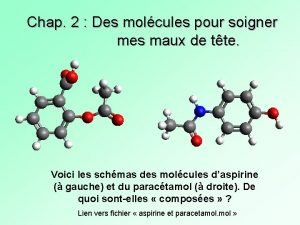
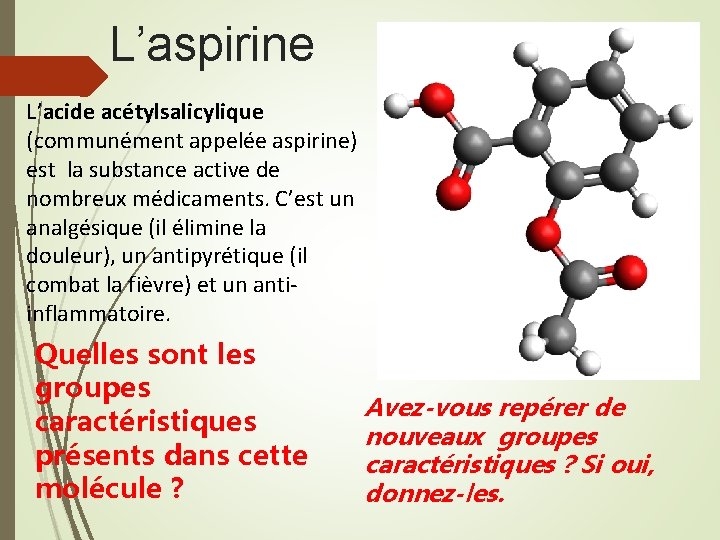
L’aspirine L’acide acétylsalicylique (communément appelée aspirine) est la substance active de nombreux médicaments. C’est un analgésique (il élimine la douleur), un antipyrétique (il combat la fièvre) et un antiinflammatoire. Quelles sont les groupes caractéristiques présents dans cette molécule ? Avez-vous repérer de nouveaux groupes caractéristiques ? Si oui, donnez-les.

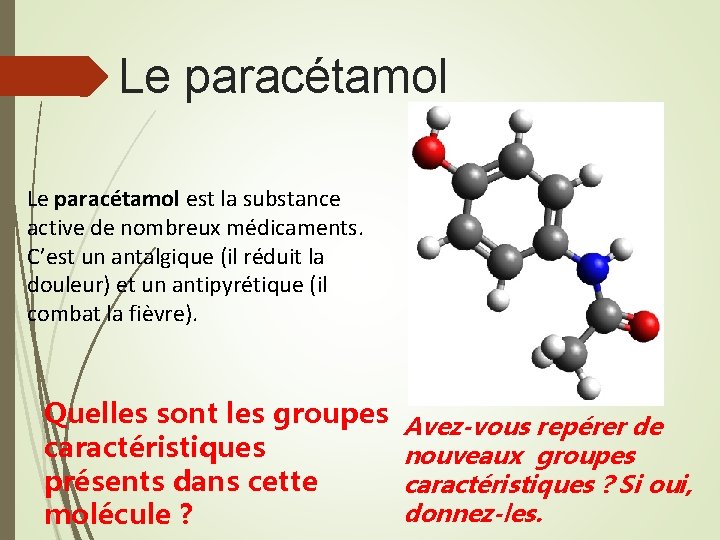
Le paracétamol est la substance active de nombreux médicaments. C’est un antalgique (il réduit la douleur) et un antipyrétique (il combat la fièvre). Quelles sont les groupes Avez-vous repérer de caractéristiques nouveaux groupes présents dans cette caractéristiques ? Si oui, donnez-les. molécule ?

La Glycine (acide aminé neutre) La glycine, jadis appelée glycocolle ou acide aminoacétique, est un acide α-aminé neutre. C'est le plus simple des acides aminés (le plus petit). La molécule de glycine joue un rôle de neurotransmetteur inhibiteur au niveau de la moelle épinière. Quelles sont les groupes Avez-vous repérer de caractéristiques nouveaux groupes présents dans cette caractéristiques ? Si oui, donnez-les. molécule ?

L’eugénol est une molécule extraite du clou de girofle connue pour ses effets antalgiques, antiinflammatoires et antibactériens. Elle est en particulier utilisée contre les douleurs dentaires et les gingivites. Quelles sont les groupes caractéristiques présents dans cette molécule ? Avez-vous repérer de nouveaux groupes caractéristiques ? Si oui, donnez-les.
 Les groupes grammaticaux
Les groupes grammaticaux Les groupes caractéristiques
Les groupes caractéristiques Les groupes de boissons
Les groupes de boissons Les six groupes d'aliments
Les six groupes d'aliments Les groupes d'aliments tableau
Les groupes d'aliments tableau Groupe nominal exemple
Groupe nominal exemple 6 groupes d'aliments
6 groupes d'aliments Escola les roquetes
Escola les roquetes Viewgrade 5 sch
Viewgrade 5 sch Carte de groupe stratégique
Carte de groupe stratégique Groupe ponctuel de symétrie exercices
Groupe ponctuel de symétrie exercices Compatibilité des groupes sanguins
Compatibilité des groupes sanguins Les 32 classes de symétrie
Les 32 classes de symétrie Représentation des 230 groupes d'espace
Représentation des 230 groupes d'espace Noeud reseau
Noeud reseau Escala de taussig
Escala de taussig Escoles publiques sant cugat
Escoles publiques sant cugat Collegio santantonio busnago
Collegio santantonio busnago Poesia cicognani
Poesia cicognani Information about varahamihira
Information about varahamihira