SAUERSTOFF SAUERSTOFF Geschichte Vorkommen Eigenschaften Bedeutung Bau Struktur


SAUERSTOFF

SAUERSTOFF Geschichte Vorkommen Eigenschaften Bedeutung Bau (Struktur) und Formel Gewinnung, Darstellung und Nachweis

GESCHICHTLICHES Entdeckung des Sauerstoffs 1774 durch Joseph Priestley (1733– 1804) Antoine Laurent de Lavoisier (1743– 1794) entdeckt 1774, dass bei Verbrennungen eine Reaktion mit Sauerstoff stattfindet SAUERSTOFF

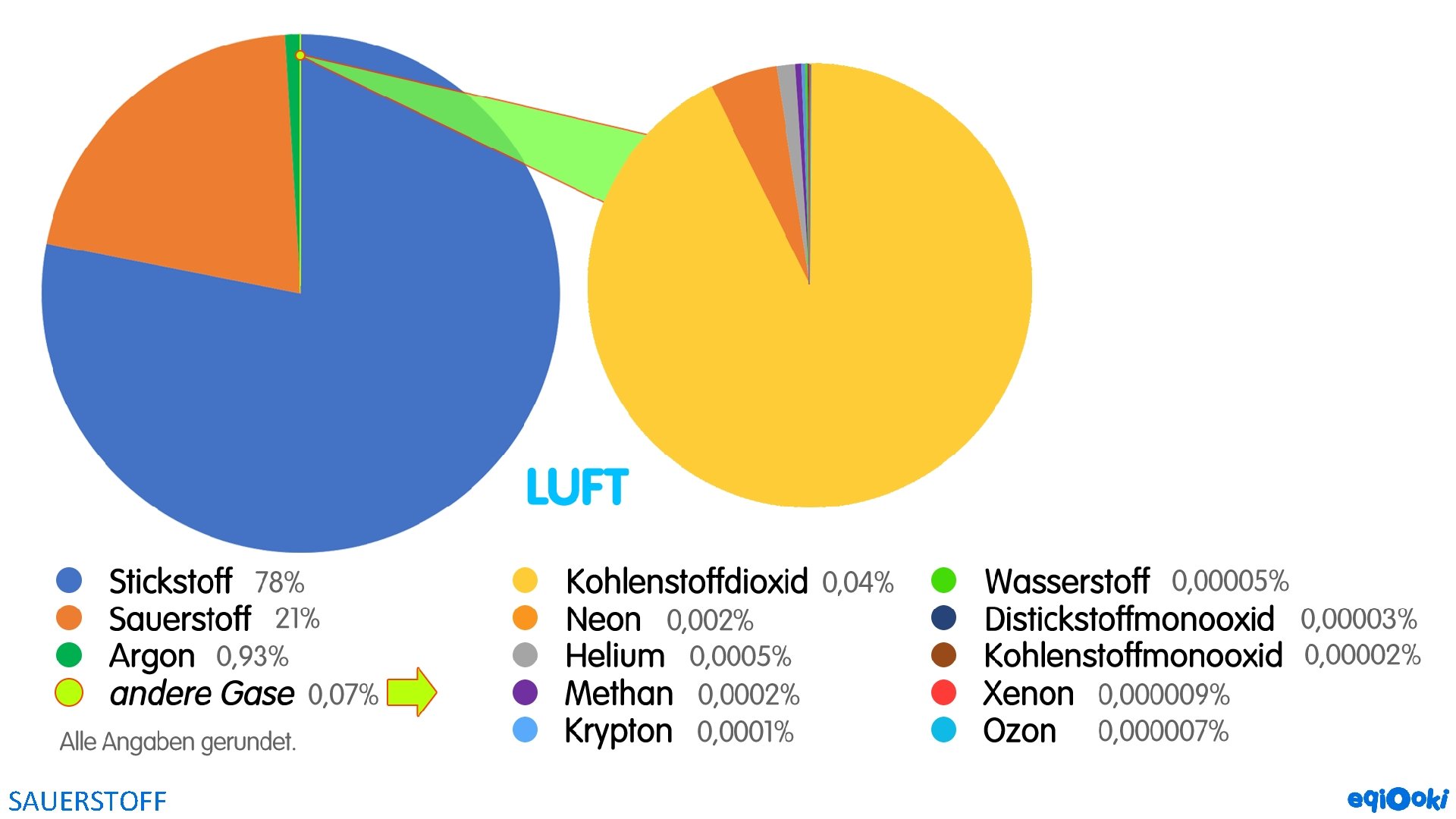
VORKOMMEN als Elementsubstanz in der Luft (ca. 20%) und gelöst in Wasser in Verbindung als Element in allen Oxiden, z. B. Sand, Wasser oder Eisenerzen SAUERSTOFF
SAUERSTOFF

EIGENSCHAFTEN farbloses, geruchloses Gas größere Dichte als Luft (r ≈ 1, 43 g/L; Luftdichte beträgt nur r ≈ 1, 28 g/L) fördert die Verbrennung (unterhält Flammen, brandfördernd) wenig wasserlöslich SAUERSTOFF

BEDEUTUNG Fotosyntheseprodukt Ausgangsstoff der Zellatmung (Energiegewinnung in Lebewesen) für alle Verbrennungen (Oxidationen) erforderlich SAUERSTOFF
![BAU besteht aus 2 -atomigen Molekülen [Molekülsubstanz] Moleküle bestehen stets jeweils aus 2 Sauerstoffatomen, BAU besteht aus 2 -atomigen Molekülen [Molekülsubstanz] Moleküle bestehen stets jeweils aus 2 Sauerstoffatomen,](http://slidetodoc.com/presentation_image_h2/813db3932f2507b0dbbd3adf2a468982/image-9.jpg)
BAU besteht aus 2 -atomigen Molekülen [Molekülsubstanz] Moleküle bestehen stets jeweils aus 2 Sauerstoffatomen, also desselben Elements [Elementsubstanz] große Anziehungskräfte im Molekül, geringe Anziehung zwischen Molekülen SAUERSTOFF

BAU Molekül → Teilchen, bestehend aus begrenzter Anzahl von Atomen, die durch starke Anziehungskräfte (Elektronenpaarbindungen) zusammengehalten werden SAUERSTOFF
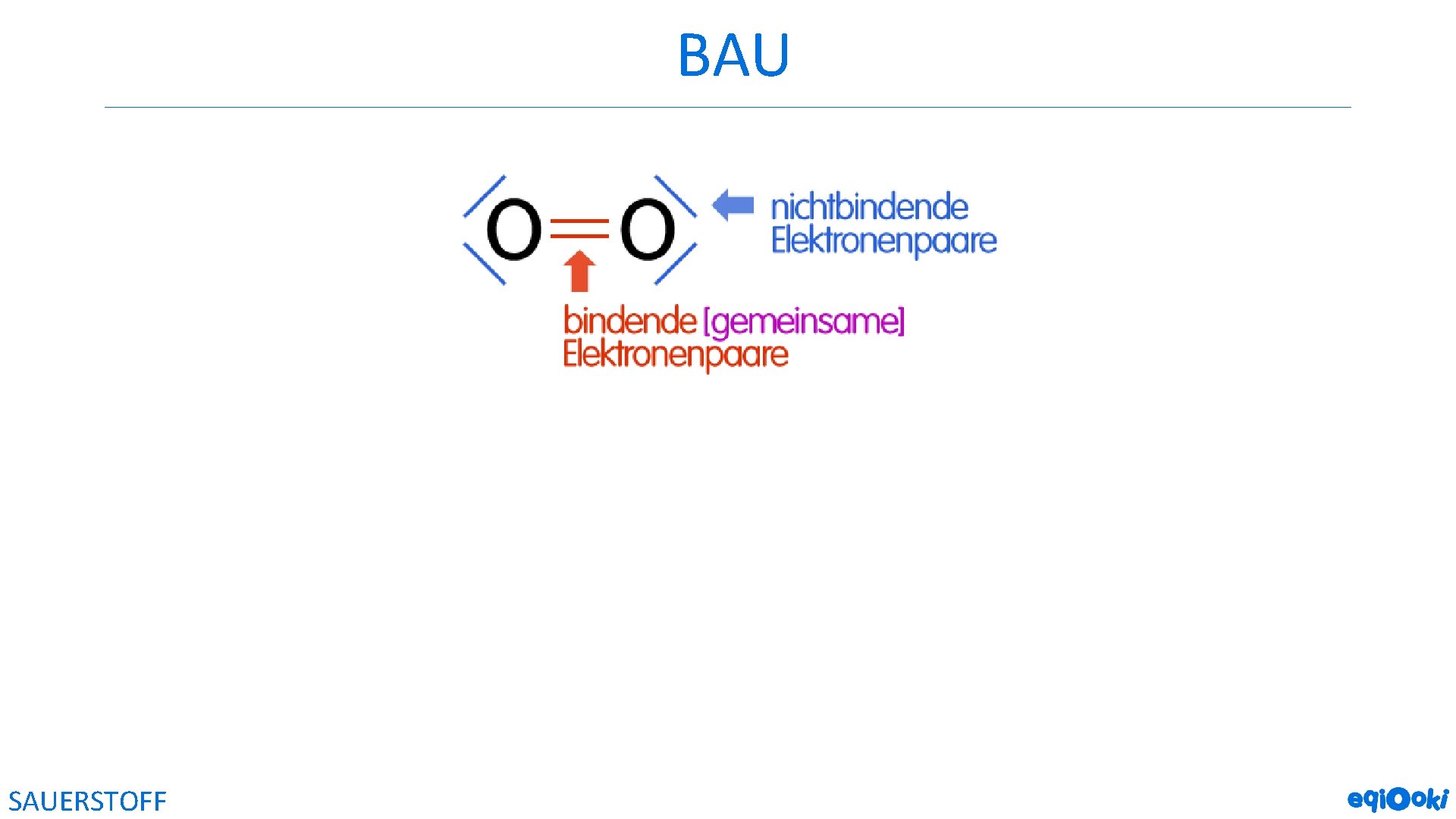
![BAU chemische Bindung im Sauerstoffmolekül: Doppelbindung (Atombindung [Elektronenpaarbindung], die aus 2 gemeinsamen Elektronenpaaren besteht] BAU chemische Bindung im Sauerstoffmolekül: Doppelbindung (Atombindung [Elektronenpaarbindung], die aus 2 gemeinsamen Elektronenpaaren besteht]](http://slidetodoc.com/presentation_image_h2/813db3932f2507b0dbbd3adf2a468982/image-11.jpg)
BAU chemische Bindung im Sauerstoffmolekül: Doppelbindung (Atombindung [Elektronenpaarbindung], die aus 2 gemeinsamen Elektronenpaaren besteht] LEWIS-Formel: SAUERSTOFF
BAU SAUERSTOFF

FORMEL O 2 Zeichen für ein Sauerstoffmolekül, bestehend aus 2 Sauerstoffatomen, sowie für den Stoff Sauerstoff Formel → zusammengesetztes chemisches Zeichen aus Symbolen und Ziffern, die Teilchenanzahlen oder -verhältnisse kennzeichnen SAUERSTOFF

AUFBEWAHRUNG Stahlflaschen (Druckgasbehälter mit blauem Ring) SAUERSTOFF

TECHNISCHE GEWINNUNG Luftverflüssigung (Druck, tiefe Temperaturen) anschließend Abdestillieren des Sauerstoffs bei – 183°C (Stickstoff bei – 196°C, Helium bei – 269°C) SAUERSTOFF

DARSTELLUNG IM LABOR Variante 1 Darstellung aus verschiedenen sauerstoffhaltigen Stoffen durch Erhitzen • z. B. Erhitzen von Kaliumpermanganat KMn. O 4 • z. B. Erhitzen von Kaliumnitrat (Salpeter) KNO 3 mehr dazu später SAUERSTOFF

DARSTELLUNG IM LABOR Variante 2 Darstellung aus Wasserstoffperoxid (H 2 O 2) mit Hilfe eines Katalysators bei Zugabe von Braunstein (Manganoxid Mn. O 2) zu Wasserstoffperoxidlösung zerfällt H 2 O 2 rasch: Wasserstoffperoxid → Wasser + Sauerstoff 2 H 2 O 2 → 2 H 2 O + O 2 (exotherm) SAUERSTOFF

DARSTELLUNG IM LABOR Variante 2 Darstellung aus Wasserstoffperoxid (H 2 O 2) mit Hilfe eines Katalysators Vorsicht! Wasserstoffperoxid ist stark ätzend Wasserstoffperoxid zerfällt langsam auch bei Lichteinwirkung (also dunkel aufbewahren) SAUERSTOFF
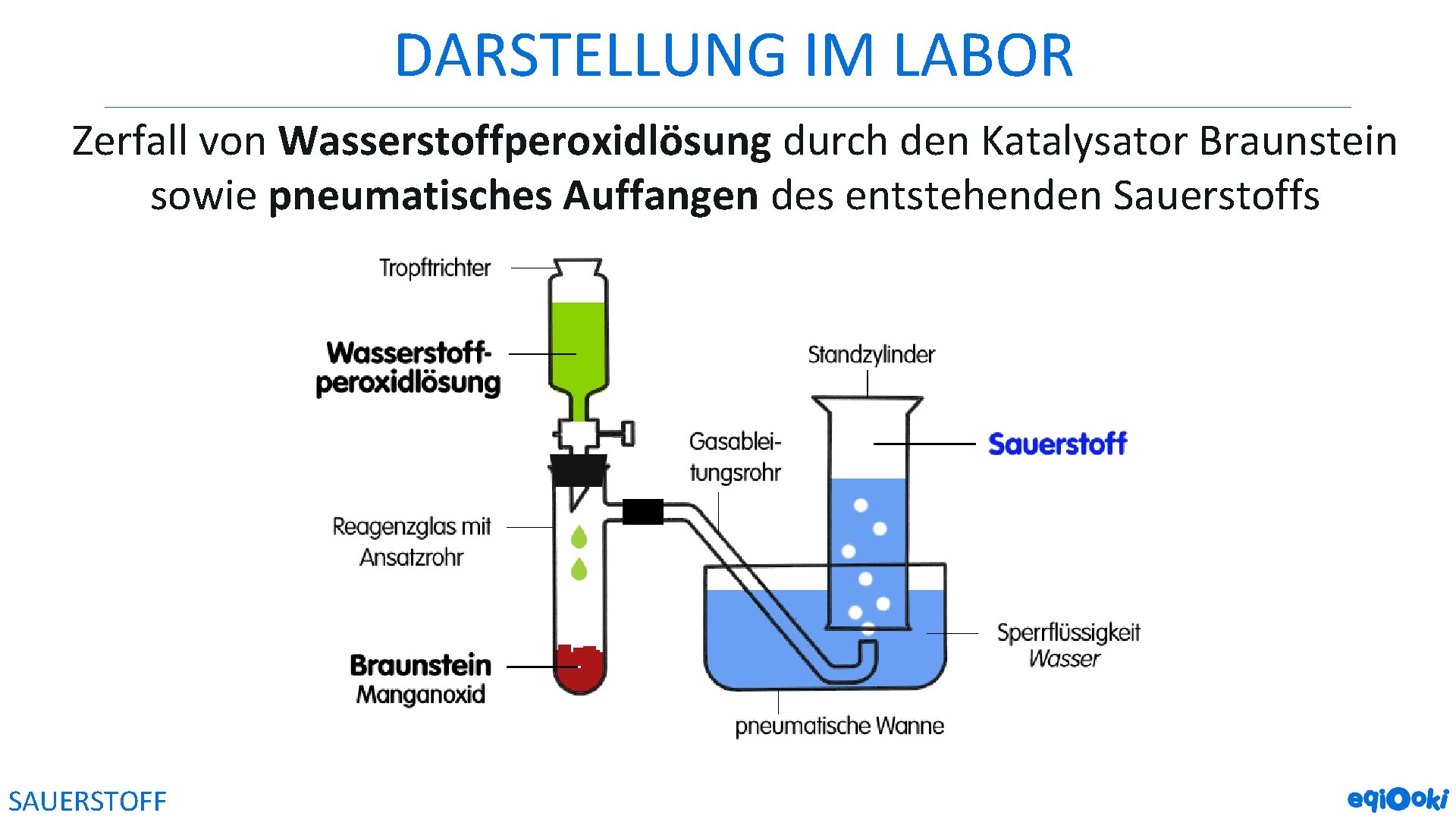
DARSTELLUNG IM LABOR Zerfall von Wasserstoffperoxidlösung durch den Katalysator Braunstein sowie pneumatisches Auffangen des entstehenden Sauerstoffs SAUERSTOFF

NACHWEIS Glimmspanprobe (glimmender Holzspan flammt auf) SAUERSTOFF
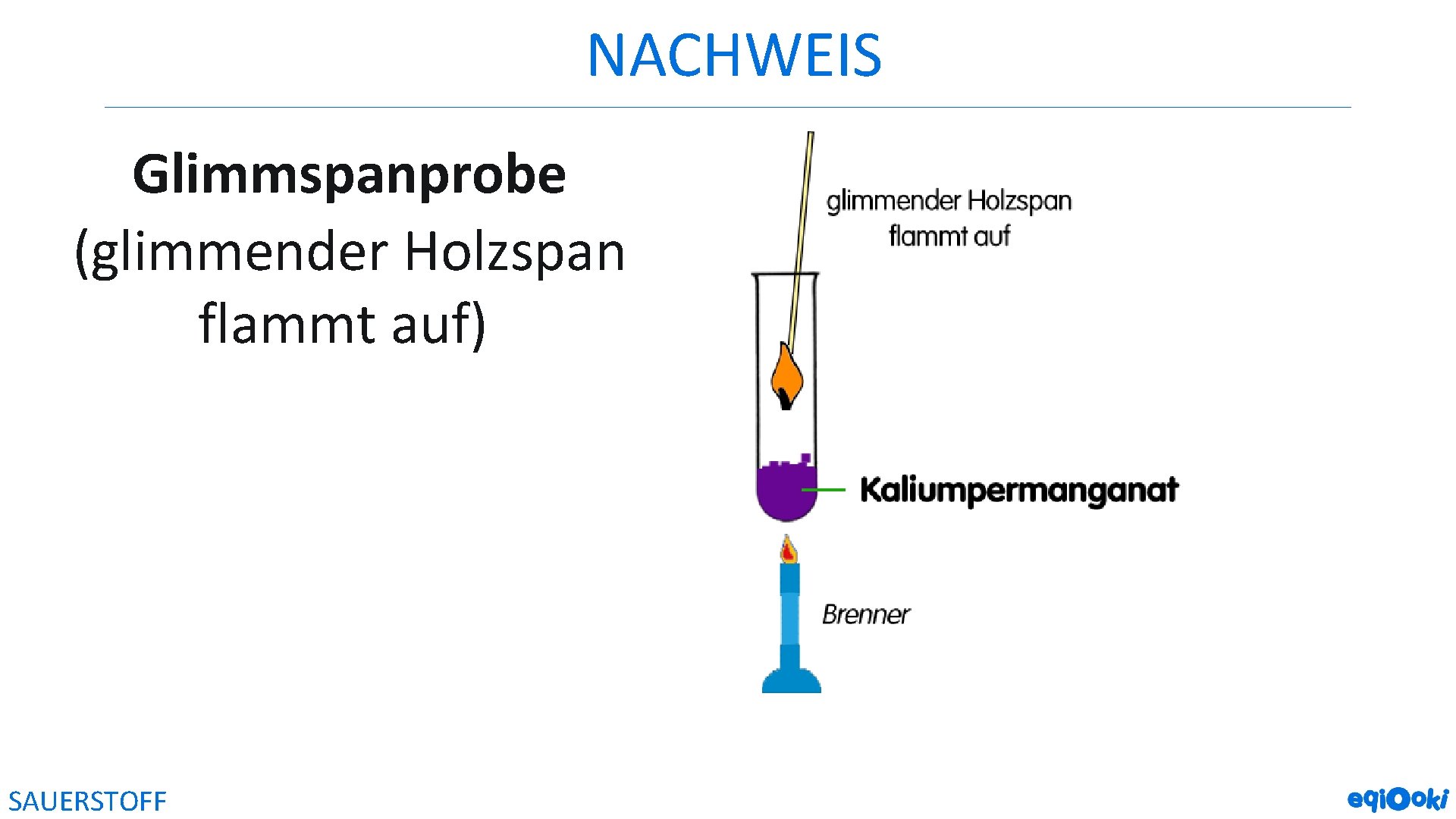
NACHWEIS Glimmspanprobe (glimmender Holzspan flammt auf) SAUERSTOFF
- Slides: 21