Sadraj predavanja struktura molekula vode H 2 O











- Slides: 14


Sadržaj predavanja • struktura molekula vode, H 2 O polarnost molekula vode, H 2 O • vodonične veze • površinski napon vode-kohezione sile • površinski napon vode-adhezija • posebne karakteristike vode odgovorne za održanje života • voda utiče na postepenu promenu temperature rasprostranjenost vode na zemlji biološki značaj fenomena plutanja leda voda kao univerzalni rastvarač

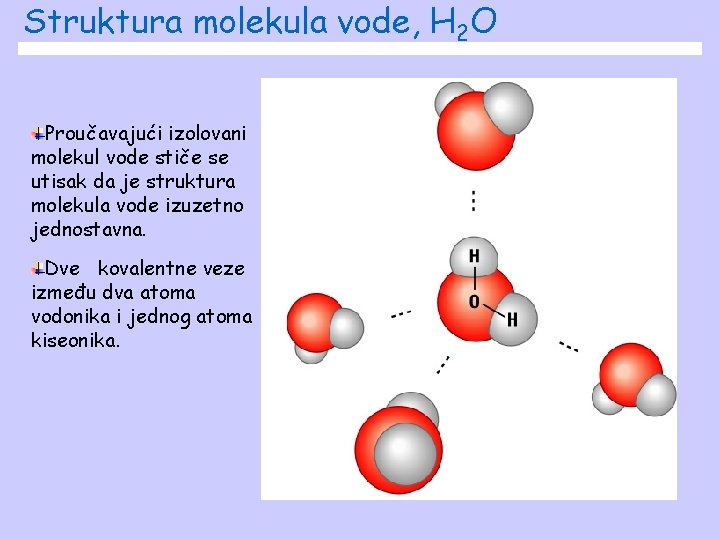
Struktura molekula vode, H 2 O Proučavajući izolovani molekul vode stiče se utisak da je struktura molekula vode izuzetno jednostavna. Dve kovalentne veze između dva atoma vodonika i jednog atoma kiseonika.

Polarnost molekula vode, H 2 O Elektroni u kovalentnoj vezi molekula vode nisu na jednakoj udaljenosti od atoma kiseonika i vodonika! Nejednaka udaljenost, odnosno podela elektronskog para je uzrok polarnosti molekula vode. ( ) ( ) Elektronegativnost –pojam na osnovu koga se opisuje jačina nukleusa (jezgra) da privlači elektrone. Kiseonik spada u veoma elektronegativne elemente.

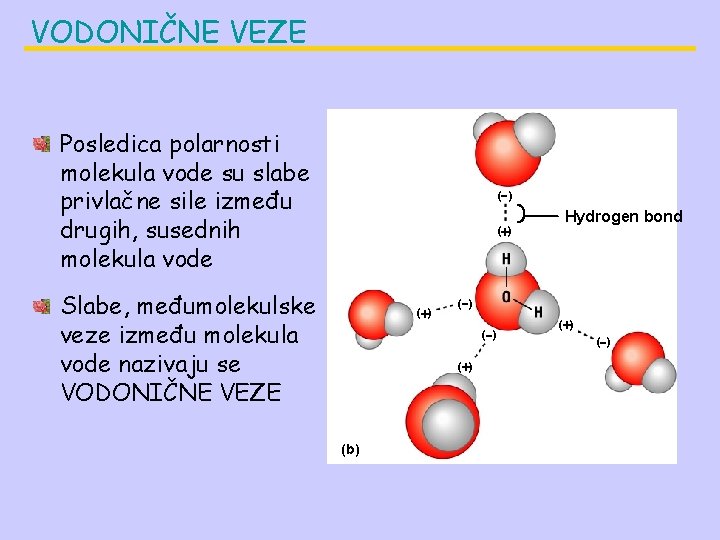
VODONIČNE VEZE Posledica polarnosti molekula vode su slabe privlačne sile između drugih, susednih molekula vode ( ) Slabe, međumolekulske veze između molekula vode nazivaju se VODONIČNE VEZE ( ) ( ) (b) Hydrogen bond ( )

Posebne karakteristike vode –odgovorne za održanje života Izuzetan značaj vode, jedninjenja koje je važno za održanje živog sveta na Zemlji posledica je izuzetnih svojstava molekula vode kao što su: polarnosti molekula vode i prisustvo vodoničnih veza Osnovne posledice koje vodu čine tako značajnom su: – Kapilarna svojstva vode, – Sposobnost vode da ublažava temperaturne promene (znatno veći toplotni kapacitet od drugih materijala), – Neuobičajena zavisnost gustine od temperature (najveća gustina na 4 °C, led ima znatno manju gustinu od vode u tečnom stanju “plutajuća svojstva”), – Voda kao univerzalni rastvarač.

Površinski napon vode-kohezione sile • Molekuli vode “drže” se na okupu zbog vodoničnih veza. • Kohezija je posledica umrežavanja molekula vode i održavanja zbog vodoničnih veza. • Kapilarnost je posledica kohezionih i adhezionih sila, i sila površinskog napona koje su “odgovorne” za transport vode u biljkama. Mikroskopske cevčice

Površinski napon vode-adhezija Površinski napon je mera jačine, odnosno izdržljivosti površine tečnosti na istezanje, odnosno pucanje. Vodonične veze su odgovorne za izuzetno visoku vrednost površinskog napona vode! Adhezione sile su “odgovorne” za odmor i predah ovog insekta!

Voda utiče na postepenu promenu temperature Isparavanjem (razmenom toplote sa okolinom) se uklanja toplota sa Zemlje i organizama. Kako voda utiče na postepenu promenu temperature? Zbog prisustva vodoničnih veza, voda pruža veliki otpor temperaturnoj promeni!

Rasprostranjenost vode na Zemljino veliko vodeno bogatstvo utiče na temperature, koje su u opsegu koji odgovara živom svetu za opstanak.

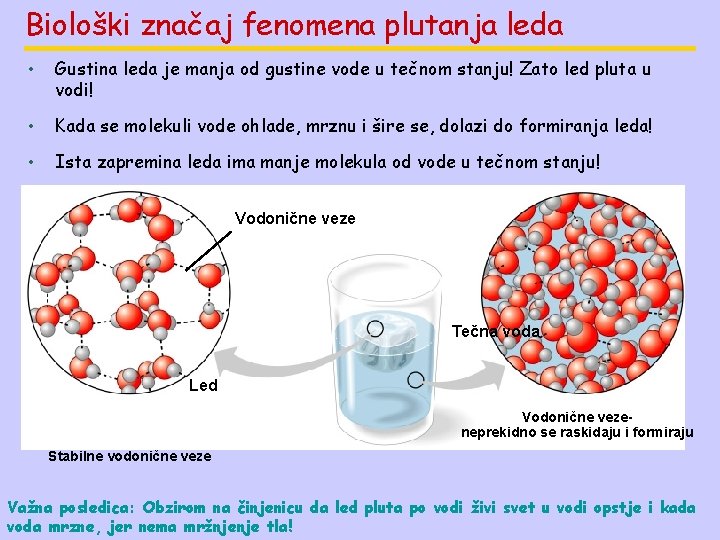
Biološki značaj fenomena plutanja leda • Gustina leda je manja od gustine vode u tečnom stanju! Zato led pluta u vodi! • Kada se molekuli vode ohlade, mrznu i šire se, dolazi do formiranja leda! • Ista zapremina leda ima manje molekula od vode u tečnom stanju! Vodonične veze Tečna voda Led Vodonične vezeneprekidno se raskidaju i formiraju Stabilne vodonične veze Važna posledica: Obzirom na činjenicu da led pluta po vodi živi svet u vodi opstje i kada voda mrzne, jer nema mržnjenje tla!

Voda kao univerzalni rastvarač Rastvor predstavlja tečnost koja se sastoji od dve ili više supstanci koje su uniformno pomešane! Vodu nazivamo univerzalnim rastvaračom jer rastvara najviše supstanci od svih poznatih tečnosti!!! Jon u rastvoru Kristali soli Kada je voda rastvarač, takav rastvor se zove vodeni!

VODA I ŽIVOT Život na Zemlji počeo je u vodi i evoluirao je 3 biliona godina. Današnja, savremena civilizacija i dalje zavisi od vode Ćelije u ljudskom organizmu sadrže od 70– 95 % vode

Na kojoj slici je prikazan led, a na kojoj voda, u tečnom stanju?