ROZPUSZCZANIE OSADU X Y M AH L A





- Slides: 14

ROZPUSZCZANIE OSADU X+ ; Y - M+ ; AH+ L- (A-; OH-) STRĄCANIE OSADU MA M+ + A - K S, s jony obce jony wspólne protonowanie Akompleksowanie M+ M+ + A- MA • czy się strąci? przy jakim stężeniu? • w jakiej „kolejności” (gdy kilka osadów) • „całkowitość strącenia” • osad 1 osad 2 IS > KS

PODSTAWY CHEMII ANALITYCZNEJ wykład 9 równowagi utleniania-redukcji (cz. 1) 2

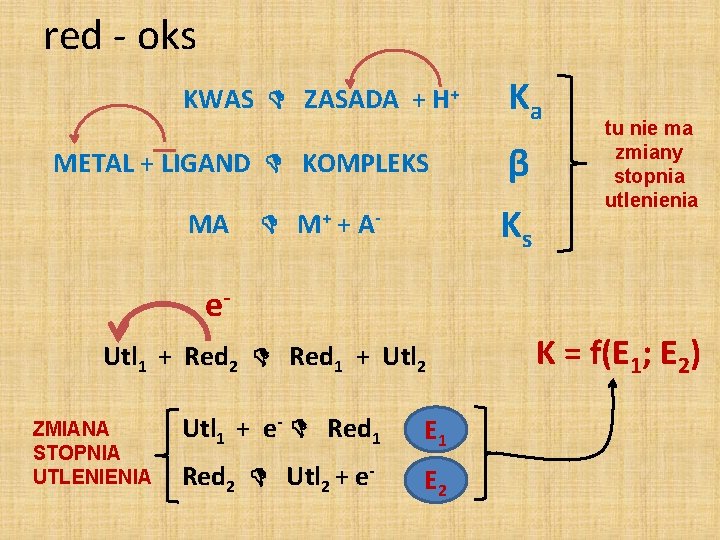
red - oks KWAS ZASADA + H+ METAL + LIGAND KOMPLEKS MA Ka β Ks M+ + A - tu nie ma zmiany stopnia utlenienia e. Utl 1 + Red 2 Red 1 + Utl 2 ZMIANA STOPNIA UTLENIENIA Utl 1 + e- Red 1 E 1 Red 2 Utl 2 + e- E 2 K = f(E 1; E 2)

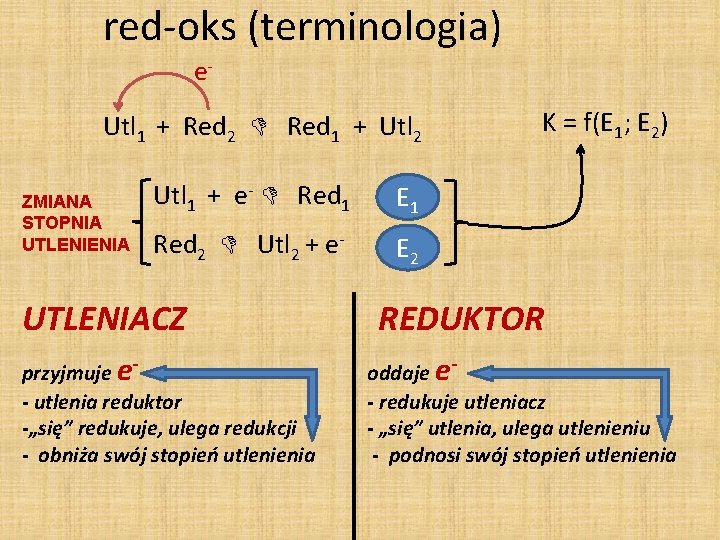
red-oks (terminologia) e. Utl 1 + Red 2 Red 1 + Utl 2 ZMIANA STOPNIA UTLENIENIA Utl 1 + e- Red 1 E 1 Red 2 Utl 2 + e- E 2 UTLENIACZ przyjmuje e- utlenia reduktor -„się” redukuje, ulega redukcji - obniża swój stopień utlenienia K = f(E 1; E 2) REDUKTOR oddaje e- redukuje utleniacz - „się” utlenia, ulega utlenieniu - podnosi swój stopień utlenienia

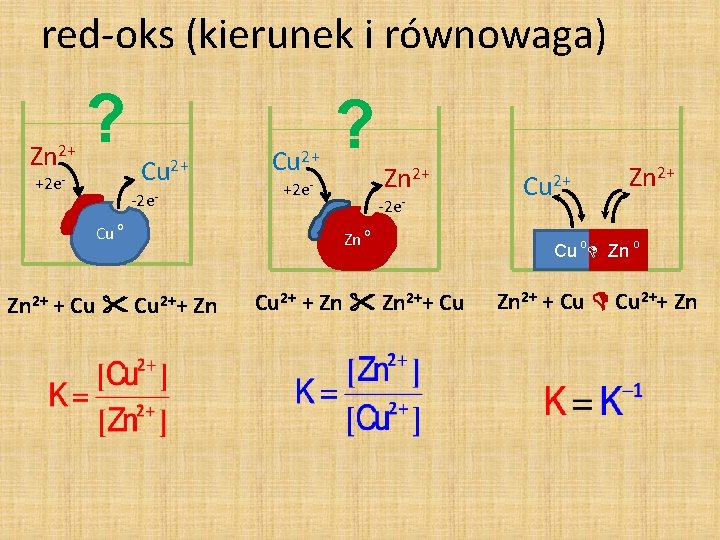
red-oks (kierunek i równowaga) Zn 2+ ? +2 e- Cu 2+ -2 e- Cu 2+ ? +2 e- Zn 2+ -2 e- Cu o Zn 2+ + Cu 2++ Zn Cu 2+ + Zn 2++ Cu Cu 2+ Zn 2+ Cu o Zn 2+ + Cu 2++ Zn

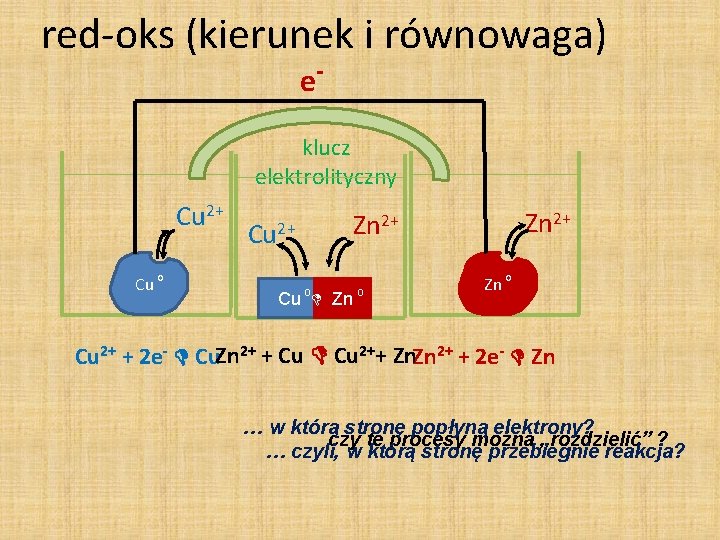
red-oks (kierunek i równowaga) e- klucz elektrolityczny Cu 2+ Cu o Cu 2+ Zn 2+ Cu o Zn o Cu 2+ + 2 e- Cu. Zn 2+ + Cu 2++ Zn. Zn 2+ + 2 e- Zn … w którą stronę popłyną elektrony? czy te procesy można „rozdzielić” ? … czyli, w którą stronę przebiegnie reakcja?

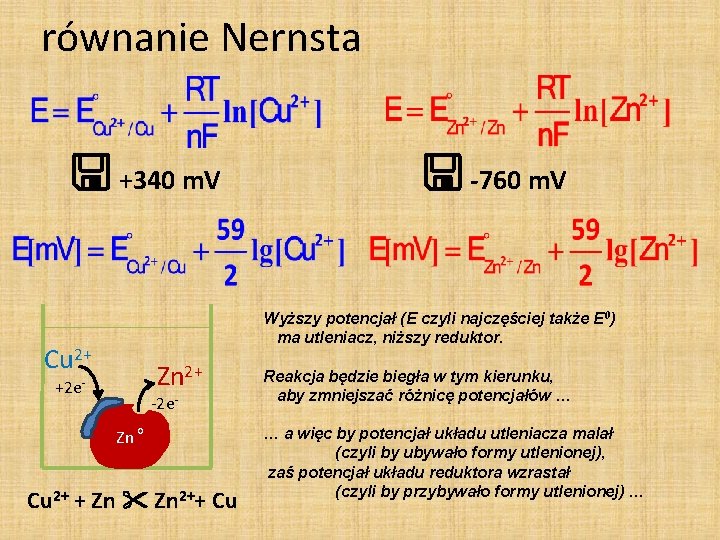
równanie Nernsta +340 m. V -760 m. V Wyższy potencjał (E czyli najczęściej także E 0) ma utleniacz, niższy reduktor. Cu 2+ Zn 2+ +2 e- -2 e. Zn o Cu 2+ + Zn 2++ Cu Reakcja będzie biegła w tym kierunku, aby zmniejszać różnicę potencjałów … … a więc by potencjał układu utleniacza malał (czyli by ubywało formy utlenionej), zaś potencjał układu reduktora wzrastał (czyli by przybywało formy utlenionej) …

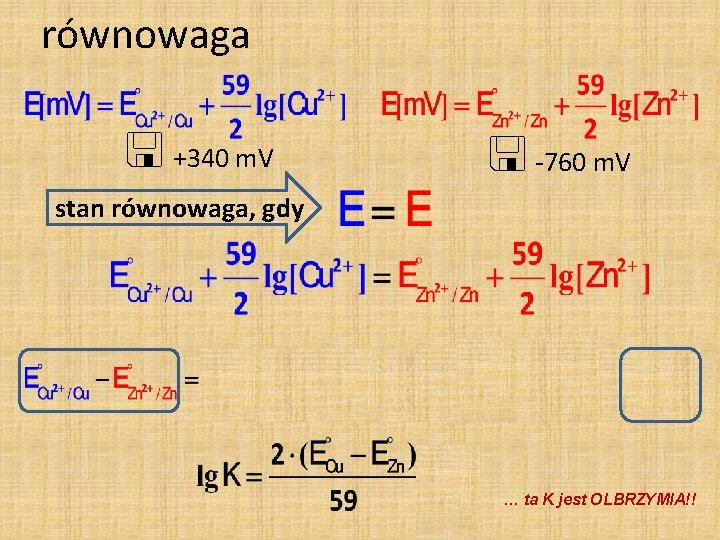
równowaga +340 m. V -760 m. V stan równowaga, gdy … ta K jest OLBRZYMIA!!

…. Gdy płynie prąd zachodzi reakcja !! Kierunek reakcji jest taki, aby ZMNIEJSZYĆ E (rozładowanie ogniwa) czyli, aby potencjał układu utleniacza malał, zaś potencjał układu reduktora wzrastał „naczynia aż do zrównania (czyli do stanu równowagi) połączone” Zrównanie potencjałów (E) … a nie E ! (E - to stała, nie zmienia się) definicja „operacyjna” potencjału standardowego (E 0): E 0 - potencjał półogniwa (E), gdy aktywności są jednostkowe …czyli, potencjał blaszki miedzianej zanurzonej w ~1 M roztworze Cu. SO 4 będzie wynosił +340 m. V - taki jest potencjał standardowy układu red-oks: Cu/Cu 2+

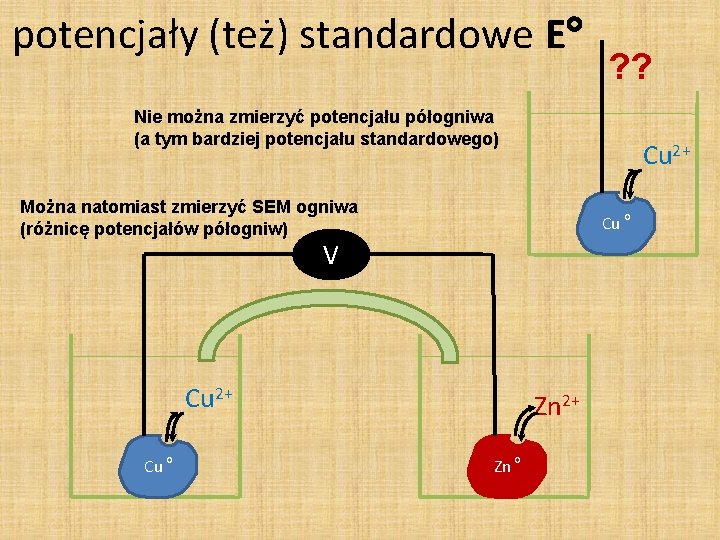
potencjały (też) standardowe E ? ? Nie można zmierzyć potencjału półogniwa (a tym bardziej potencjału standardowego) Cu 2+ Można natomiast zmierzyć SEM ogniwa (różnicę potencjałów półogniw) Cu o V Cu 2+ Cu o Zn 2+ Zn o

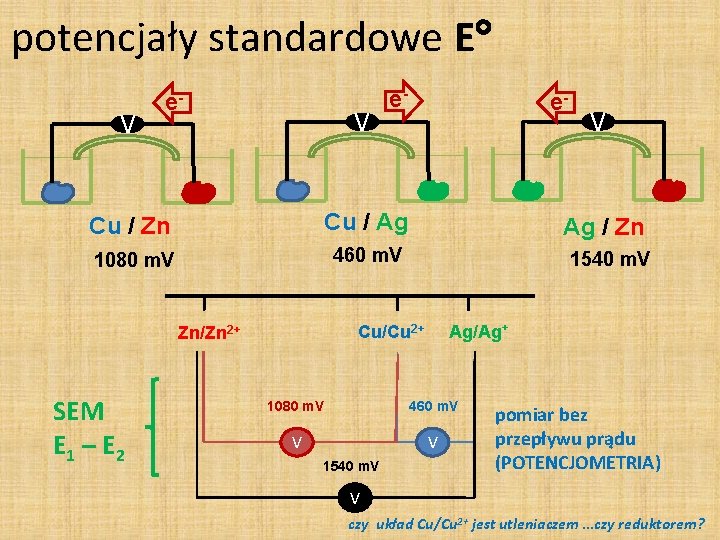
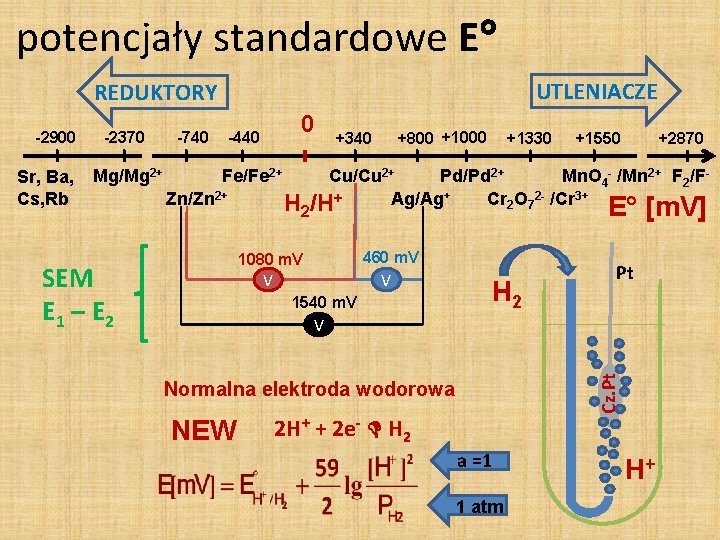
potencjały standardowe E V e- Cu / Zn Cu / Ag 1080 m. V 460 m. V 1540 m. V Ag/Ag+ 1080 m. V 460 m. V V V 1540 m. V V Ag / Zn Cu/Cu 2+ Zn/Zn 2+ SEM E 1 – E 2 e- pomiar bez przepływu prądu (POTENCJOMETRIA) V czy układ Cu/Cu 2+ jest utleniaczem …czy reduktorem?

potencjały standardowe E UTLENIACZE REDUKTORY Sr, Ba, Cs, Rb -2370 Mg/Mg 2+ -740 0 -440 Fe/Fe 2+ Zn/Zn 2+ SEM E 1 – E 2 H 2 +800 +1000 +340 +1330 +1550 +2870 Cu/Cu 2+ Pd/Pd 2+ Mn. O 4 - /Mn 2+ F 2/FAg/Ag+ Cr 2 O 72 - /Cr 3+ /H+ E [m. V] 1080 m. V 460 m. V V V H 2 1540 m. V Pt V Cz. Pt -2900 Normalna elektroda wodorowa NEW 2 H+ + 2 e- H 2 a =1 1 atm H+

równanie Nernsta „za logarytmem” jest wyrażenie na stałą równowagi połówkowej reakcji red-oks (w kierunku utleniania) w tym „wyrażeniu na stałą” występują wszystkie indywidua (a nie tylko te, które zmieniają stopień utlenienia), … a więc także jony wodorowe i inne biorące udział w reakcji!

równanie Nernsta Fe 3+ + e- Fe 2+ I 2 + 2 e- 2 ICr 2 O 72 - + 14 H+ +6 e- 2 Cr 3+ + 7 H 2 O
