Revolusjon med trang fdsel gjre individualisert medisin til
















- Slides: 26

Revolusjon med trang fødsel - å gjøre individualisert medisin til en realitet dr. med. Hallvard Lærum, Stab IKT Presentasjon for AMG 5. sept 2012

Bakgrunn • Det er nå praktisk og økonomisk mulig å sekvensere alle genene hos en pasient ved hjelp av High Throughput Sequencing (HTS)-teknikker. • Funnene fra slike undersøkelser danner grunnlag for såkalt individualisert medisin, og har konsekvenser for alt fra valg av behandling til hvilken risiko pasienten har for å bli syk. • Få leger har tilstrekkelig kunnskap om disse omfattende funnene, og vi tror det er lite sannsynlig at helsepersonell vil kunne tilegne seg kunnskapen på egen hånd. • Teknikken skaper en rekke tekniske, medisinske, etiske og juridiske utfordringer.

gen. AP • Tverrfaglig forskningsprosjekt støttet av Norges forskningsråd i VERDIKT-prosjektet • Samarbeid mellom OUS og Ui. O – – Avd. for medisinsk genetikk OUS Stab IKT OUS Avd. for farmakologi OUS Nyremedisinsk og transplantasjonskirurgisk seksjon ved Kreft, kirurgi og transplantasjonsklinikken OUS – – Norwegian Sequencing Center Inst. for informatikk Ui. O USIT Juridisk fakultet Ui. O

Mål for gen. AP-prosjektet • Utforme plattform for å lagre og tilgjengeliggjøre data fra sekvensering av hele pasientens arvemateriale – Automatisering av analyseprosess fra rådata til genetiske funn • Sørge for sikker lagring og tilgangsstyring etter gjeldende lover og forskrifter – Støtte sikker formidling av genomdata nasjonalt – Gi innspill til endring av bioteknologiloven ut fra kliniske behov demonstrert av plattformen • Støtte bruk av genetiske data i klinisk praksis ved å formidle tolkninger av dem – Prøve ut og tilpasse internasjonale innholdsstandarder for genetiske rapporter for integrasjon i elektronisk pasientjournal. – Utvikle algoritmer for tolkning av genetiske funn innen diagnostikk og prognose, behandlingsanbefalinger (farmakogenomikk) og prediktive tester (risiko for sykdom)

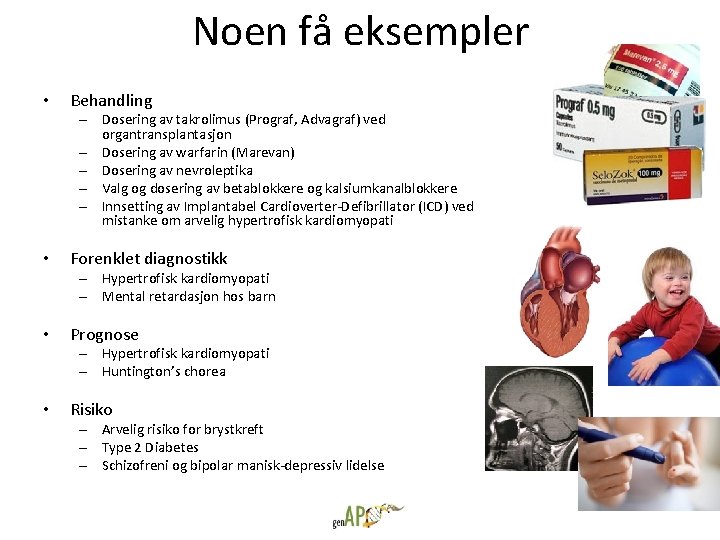
Noen få eksempler • Behandling – Dosering av takrolimus (Prograf, Advagraf) ved organtransplantasjon – Dosering av warfarin (Marevan) – Dosering av nevroleptika – Valg og dosering av betablokkere og kalsiumkanalblokkere – Innsetting av Implantabel Cardioverter-Defibrillator (ICD) ved mistanke om arvelig hypertrofisk kardiomyopati • Forenklet diagnostikk – Hypertrofisk kardiomyopati – Mental retardasjon hos barn • Prognose – Hypertrofisk kardiomyopati – Huntington’s chorea • Risiko – Arvelig risiko for brystkreft – Type 2 Diabetes – Schizofreni og bipolar manisk-depressiv lidelse

Marevan (Warfarin) • Farlig legemiddel – 21 pasienter døde på grunn av Marevan i Norge i 2011 (blødning). 88000 fikk resept på medikamentet i 2011. • Genetisk styrt behandling gir riktigere dosering (1) – NEJM 2009: Bedre tilpasset dosering ved bruk av genetiske data enn kliniske algoritmer eller fast dosering. • Aktuelle genvarianter – CYP 2 C 9: Variantprevalensen for *2 og *3 er hhv. 10% og 6% hos hvite (kaukasiere) • • • *1: normal warfarindosering *2: 30% reduksjon av metabolisme *3: 90% reduksjon av metabolisme – VKORC 1: ”A”- allel gir lavere produksjon av VKORC 1 enn ”G”-allel, og dermed mindre behov for warfarin. 37% av hvite har ”A”-allel • • Men: CYP 4 F 2: rs 2108622 -varianten gir lavere CYP 4 F 2 og dermed høyere nivå av vitamin K, dvs. større behov for warfarin. Tør vi gi marevan til pasienter med kombinasjonen CYP 2 C 9*3 og VCORC 1 -A ? – Skal ha dramatisk redusert dosering (under 10%) • Tør vi behandle pasienter med marevan uten å vite dette? (1) “Estimation of the Warfarin Dose with Clinical and Pharmacogenetic Data. ” New England Journal of Medicine 360, no. 8 (February 19, 2009): 753– 764.

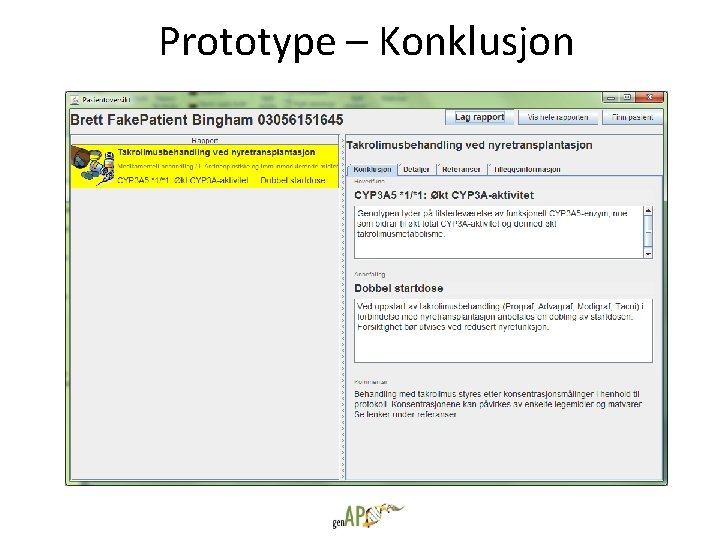
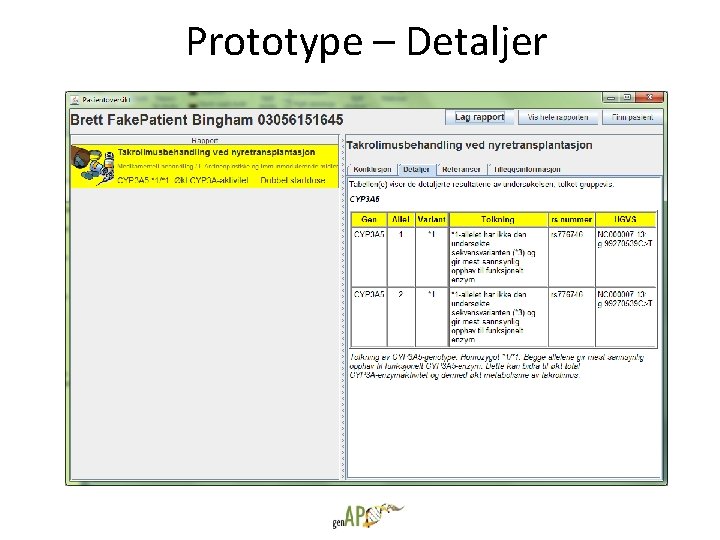
Takrolimus • Legemiddel for organtransplantasjon – Takrolimus er et immunsupprimerende legemiddel som brukes for å unngå frastøtning ved organtransplantasjon. • Store forskjeller i metabolisme ut fra genetiske varianter – Noen mennesker (ca. 15%) har mye høyere metabolisme av takrolimus enn andre, og krever dobbelt så høy dose ved oppstart, dvs. like etter at nyren er transplantert inn. – Flere gener er involvert, men sammenhengen er sterkest for CYP 3 A 5 -genet. *1 varianten (homozygot eller heterozygot) gir CYP 3 A 5 -uttrykk, og dermed økt metabolisme i forhold til den norske normalbefolkningen. • Forskjellen kan bety liv og død – Pasienter som ikke kommer raskt opp i ønsket legemiddelkonsentrasjon har økt risiko for frastøtning. – De som har frastøtning tidlig etter transplantasjonen får hyppigere frastøtning senere, og har dårligere overlevelse. – CYP 3 A 5 vurderes innført som standard undersøkelse i den nasjonale tx-protokollen.

Utfordringer

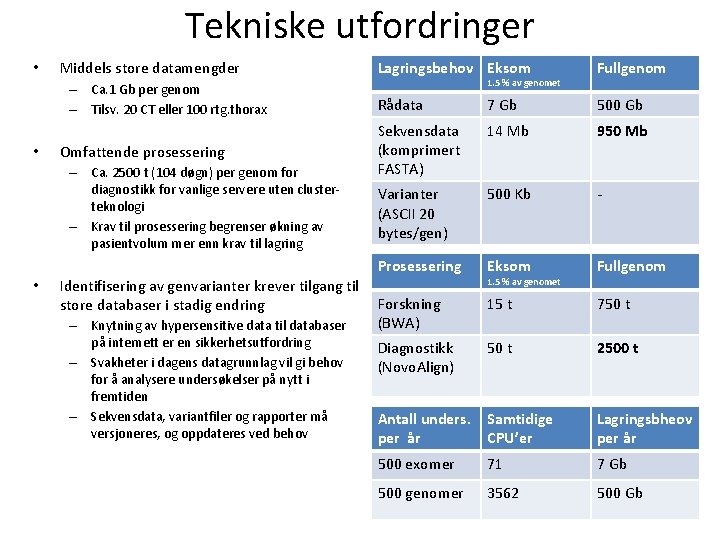
Tekniske utfordringer • Middels store datamengder – Ca. 1 Gb per genom – Tilsv. 20 CT eller 100 rtg. thorax • Omfattende prosessering – Ca. 2500 t (104 døgn) per genom for diagnostikk for vanlige servere uten clusterteknologi – Krav til prosessering begrenser økning av pasientvolum mer enn krav til lagring • Identifisering av genvarianter krever tilgang til store databaser i stadig endring – Knytning av hypersensitive data til databaser på internett er en sikkerhetsutfordring – Svakheter i dagens datagrunnlag vil gi behov for å analysere undersøkelser på nytt i fremtiden – Sekvensdata, variantfiler og rapporter må versjoneres, og oppdateres ved behov Lagringsbehov Eksom Fullgenom Rådata 7 Gb 500 Gb Sekvensdata (komprimert FASTA) 14 Mb 950 Mb Varianter (ASCII 20 bytes/gen) 500 Kb - Prosessering Eksom Fullgenom Forskning (BWA) 15 t 750 t Diagnostikk (Novo. Align) 50 t 2500 t Antall unders. per år Samtidige CPU’er Lagringsbheov per år 500 exomer 71 7 Gb 500 genomer 3562 500 Gb 1. 5 % av genomet

Medisinske utfordringer • Få leger har oppdatert genetisk kunnskap med relevans for sitt fagfelt ut over diagnostikk – Hovedvekten av genetiske undersøkelser fra amerikanske primærleger dreide seg om vordende foreldre med mistanke om å være bærere av sykdomsgener (Ronquillo et al 2012*) • Individualisert medisin betyr at hver pasient må vurderes for seg, selv om de har samme diagnose – Kritisk å få tilgang på kunnskap som er tilpasset hver enkelt pasient – Tolkning av genetiske funn bør automatiseres og formidles dit leger tar beslutninger om utredning og behandling • Tolkning er i økende grad avhengig av pålitelige og oppdaterte grunndata – Vanlig forekommende varianter med sterke effekter er i hovedsak avdekket – Ny kunnskap vil komme fra effekt av sjeldne varianter, eller kombinert effekt av flere varianter – Kvaliteten på offentlig tilgjengelige databaser med genetisk kunnskap er variabel

Etiske utfordringer • Retten til ikke å vite – Ikke alle vil takle en dårlig prognose – Hva gjør vi med utilsiktede funn? • Retten til ikke å diskrimineres – Risiko for å utvikle sykdom kan påvirke forhold til familie, arbeidsgiver, forsikringsselskap og andre – Genomdata sier også noe om dine foreldres gener; hvem de er og hvor du kommer fra • Retten til personvern, og potensiale for overvåkning – Gensekvensene er så variable at selv kortere utdrag kan være unike for deg – Genomdata kan brukes til å identifisere deg og til å se hvor du har vært • Men også: retten til god helsehjelp – Diagnostikk, forebygging og behandling kan forbedres betydelig med genetiske undersøkelser – Det er uetisk å bli utsatt for bivirkninger eller uvirksom behandling hvis det kan unngås

Juridiske utfordringer • Bioteknologiloven kap. 5 – Om prediktive undersøkelser • Alle typer skal godkjennes av helsedepartmentet og bioteknologinemda • Pasienten skal gi skriftlig samtykke til undersøkelsen • Pasienten skal gis genetisk veiledning før, under og etter undersøkelsen – Om genetiske masseundersøkelser og farmakogenetiske undersøkelser • Kan godkjennes i forskrift, og kan gi unntak fra kravene over • Konsekvens: Med mindre det gis unntak i forskrift, skal pasienten gi skriftlig samtykke for alle typer genetiske undersøkelser – Kan pasienten gi blankofullmakt til et helt genom? – Er hver ny tolkning av utvalgte gener i et genom en ny undersøkelse? • Helseinformasjonssikkerhetsforskriften og lesing av informasjon på tvers av virksomheter – Egne avtaler mellom virksomheter – Skriftlig pasientsamtykke i hvert tilfelle av tilgang, men kan gis overfor hele virksomheter for en periode – Logging av forespørsel om og resultat av tilgang

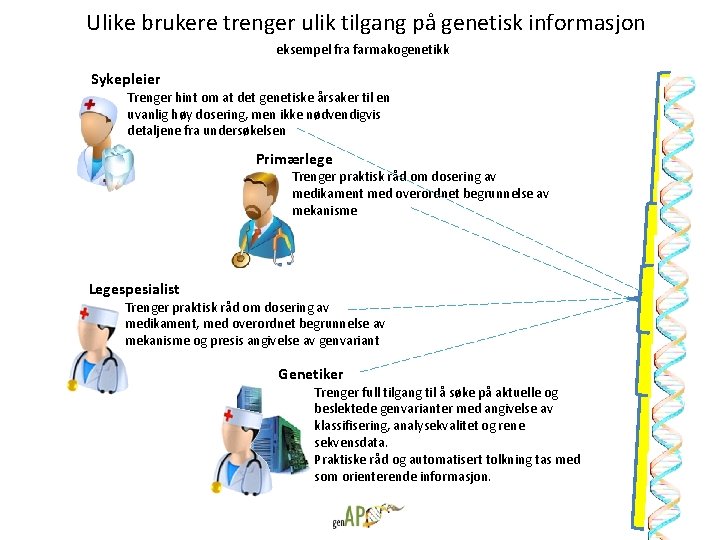
Ulike brukere trenger ulik tilgang på genetisk informasjon eksempel fra farmakogenetikk Sykepleier Trenger hint om at det genetiske årsaker til en uvanlig høy dosering, men ikke nødvendigvis detaljene fra undersøkelsen Primærlege Trenger praktisk råd om dosering av medikament med overordnet begrunnelse av mekanisme Legespesialist Trenger praktisk råd om dosering av medikament, med overordnet begrunnelse av mekanisme og presis angivelse av genvariant Genetiker Trenger full tilgang til å søke på aktuelle og beslektede genvarianter med angivelse av klassifisering, analysekvalitet og rene sekvensdata. Praktiske råd og automatisert tolkning tas med som orienterende informasjon.

Kan vi skille på sensitivitet for ulike gener? Gener relevante for: Har betydning for: Stigmatiserende? Behandling Alt helsepersonell involvert i å yte behandlingen Nei, sjelden Diagnostikk Legespesialister Kan være det, men funnene er som regel ventet Sykdomsrisiko og prognose Genetikere Ja, ofte • Overlapp! – Om brystkreftpasienter ikke kan omsette tamoxifen til aktiv form (CYP 2 D 6), er prognosen dårligere – Mange diagnostiske tester sier også noe om prognosen (for eksempel kardiomyopati, Huntington’s chorea). Hva med de som ikke vil vite prognosen om den er dårlig?

Foreløpige utkast til innspill for endring av lovverk • Mer differensierte hjemler for tilgang • Større grad av implisitt samtykke for å utføre genetiske undersøkelser om pasientbehandling og formidle tolkningene til samarbeidende helsepersonell

Utfordringer for kliniske IKT-systemer (1) • Kompliserte krav til informasjonssikkerhet – Tilgangsstyring til deler av pasientopplysningene ut fra rolle, tilsv. skjermet journal for psykiatri – Håndtering av pasientsamtykke samtidig med pasienters rett til ikke å vite • Vanlig svarrapportering er ikke egnet – Et mindre antall genvarianter (eks. CYP-genene) kan ha konsekvenser for et stort antall legemidler eller andre behandlingsformer • Skal man liste opp 300 -500 legemidler på tampen av en svarrapport, eller lage en svarrapport per medikament? – Tolkningene har relevans i lang tid, ikke bare de første månedene etter prøvetakning • Må i så fall alle genetiske svarrapporter memoreres for hver pasient? – Alle kjente fysiologiske mekanismer er i prinsippet berørt • Skal de genetiske svarrapportene ha sin egen subjournal?

Utfordringer for kliniske IKT-systemer (2) • Tolkningene av funnene må formidles dit beslutningene tas – Eks. legges inn i beslutningsstøtte – Eks. automatisk oppslag eller ”infobuttons” • Klinisk innhold må struktureres både i rapportene og i mottakende systemer – Angivelse av de genetiske variantene tolkningen er bygget på – Integrasjon med eksisterende pasientopplysninger • Familietrær og arvelige sykdommer • Fysiologiske variabler (blodtrykk, vekt, høyde) – Angivelse av anbefaling etter tolkningen • Legemidler og annen behandling • Laboratorieundersøkelser og andre supplerende undersøkelser • Differensialdiagnoser, angivelse av risiko for tilstander • Påvirkning av tolkninger i andre former for beslutningsstøtte

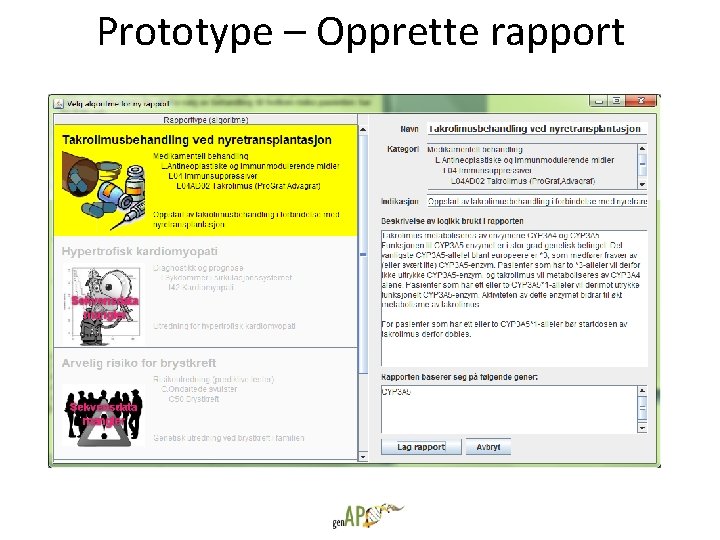
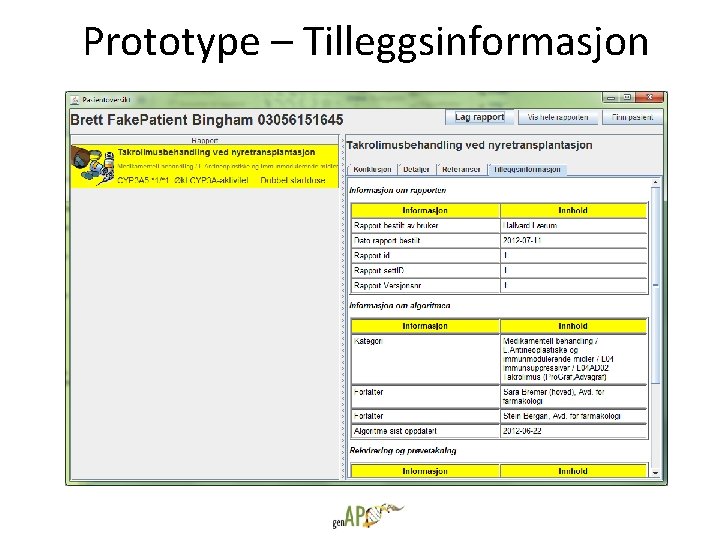
Utvikling av prototype for presentasjon av automatiske tolkninger • Brukere bestiller rapporter selv • Kun en type rapport tilgjengelig – Takrolimus ved nyretransplantasjon • Reaksjoner og innspill fra potensielle brukere – Vet de at de trenger informasjonen? – Tror de på premissene som formidles? – Fungerer denne måten å formidle på? – Generell anvendbarhet

Prototype – Opprette rapport

Prototype – Konklusjon

Prototype – Detaljer

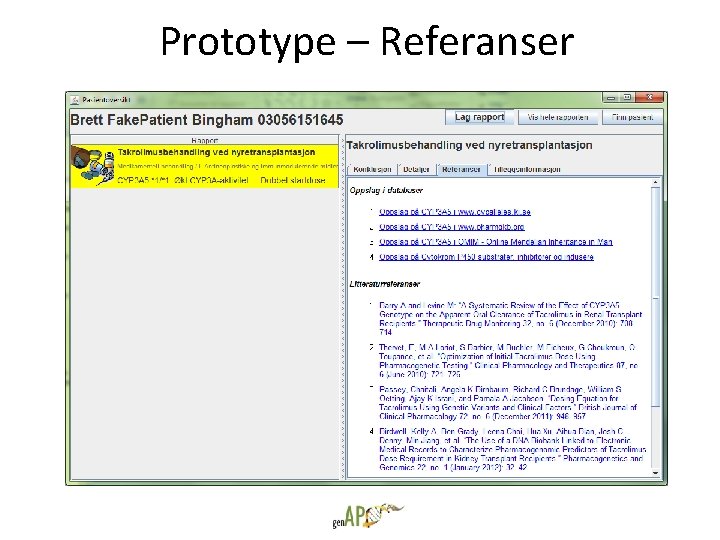
Prototype – Referanser

Prototype – Tilleggsinformasjon

Genetisk variasjon • Hvert genom har 3. 4 millarder basepar • Hver person har millioner av varianter i sitt genom – En stor andel genetiske varianter er ikke beskrevet før – I gjennomsnitt har hver person 70 varianter (mutasjoner) som er helt nye, dvs. er verken arvet fra mor eller far – I gjennomsnitt har hver person 100 ”loss of function” varianter, som isolert sett burde gitt sykdom. Det gjør de ikke.

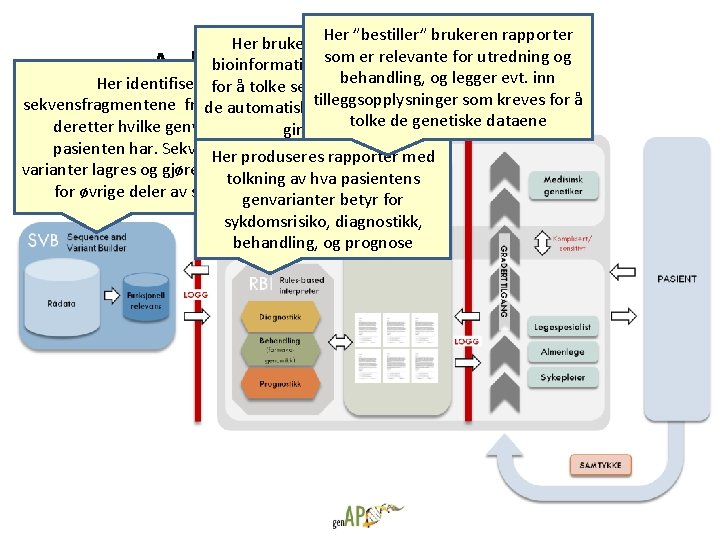
Her ”bestiller” Her bruker genetikere og brukeren rapporter som er relevante bioinformatikere egne verktøy for utredning og behandling, Her identifiseresfor å tolke sekvensdataene omog legger evt. inn sekvensfragmentene frade rådataene, automatisketilleggsopplysninger tolkningene ikke som kreves for å tolke de genetiske dataene deretter hvilke genvarianter gir resultat pasienten har. Sekvenser Her og produseres rapporter med varianter lagres og gjøres tilgjengelig tolkning av hva pasientens for øvrige deler av systemet genvarianter betyr for sykdomsrisiko, diagnostikk, behandling, og prognose Arkitektur for plattform

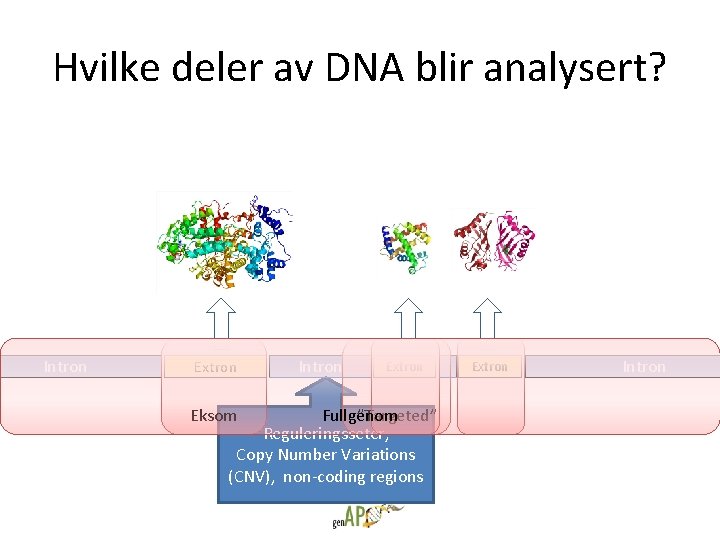
Hvilke deler av DNA blir analysert? Intron Extron Eksom Intron Extron Fullgenom ”Targeted” Reguleringsseter, Copy Number Variations (CNV), non-coding regions Extron Intron
 Kompetanseanalyse
Kompetanseanalyse Fvo medisin ntnu
Fvo medisin ntnu Komparativ medisin
Komparativ medisin Hva betyr revolusjon
Hva betyr revolusjon Hovedtrekk ved den industrielle revolusjon
Hovedtrekk ved den industrielle revolusjon Den amerikanske revolusjon
Den amerikanske revolusjon Revolusjon definisjon
Revolusjon definisjon Til haqida reja
Til haqida reja Der låg han med høy til pute
Der låg han med høy til pute Unngå mat og drikke med mye sukker til hverdags
Unngå mat og drikke med mye sukker til hverdags Meddi linin hükmü nedir
Meddi linin hükmü nedir Vẽ và trang trí lọ hoa
Vẽ và trang trí lọ hoa Con bướm trắng lượn cành hồng
Con bướm trắng lượn cành hồng Muôn thiên thần cánh trắng
Muôn thiên thần cánh trắng Lóa màu trắng hoa
Lóa màu trắng hoa Các bước trang trí hình vuông
Các bước trang trí hình vuông Mối quan hệ giữa gen và tính trạng
Mối quan hệ giữa gen và tính trạng Tình yêu thiên chúa như trăng như sao
Tình yêu thiên chúa như trăng như sao Tập thơ vầng trăng quầng lửa
Tập thơ vầng trăng quầng lửa Uyen trang nguyen
Uyen trang nguyen Vẽ tạo dáng và trang trí chậu cảnh
Vẽ tạo dáng và trang trí chậu cảnh đặc điểm văn biểu cảm
đặc điểm văn biểu cảm Trang ngy
Trang ngy Dừng chân nghỉ lại nha trang
Dừng chân nghỉ lại nha trang Dr trang ha
Dr trang ha O hen ri là ai
O hen ri là ai Vẽ trang trí đồ vật có dạng hình chữ nhật
Vẽ trang trí đồ vật có dạng hình chữ nhật