Reunin del Comit Coordinador Reunin Extraordinaria Consejo de


















- Slides: 23

Reunión del Comité Coordinador Reunión Extraordinaria Consejo de Salud Suramericano (UNASUR) Acceso a Antivirales y Kits Diagnósticos Dentro el Contexto de La Pandemia de Influenza A (H 1 N 1) 7 de Agosto 2009 James Fitzgerald Coordinador, Proyecto de Medicamentos Esenciales y Productos Biológicos OPS/OMS – Washington Organización Panamericana de la Salud 1

Contenido…. Antivirales: – – Recomendaciones de OPS/OMS para el uso Fuentes de productos Inventarios Globales, Regionales y Nacionales Propiedad Intelectual y Acceso a Antivirales Kits Diagnósticos: – – Diagnósticos: métodos mas comunes Kits comerciales Acceso e Innovación: un proceso Intersectorial. . – – Prioridades de Innovación Tecnológica Pandemias, Obligaciones de Derechos Humanos y Acceso a Insumos Estratégicos Organización Panamericana de la Salud 2

Recomendaciones de OMS/OPS para el uso • Recomendaciones válidas para: pacientes confirmación o importante sospecha de infección por virus estacional o pandémico, con presentación clínica grave o progresiva, susceptibles a los a AV que están disponibles. • No usar antivirales si hay alta resistencia. • Más de una cepa circulante con diferente susceptibilidad: combinación de Antiviral. • Casi todas las recomendaciones son basadas en nivel bajo o muy bajo de evidencia • Alerta No. 122 de la OMS, Mayo 2009: que el publico no debería adquirir antivirales a través del Internet o sin receta. Organización Panamericana de la Salud 3

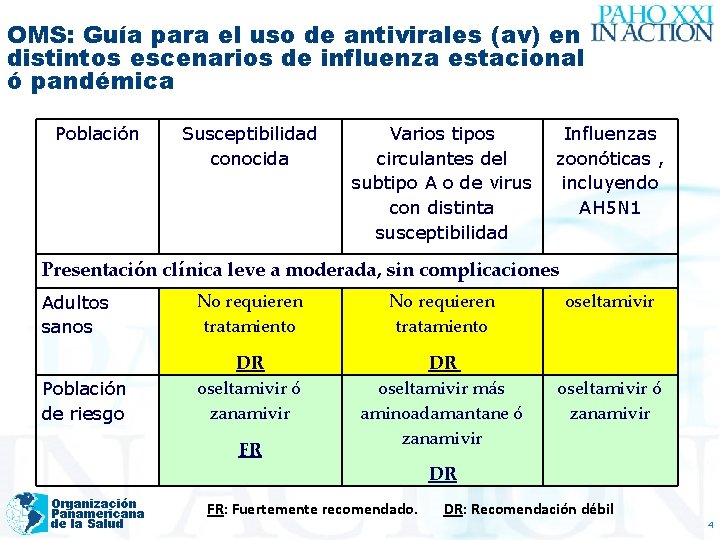
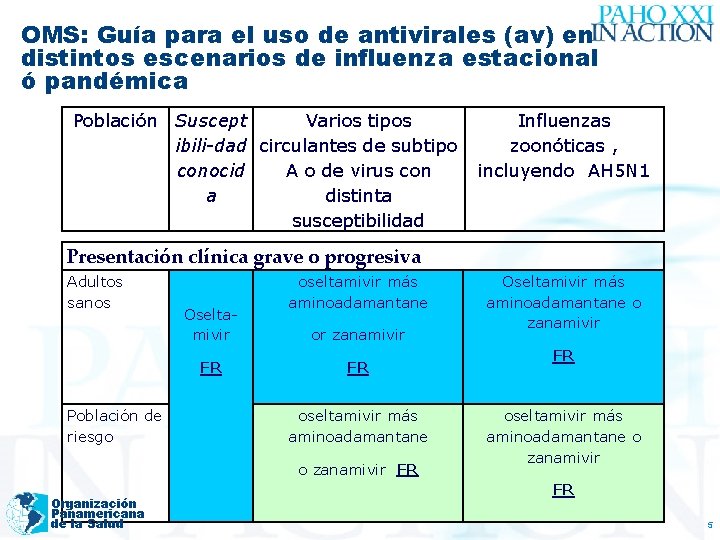
OMS: Guía para el uso de antivirales (av) en distintos escenarios de influenza estacional ó pandémica Población Susceptibilidad conocida Varios tipos circulantes del subtipo A o de virus con distinta susceptibilidad Influenzas zoonóticas , incluyendo AH 5 N 1 Presentación clínica leve a moderada, sin complicaciones Adultos sanos No requieren tratamiento Población de riesgo DR oseltamivir ó zanamivir DR oseltamivir más aminoadamantane ó zanamivir FR oseltamivir ó zanamivir DR Organización Panamericana de la Salud FR: Fuertemente recomendado. DR: Recomendación débil 4

OMS: Guía para el uso de antivirales (av) en distintos escenarios de influenza estacional ó pandémica Población Suscept Varios tipos ibili-dad circulantes de subtipo conocid A o de virus con a distinta susceptibilidad Influenzas zoonóticas , incluyendo AH 5 N 1 Presentación clínica grave o progresiva Adultos sanos Oseltamivir FR Población de riesgo oseltamivir más aminoadamantane or zanamivir FR oseltamivir más aminoadamantane o zanamivir FR Organización Panamericana de la Salud Oseltamivir más aminoadamantane o zanamivir FR oseltamivir más aminoadamantane o zanamivir FR 5

Fuentes de Antivirales PROVEEDOR PRODUCTO PRECIO * US$ TTO ROCHE Oseltamivir 75 mg cápsula (Tamiflú) , Blister por 10 cápsulas Appx 16. 00 FOB (1) HETERO Oseltamivir 75 mg cápsula (Fluvir) Blister por 10 cápsulas Appx 11. 50 FOB (1) CIPLA (2) Oseltamivir 75 mg cápsula (Antiflu) Blister por 10 cápsulas (2) Oseltamivir Pediátrico suspensión oral Frasco 4. 00 -10. 00 FOB (1) RANBAXY Oseltamivir 75 mg cápsula (Antiflu) Blister por 10 cápsulas Appx 7. 50 FOB (1) GSK Zanamivir Rotacaps e Diskhaler Appx 16. 00 (3) Organización Panamericana de la Salud *Precios ofrecidos a la OPS entre Mayo – Junio 2009 (1) Al precio FOB se adiciona un 15% para fletes y seguro (2) Precalificado por el OMS / QSM (3) Sujeto a una política de precio diferenciado por país 6

Inventarios Globales, Regionales y Nacionales • Desde el stock regional (Panamá), la OPS has distribuido entre mayo – agosto 2009 mas que 1 millón de tratamientos de Oseltamivir (Roche) a los países • El inventario regional será reconstruida por otra donación de Roche (parcialmente a través de la OMS, 5. 65 millón de tratamientos en total) y una donación de 440, 000 tratamientos de los EEUU. • OMS recibirá 2 millón de tratamientos de Zanamivir para distribución • No hay una recomendación para el nivel de cobertura de la población; se considera que se requería una cobertura de 3 – 6% de la población con una incidencia de 15%, pero cada país debería evaluar sus necesidades en función del contexto nacional. Organización Panamericana de la Salud 7

Capacidad de Producción Global y Regional • Roche: • 400 m tratamientos por año: • problemas de disponibilidad de acido de shikimic para la producción de la API (? ) • Licencias voluntarias con Hetero y otros productores para África / China: • No estableció una licencia voluntaria (sector privado farmacéutica) para asegurar disponibilidad en LAC • Cipla / Ranbaxy: aumentando capacidad de producción • GSK: hasta 190 m tratamientos al final de 2009 • OMS: Expresión de interés emitida para la producción de los antivirales para aumentar capacidad y precalificar fuentes (2009) Organización Panamericana de la Salud 8

Propiedad Intelectual, Innovación e Acceso a Antivirales • La patente es un instrumento de aplicación exclusivamente doméstica y que depende de órganos estatales nacionales, institutos de propiedad intelectual en el caso de la vigencia de la patente o de los Ministerios de Salud y/o agencias reguladoras nacionales (o de referencia según el caso). • No existe el concepto de ‘una patente global o universal’ de Oseltamivir / Zanamivir. La situación varia en cada país. Sin un título de patente emitido por el producto o alguna de las tecnologías asociadas a su producción (patente de proceso), cualquier productor es libre de distribuir y comercializar la versión genérica de Oseltamivir (o Zanamivir), una vez que tenga el registro sanitario otorgado por las autoridades nacionales. Organización Panamericana de la Salud 9

Propiedad Intelectual y Acceso a Antivirales • El actual contexto de crisis sanitaria puede justificar la adopción de medidas excepcionales, tales como la terminación unilateral de los derechos del titular de la patente, mediante la promulgación de una licencia obligatoria/voluntaria y/o autorización de producción para uso gubernamental. • Flexibilidad prevista en el Articulo 31 del Acuerdo de Derechos de Propiedad Intelectual Aplicados al Comercio (ADPIC), reafirmada por la declaración de Doha de 2001; • Excepción de aquellos países que no cuentan con capacidad propia de manufactura (Parrafo 6 Declaración/Articulo 31 bis). puede ser de algún modo abreviado. Organización Panamericana de la Salud 10

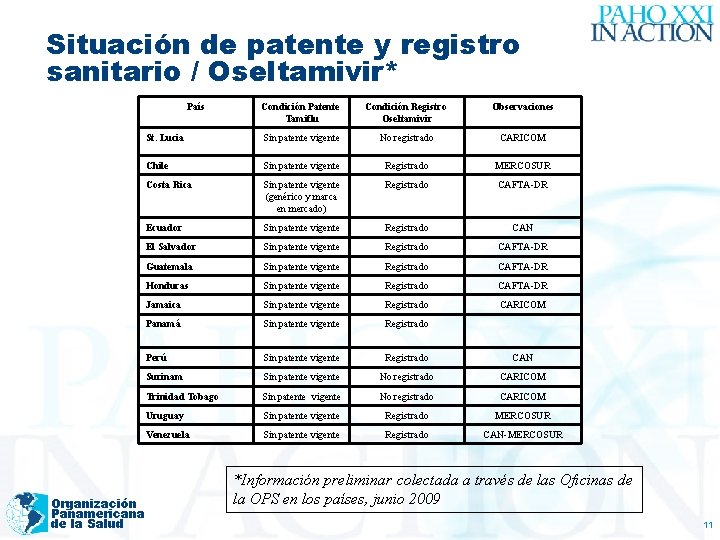
Situación de patente y registro sanitario / Oseltamivir* País Organización Panamericana de la Salud Condición Patente Tamiflu Condición Registro Oseltamivir Observaciones St. Lucia Sin patente vigente No registrado CARICOM Chile Sin patente vigente Registrado MERCOSUR Costa Rica Sin patente vigente (genérico y marca en mercado) Registrado CAFTA-DR Ecuador Sin patente vigente Registrado CAN El Salvador Sin patente vigente Registrado CAFTA-DR Guatemala Sin patente vigente Registrado CAFTA-DR Honduras Sin patente vigente Registrado CAFTA-DR Jamaica Sin patente vigente Registrado CARICOM Panamá Sin patente vigente Registrado Perú Sin patente vigente Registrado CAN Surinam Sin patente vigente No registrado CARICOM Trinidad Tobago Sin patente vigente No registrado CARICOM Uruguay Sin patente vigente Registrado MERCOSUR Venezuela Sin patente vigente Registrado CAN-MERCOSUR *Información preliminar colectada a través de las Oficinas de la OPS en los países, junio 2009 11

ACTIVIDADES DE LOS CNIs DURANTE FASES 5– 6 1. Contribuir con la caracterización de la propagación de la pandemia en el país y sub-región, relacionados cambios en los aspectos clínicos y epidemiológicos. 2. Vigilancia virologica para identificar cambios en la virulencia, drifts antigénicos y la sensibilidad antiviral del virus pandémico. 3. Compartir muestras clínicas y/o aislados virus de casos humanos y otras informaciónes para ayudar en el desarrollo de vacunas antipandémicas y en la determinación de la sensibilidad a antivírales y variaciones antigenicas Organización Panamericana de la Salud 12

Diagnósticos: métodos más comunes • Inmmunofluorescencia • Aislamiento en cultivo de celulas y/o huevos embrionados • PCR – Convencional (rt-PCR) – En Tiempo Real ( PCR-TR) • Reactivos para el diagnostico del nuevo subtipo Influenza A (H 1 N 1) y de cepas estacionales por PCR TR Organización Panamericana de la Salud 13

Reactivos de Diagnostico del nuevo flu A (H 1 N 1) • Kit Primers, Probes y control positivo (CDC/OMS) – – Flu A (M) Flu A (M sw) Flu A (H 1 sw) RNP • Reactivos adicionales (Responsabilidad de los NICs) – Kit para extracción de RNA (Qiagen(DG)) – Kit de Enzimas para PCR (Invitrogen (dry ice)) Organización Panamericana de la Salud 14

Kits Comerciales • Influenza A/H 1 N 1 Detection Set – Roche • Influenza A (H 1 N 1) Applied Biosystems (Taq. Man MGB) • Influenza A (H 1 N 1) Biosearch Technologies (BHQ) • Luminex – Abbot (Multiplex para 12 virus respiratorios). • Otros? ? ? Organización Panamericana de la Salud 15

Kits Commerciales • Están disponibles en el mercado, todavía clasificados como productos para investigación. • Sendo utilizado por laboratorios privados en algunos países. • Algunos requieren equipos específicos. • Todavía no han sido evaluados comparativamente por instituciones independientes. • Biosearch Technologies y Applied Biosystem utilizan los primers y probes disponibles en el protocolo de PCR en tiempo real de OMS. • Biosearch Technologies: el mismo marcador de CDC (BHQ) Organización Panamericana de la Salud 16

Acceso e Innovación: Un proceso intersectorial. . Organización Panamericana de la Salud Fonte: Morel et al (2005) Science 309: 401 -404, 2005 17

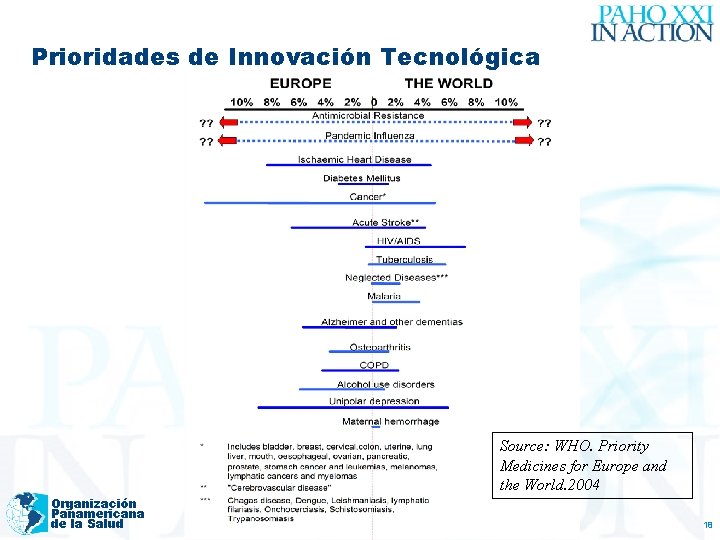
Prioridades de Innovación Tecnológica Source: WHO. Priority Medicines for Europe and the World. 2004 Organización Panamericana de la Salud 18

OPS CD 48. R 15 Salud Pública, Innovación y Propiedad Intelectual: Una Perspectiva Regional Difusión, promoción y apoyo a la implementación de la Estrategia Global (WHA 61. 21) a través de una perspectiva regional. 1. 2. 3. 4. Promover la investigación e innovación tecnológica en los sectores farmacéutico, científico e industrial; Fortalecer la interrelación y colaboración de aquellos actores claves que desde distintos sectores (público, privado, académico, industrial y científico) puedan jugar un papel en la implementación de la estrategia Traducir la voluntad política expresada durante el proceso de discusión del IGWG en propuestas presupuestarias que correspondan con sus prioridades sanitarias; A mejorar la cooperación entre países y en el seno de las organizaciones de integración sub-regional, para promover la transferencia tecnológica y fomentar la investigación e innovación tecnológica entre países (Sur-Norte, Sur-Sur). Organización Panamericana de la Salud 19

Actividades de la OPS en curso • Licitación publica para el Oseltamivir y de Zanamivir a través del Fondo Estratégico de la OPS (Aug 2009) • Revisión de los marcos regulatorios (de PI y de registro sanitario) para los antivirales • Sensibilizar las asociaciones regionales farmacéuticas de la necesidad de analizar la capacidad de producción regional • Reunión sobre Elementos 1 – 3 de la EGPA, Septiembre 2009 para discutir a nivel regional las prioridades de innovación tecnológica y capacidades productivas • Reunión regional con las ARNs sobre aspectos regulatorios (Vacunas y Medicamentos), BA Oct 2009, entre otro la farmacovigilancia Organización Panamericana de la Salud 20

Normativa del Protocolo de San Salvador (OEA) Art. 10: Toda persona tiene derecho a la salud entendida como el disfrute del más alto nivel de bienestar físico, mental y social. Medidas para garantizar este derecho: …c) la total inmunización contra las principales enfermedades infecciosas; … …d) la prevención y el tratamiento de las enfermedades endémicas, profesionales y de otra índole… Un medicamento vital o esencial debe ser tratado como un bien público; y el bien común debe prevalecer sobre el bien individual Organización Panamericana de la Salud 21

Pandemias, Obligaciones de Derechos Humanos y Acceso a Insumos Estratégicos “El uso de los principios, tratados y estándares de derechos humanos es visto en la OPS y OMS no como una herramienta opcional para la promoción y protección de la salud, sino como una estrategia esencial para mejorar la salud de los pueblos…” Dra. Mirta Roses, Director OPS Lanzamiento del Primer Centro Colaborador sobre derechos humanos y salud pública, Escuela de Derecho de Georgetown, Washington DC, Octubre 2006 Organización Panamericana de la Salud 22

James Fitzgerald, Coordinador y Asesor Principal Proyecto de Medicamentos Esenciales y Biológicos OPS Correo: fitzgerj@paho. org Tel: +1 202 974 3282 Con el apoyo de: Jose Luis Castro, Pilar Ramon-Pardo, Otavio Oliva, Javier Vasquez y Jaume Vidal de la OPS/WDC, y Charles Penn, Elil Rengenathan y Sabine Kopp de la OMS Organización Panamericana de la Salud 23
 Excelso eminente de elevación extraordinaria
Excelso eminente de elevación extraordinaria Esquema de contratos de trabajo
Esquema de contratos de trabajo Jornadas extraordinarias
Jornadas extraordinarias Harry potter reunin
Harry potter reunin Reunin
Reunin Reunin
Reunin La reunin
La reunin Servicios de intranet del consejo general del notariado
Servicios de intranet del consejo general del notariado Kahoot.comit
Kahoot.comit Repl.comit
Repl.comit Que es un comit
Que es un comit Que es un comit
Que es un comit Fortalezas de una empresa
Fortalezas de una empresa Plan de trabajo coordinador deportivo
Plan de trabajo coordinador deportivo El coordinador
El coordinador Iso casco
Iso casco El coordinador
El coordinador El coordinador
El coordinador El coordinador
El coordinador Coordinador de distrito
Coordinador de distrito Coordinador de tribunal
Coordinador de tribunal Qué rol cumple la presidencia del consejo de ministros
Qué rol cumple la presidencia del consejo de ministros Cuentos del conde lucanor cortos
Cuentos del conde lucanor cortos Frutos del don de consejo
Frutos del don de consejo